Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes en vivo de los axones de la raíz dorsal después de rizotomía
En este artículo
Resumen
Un In vivo Imágenes de protocolo para monitor principal axones sensoriales después de aplastar a la raíz dorsal se describe. Utilizar los procedimientos de campo amplio microscopía de fluorescencia y thy1-YFP ratones transgénicos, y permitir imágenes repetidas de la regeneración de axones más de 4 cm en el SNP y la interacción axón con la interfaz del sistema nervioso central.
Resumen
Los axones sensoriales primarias heridos por lesiones raíz espinal no se regeneran en la médula espinal, causando dolor crónico y pérdida sensorial permanente. La regeneración de la raíz dorsal (DR) los axones en la médula espinal se previene en la zona de la raíz dorsal de entrada (DREZ), la interfaz entre el SNC y SNP. Nuestra comprensión de los eventos moleculares y celulares que impiden la regeneración en DREZ es incompleta, en parte debido a los cambios complejos asociados con la lesión del nervio se han deducido del análisis post-mortem. Dinámica de procesos celulares, tales como la regeneración axonal, se estudia mejor con las técnicas que la captura de eventos en tiempo real con múltiples observaciones de cada animal vivo. Nuestra capacidad para controlar las neuronas en serie en vivo ha aumentado dramáticamente debido a las innovaciones revolucionarias en la óptica y los transgénicos de ratón. Varias líneas de thy1-GFP ratones transgénicos, en el que los subgrupos de neuronas son genéticamente etiquetados en distintos colores fluorescentes, permiten las neuronas individuales para ser captado en vivo 1. Estos ratones se han utilizado ampliamente para imágenes in vivo de los músculos y el cerebro 2-4 5-7, y han proporcionado nuevos conocimientos sobre los mecanismos fisiológicos que los análisis estáticos no se podría haber resuelto. Los estudios de imágenes de las neuronas en la médula espinal que viven sólo recientemente han comenzado. Lichtman y sus colegas han demostrado su viabilidad mediante el seguimiento de heridos columna dorsal (DC), los axones con un amplio campo de la microscopía 8,9. Multi-fotón de imágenes in vivo de la profunda posición axones DC, microglia y los vasos sanguíneos también se ha logrado 10. En los últimos años, hemos sido pioneros en la aplicación de imágenes in vivo para controlar la regeneración de los axones DR con amplio campo de la microscopía y la línea H de thy1-YFP ratones. Estos estudios nos han llevado a una nueva hipótesis acerca de por qué los axones DR se les impide la regeneración de la médula espinal 11.
En la línea H de thy1-YFP ratones, distintas YFP + axones son superficialmente posición, que permite a varios axones a ser monitoreados simultáneamente. Hemos aprendido que los axones DR llegar a DREZ son mejores imágenes en el lumbar que en la médula espinal cervical. En el presente informe se describen varias estrategias que nos han sido útiles para asegurar imágenes de éxito a largo plazo y de la regeneración de los axones repetidas DR. Estos incluyen métodos que eliminan la intubación y la interrupción de las vías respiratorias repetidas, minimizar la cirugía asociada con el estrés y la formación de cicatrices, y obtener imágenes estables en alta resolución sin fototoxicidad.
Protocolo
1. Microscopio de configurar y preparación de imágenes
- Nuestra imagen creada se compone de un microscopio estereoscópico Leica MZ16 fluorescentes con una velocidad de obturación rápida y una cámara CCD enfriado controlado por el software Metamorph.
- Prepare una almohadilla térmica de temperatura controlada y ajustar la producción a 32,5 ° C para mantener la temperatura corporal del animal durante y después de la cirugía.
- Ringer tibia estéril la solución o líquido cefalorraquídeo artificial (ACSF) a 32,5 ° C de antemano para el riego de la médula espinal durante la cirugía.
- Anestesiar al animal con una inyección intraperitoneal de xilazina (8 mg / kg) y ketamina (120 mg / kg) de cóctel.
- Afeitarse la parte superior con una maquinilla de pequeños animales y difundir una pequeña gota de crema de depilación en el área afeitada con punta de algodón, hisopos. Minutos más tarde, eliminar la loción aplicada al 70% de etanol esponjas gasa empapada.
2. Laminectomía y la exposición quirúrgica de la raíz dorsal L5
- Colocar el animal en una piscina climatizada (32,5 ° C) pad y desinfectar la piel con esponjas empapadas etanol al 70%.
- Bajo la iluminación de campo claro en el microscopio estereoscópico, realizar una incisión (2 - 3 cm) en la piel de la espalda. Si es necesario, utilizar aplicadores de algodón para detener el sangrado.
- Reflejan la musculatura vertebral para exponer las vértebras lumbares subyacente.
- Exponer los segmentos L3-S1 espinal por el lado derecho hemi-laminectomía usando pinzas pequeñas. Una laminectomía parcial de la exposición de 4-6 segmentos de la médula espinal lumbar y sacra se crea mediante la eliminación de la parte derecha posterior de la vértebra L5 a nivel de la cresta ilíaca de la cadera (la ubicación de DRG L5) rostral de la vértebra L2 (2 vértebras caudales de la última costilla). Perfundir la cavidad con solución de Ringer estéril caliente de.
- La posición del animal en un cojín de apoyo (gasa de algodón laminado) para aplanar la columna vertebral. Use ganchos de retracción para ampliar el área expuesta.
- En este punto (aproximadamente 30 minutos después de la primera inyección ip de anestesia, un suplemento (0.5X) debe inyectarse por vía subcutánea con el fin de mantener al animal anestesiado completamente. Por otra parte, el gas de anestesia (2-4% isoflurano en oxígeno 0.5L/min ) puede ser utilizado para anestesia repetida durante las sesiones de formación de imágenes más de 1 hora.
3. Rizotomía / aplastar a la raíz dorsal
- Cambiar a la excitación de fluorescencia para visualizar YFP etiquetados (+) los axones.
- Con la punta de un Sub-Q (26ga.) aguja, realizar una pequeña incisión en la duramadre que recubre la raíz L5 dorsal (DR). Perfundir en varias ocasiones con solución de Ringer y limpia suavemente con aplicadores de algodón.
- Identifique el sitio de ser aplastado e insertar un lado de la pinza fina (Dumont # 5) subdurally.
- Cerrar las pinzas suavemente pero con firmeza, manteniendo la parte medial de la raíz L5 por 10 segundos, y luego suavemente suelte el fórceps.
- Lavar repetidas veces con solución fisiológica y limpia suavemente con aplicadores de algodón.
4. De adquisición de imágenes y procedimientos de post-op
- Obtener varias imágenes de toda la zona expuesta incluyendo el sitio de aplastar y DREZ el antes y el después de la aglomeración, tanto en la ampliación de baja y alta.
- Las imágenes se adquieren, ya sea como imágenes individuales o múltiples flujos de 10 a 20 cuadros adquiridos dentro de los 30 - al tiempo de exposición de 40 ms. En enfocar las imágenes son seleccionadas, y un montaje panorama más tarde se crea el uso de Photoshop.
- Para minimizar la formación de cicatrices, bien aplicar un pedazo de membrana delgada matriz sintética (Biobrane), seguido por artificial dura, en la parte superior de la médula espinal expuesta. Asegúrese de cortar las piezas a encajar con precisión en la ventana de la médula espinal expuesta de modo que se adhieren a la médula espinal.
- Cerca de la musculatura con 5-0 suturas estériles y cerrar la incisión de línea media con clips de la herida.
- Inyectar la solución de Ringer (0,3 a 0,5 ml por vía subcutánea), y administración de buprenorfina como analgesia postoperatoria (0,05 mg / kg) por vía subcutánea cada 12 horas durante 2 días.
- Mantener al animal en una almohadilla térmica (34 ° -35 ° C) hasta que se recupere.
5. Imagen repetida
- Anestesiar al animal y eliminar los clips de heridas y suturas.
- Quitar artificial dura y delgada membrana sintética parches de la matriz y mantenerlos en un tubo estéril con solución de Ringer para su posterior reutilización.
- Quite con cuidado cualquier cicatriz de tejido conectivo acumulada con la punta doblada de una aguja, Sub-Q y unas pinzas finas. Perfundir frecuentemente con solución de Ringer cálida.
- Volver a exponer el campo quirúrgico, incluyendo el sitio aplastar y DREZ, reubicar YFP + axones imágenes en las sesiones anteriores, y repetir los procedimientos descritos en la sección 4.
6. Los resultados representativos:
Hemos observado que, mientras no regenerarse después de una lesión en la sección transversal, casi todos los axones + YFP creció a través del sitio delesiones por 3 días después de aplastar (Figura 1) 11. Por lo general, al día siguiente después de aplastar, se observó muerte de devolución de la degeneración de los axones muñón proximal y la fragmentación / degeneración de los axones mismo distal a la aglomeración, que confirmó que los axones dañados había sido adecuadamente (por ejemplo, la Figura 1, el día 3 y 5) . Varios criterios adicionales se aplican para distinguir sin ambigüedad la regeneración de los axones de los axones que se salvaron o se había recuperado de la lesión. Estas fueron las siguientes: (1) axones que se regeneran muestran una expansión de la porción no fluorescente de la YFP + axón en el lugar de aplastar a causa de la degeneración proximal y distal (en contraste con la reducción de la brecha sin etiqueta, debido a citoplasma fluorescentes rellenar el sitio de aplastamiento si los axones sobrevivieron a la lesión), (2) la regeneración de los axones son mucho más delgadas, con menor intensidad fluorescente, y más ondulado que los axones que sobrevivieron a la lesión, (3) la regeneración de axones son más delgados y más débilmente fluorescentes que los fragmentos fluorescentes degeneración de los axones a través del cual se extendieron, (4) a diferencia de los axones supervivientes o salvado, la regeneración de los axones parada en el DREZ, y (5) en contraste con los sobrevivientes o escatimado axones axones que se regeneran no muestran los nodos de Ranvier. La figura 1 muestra cuatro axones superficial + YFP inmediatamente después de aplastar (A1; flechas de colores). Tres días después de la aglomeración, los cuatro axones se extienden una neurita única que crece a través del sitio de aplastamiento (A2). Cinco días después de aplastar, neuritas se mantienen estables y no hay un crecimiento adicional de los axones estos u otros proximal (A3).
La regeneración de axones que cruzó el sitio a través de aplastar alargado mucho más grueso y más brillante fragmentos fluorescentes de un axón degenerado (es decir, los tubos endoneurales), y llegar a la DREZ tan pronto como 4 días después de la aglomeración (alrededor de 3 mm / 2 días) 11. Imagen repetida de estos axones y sus puntas cada dos o tres días durante dos semanas más (Figura 2) reveló que no crecen hacia adelante o retroceder, pero se mantuvo inmóvil. El único cambio notable fue la hinchazón de las extremidades y los ejes de algunos axones. Estas observaciones demuestran por lo tanto, inmovilización sorprendentemente rápido y crónica de los axones que se regeneran en el DREZ.
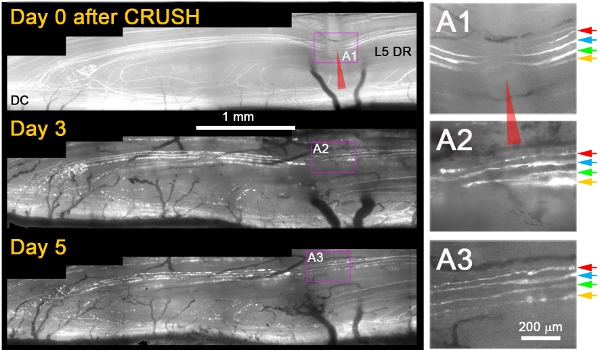
Figura 1: imagen repetida de la L5 DR YFP + axones en el lugar de aplastar a la raíz dorsal durante 5 días. La porción medial de la raíz L5 fue aplastada (rojo punta de flecha) y la imagen en los días 0, 3 y 5 después de la aglomeración. El área de la aglomeración se magnifica en los paneles de la derecha (A1-A3).

Figura 2:. Imagen repetida de los axones llegó a la DREZ más de 20 días después de aplastar a la raíz L5 Día 4, tres axones (flechas de colores) llegó a la DREZ. Las puntas de estos axones permanecen en el mismo lugar y tienen un aspecto similar en las sesiones posteriores de imágenes de los días 7, 9, 13, 15 y 20. Posiciones de un extremo del axón en relación con otros consejos de los axones y las señales (asteriscos) se utilizaron para determinar la motilidad axón entre las sesiones de formación de imágenes.
Discusión
DR regeneración de imagen directamente en ratones vivos es particularmente difícil porque requiere una laminectomía dorsal sustancial para controlar el crecimiento del axón en una amplia zona seguido por múltiples procedimientos invasivos quirúrgicos y anestésicos en las sesiones de formación de imágenes posteriores. Las estrategias que han contribuido a superar estos retos. Imágenes en primer lugar, el éxito requiere la reducción de la mortalidad del ratón (aproximadamente el 25%), reduciendo al mínimo la...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Agradecemos al Dr. Alan Tessler por sus comentarios y ayuda editorial. Este trabajo fue apoyado por el NIH NS062320.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| H línea thy1-YFP (2-4 meses de edad, ambos sexos) | Jackson Laboratory (Bar Harbor, ME) | 003782 | |
| Xilazina (inyección AnaSed, solución estéril) | Lloyd Laboratories, (Shenandoah, LA) | 4811 | 8 mg / kg |
| La ketamina (inyección de clorhidrato de ketamina, USP) | Hospira, Inc. (Lake Forest, IL) | 2051 | 120 mg / kg |
| La buprenorfina (inyectable Buprenex) (0,05 mg / kg) | Reckitt Benckiser Pharmaceuticals Inc. (Richmond, VA) | 7571 | |
| Pequeñas máquinas de cortar el pelo de animales | Oster Profesional, (McMinnville, TN) | 76059-030 | |
| Loción capilar eliminación | Church & Dwight Co. (Princeton, NJ) | NAIR con aceite para bebé | |
| Gasas | Fisher Scientific, (Pittsburgh, PA) | 22-362-173 | |
| Con puntas de algodón | Fisher Scientific, (Pittsburgh, PA) | 14 a 960-3T | |
| Jeringas de 1 ml | Becton, Dickinson y Compañía Franklin Lakes, NJ) | 309602 | |
| Subcutánea (Sub-Q) agujas, 26ga. | Becton, Dickinson and Company (Franklin Lakes, NJ) | 305115 | |
| Tijeras y pinzas de primavera | Herramientas de Bellas Ciencia, (Foster City, CA) | ||
| 2,5 mm gubia curva | Herramientas de Bellas Ciencia, (Foster City, CA) | 16221-14 | |
| Lactato de Ringer USP Inyección | B. Braun Medical Inc. (Irvine, CA) | BBR-L7502 | |
| Solución salina estéril | APP Pharmaceuticals, (Schaumburg, IL) | 918610 | |
| Membrana delgada matriz sintética (Biobrane) | Bertek Pharmaceuticals, (Morgantown, Virginia Occidental) | 62794-096-251 | |
| Artificial dura | Gore Impedir MVP sustituto Dura, WL Gore & Associates, (Flagstaff, AZ) | 1MVP40 | |
| 5-0 suturas de seda | Ethicon, Inc. (Somerville, NJ) | K-580 | |
| Clips de la herida | Perfecto - Ets Bruneau, (Burnea, Francia) | A75 | |
| Estereoscópico fluorescente | Leica Microsystems, (Wetzlar, Alemania) | MZ16 | |
| CCD de la cámara | Hamamatsu, (Bridgewater, NJ) | ORCA-Rx2 | |
| Controlador de temperatura | World Precision Instruments (Sarasota, FL) | ATC 1000 | |
| Metamorph software | Molecular Devices, (Sunnyvale, CA) | ||
| Photoshop | Adobe Systems, San Jose, CA |
Referencias
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i. in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados