Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La creación de dos dimensiones con dibujos sustratos para el confinamiento de proteínas y células
En este artículo
Resumen
Monocapas auto-ensambladas (SAMs) formado por largas cadenas de alcanos tioles en oro proporcionan sustratos bien definidos para la formación de los patrones de proteínas y el confinamiento de la célula. Impresión por microcontacto de hexadecanethiol con un polidimetilsiloxano (PDMS) sello seguido por el relleno con un glicol terminada alcano tiol monómero produce un patrón en el que las proteínas y las células de absorber sólo a la región hexadecanethiol sellado.
Resumen
Impresión por microcontacto proporciona un método rápido y altamente reproducible para la creación de sustratos bien definidos patrones. Mientras que una impresión por microcontacto pueden ser empleadas para imprimir directamente a un gran número de moléculas, incluyendo proteínas, DNA 2, 3 y silanos, 4 la formación de uno mismo -ensambladas monocapas (SAM) de largo tioles cadena de alcanos en el oro proporciona una forma sencilla de limitar las proteínas y las células a patrones específicos que contienen las regiones adhesiva y resistente. Esta detención se puede utilizar para controlar la morfología celular y es útil para examinar una serie de preguntas en proteínas y biología celular. Aquí se describe un método general para la creación de patrones de proteínas bien definido para los estudios celulares 5 Este proceso consiste en tres pasos:. La producción de un maestro de modelado usando fotolitografía, la creación de un sello de PDMS, y microcontacto impresión de un oro sustrato recubierto. Una vez modelados, los sustratos de cultivo de células son capaces de limitar las proteínas y / o células (células primarias o líneas celulares) para el patrón.
El uso de la química monocapa auto-ensambladas permite un control preciso sobre las regiones adhesivas con dibujos de proteína / celular y de las no-adhesivo, lo que no se puede lograr utilizando estampación directa de proteínas. Hexadecanethiol, la larga cadena alcano tiol utilizado en la etapa de impresión microcontacto, produce una superficie hidrofóbica que fácilmente absorbe las proteínas de la solución. El glicol de terminación tiol, que se utiliza para rellenar las zonas no impresas del sustrato, crea una monocapa que es resistente a la adsorción de proteínas y por lo tanto el crecimiento celular. 6 Estos monómeros tiol produce monocapas altamente estructurado que definen con precisión las regiones del sustrato que pueden apoyar adsorción de proteínas y el crecimiento celular. Como resultado, estos sustratos son útiles para una amplia variedad de aplicaciones, desde el estudio del comportamiento 7 intercelular a la creación de la microelectrónica. 8
Mientras que otros tipos de química monocapa se han utilizado para los estudios de cultivos celulares, incluyendo el trabajo de nuestro grupo con trichlorosilanes para crear patrones directamente sobre sustratos de vidrio, 9 monocapas patrón formado por tioles alcano en el oro son claros para prepararse. Por otra parte, los monómeros utilizados para la preparación de monocapa están disponibles comercialmente, estable, y no requieren almacenamiento o manipulación en atmósfera inerte. Sustratos patrón preparada a partir de alcanos tioles también pueden ser reciclados y reutilizados varias veces, el mantenimiento de confinamiento celular. 10
Protocolo
1. Preparación del Maestro patrones (Figura 1)
- El centro de la oblea de silicio en el spin-aplicador y enjuagar la lámina con acetona durante la fase inicial del programa de rotación de dos ciclos en la Tabla 1. La acetona se evapora durante la segunda etapa del programa spin dejando una hostia limpia y seca.
- Aplicar aproximadamente 1 ml AZ9245 fotosensible / a (de diámetro) para el pan y el giro escudo con las condiciones descritas en la Tabla 1.
- Soft-hornear la oblea fotosensible recubierto a 110 º C durante 2 m con una placa de alta uniformidad.
- Photopattern el sustrato utilizando un sistema de escritura directa fotolitografía o un sistema alineador de máscara y la máscara adecuada. Las máscaras se pueden comprar en un número de fuentes comerciales. Además, las transparencias impresas con tinta UV absorbentes, pegado a un plano óptico, se puede utilizar para producir modelos con características de gran tamaño.
- Desarrollar la oblea con dibujos en 01:02 400K desarrollador: semi-conductor de agua desionizada de grado de 1 m 45 s con agitación suave. Enjuague bien con agua semi-conductor de grado desionizada y se seca con una corriente de nitrógeno (N 2) de gas. El desarrollo del patrón se puede comprobar con un microscopio con un filtro UV. Si el patrón no está completamente desarrollado, la oblea se puede devolver a la solución de desarrollo de tiempo adicional.
Nota: Para obtener mejores resultados, photopatterning debe llevarse a cabo en un entorno limpio.
2. Preparación de PDMS sello (Figura 2)
- Preparar un 10:1 en peso de resina: mezcla de endurecedor de Sylgard 182 (PDMS) y cubren por completo el maestro (obleas photopatterned) con la mezcla en una placa de Petri desechables.
- De gas-el PDMS-cubierta principal en un desecador de vacío hasta que no se ven burbujas y permitir que el sello de curar en un horno a 65 ° C durante 1,5 h. Antes del curado, es importante asegurarse de que el maestro está en el fondo del plato, ya que puede subir a la superficie durante el paso de desgasificación.
- Cortar el PDMS sello del maestro y el ajuste al tamaño adecuado. Tienda de la marca en un recipiente con tapa (lado característica arriba) para protegerlo del polvo y los escombros.
3. Preparación del sustrato de oro con dibujos (Figura 3)
- Prepare 25 mm no. Un cubreobjetos de vidrio redondas para la deposición de metales mediante el tratamiento con plasma de oxígeno de 10 m. Aclarar dos veces con agua 18,2 mW desionizada seguido por dos veces con etanol, secar con una corriente de N 2 gas entre cada paso.
- El uso de un bolsillo multi-haz de electrones del sistema de depósito, depósito de 50 Å de titanio seguido por 150 de oro Å. No ventile el evaporador entre la deposición de la capa de titanio y una capa de oro. Por otra parte, recubierto de oro cubreobjetos se pueden comprar en una variedad de proveedores, sin embargo, es importante que las capas de metal son preparadas por evaporación por haz de electrones y evaporación térmica no. Si se compran desde una fuente externa, los sustratos de oro se puede limpiar por la oxidación de plasma o "piraña" (07:03 Conc. H 2 SO 4:. 30% H 2 O 2) 11 antes de su uso.
Nota: "Piraña" La solución es explosivo en la presencia de compuestos orgánicos.
- Prepare la solución de sellado, 10 hexadecanethiol mM en etanol absoluto, y la solución de relleno, 1 mM de glicol terminado tiol en etanol absoluto.
- Enjuague el sello con etanol y secar bien con gas N 2. Aplicar estampado solución al gota a gota sello PDMS hasta que esté completamente cubierto. Seque el sello de fondo con N 2 gas. Proceder a la 5a o 5b en su caso sobre la base de las características de la marca de PDMS.
- Presione suavemente el sello sobre el sustrato de oro y permitir que la monocapa para formar a 15 s.
- Coloque el sustrato de oro en una placa de Petri que contiene 18,2 mW agua desionizada, asegurando el sustrato se sumerge. Presione suavemente el sello sobre el sustrato de oro y permitir que la monocapa para formar a 15 s.
- Enjuagar el sustrato sellada dos veces con etanol, secado con N 2 gas después de cada lavado y el lugar del sustrato en una placa de Petri.
- Cubrir la superficie con una solución de relleno y sellado de la placa con parafilm para evitar la evaporación.
- Deje que la monocapa de fondo a la forma en la oscuridad durante 12-14 h.
- Quitar los cubreobjetos con dibujos de la solución de relleno y enjuague dos veces con etanol, secado con N 2 gas después de cada lavado.
4. La aplicación de proteínas y células al sustrato con dibujos
- Coloque el cubreobjetos con dibujos en una pequeña placa de Petri o cámara de cultivo celular y la tapa con 500 l de 1 ml de fosfato de Dulbecco solución salina tamponada (DPBS). El DPBS debe cubrir completamente el sustrato durante la incubación de proteínas para asegurar una cobertura uniforme de proteínas.
- Añadir una solución concentrada de proteína a la DPBS y mezclar la solución por tuberíating varias veces. Incubar la mezcla de proteínas con el sustrato a 37 ° C durante 1 h. Las concentraciones finales de laminina y fibronectina son generalmente de 12 mg / ml y 20 mg / ml, respectivamente. Las proteínas pueden ser marcadas con un colorante fluorescente amina reactiva para permitir la visualización fácil del patrón. Sin embargo, la proteína marcada se debe mezclar 1:1 con proteínas sin etiquetar como el etiquetado de proteínas puede interferir con la actividad biológica.
- Después de la incubación, lavar bien el sustrato con DPBS (4-5x) para eliminar la proteína no consolidados, teniendo cuidado de que no se seque el sustrato o para hacer que a través de la interfase aire-agua. Después de los primeros tres lavados, agregar aproximadamente 500 l de los medios de comunicación completa crecimiento de las células para mantener un sustrato húmedo.
- Vuelva a colocar el medio de cultivo utilizado para lavar la superficie con medio fresco.
- Se disocian y el recuento de las células de revestimiento sobre el sustrato. Cualquiera de las células disociadas primarios, tales como las neuronas del hipocampo, o líneas celulares inmortalizadas, tales como células CHO-K1, se puede utilizar.
- Placa de disociar las células sobre el sustrato. Normalmente de 30 a 200 células / mm 2 se utilizan.
5. Los resultados representativos:
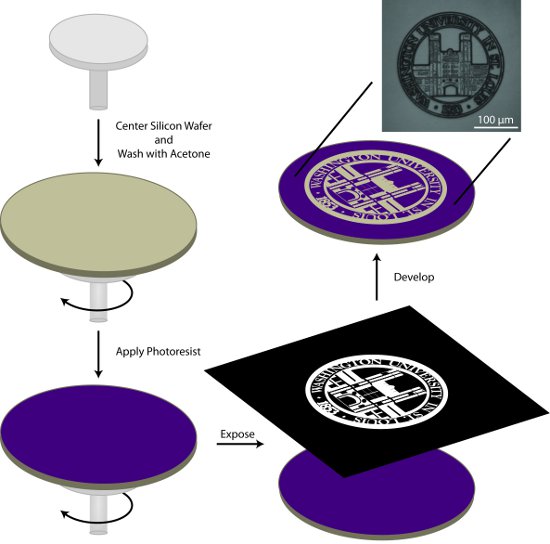
Figura 1. Esquema general para la preparación de fotolitografía de un maestro de modelado. En este proceso, una oblea de silicio se limpia con acetona, recubierto con fotosensible, expuesta a los patrones de interés y el modelo desarrollado.

Figura 2. Esquema general para la preparación del sello de PDMS. En este proceso, el maestro de modelado se cubre con Sylgard (10:01 resina: endurecedor), de-cámaras de gas en un secador de vacío, curado en un horno a 60 ° C, y cortar a medida.
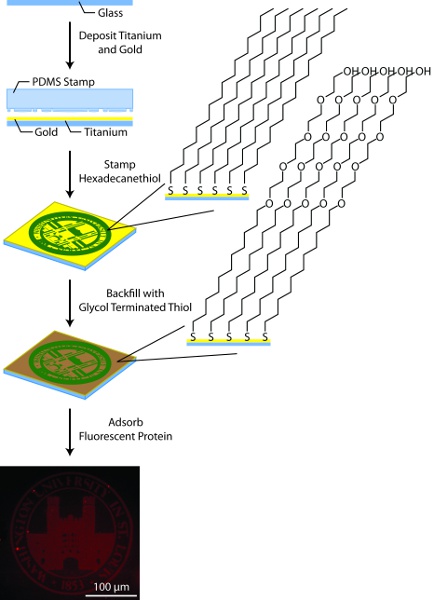
Figura 3. Esquema general de los patrones del sustrato. En este proceso, sustratos de vidrio están recubiertas con titanio (50 bis) y oro (150A) con un cañón de haz de electrones, modelado por hexadecanethiol microcontacto impresión con un sello de PDMS, rellenar con glicol terminado tioles alcano, y recubiertas con proteína fluorescente marcado.

Figura 4. Patrones maestro (A) y el sello PDMS (B), preparado según los métodos descritos. Las barras de escala son 100μm.
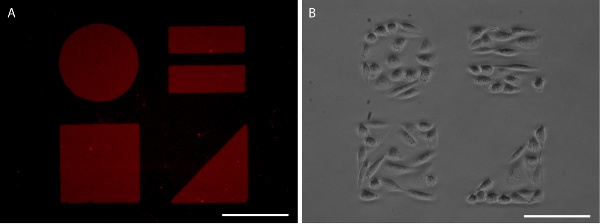
Figura 5. SAMs con dibujos visualiza con AlexaFluor 647 marcado con fibronectina (A) y CHO-K1 confinamiento celular (B). Las barras de escala son 100 micras.
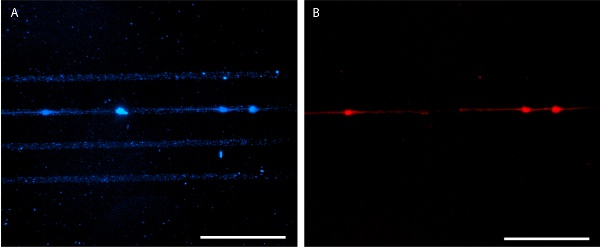
Figura 6. Patrones laminina sembrado con E18 neuronas del hipocampo del ratón a los 4 días in vitro. AlexaFluor 350-conjugado anti-laminina anticuerpos se utiliza para la visualización de patrones (A) y E18 neuronas del hipocampo del ratón están manchadas con MitoTracker Red 580 (B). Las barras de escala son 100 micras.
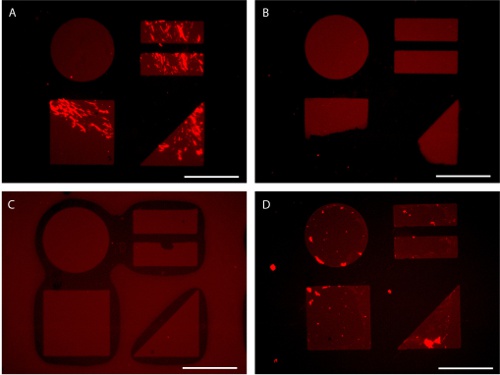
Figura 7. Escollos potenciales en la preparación del sustrato patrón visualizado por AlexaFluor 647-conjugado de fibronectina adsorción. (A) lleva insuficiente mezcla de proteínas desigual adsorción. (B) la aplicación desigual de la presión durante la estampación conduce a la transferencia parcial de Patten. (C) El exceso de presión durante la estampación puede llevar a la marca de colapso. (D) La exposición de la superficie modelada a la interfaz de aire y agua durante el enjuague puede dar lugar a proteínas de fondo de adsorción. Las barras de escala son 100 micras.

Figura 8. Patrón sumergidas pueden producir patrones con pequeños detalles que son difíciles de impresión mediante la impresión de microcontacto convencionales en el aire. Imágenes (A) y (B) muestran las diferentes regiones de un mismo patrón, impresas con el mismo sello PDMS en el aire (A) o agua destilada (B). 10μm en toda las líneas de apoyo que rodean el patrón (añadido para ayudar a evitar el colapso de timbre) se ve en (A), sin embargo, las características de puntos pequeños, como se muestra en (B) no se ven. Esto demuestra que la impresión en el aire funciona bien para las grandes características, pero la impresión en el agua puede ser necesario para los patrones con características más pequeñas. Las barras de escala de 20 micras.
| Ciclo | Velocidad de aceleración (rpm / s) | Velocidad final (rpm) | Tiempo (s) |
| 1 | 500 | 1000 | 5 |
| 2 | 3800 | 3800 | 30 |
Tabla 1.Dos ciclos del programa spin utiliza para crear una capa de 4,5 micras de espesor de AZ9245 sobre una oblea de silicio.
Para preparar sellos PDMS para la formación de patrones sustratos, un maestro en fotosensible es el primero fabricado (Figuras 1 y 4A). El maestro es el inverso de la marca y se crea utilizando un sistema de escritura directa en la litografía o un alineador de la máscara. Cuando un fotoprotector positivo, como AZ9245, se utiliza para el maestro de producción, la oblea de resistencia con recubrimiento es expuesto a la luz con el mismo patrón que aparecerá en el sustrato final. Aunque no siempre es posible, se ha informado de que la relación de aspecto ideal (tamaño de la característica de resistir espesor) para maestros sello PDMS es de 1:2. 13 Hemos encontrado que las relaciones de aspecto de 01:40 son posibles, dependiendo de la naturaleza del patrón. AZ9245 obleas de silicio recubierto en las condiciones descritas aquí dar fotosensible con un espesor nominal de 4,5 micras. Hemos encontrado que este espesor de AZ9245 se pueden utilizar para producir maestros PDMS con características que van desde> 100 mm a 2 micras.
PDMS sellos se echan de Sylgard 182 (o Sylgard 184) con el maestro fabricados a partir de fotosensible (Figura 2). Maestros fotosensible puede ser utilizado varias veces para crear muchas copias de la misma calaña. Después del endurecimiento del PDMS, sellos se retiran de la maestra con una cuchilla de afeitar y el sello resultante puede visualizarse con un microscopio mediante la colocación de lado el sello hacia abajo en función de un cubreobjetos (Figura 4)
Adecuada los resultados de estampado en un patrón agudo, proteínas claro que se puede visualizar mediante la aplicación de la proteína marcada con fluorescencia (Figuras 3 y 5). Por otra parte, la inmunohistoquímica puede ser utilizado para visualizar el patrón de proteínas después de la fijación de células (Figura 6). Crecimiento de las células es muy limitada con el patrón de proteínas de las dos líneas de células inmortalizadas y células primarias (figuras 5 y 6).
Si bien esta técnica es fácil de dominar, varios problemas comunes puedan surgir. La aplicación de la proteína sin mezcla suficiente de la solución concentrada de proteínas en el DPBS puede llevar a la desigual distribución de las proteínas (Figura 7). Sellado incorrecto puede llevar a la transferencia parcial o patrón de colapso de timbre (Figura 7B-C). Además, la exposición de dibujos que contiene el sustrato de la proteína adsorbida en el aire puede afectar la monocapa causando disminución de la resistencia en el fondo (Figura 7D). Patrones compone de características muy pequeña (<5 micras) y altas tasas de aspecto a menudo requieren el uso de la impresión por microcontacto sumergido. En este procedimiento (3.5b) se utiliza el agua como una barrera para evitar que se deposite hexadecanethiol sobre el sustrato fuera del patrón (Figura 8). 14
Discusión
Una serie de cuestiones que pueden surgir en la producción litográfica de la maestra utilizado para la creación de marca de PDMS. Subexposición de los resultados de obleas resistencia con recubrimiento en los patrones de nebuloso y confuso y la sobreexposición de los resultados de obleas resistencia con recubrimiento en las características de ampliación o no. En general, los maestros con tamaños grandes (> 10 mm) son relativamente fáciles de patrón y se desarrollan, mientras que maestros con característica...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría agradecer a todo el grupo de Maurer en la Universidad de Washington, cuyo conocimiento colectivo ha hecho posible este protocolo. La financiación de este trabajo es proporcionado por el Instituto Nacional de Salud Mental (1R01MH085495).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| De obleas de silicio | Wafer Recuperar Servicios | 2 pulgada | |
| Giro aplicador / placa caliente | Brewer Ciencia | Cee 200CB spin-Bake sistema | |
| AZ9245 fotosensible | Mays Chemical Company | 105880034-1160 | |
| Escritura directa fotolitografía sistema | Microtech srl | LW325 LaserWriter sistema | |
| Máscara de alineador | HTG | 3h | |
| AZ Autor 400K | Mays Chemical Company | 105880018-1160 | |
| Sylgard de silicona 182 Kit de elastómero | Dow Corning | ||
| 25 mm no. Un cubreobjetos de vidrio redondo | VWR | 16004-310 | |
| Plasma Oxidante | Diener | Femto | |
| Piezas de titanio Kamis | Incorporado | 99,95% | |
| Pellets de oro | Kamis Incorporated | 99,999% de pureza | |
| Haz de electrones del evaporador | Kurt J. Lesker | PVD 75 Thin Film sistema de deposición de | con el accesorio de haz de electrones |
| Hexadecanethiol | Alfa Aesar | A11362 | |
| 1-mercaptoundec-11-il) tetra (etilenglicol) | Sigma Aldrich | 674508 | |
| Etanol | Pharmco-aaper | 111000200 | 200 pruebas, absoluta |
| Parafilm | VWR | 52858-000 | |
| DPBS | VWR | 4500-434 | Sin el calcio y el magnesio |
| Ratón laminina I | VWR | 95036-762 | |
| La fibronectina de plasma humano | Invitrogen | 33016-015 | |
| AlexaFluor ® 647 de ácido carboxílico, éster de succinimidilo | Invitrogen | A-20006 | |
| MitoTracker Red 580 | Invitrogen | M22425 | |
| AlexaFluor ® 350 de ácido carboxílico, éster de succinimidilo | Invitrogen | A-10168 | |
| Anticuerpos anti-laminina | Fisher Scientific | AB2034MI |
Referencias
- Wilbur, J., Kumar, A., Biebuyck, H., Kim, E., Whitesides, G. Microcontact printing of self-assembled monolayers: Applications in microfabrication. Nanotechnology. 7, 452-457 (1996).
- Chang, J., Brewer, G., Wheeler, B. A modified microstamping technique enhances polylysine transfer and neuronal cell patterning. Biomaterials. 24, 2863-2870 (2003).
- Lange, S., Benes, V., Kern, D., Horber, J., Bernard, A. Microcontact printing of DNA molecules. Analytical Chemistry. , 1641-1647 (2004).
- Xia, Y., Mrksich, M., Kim, E., Whitesides, G. Microcontact printing of octadecylsiloxane on the surface of silicon dioxide and its application in microfabrication. J. Am. Chem. Soc. , 9576-9577 (1995).
- Mrksich, M., Dike, L., Tien, J., Ingber, D., Whitesides, G. Using microcontact printing to pattern the attachment of mammalian cells to self-assembled monolayers of alkanethiolates on transparent films of gold and silver. Experimental Cell Research. , 305-313 (1997).
- Prime, K. L., Whitesides, G. M. Adsorption of proteins onto surfaces containing end-attached oligo(ethylene oxide) - a model system using self-assembled monolayers. J. Am. Chem. Soc. 115, 10714-10721 (1993).
- Raghavan, S., Desai, R., Kwon, Y., Mrksich, M., Chen, C. Micropatterned Dynamically Adhesive Substrates for Cell Migration. Langmuir. , 17733-17738 (2010).
- Rogers, J., Bao, Z., Baldwin, K., Dodabalapur, A., Crone, B., Raju, V. R., Kuck, V., Katz, H., Amundson, K., Ewing, J. Paper-like electronic displays: Large-area rubber-stamped plastic sheets of electronics and microencapsulated electrophoretic inks. Proc Natl Acad Sci U S A. 98, 4835-4840 (2001).
- Yanker, D., Maurer, J. Direct printing of trichlorosilanes on glass for selective protein adsorption and cell growth. Molecular Biosystems. 4, 502-504 (2008).
- Johnson, D., Maurer, J. Recycling and reusing patterned self-assembled monolayers for cell culture. Chemical Communications. , 520-522 (2011).
- Herne, T., Tarlov, M. Characterization of DNA probes immobilized on gold surfaces. J. Am. Chem. Soc. , 8916-8920 (1997).
- Hanson, E., Schwartz, J., Nickel, B., Koch, N., Danisman, M. Bonding self-assembled, compact organophosphonate monolayers to the native oxide surface of silicon. J. Am. Chem. Soc. , 16074-16080 (2003).
- Johannes, M., Cole, D., Clark, R. Atomic force microscope based nanofabrication of master pattern molds for use in soft lithography. Applied Physics Letters. , (2007).
- Bessueille, F., Pla-Roca, M., Mills, C. A., Martinez, E., Samitier, J., Errachid, A. Submerged microcontact printing (SμCP): An unconventional printing technique of thiols using high aspect ratio, elastomeric stamps. Langmuir. , 12060-12063 (2005).
- Xia, Y., Whitesides, G. Extending microcontact printing as a microlithographic technique. Langmuir. , 2059-2067 (1997).
- Biasco, A., Pisignano, D., Krebs, B., Pompa, P. P., Persano, L., Cingolani, R., Rinaldi, R. Conformation of microcontact-printed proteins by atomic force miroscopy molecular sizing. Langmuir. , 5154-5158 (2005).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. J Vis Exp. (22), e1065-e1065 (2008).
- Piner, R., Zhu, J., Xu, F., Hong, S., Mirkin, C. "Dip-pen" nanolithography. Science. 283, 661-663 (1999).
- Ryan, D., Parviz, B. A., Linder, V., Semetey, V., Sia, S. K., Su, J., Mrksich, M., Whitesides, G. M. Patterning multiple aligned self-assembled monolayers using light. Langmuir. , 9080-9088 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados