Method Article
Estudio del citoesqueleto de actina en vivo las células endoteliales que expresan GFP-actina
En este artículo
Resumen
Imágenes microscópicas de vida las células endoteliales que expresan GFP-actina permite la caracterización de los cambios dinámicos en las estructuras del citoesqueleto. A diferencia de las técnicas que utilizan las muestras fijadas, este método proporciona una evaluación detallada de los cambios temporales en el citoesqueleto de actina en las células del mismo, antes, durante y después de diversos estímulos físicos, farmacológicos o inflamatorios.
Resumen
El endotelio microvascular juega un papel importante como una barrera selectivamente permeable a los líquidos y solutos. Las uniones adhesivas entre las células endoteliales regulan la permeabilidad del endotelio, y muchos estudios han indicado la importante contribución del citoesqueleto de actina a la determinación de la integridad de la unión 1-5. Una banda de actina cortical se cree que es importante para el mantenimiento de la estabilidad uniones 1, 2, 4, 5. Por el contrario, las fibras de actina estrés se cree que generan tensión centrípeta dentro de las células endoteliales, que debilita las uniones 2-5. Gran parte de esta teoría se ha basado en estudios en los que las células endoteliales son tratados con mediadores inflamatorios que aumentan la permeabilidad endotelial, y la fijación de las células y el etiquetado de F-actina para la observación microscópica. Sin embargo, estos estudios proporcionan una comprensión muy limitada de la función del citoesqueleto de actina de las células ya que las imágenes fijas proporcionan instantáneas sólo entiempo que no tienen información sobre la dinámica de las estructuras de actina 5.
Imágenes de células vivas, permite la incorporación de la naturaleza dinámica del citoesqueleto de actina en los estudios de los mecanismos que determinan la integridad de la barrera endotelial. Una gran ventaja de este método es que el impacto de los diversos estímulos inflamatorios en las estructuras de actina en las células endoteliales puede ser evaluada en el mismo conjunto de células vivas, antes y después del tratamiento, la eliminación de los posibles sesgos que pueden ocurrir al observar las muestras fijadas. Humanos vena umbilical células endoteliales (HUVEC) se transfectaron con GFP-β-actina de plásmidos y crecido a la confluencia en cubreobjetos de vidrio. Time-lapse imágenes de GFP-actina en HUVEC confluentes son capturados antes y después de la adición de mediadores inflamatorios que provocan cambios dependientes del tiempo en la integridad de la barrera endotelial. Estos estudios permiten la observación visual de la secuencia fluida de los cambios en el citoesqueleto de actina que contribuyen al endoteliol alteración de la barrera y la restauración.
Nuestros resultados muestran de forma consistente local, rica en actina formación lamellipodia y la rotación en las células endoteliales. La formación y el movimiento de las fibras de actina estrés también puede ser observado. Un análisis de la frecuencia de formación y la rotación de los locales lamellipodia, antes y después del tratamiento con estímulos inflamatorios pueden ser documentados por los análisis quimógrafo. Estos estudios proporcionan información importante sobre la naturaleza dinámica del citoesqueleto de actina en las células endoteliales que pueden utilizarse para descubrir los mecanismos moleculares previamente no identificado importante para el mantenimiento de la integridad de la barrera endotelial.
Protocolo
1. Transfección de HUVEC con GFP-actina
- Varios métodos pueden utilizarse para transfectar HUVEC. Nuestro laboratorio utiliza el sistema de Nucleofector (Lonza, Basilea, Suiza) se describen a continuación. En general, trabajar con rapidez para mejorar la viabilidad celular y la eficiencia de transfección. Cada transfección requiere de 5 x 10 5 HUVEC que se sembraron en dos cubreobjetos de vidrio (Corning N º 1, 22 x 50 mm). El Nucleofector combina la electroporación y reactivos químicos para transfectar ADN plásmido, y por lo general alcanza una eficiencia de expresión> 50%. Transfección reactivos químicos son un método alternativo. Un grupo tiene éxito transfectaron células endoteliales bovinas con GFP-actina, utilizando el reactivo GenePORTER 6. El protocolo Nucleofector usamos se describe a continuación.
- Preesterilizado cubreobjetos cultureware u ordinario se puede utilizar, dependiendo del tipo de cámara. Para cubreobjetos de vidrio, esterilizar en una campana de seguridad biológica mediante la colocación de los ellos en una placa de 10 cm de la culturaque contiene aproximadamente 5 ml de etanol al 70% durante 2 min. Recogerlos con una pinza estéril y secar al aire apoyándose contra la ladera de una placa de cultivo por separado.
- Una vez seco, coloque cada portaobjetos en su propia placa de cultivo de 10 cm. Una pipeta 300 l gota de solución de gelatina caliente (1,5% al 0,9% de NaCl) en el centro del cubreobjetos y dejar reposar durante 5 min., Y luego aspirar. Mantener esta capa de la matriz en el centro, sin tocar los bordes, se asegurará de que las células se sembraron densidad y lograr la confluencia con rapidez.
- Preparar un tubo de microcentrífuga 1,5 ml por transfección con 500 l de EGM2MV los medios de comunicación (Lonza) y dejar de lado en un 37 ° C, 5% de CO 2 incubadora.
- Separe HUVEC con 0,25% de tripsina-EDTA y recoger en un tubo cónico de 15 ml. Contar las células. 5 x 10 5 células se necesitan para cada transfección. Ajustar el volumen de suspensión celular para obtener un pellet que contiene 5 x 10 5 células multiplicado por el número de Taxiscciones a realizar.
- Se centrifuga la suspensión celular en una centrífuga clínica a 5000 rpm durante 3 minutos a temperatura ambiente. Aspirar el sobrenadante por la inclinación del tubo para retirar los medios de comunicación tanto como sea posible.
- Resuspender el precipitado con la solución básica Nucleofector ya sea de la HUVEC o primaria de las células endoteliales Nucleofector Kit (Lonza). Use 100 L por cada 5 x 10 5 células. Debido a la toxicidad de esta solución, es importante trabajar de forma rápida, mientras que las células se suspenden en esta solución.
- Añadir el vector GFP-β-actina plásmido (0,2-2 mg por cada 100 l de la suspensión Nucleofector) a la muestra de la transfección. 0,2-2 g de GFP-actina de ADN plásmido por 5 x 10 5 células por transfección.
- Transferencia de 100 L de la suspensión celular a una cubeta Nucleofector. Tapa y grifo de la cubeta algunos de veces para asegurar la suspensión de células es todo el camino hasta el fondo.
- Coloque la cubeta en la ranura de la cubeta Nucleofector II del dispositivo y ejecutar el dprograma de electroporación esired. Usamos el programa A-034 de HUVEC.
- Volver a la cubeta de la campana de seguridad biológica. Lleve uno de los tubos de microcentrífuga de la incubadora a 37 ° C que contiene 500 l de EGM2MV a la campana. Utilizando una de las pipetas de transferencia en el kit Nucleofector, añadir con cuidado la cálida 500 l de los medios de comunicación de la suspensión celular en la cubeta. La transferencia de todo el contenido de la cubeta de nuevo en el tubo de microcentrífuga y colocar en la incubadora durante 15 minutos. para permitir a las células para recuperarse.
- Repita los pasos 9-11 como sea necesario si hay más células se transfectaron.
- Un tubo de microcentrífuga que contiene 600 l de la suspensión de HUVEC transfectadas pueden ser sembradas en dos cubreobjetos. Bajo el capó y con una micropipeta 1000 l, con cuidado la pipeta hacia arriba y abajo una vez para mezclar la suspensión, y luego colocar 300 l de la suspensión directamente en un cubreobjetos recubiertos de gelatina. No deje que la suspensión toque el borde del cubreobjetos. Lugar en los 37 ° C / 5% de CO 2 incubadora para 1-4 h para permitir la unión de las células.
- Después de 1-4 h, inspeccionar las células transfectadas para confirmar que se han adherido a la cubreobjetos. A continuación, añadir 10 ml de EGM2MV medios de comunicación, y volver a la placa a los 37 ° C / 5% de CO 2 incubadora. GFP-actina expresión típicamente se observa en 4-8 horas. Los experimentos se realizan normalmente dentro de las 24-48 h.
2. Configuración de la cámara de imágenes de células vivas, y el calentador de la etapa
- Para la mayoría de nuestros estudios, hemos utilizado un Warner instrumentos abierta de diamante baño (RC22) colocado en un PH-1 calentador de la etapa, alimentado por un sistema de flujo por gravedad. Sin embargo, existen varias opciones para vivir las etapas de células de imágenes, incluidas las cámaras que se adaptan a los platos de vidrio cultivo de fondo, cámaras abiertas frente a cerradas, y varias microincubator / objetivo combinaciones de calefacción y grandes sistemas de incubadora. En última instancia, la selección de la cámara dependerá de factores como la necesidad de acceder a la bañera para añadir un agente de prueba o de drogas, wheexiste el medio será estático o bajo flujo, y la duración del experimento. Además, a veces factores como la inestabilidad de la temperatura puede causar la deriva de enfoque, y puede ser minimizada por los sistemas de control que pueden mantener la temperatura estable y baño objetivo.
- Alícuota suficiente medio para el experimento. Nos alícuota de 50 ml de solución de albúmina salina fisiológica (APSS, Tabla 1) por cada hora que el experimento va a durar.
- Ya sea un sistema de bombeo o por gravedad, pueden ser utilizados para entregar el medio de la cámara. Para nuestro sistema, añadimos APSS a un simple sistema de flujo por gravedad construido a partir de una línea de flujo por vía intravenosa, conectado a un calentador en línea (Warner Instrumentos modelo SH-27A). Aplicamos el flujo en aproximadamente 40 ml / h.
- Si una cámara de baño abierta como la nuestra se utilizará, aplicar grasa de vacío hasta el borde exterior de la parte inferior de la bañera de diamantes y con un aplicador con punta de algodón. A continuación, se obtiene una celda cubierta de cubreobjetos de la incubadora, y levante suavemente el cubreobjetos con unas pinzas. Gently toque la parte posterior a un Kimwipe para absorber el exceso de medio lado mientras se mantiene la cubierta de la celda húmeda. Con las células boca arriba, colocar el baño de diamante sobre el cubreobjetos para formar una cámara.
- Rápidamente el lugar de la cámara en el calentador de la etapa y de la mano a apretar las abrazaderas sobre la cámara. Una preocupación importante en esta etapa es la posibilidad de que las células se seque. Por lo tanto, es importante trabajar de forma rápida y cuando se hace, inmediatamente pipeta ~ 1 ml de medio en la cámara para evitar que las células se sequen.
- Nuestra cámara permite un flujo constante del medio sobre las células. Justo antes de girar sobre el flujo, es importante conectar una manguera de vacío a su titular en la cámara para permitir la salida del medio de cultivo en exceso (APSS). El calentador de línea y el calentador de baño también debe convertirse en un punto de este (a 37 ° C). Nuestro sistema también dispone de una sonda termistor para monitorear la temperatura, que debe ser colocado en el borde de la bañera.
- Limpie con cuidado la parte inferior de la coverslip con un Kimwipe empapado con EtOH al 70% para eliminar los restantes medios de comunicación EGM2MV y la acumulación de sal. Limpie por segunda vez con un Kimwipe seco o papel para lentes.
- Después de la cámara se ha establecido, el flujo está activado, y la temperatura es constante a 37 ° C, permiten a las células por lo menos 30 minutos para ajustar y estabilizar antes de comenzar el experimento.
- Durante la espera, a su vez en todos los componentes del microscopio de imagen en vivo de las células (las lámparas, el controlador de la rueda de filtros, cámara, ordenador).
3. Adquisición de datos con imágenes de microscopio de células vivas
- Varios sistemas de microscopia de células en vivo están disponibles. Nuestro sistema es una Nikon Eclipse TE-2000U con los siguientes componentes:
- Sutter Instrumentos Lambda LS 300 W lámpara de xenón
- Sutter Instrumentos Lambda 3.10 de la rueda de excitación filtro con SmartShutter y S492 filtro (D350 y S572 filtros de excitación también están disponibles para las aplicaciones de los rayos UV y PP)
- Dicroicos 2002bs emisor (Nikon 61002M)
- IC del Plan Fluor Objetivo DLL 10X, NA 0,30 (Nikon MRH10100)
- Plan Fluor ELWD 40X Objetivo DM, NA 0,60 (Nikon MRH08420)
- Plan Apo VC 100X Objetivo del petróleo, NA 1.40 (Nikon MRD01901)
- Fotometría CoolSnap HQ2 cámara de 1392 x 1040 arsenal de imágenes, 6,45 x 6,45 m píxeles
(Roper Scientific) - También tenemos dos paquetes de software que puede ser utilizado para la adquisición de imágenes. Elementos Nikon AR-3.0, y Metamorph 6.1.
- Después de ver las células y encontrar un lugar apropiado para el estudio, bloquear el botón de enfoque grueso y comprobar la configuración de la adquisición de software de modo que:
- La rueda de filtro está establecida para el filtro S492 (con la etiqueta "FITC" en nuestra configuración)
- En el software de adquisición, el objetivo debe corresponderse con la ampliación deseada (nuestro microscopio no está motorizado, pero esto es la proporción m / pixel). También asegúrese de que la lente Optivar en el microscopio se ajusta a la ampliación de 1.0X. Ajuste de la Optivar a 1,5 X puede aumentar la ampliación, sin embargo a expensas de la pérdida de intensidad de la señal.
El aumento que se utilizará depende objetivos del estudio. Para el mejor detalle, un objetivo 100X con una apertura numérica alta será la mejor resolución espacial y la transmisión de la señal. Nuestro microscopio está equipado con un objetivo de larga distancia de trabajo 40x destinado a una aplicación diferente que requiere la distancia extra. Sin embargo, este objetivo puede ser útil cuando queremos observar varias celdas al mismo tiempo, y funciona muy bien para ver orgánulo del tamaño de las estructuras, sin embargo, a un costo de perder la resolución espacial y la intensidad de la señal. Para cualquier estudio en el que la intensidad de la señal es un punto final, o para obtener más técnicas de imagen avanzadas, como la fluorescencia moteado microscopio, un objetivo de 100X se recomienda. - El tiempo de exposición de la cámara se sitúa entre 0,5 a 2 s. Esto depende de la intensidad de la GFP-actina en las células. Por lo general, el uso del tiempo de exposición más bajo posible para evitar bleaching de la GFP-actina y la toxicidad potencial de las células.
- Para conseguir la mejor resolución, la Agrupación se debe establecer en 1 x 1 y la ganancia de 1. En algunos casos hemos puesto a hurgar en la basura 2 x 2 para reducir el tiempo de exposición, sin embargo, esto reduce la precisión de las mediciones que podemos hacer en los objetos en movimiento en el estudio de lapso de tiempo.
- Configurar los valores de time-lapse:
- Seleccione la carpeta para guardar las imágenes capturadas y escriba un nombre de archivo.
- Establecer el número de imágenes y los tiempos de intervalo de duración del experimento. Por lo general utilizan un intervalo de 15 min a 1 s entre las imágenes y hasta 2 horas de duración.
- Asegúrese de que el obturador activo está dispuesto a ser cerrado entre las adquisiciones.
- Antes de iniciar el lapso de tiempo de adquisición de imágenes, apague las luces del cuarto y la captura de una imagen única para comprobar la configuración.
- También capturar una imagen de campo claro. Asegúrese de que el condensador está en la fase adecuada o filtro DIC. Encenderla lámpara halógena y recoger la imagen. Apague la lámpara halógena.
- Volver a "FITC" la configuración del time-lapse y la captura de una imagen de prueba.
- Captura de la serie de tiempo continuo.
Durante el experimento, es importante monitorear las imágenes a medida que se adquieren. En algunos casos, pequeños cambios de temperatura dentro de la cámara puede causar la deriva de enfoque. Esto se puede evitar mediante la optimización de los flujos de entrada y las líneas de vacío para que el flujo es constante a lo largo de las células. Además, reduce el tráfico en la habitación de microscopio, y redirigir los borradores de los ventiladores de techo lejos del microscopio puede ser útil. Una alternativa que ha funcionado bien en nuestra experiencia es el uso de 37 ° C / 5% CO 2 cámaras de incubadora que encierran toda la etapa y el objetivo. Estos ofrecen la ventaja de las células de vigilancia durante la noche o más, pero el acceso a las células es limitada.
Si es necesario, poner en pausa la adquisición de lapso de tiempo y centrar la imagen. Realizar el nuevo enfoque tan pronto como sea posible evitar que se altere el intervalo de tiempo entre las imágenes. - Un protocolo típico constará de 20-30 minutos de imágenes de línea de base antes de agregar un agente de la prueba seguido de 0,5 a 4 horas de la adquisición de imágenes adicionales. La duración del experimento puede ser limitado por photobleaching de la GFP con el tiempo, por lo que es importante elegir el menor tiempo posible exposición. También puede ser conveniente cambiar el intervalo entre imágenes lapso de tiempo de 30 a 60 s, si un estudio más largo que se desea.
4. Análisis de datos
- Varios paquetes de software se puede utilizar para analizar los conjuntos de imágenes, tales como elementos de NIS, Metamorph, Slidebook, etc suelen realizar nuestro análisis de imagen mediante NIH ImageJ que permite el análisis en cualquier computadora en el laboratorio o en casa. Las versiones que utilizamos son:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
Fiyi (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ se puede utilizar para analizar muchos procesos dinámicos, que incluyen:
- Frecuencia de las protuberancias lamellipodia
- Distancia, tiempo, velocidad y de salientes
- Actina movimiento de fibra a través del tiempo
- En ImageJ, cuando el conjunto de imágenes se abre el número de segmento / rebanadas total se muestra en la esquina superior izquierda de la ventana, junto con el nombre del archivo, el número de píxeles, tipo de archivo y el tamaño. La barra de desplazamiento Z en la parte inferior se corresponde con el tiempo. Además, desplazar el puntero sobre la imagen, se mostrará la x, y, z y la ubicación de píxeles en la parte inferior de la barra de herramientas ImageJ.
- Protrusión lamelipodios puede ser estudiado mediante la determinación del número de nuevas protuberancias en el tiempo. Esto puede ser hecho por el perímetro de toda la celda o en una región seleccionada. Este tipo de análisis también se puede realizar en las células nonconfluent, transfectadas con contraste de fase o microscopía DIC. Sin embargo, usando las células que expresan GFP-actina permite el análisis de las monocapas confluentes, sobre todo cuando las células que contienen y que carecen de GFP-actina son adyacentes entre sí.
- Distancia lamelipodios protuberancia, la persistencia (tiempo), y la velocidad puede ser evaluada por quimógrafo (línea de exploración) el análisis. Dibuje una línea perpendicular al borde de una celda (esto es más fácil si no hay una celda de al lado, o la celda de al lado no expresa GFP-actina). En ImageJ, pulsando la tecla "/" genera una quimógrafo, con el eje X representa dIstance y el tiempo de eje-y que representan (15 s de 1 minuto por cada pixel de acuerdo con las directrices sobre el intervalo de tiempo). Las líneas pueden ser dibujadas sobre una saliente y la lamellipodia dimensiones de la caja de medición (pulsando M en ImageJ). La distancia, tiempo y velocidad, entonces se puede calcular.
- El movimiento de las fibras de estrés también se puede medir mediante el análisis quimógrafo de una manera similar.
5. Los resultados representativos:
Con el protocolo de transfección, que normalmente vemos la expresión de GFP-actina en al menos el 50% de la HUVEC transfectadas, y puede encontrar a menudo en zonas donde el cubre> 90% de las HUVEC en la región expresan GFP-actina. Un ejemplo de un experimento de imágenes de células en vivo con HUVEC subconfluentes que expresan GFP-actina se muestra en la película 1. Para este experimento en particular, la imagen fue adquirida de una vez por minuto. Como se puede ver en la película, GFP-actina en el HUVEC se puede observar todo el citoplasma, así como en la estructura filamentosadas y locales lamellipodia que sobresale a lo largo del borde de la celda. También se observa en la película es que las buenas prácticas agrarias-actina de expresión no es uniforme entre las células. Células elegidas para el estudio suelen tener suficiente GFP-actina presentes para visualizar las diferentes estructuras que contienen actina filamentosa. Las células que expresan altos niveles de GFP-actina puede ser problemática para el estudio porque en estas células suele ser difícil de distinguir de actina F-estructuras de la gran cantidad de G-actina presente.
Movie 2 muestra un ejemplo del comportamiento de HUVEC confluentes que expresan GFP-actina. Al igual que el HUVEC subconflent, activa la formación de lamellipodia y la rotación a lo largo de los perímetros de las células era evidente. Sin embargo, estos lamellipodia frecuencia dieron lugar a la membrana de volantes, lo que indica protrusión menos eficiente 7. Esto se debe probablemente a la presencia de celdas adyacentes bloqueando el sustrato cerca. Las fibras de actina cortical y las fibras de estrés también son visibles en las películas 1 y 2. A pesar de que las células observed se mantuvo estacionario, las fibras de estrés son similares a las fibras del arco transverso en la migración de células, que forman cerca del borde de la celda y se desplaza lateralmente hacia el centro de la celda donde se desmonte 8, 9. Una característica adicional dinámica observada en estas células es la formación de estructuras en anillo de actina que se expandió de manera concéntrica, anteriormente denominada actina nubes 10.
Un ejemplo de cómo la distancia, la persistencia, y la velocidad de protuberancias celulares se cuantifica a partir de estas imágenes de lapso de tiempo establece mediante el análisis quimógrafo se muestra en la Figura 1. En la Figura 1A, una línea de un píxel se dibuja aproximadamente perpendicular al borde de la celda para la generación de un quimógrafo (fig. 1B). En este quimógrafo, la región definida por la línea se coloca verticalmente y las imágenes de todo el lapso de tiempo se apilan horizontalmente. Mirando de izquierda a derecha en el quimógrafo, salientes se presentan como los movimientos al alza en el borde de la celda. En la Figura 1C, una línea de apoyo seerimposed en el borde de una de estas protuberancias, y los datos de píxeles asociado a esa línea se recogieron y se muestran en la ventana de resultados en la parte inferior del panel. Este análisis permite la cuantificación de la dinámica de protrusión, y también se puede utilizar para estimar la frecuencia de la protrusión (número de salientes / hora) en esta región de la célula.
Un ejemplo del análisis del movimiento de resistencia en la fibra se muestra en la Figura 2. La mayoría de las fibras de estrés se observó formado cerca de la periferia de la célula y se dirigió hacia el centro de la celda, donde finalmente se desmonta. Esto también puede ser cuantificada mediante el análisis quimógrafo. Se traza una línea perpendicular al borde de la celda y las fibras de estrés (Figura 2A) y un quimógrafo se genera (Figura 2B). Las fibras de estrés aparecen como líneas continuas en la zona de citoplasma en el quimógrafo, a menudo en movimiento hacia abajo y hacia la derecha (hacia el centro de la celda). A veces, las fibras son difíciles de ver en el quimógrafo original, y en estos casosutilizar el filtro Máscara de enfoque para enfocar la imagen (Fig. 2C). Las líneas se dibujan en las fibras de estrés y los datos de píxeles son recolectados a través de la función de medida (Figura 2). Una forma alternativa de recoger estos datos es dibujar una línea desde el principio hasta el final de la fibra de estrés identificados para obtener la pendiente media de la duración que la fibra se observó (Figura 2E). Este análisis permite cuantificar el movimiento de resistencia en la fibra lateral y también se puede utilizar para cuantificar el número de fibras de estrés observado en esta región de la célula.
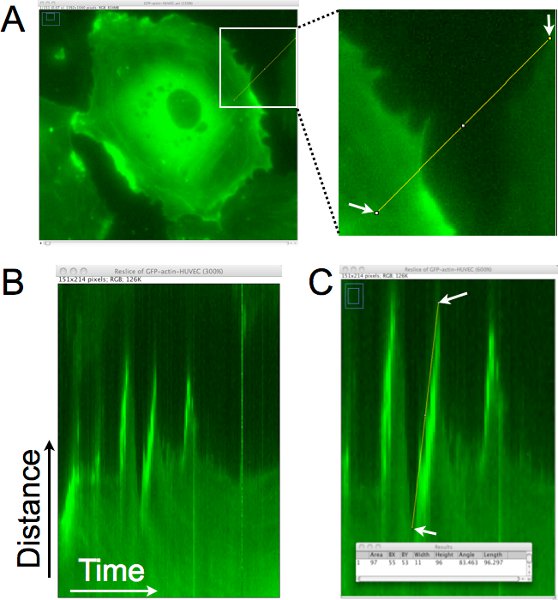
Figura 1. Quimógrafo análisis del borde de la celda para determinar la distancia saliente, la persistencia, y la velocidad de locales lamellipodia. A. Una línea de un píxel se dibuja aproximadamente perpendicular al borde de la celda. Esta región se extrae de cada imagen del lapso de tiempo establecido para generar un montaje de la región a través del tiempo. B. En the quimógrafo resultante, el eje X representa el tiempo, moviéndose de izquierda a derecha, y el eje y muestra la distancia. Movimiento de los borde de la celda con el tiempo se puede evaluar en este quimógrafo, y lamellipodia se identifican las regiones donde el borde de la celda, moviéndose hacia la derecha, va hacia arriba. C. Se traza una línea en el borde de la celda donde ha sido una protrusión de un lamellipodium identificados. Las dimensiones del rectángulo de la línea trazada sean adquiridas (como se muestra en una ventana superpuesta). El ancho se utiliza para calcular el tiempo de protrusión o la persistencia. La altura se utiliza para calcular la distancia saliente. La velocidad saliente se calcula dividiendo la altura por el ancho. En este ejemplo, la distancia al alza fue de 96 píxeles x 0,16125 m / pixel = 15,5 m, y el tiempo fue de 11 píxeles x 1 min / pixel = 11 min. La velocidad se calcula como 15,5 μm/11 min. = 1,4 m / min.

Figura 2. quimógrafo análisis del movimiento de las fibras de estrés de actina. A. Una línea de un píxel es perpendicular a la orilla de la célula para generar un quimógrafo. B. Como se muestra en la fig. 1, en el quimógrafo resultado, el eje X representa el tiempo y la distancia del eje. Fibras de estrés se observan como líneas continuas en la célula, a menudo va hacia abajo y hacia la derecha (flechas) C. Para visualizar mejor las fibras de estrés, el filtro de máscara de enfoque se puede utilizar. En este ejemplo, un radio de 3 píxeles y el peso de la máscara de 0,60 fue utilizado. D. Las líneas de un solo píxel se dibujan sobre la fibra de estrés identificados, y los datos recopilados. En este panel de tres líneas fueron dibujadas y luego en "delete" se ha presionado para hacer una anotación permanente (línea blanca) de su ubicación después de cada medición. E. Alternativamente, si la distancia media, la hora y la velocidad de la fibra de la tensión que se desea, una línea se pueden extraer de los puntos inicial y final (línea amarilla), y los datos der que pueden ser adquiridos (resaltado en la ventana de resultados). Para este ejemplo, las mediciones se hicieron en esta fibra de estrés para 37 cuadros x 1 min marco /. = 37 min. La distancia recorrida durante este período fue de 75 fotogramas x 0,16125 m / pixel = 12,1 micras. La velocidad resultante lateral de la fibra de estrés fue de 12,1 μm/37min = 0,33 m / min. Un valor positivo de la velocidad se asigna para las fibras de moverse hacia el centro de la celda, y negativos para las fibras en movimiento hacia la periferia.
Imágenes de la película 1. Lapso de tiempo de vivir HUVEC que expresan GFP-actina. El intervalo entre las imágenes es de 1 min. Local lamellipodia sobresalían a lo largo de todo el perímetro de las células. Además, las fibras de estrés de arco transversal moverse lateralmente hacia el centro de las células. Cuando la trombina (1 U / ml) se añadió al baño, las células se contrajo ligeramente y los salientes exteriores de lamellipodia una pausa durante unos 10 min. Después de las células contratados, formación y rotación de reanudar lamellipodia d. Haga clic aquí para ver la película.
Movie 2. HUVEC confluentes que expresan GFP-actina, antes y después del tratamiento con trombina. El tiempo transcurrido se muestra en la esquina inferior derecha de minutos: segundos. El intervalo entre las imágenes es de 30 s. Trombina (1 U / ml) después de la de 45 minutos. de referencia período. Eventos anotados son locales lamellipodia formación y la rotación (puntas de flecha cerca de los bordes celulares, 0:59 - 37:29), la actina nubes (flechas, 1:59-21:29), y una brecha en un cruce tricellular que se amplía después de la adición de trombina (flecha, 62:30 - 70:00). Transversal las fibras de estrés de arco son también evidentes en varias de las células. Las células muestran la formación de activos y volumen de ventas de locales lamellipodia a lo largo de su perímetro, con muchos dando lugar a una membrana de volantes. Trombina provocó una pausa en la formación de lamellipodia y facturación, y la breve aparición de algunos pequeños espacios entre las células.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Haga clic aquí para ver la película.
Discusión
La imagen de la GFP-actina en las células endoteliales en vivo permite un análisis detallado de la dinámica del citoesqueleto de actina en respuesta a estímulos inflamatorios. Este método también puede ser útil para construir sobre los hallazgos previos que muestran que la remodelación del citoesqueleto en respuesta a las fuerzas físicas como la tensión de corte 11. Además, este método permite una evaluación detallada de la contribución de la dinámica del citoesqueleto de actina a las diversas actividades de las células endoteliales, como la migración, la mitosis, la formación de uniones intercelulares y la maduración de la unión, y el mantenimiento de la función de barrera.
En los datos presentados, el comportamiento del citoesqueleto de actina endotelial se puede observar antes y después del tratamiento con trombina. Lamellipodia locales a lo largo de los bordes de las células endoteliales se observó la formación y la regresión en el tiempo en monocapas de células tanto nonconfluent y confluente. El tratamiento con trombina interrumpió brevemente la forma lamellipodiación y el volumen de ventas. La trombina también hizo que las células se contraen ligeramente, de acuerdo con los informes anteriores que la trombina hace que el estrés de actina formación de la fibra y el desarrollo de aumento de la tensión centrípeta en las células endoteliales 12-14. Sin embargo, a partir de estudios de células en vivo de imágenes de este tipo, el origen de las fibras de estrés se puede determinar. En HUVEC, la mayoría de las fibras de estrés se originan en la periferia de la célula y se asemejan a las fibras transversales del arco en la migración de las células 8, 9. Otro punto fuerte de este método sobre el uso de células fijas es que el número de fibras de estrés pueden ser cuantificados en las células antes y después del tratamiento de trombina, lo que elimina el sesgo de selección entre los grupos experimentales.
Con este protocolo se evalúa el movimiento dinámico del borde de la celda y las fibras de actina estrés. Para entender la dinámica de actina monómeros en las células endoteliales, las técnicas más avanzadas como la recuperación de fluorescencia después de photobleaching (FRAP) o fluorescencia moteado microscopia (FSM) se puede aplicar 15, 16. Además, debido a las células endoteliales microvasculares pueden representar un mejor modelo de la función de barrera microvascular, la optimización de los protocolos de transfección para expresar eficazmente GFP-actina en las células endoteliales microvasculares representa una futura dirección lógica.
En resumen, las imágenes en vivo de las células endoteliales que expresan GFP-actina constituye un poderoso instrumento para determinar cómo el citoesqueleto de actina de células endoteliales responden a diversos tipos de estímulos. Los estudios que utilizan monocapas endoteliales confluentes bien le ayudará a determinar las funciones de las estructuras dinámicas como la actina-ricos lamellipodia y transversal las fibras de estrés de arco en función de barrera endotelial. Además, imágenes de células vivas de las células endoteliales que expresan GFP-actina y otras proteínas de fusión que permiten la visualización de otras estructuras subcelulares proporcionará información detallada espacio-temporal necesaria para comprender la señalización y los mecanismos estructurales que determine integridad de la barrera.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
El plásmido GFP-β-actina fue generosamente proporcionado por el Dr. Wayne Orr, LSUHSC-S del Departamento de Patología, y se amplificó en el laboratorio del Dr. Becky Worthylake, LSUHSC-NO Departamento de Farmacología. Este trabajo fue apoyado por becas de los Institutos Nacionales de Salud (P20 RR-018766) y la Asociación Americana del Corazón (05835386N).
Materiales
| Name | Company | Catalog Number | Comments |
| 1. Ringer 5x de archivo | |||
| Químico | Empresa | Número de catálogo | Cantidad |
| Cloruro de sodio | EMD | SX0420-3 | 35 g |
| Cloruro de Potasio | JT Baker | 3040 | 1,75 g |
| Cloruro de calcio | Sigma | C-3881 | 1,47 g |
| Sulfato de magnesio | Sigma | M-9397 | 1,44 g |
| El agua filtrada estéril | N / A | N / A | Llevar a 1 L |
| Filtro estéril en botellas autoclave y se almacena a 4 º C | |||
| 2. MOPS buffer | |||
| Químico | Empresa | Número de catálogo | Cantidad |
| MOPS | Sigma | M3183 | 125,6 g |
| El agua filtrada estéril | N / A | N / A | Llevar a 1 L |
| Filtro estéril en botellas autoclave y se almacena a 4 º C | |||
| 3. Solución de albúmina salina fisiológica (APSS) | |||
| Químico | Empresa | Número de catálogo | Cantidad |
| Timbre de valores (5x) | N / A | N / A | 200 ml |
| Trapeadores Buffer | N / A | N / A | 5 ml |
| Fosfato de sodio | Sigma | S-9638 | 0,168 g |
| El piruvato de sodio | Sigma | P5280 | 0,22 g |
| EDTA sal sódica | Sigma | ED2SS | 0,0074 g |
| Glucosa | Sigma | G7528 | 0,901 g |
| Albúmina, bovina | USB | 10856 | 10 g |
| El agua filtrada estéril | N / A | N / A | Llevar a 1 L |
| Ajustar el pH de 7,4 a 37 ° C, luego de filtro estéril en botellas autoclave y se almacena a 4 º C. | |||
| 4. 0,9% | |||
| Químico | Empresa | Número de catálogo | Cantidad |
| Cloruro de sodio | EMD | SX0420-3 | 9 g |
| El agua filtrada estéril | N / A | N / A | Llevar a 1 L |
| Filtro estéril en botellas autoclave y se almacena a 4 º C | |||
| 5. 1,5% solución de gelatina | |||
| La gelatina de piel porcina | Sigma | G2500 | 15 g |
| 0,9% | N / A | N / A | Llevar a 1 L |
| Caliente la solución a 37 ° C para disolver la gelatina suficiente. Mientras aún está caliente, filtro estéril en botellas autoclave y se almacena a 4 º C | |||
Referencias
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados