Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Detección y Genogrouping de norovirus en las heces de los niños por TaqMan en un solo paso RT-PCR
En este artículo
Resumen
Un One-Step RT-PCR para la detección e identificación genogrupo de los aislamientos de Norovirus en las heces de los niños, que utiliza cebadores y sondas TaqMan específicas para el marco de lectura abierto 1 (ORF1)-ORF2 región de la unión, la región más conservada del genoma del norovirus es descrito. Un no-comercial, rentable método de extracción de ARN se detalla.
Resumen
Los norovirus (NOV) son la principal causa de brotes de gastroenteritis aguda esporádica en todo el mundo en los seres humanos de todas las edades. Ellos son causa importante de hospitalización en niños con un impacto en la salud pública similar a la del rotavirus. NOV son virus de ARN de una gran diversidad genética y hay una continua aparición de nuevas cepas. Cinco genogrupos son reconocidos; GI y GII, con sus muchos genotipos y subtipos, siendo los más importantes para la infección humana. Sin embargo, el diagnóstico de estas dos genotipos sigue siendo problemática, retrasando el diagnóstico y tratamiento. 1, 2, 3
Para la extracción de RNA de muestras de heces, el método más comúnmente utilizado es el kit de QIAmp ARN viral comercial de Qiagen. Este método combina las propiedades de unión de una membrana de gel de sílice, tampones que RNasas de control y proporcionan unión óptimos de los ARN a la columna junto con la velocidad de MicroSpin. Este método es sencillo, rápido y fiable y es carrIED en unos pocos pasos que se detallan en la descripción proporcionada por el fabricante.
El Norovirus es sólo superada por rotavirus es la causa más común de diarrea. Diagnóstico de norovirus deben estar disponibles en todos los estudios sobre la patogenia de la diarrea, así como en los brotes de diarrea o de casos individuales. En la actualidad, sin embargo, el diagnóstico de norovirus se limita a unos pocos centros, debido a la falta de métodos sencillos de diagnóstico. Este retraso diagnóstico y el tratamiento 1, 2, 3. Además, debido a los costos de transporte y regulación de los buffers corrosivos dentro y entre los países el uso de estos equipos fabricados plantea problemas logísticos. Como resultado, en este protocolo se describe una alternativa, económica, en casa método que se basa en el original de la pluma y col. Método 4, que utiliza las propiedades de unión de ácidos nucleicos de partículas de sílice junto con las propiedades anti-nucleasa de tiocianato de guanidinio .
et al. 5 se detalla. La secuenciación del producto de PCR de la PCR convencional permite la diferenciación de genotipos pertenecientes al GI y GII genogrupos.
Protocolo
1. Las muestras de heces
- Las muestras de heces deben conservarse congelados para preservar el ARN. Para hacer una suspensión al 10% fecal, tome aproximadamente 0,1 g de muestra de heces descongelado y completar a 1 ml con PBS.
- Dividir en partes alícuotas en 200 l para evitar los ciclos de congelación y descongelación. Almacene las alícuotas a -70 ° C.
- Descongele y centrifugue alícuotas a 4.000 g durante 10 minutos antes de su uso en la extracción.
2. Preparación de partículas de sílice para la extracción con guanidina y sílice
- A temperatura ambiente, suspender 30 g de dióxido de silicio y completar con dH 2 O hasta 250 ml.
- Después de 24 horas de sedimentación, eliminar 215 ml del sobrenadante por succión. Añadir DH 2 O hasta 250 ml, y la suspensión de la sílice precipitado por agitación.
- Después de otras 24 horas, separar el sobrenadante por succión, y ajustar el pH de la suspensión de sílice a un pH de 2,0, utilizando ácido clorhídrico (HCl). Alícuota de la suspensión de sílice en el bot de vidrioTLEs y autoclave.
3. Preparación de la L6 de búfer de extracción con guanidina y sílice
- A temperatura ambiente, preparar L6 tampón disolviendo 60 g de tiocianato de guanidinio (GuSCN) y 1,3 g de Triton X-100 en 50 ml de 0,1 M de hidrocloruro de Tris, pH 6,4, y 11 ml de una EDTA 0,2 M, pH 8,0 solución.
4. Preparación del tampón de L2 para extracción con guanidina y sílice
- A temperatura ambiente, preparar tampón L2 disolviendo 180 g de tiocianato de guanidinio (GuSCN) en 150 ml de 0,1 M de hidrocloruro de Tris, pH 6,4.
5. Procedimiento de extracción
- En cada extracción de una muestra de heces positivo NoV, como control positivo, y agua DEPC tratados, como control negativo, se debe incluir.
- En un tubo de centrífuga de micro-mezclar los siguientes; 1 ml de tampón L6, 20 l de partículas de sílice, y añadir 200 l de la suspensión extracto 10% fecal. Vortex brevemente y dejar a temperatura ambiente durante 15 millasn.
- Centrifugar la suspensión a 6000 g durante 10 s, y lavar el precipitado con 1 ml de tampón L2 dos veces, seguido por dos lavados con etanol al 70% y una vez con acetona. Secar el precipitado en un bloque de calentamiento en seco a 56 ° C durante 5 min.
- Hidratación el ARN en el sílice precipitado mediante la adición de 50 l de RNasa libre de dH 2 0. Añadir 1 l de RNasin, mezclar invirtiendo el tubo y se incuba a 56 ° C durante 15 min.
- Centrifugar durante 3 minutos a plena velocidad, en una centrífuga de mesa, y recoger 40 l del sobrenadante que contiene el ARN.
- Cuantificar los extrajeron muestras de ARN utilizando Nanodrop 2000 espectrofotómetro (Thermo Scientific). A continuación, almacenar a -70 ° C hasta su uso, hasta 6 meses. (Nota: Una mejor manera de preservar el total de ARN intacto es convertirlo en cDNA).
6. La extracción comercial alternativo mediante el ARN viral kit QIAamp ARN
Las instrucciones completas se encuentran en el folleto provIDed con el kit de QIAGEN. Brevemente el procedimiento es como sigue:
- L Pipetee 560 de tampón AVL que contiene el ARN portadoras en un tubo de 1,5 ml, y añadir 140 l de la suspensión de heces 10%. Mezclar por vortex pulso durante 15 segundos. Incubar a temperatura ambiente durante 10 min.
- Añadir 560 l de etanol (96-100%) a la muestra y mezclar por vortex pulso durante 15 segundos, centrifugar brevemente.
- Aplicar 630 l de esta solución a una columna de centrifugación coloca en un tubo de recogida de 2 ml. Centrifugar durante 1 min a 6.000 g, y luego colocar la columna de centrifugación en un tubo limpio ml 2.
- Lavar la columna que contiene ARN enlazados con 500 l de buffer AW1 y se centrifuga a 6.000 g durante 1 min. Coloque la columna en un tubo de recogida limpio de 2 ml.
- Lavar la columna con 500 l de tampón AW2 y centrifugar a toda velocidad (20.000 g ó 14.000 rpm) durante 3 min.
- La columna de giro en un lugar limpio de 1,5 ml de micro-tubo de centrífuga, añadir 40 l agua tratada con DEPC y eluir el RNA a toda velocidad. Repita el procedimiento ence para una final de 80 L de ARN eluidos.
- Cuantificar los extrajeron muestras de ARN utilizando Nanodrop 2000 espectrofotómetro (Thermo Scientific). A continuación, almacenar a -70 ° C hasta su uso, hasta 6 meses. (Nota: Una mejor manera de preservar el total de ARN intacto es convertirlo en cDNA).
7. La detección de norovirus en el ARN extraído por el tiempo de un paso real RT-PCR con sondas específicas de Taqman
Instrumento StepOnePlus PCR en Tiempo Real de Sistemas (Applied Biosystems).
Metodología
- Limpiar y limpiar todas las superficies de trabajo, pipetas y centrífugas con RNasa LEJOS para eliminar cualquier potencial de contaminación RNasa.
- Pipetear la GI y GII NoV detección mezclas maestras de acuerdo a la Tabla 1. Primers y sondas TaqMan están listados en la Tabla 2.
- Alícuota de 10 l de mezcla maestra apropiada a cada tubo de reacción.
- Añadir 5 ml de la muestra problema sin diluirARN, agua tratada con DEPC como control negativo, o IG, respectivamente, GII positivo ARN de control, a los pocillos de reacción correspondientes. Todas las muestras deben procesarse por duplicado. Los controles positivos y las normas de concentración de 300 mg / l y 500 mg / l, respectivamente, fueron proporcionados por Nacional Calicivirus Laboratorio Centro para el Control y Prevención de Enfermedades (CDC).
- Centrifugar la placa de reacción a 6.000 g durante 10 seg.
- En la pantalla del experimento de propiedades, definir y seleccionar un tipo de experimento para la carrera. Asegúrese de que los reactivos TaqMan se muestran como el tipo de reactivos, y que decía: pre-PCR y la amplificación se seleccionan.
- Ejecutar 15 l reacciones utilizando el perfil térmico en la Tabla 3.
- Analizar los resultados.
8. La genotipificación del NoV GI y GII Usando convencional de RT-PCR y secuenciación
(No se menciona en este video, ya que es un método común y ampliamente utilizado.)
Instrumento. Applied Biosystems StepOne y StepOnePlus en tiempo real de sistemas de PCR con la plantilla Quantitec.
Metodología
- Antes de genotipado, el genogrupo (GI o GII) de las muestras se determinó por la detección de RT-PCR se ha descrito anteriormente. GI NoV ARN tiene que ser amplificado con la mezcla maestra genotipo GI y el GII NoV ARN con la mezcla de determinación del genotipo GII maestro.
- Pipetear la GI y GII NoV genotipo maestro de las mezclas de acuerdo a la Tabla 4. Primers GI SKF / SKR y G2 SKF / SKR se enumeran en la Tabla 5.
- Alícuota de 45 l de la mezcla maestra adecuada para tubos de 0,2 mL de reacción.
- Añadir 5 l de agua tratada con DEPC a cada tubo de control negativo, y 5 l de pre-seleccionados, nov (GI y / o GII) ARN positivos en el tubo de reacción correspondiente.
- Ejecutar 50 reacciones l utilizando el perfil térmico en la Tabla 6.
- Enviar PCR productos conteNing al menos 100 ng / l de la región amplificada a cápsida Macrogen Compañía para la purificación y secuenciación. (9700 Gran Séneca carretera. Rockville, MD 20850 y $ 10 por muestra por secuenciación).
9. Los resultados representativos
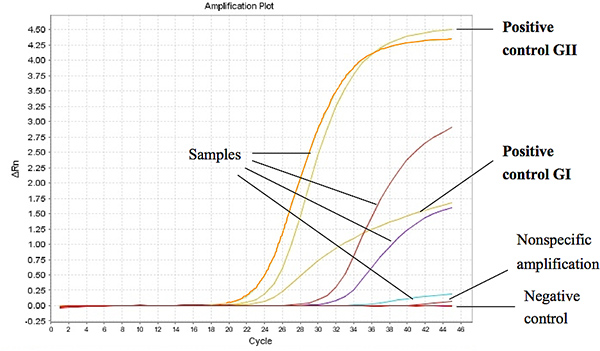
La figura 1 muestra los resultados representativos de la TaqMan One-Step RT-PCR cuando se utiliza para el ARN de ensayo extraídas de muestras de heces diarreicas de los niños. El ciclo umbral (Ct) de una muestra positiva se fijó en menor o igual a 37 Ct para el GI y GII 39 para Ct. El CT-valores para los controles positivos se encontraron en menos de 27 y 18 de la unión ORF1-ORF2 para el GI y GII, respectivamente. Haga clic aquí para ver más grande la figura .
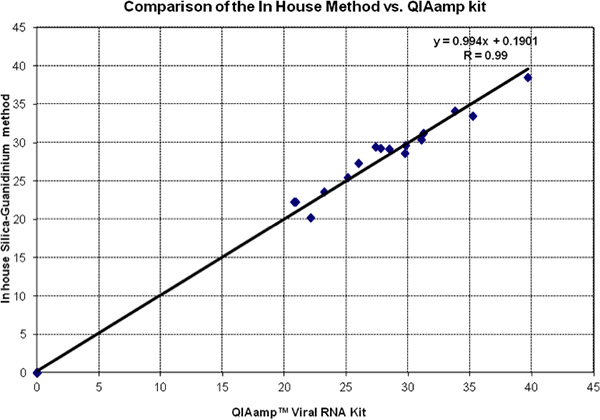
Figura 2 muestra una comparación cabeza a cabeza de los valores de Ct de la sílice en el método de guanidinio y el kit de QIAmp ARN viral. Los datos de ambas pruebas caer muy cerca de la línea de igualdad (pendiente = 1 y la intersección = 0). Esto se ve confirmado por el análisis de regresión y el coeficiente de correlación. Todos los controles negativos se evaluaron y se encontró que 0 por ambos métodos.
| Master Mix | Concentración final | Volumen (l) |
| H 2 0 PCR | 2,875 | |
| Quantitect RT-PCR Master Mix | 1x | 6,250 |
| RT Mix | 1x | 0,125 |
| 50 micras Cog R imprimación | 1 mM | 0,250 |
| 50 micras de imprimación Cog F | 1mM | 0,250 |
| 10 mM de la sonda del anillo | 1 mM | 0.125/0.250 * |
| 10,00 |
* 0,250 l de cada sonda se utilizó para las pruebas de IG, mientras que 0,125 l de cada sonda se utilizó para las pruebas de la GII.
Tabla 1. Qiagen Quantitect mezcla maestra para la investigación GI y GII (Trujillo et al., 2006). 7
| Nombre | Geno-grupo | Utilizar | Secuencia (5 'a 3') |
| Cog 1R | GI | Cartilla | CTT AGA CGC CAT CAT CAT TYA C |
| Cog 1F | GI | Cartilla | CGY TGG ATG CGN TTY CAT GA |
| Cog 2R | GII | Cartilla | TCG ACG CCA TCA TCT ACA TTC |
| Cog 2F | GII | Cartilla | CAR GAR BCN ATG TTY AGR TGG ATG AG |
| Anillo de 1A | GI | Sonda | FAM-AGA TYG CGA TCY CCT GTC CA-BHQ-1 |
| Anillo 1B | GI | Sonda | FAM-AGA TCG CGG CCT TCT GTC CA-BHQ-1 |
| RING2-TP | GII | Sonda | FAM-TGG GAG GAT GGC CGC AAT CT-BHQ-1 |
Tabla 2. Primer y oligonucleótidos sonda utilizada para la cuantitativa en tiempo real RT-PCR para genogrupos I, II (Kageyama et al.2003) 8.
| Paso | Temperatura (° C) | Tiempo (min) | |
| 1 | 50 | 30:00 | síntesis de ADNc |
| 2 | 95 | 15:00 | HotStart Taq activación de la polimerasa |
| 3 | 95 | Doce y quince | |
| 60 | 01:00 | Ciclos de 45X |
Mesa3. El perfil térmico de un solo paso Taqman en tiempo real RT-PCR (Trujillo et al., 2006). 7
| Master Mix | Concentración final | Volumen (l) |
| H 2 0 PCR | 29,50 | |
| 5X Qiagen RT-PCR Buffer | 1x | 10,00 |
| 10 mM dNTP Mix | 0,4 mM | 2,00 |
| Mezcla de enzimas | 2,00 | |
| 40 U / l ARNsin | 20 U / l | 0,50 |
| 10 mM de SKF | 0.1 mM | 0,50 |
| 10 mM SKR | 0.1 mM | 0,50 |
| 45,00 |
Tabla 4. Qiagen One-Step RT-PCR Master Mix para la determinación del genotipo GI y GII.
| Nombre | Geno-grupo | Utilizar | Secuencia (5 'a 3') |
| G1SKF | GI | Cartilla | 5'-CTG CCC GAA TTY GTA AAT GA - 3 |
| G1SKR | GI | Cartilla | 5'-CCA CAC CAR CCA TTR Un TAC - '3 |
| G2SKF | GII | Cartilla | 5'-GGG AGG CNT GCG ATC ACG A - 3 |
| G2SKR | GII | Cartilla | 5'-CCR CCN GCA TRH CCR TTR TA CAT-3 |
Los cebadores Tabla 5. Utilizado para la amplificación de la Región C de la región de la cápside (Kojima et al., 2002). 5
| Paso | Temperatura (° C) | Tiempo (min) | |
| 1 | 60 | 30:00 | síntesis de ADNc |
| 2 | 96 | 15:00 | HotStart Taq activación de la polimerasa |
| 3 | 94 | 00:30 | |
| 52 | 01:00 | Ciclos de 40X | |
| 72 | Doce y media | ||
| 4 | 72 | 10:00 | Recocido |
Tabla 6. El perfil térmico para Taqman One-Step RT-PCR.
Access restricted. Please log in or start a trial to view this content.
Discusión
Uso de la económica en casa-método para aislar ácido nucleico a partir de muestras de heces, se obtiene resultados iguales como con el kit comercial QIAmp viral de RNA de Qiagen, y junto con la TaqMan RT-PCR desarrollado en nuestro laboratorio que puede detectar una amplia gama de NoV genotipos pertenecientes al GI y GII genogrupo. Una publicación reciente del protocolo de la región C informaron las tasas de genotipado de 78% 6. Desde la diversidad de las cepas contemporáneas NoV ha ido en aumento duran...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer al Centro de Calicivirus Laboratorio Nacional para el Control y Prevención de Enfermedades (CDC) para el tipo de regalo algunos aspectos positivos estándar y el control de Nov, y los Laboratorios de la Escuela de Salud Pública de Johns Hopkins para la prestación de los reactivos.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Guanidina isotiocianato | Sigma-Aldrich | G9277 | |
| Tris HCL | Sigma-Aldrich | T5941 | |
| EDTA | Sigma-Aldrich | E5134 | |
| Sílice | Sigma-Aldrich | S5631 | |
| Triton X 100 | BDH Chemicals | 14530 | |
| Dietilpirocarbonato | Sigma-Aldrich | D-5758 | |
| QIAamp Viral RNA Mini Kit (250) | QIAGEN | 52906 | |
| QuantiTec sonda RT-PCR kit (200) | QIAGEN | 204443 | |
| Qiagen One Step RT-PCR kit (200) | QIAGEN | 210212 | |
| Inhibidor de RNasa de 2000 unidades | A.Biosystems | N808-0119 | 2000 unids / vial |
| Antiadherente ERNA sin tubos de microcentrífuga | Ambion | AM12450 | |
| UltraPure agarosa 1000 | Invitrogen | 16550-100 |
Referencias
- Medici, M. Molecular epidemiology of Norovirus infections in sporadic cases of viral gastroenteritis among children in Northern Italy. L. Medical Virology. 78, (2006).
- Vidal, R. Novel recombinant Norovirus causing outbreaks of gastroenteritis in Santiago, Chile. J. Clinica Microbiology. 4, (2006).
- Xavier, M. Detection of caliciviruses associated with acute infantile gastroenteritis in Salvador, an urban center in Northeast Brazil. Braz. J. Med. Biol. Res. 42, (2009).
- Boom, R. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Kojima, S. Genogroup-specific PCR primers for detection of Norwalk-like viruses. J. Virol. Methods. 100, 107-114 (2002).
- Mattison, K. Multicenter comparison of two norovirus ORF2-based genotyping protocols. J. Clin. Microbiol. 47, 3927-3932 (2009).
- Trujillo, A. A. Use of TaqMan real-time reverse transcription-PCR for rapid detection, quantification, and typing of norovirus. J. Clin. Microbiol. 44, 1405-1412 (2006).
- Kageyama, T. A broadly reactive and highly sensitive assay for Norwalk-like viruses on real-time quantitative RT-PCR. J. Clin. Microbiol. 41, 1548-1557 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados