Method Article
Electroporación de mesénquima craneofacial
En este artículo
Erratum Notice
Resumen
Cartílagos craneofaciales en estrecho contacto con otros tejidos, y son difíciles de manipular en animales vivos. Estamos utilizando electroporación para ofrecer herramientas moleculares durante el crecimiento del esqueleto craneofacial sin pasar por los primeros efectos de embriones. Este enfoque nos permite analizar de manera eficiente las moléculas candidatas In vivo.
Resumen
La electroporación es un método eficaz para el suministro de ADN y otras macromoléculas cargadas en los tejidos en los puntos precisos de tiempo y en lugares precisos. Por ejemplo, la electroporación se ha utilizado con gran éxito para estudiar el desarrollo neuronal y de la retina en Xenopus, pollo y ratón 1.10. Sin embargo, es importante señalar que en todos estos estudios, los investigadores no estaban dirigidas a los tejidos blandos. Debido a que estamos interesados en el desarrollo craneofacial, adaptamos un método para apuntar mesénquima facial.
Cuando se realizaron búsquedas en la literatura, encontramos, para nuestra sorpresa, muy pocos informes de la transferencia de genes con éxito en el tejido cartilaginoso. La mayoría de estos estudios fueron estudios de terapia génica, como la entrega de siRNA o de proteínas en líneas celulares condrogénica, o, en modelos animales de artritis 11-13. En otros sistemas, como el pollo o el ratón, la electroporación de mesénquima facial ha sido un desafío (COMUNICACI personaliones, Departamento de Desarrollo Craneofacial, KCL). La hipótesis de que la electroporación en los tejidos cartilaginosos y procartilaginous en Xenopus podría funcionar mejor. En nuestros estudios, nos muestran que la transferencia de genes en los cartílagos faciales se produce de manera eficiente en las etapas iniciales (28), cuando el primordio facial sigue siendo compuesto de los tejidos blandos antes de la diferenciación del cartílago.
Xenopus es un sistema de vertebrados muy accesible para el análisis del desarrollo craneofacial. Estructuras craneofaciales son más visibles en Xenopus que en cualquier modelo de otros vertebrados, principalmente debido a embriones de Xenopus son fertilizados externamente, lo que permite el análisis de las etapas más tempranas, y facilitar imágenes en vivo a una resolución única célula, así como la reutilización de las 14 madres. Entre los modelos de vertebrados desarrollo externo, Xenopus es más útil para el análisis craneofaciales que el pez cebra, Xenopus, como las larvas son más grandes y más fáciles de dissect, y el desarrollo de la región facial es más accesible a las imágenes de la región equivalente en pescado. Además, Xenopus es evolutivamente más cerca de los humanos que el pez cebra (~ 100 millones años más) 15. Por último, en estas etapas, los renacuajos Xenopus son transparentes, y la expresión simultánea de proteínas fluorescentes o moléculas que permiten una fácil visualización de los cartílagos en desarrollo. Creemos que este enfoque nos permitirá poner a prueba rápida y eficiente las moléculas candidatas en un sistema modelo in vivo.
Protocolo
Parte 1A. Equipo
Microscopio: alcance vertical estéreo disección con el objetivo de baja potencia
- Tensión / generador de impulsos: BTX 830 ECM sistema de electroporación de onda cuadrada
- Pipeta extractor: P-87 Micropipeta Extractor (Compañía Sutter Instrument, CA)
- Manipulador: grueso, o combinarse gruesa y fina en función de la preparación.
- Titular de la micropipeta: Herramientas de Bellas Ciencia
- Electrodo: hechos en casa
- Electroporación de cámara: en casa
Electrodos en forma de L:
- Cortar 8 cm de alta pureza 0,4 mm de alambre de tungsteno (Goodfellow) y colocará en el punto medio de una jeringa de 1 ml con masilla (usamos Blu-Tack). Deja 4 cm de alambre de tungsteno expuestos desde la punta de la jeringa y la punta curva en forma de L, de 1 cm desde el extremo (Fig. 1A).
- Recortar la punta para que el extremo mide 0,5 mm de longitud. Tsu punta es la terminal del electrodo.
- En paralelo el exceso de alambre de tungsteno a la jeringa y la utilizan para conectar el generador de impulsos del electrodo.
- Repita el proceso de hacer un par de electrodos.
- Conecte los electrodos al generador de pulso cuadrado de onda a través de cables de CC.
Electroporación cámara
- Línea inferior de 90 mm plato con ~ 5 mm de plastilina no tóxica.
- Rellene plato con los medios de comunicación de la electroporación.
- Usando N º 5 pinzas de relojero hacerse un bien en forma de T (Fig. 2). El bien siempre debe medir ~ 2 mm x 2 mm x 10 mm y el corto ~ 2 mm x 2 mm x 5 mm. El plato de electroporación se pueden lavar y reutilizar.
Parte 1B. Reactivos
ADN o macromoléculas cargadas
- Micropipetas: 1 mm de ancho, 4 "de largo capilares de vidrio de borosilicato (WPI, TW100-F)
- Los medios de cultivo: Normal Medios Anfibios (NAM)
- > 10 X stock: 1100 mM NaCl, 20mM KCl, 10 mM de Ca (NO 3) 2 • 4H 2 O, 1 mM EDTA.
- Autoclave y almacenar a 4 ° C.
- 1 X NAM: Diluir 10 veces desde el almacén de amortiguación, con 0,1 mM NaHCO 3 y 0,2 mM Na 3 PO 4.
- Renacuajos Xenopus laevis, etapa 28
Preparación del ADN:
- Prepare plásmidos de expresión a través de protocolos estándar.
- Resuspender el ADN a una concentración final de 1 mg / l en la nucleasa libre de H 2 0.
* Hemos tenido éxito con vectores que contienen un fuerte promotor de CMV, como pCS2 + [16]. Para el análisis de linaje, por lo general incluyen el ADN que codifica la proteína verde fluorescente (GFP pCS2 +) a una concentración final de 0,1 mg / l. Concentraciones [de ADN entre 0.1-3 mg / l también fueron probados. Se encontró que las concentraciones por debajo de 0,8 mg / l células ineficiente etiqueta, mientras que las concentraciones de ADN de más de 2 mg / m yu, l no ha mejorado la eficiencia de la electroporación].
Morfolino oligonucleótidos preparación:
(Nota:. OM deben ser fluoresceinado (3'-carboxifluoresceína modificados) o acusado de otro tipo)
- Resuspender morfolino oligonucleótidos (OM) (GeneTools, www.genetools.com ) a una concentración de 2 mM de nucleasa libre de H 2 0.
- Alícuota de la solución madre de calor a 65 ° C durante 5 minutos.
- Se diluye a la concentración final de 0,5 mM en agua libre de nucleasa.
* 0.1-1mm soluciones MO fueron probados. 0,5 mM soluciones MO fueron suficientes para la electroporación de muchas células mesenquimales.
Micropipetas
- Prepare micropipetas de vidrio de borosilicato capilares (1 mm de ancho, 4 "de largo, no WPI. TW100-F). Utilice extractor de aguja para preparar micropipetas con un cono 8-12 mm de largo y de punta fina.
- Aplastar a punta de ~ 2 mmde la punta con las pinzas, la creación de una ruptura irregulares.
Medios de comunicación
- Medio de incubación: Preparar fresca 3.4 normal de Medios Anfibios (NAM) de 1x de valores. Añadir 0,025 mg / ml de gentamicina.
- Los medios de comunicación de la electroporación: como el anterior, con el 0,1% de benzocaína (Sigma, 06950).
2. Electroporación
Micropipeta de configuración
- Rellene micropipeta con una solución inyectable ~ l.
- Seguro micropipeta en micromanipulador y se unen a microinyector (Picospritzer II).
- Micropipeta ángulo a 50 ° de la mesa.
- Ajuste la presión de inyección a 20 PSI.
- Calibrar micropipeta para inyectar 30 nl por impulso.
Tadpole preparación
- Anestesiar etapa 28 larvas de Xenopus incubando en los medios de comunicación de la electroporación por 5 minutos.
- Transferencia de renacuajo anestesiado en la cámara de electroporación llena de medios de comunicación de la electroporación. La posición del embriónen el tiempo y modo que la cabeza se apoya en el cruce con la cara dorsal hacia abajo y la parte ventral expuesta. La cabeza debe estar ligeramente elevada en comparación con la cola.
- Con unas pinzas, suavemente seguro renacuajo bien en los alrededores de plastilina. (Nota:.. Si el renacuajo no está asegurada, puede contracción y contacto de los electrodos durante la electroporación En este caso, descartar el renacuajo como pañuelos de papel se verá seriamente dañada)
Electroporación
- Inserte la punta de micropipeta inmediatamente posterior a la glándula de cemento y en mesénquima facial.
- Inyectar la solución de 30 nl en mesénquima.
- Retraer micropipeta.
- Alinear rápidamente puntas de los electrodos paralelos a la cabeza del embrión (Fig. 3).
- Aplicar 8 50 ms, legumbres 20mV cuadrados.
- Retraer los electrodos.
- El uso de pinzas cuidadosamente liberación renacuajo de bien y de transferencia de hasta 3 / 4 NAM, 0,025 mg / ml de gentamicina.
- Los renacuajos pueden ser incubados en 3 / 4 NAM, 0,025 mg / ml Overnight, o más.
- Seleccionar embriones para la electroporación eficiente mediante microscopía de fluorescencia después de 24 horas.
3. Los resultados representativos:
El uso de moléculas fluorescentes permite la detección fácil de embriones electroporated. La figura 4 muestra un lote típico de MO electroporated renacuajos ~ 12, 48 y 96 horas después de la electroporación, se incubaron a 14,5 ° C. Mediante microscopía de fluorescencia, OM se puede visualizar inmediatamente después de la electroporación y persistir durante varios días después de la electroporación. En nuestra experiencia, la fluorescencia es débilmente evidente en la etapa 46 (~ 5 días después). En los cartílagos, la fluorescencia disminuye dramáticamente después de la aparición de la diferenciación (~ º 42), sin embargo, MO fluorescencia persiste con más fuerza en otros tipos celulares, como el endodermo faríngeo. Microscopía de fluorescencia muestra que los oligonucleótidos se incorporan en varios tejidos craneofaciales incluyendo el cartílago. Oligonucleótidos c fluorescenciaa menudo un ser visualizado en el tejido en ambos lados de la cabeza. Esto es probablemente debido a la rápida difusión de la solución inyectable en todo el mesénquima craneofacial sueltos antes de la electroporación.
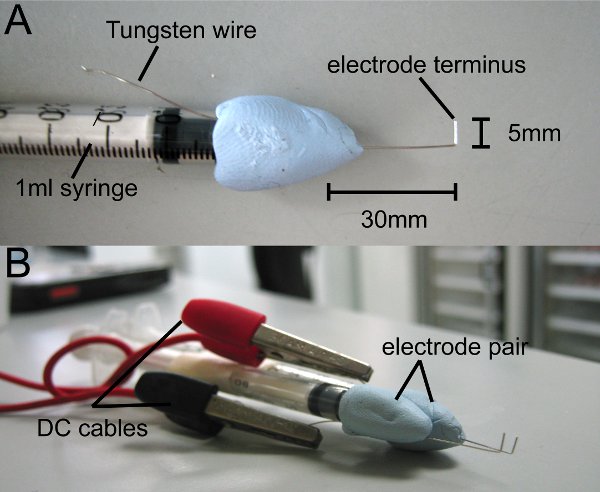
Figura 1 electrodos hechos en casa. En forma de L de alambre de tungsteno es conectada a una jeringa de 1 ml con no-tóxico de barro o masilla. (A) El término del electrodo mide 5 mm. (B) Coloque un par de electrodos, de modo que los extremos son paralelas. Electrodos se conectan al generador de impulsos a través de cables de CC.

Figura 2 cámara de electroporación. (A) 90 mm plato forrado con plastilina está lleno de medios de comunicación y una cámara en forma de T tallada con fórceps No relojero de 5 años. (B) El lado más largo mide 2 mm x 2 mm X10 mmmientras que las medidas sólo 2 mm x 2 mm x 5 mm. La cabeza del embrión se basa en el cruce, la parte ventral hacia arriba.
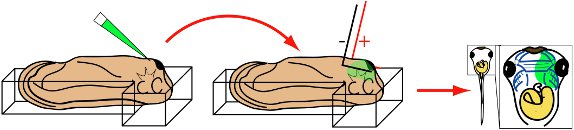
Figura 3 Esquema que ilustra el procedimiento de electroporación. St. 28 renacuajo se coloca en la cámara de electroporación, lado ventral hacia arriba. Micropipeta se inserta en la glándula de cemento facial mesénquima subyacente. Inyectar. Micropipeta se elimina en forma de L y los electrodos están alineados en paralelo que flanquean la cabeza. Aplicar ocho de 50 ms, 20 mV pulsos cuadrados. Retraer los electrodos. Renacuajos crecen en etapas deseado. Visualizar OM o la expresión de GFP mediante microscopía de fluorescencia.
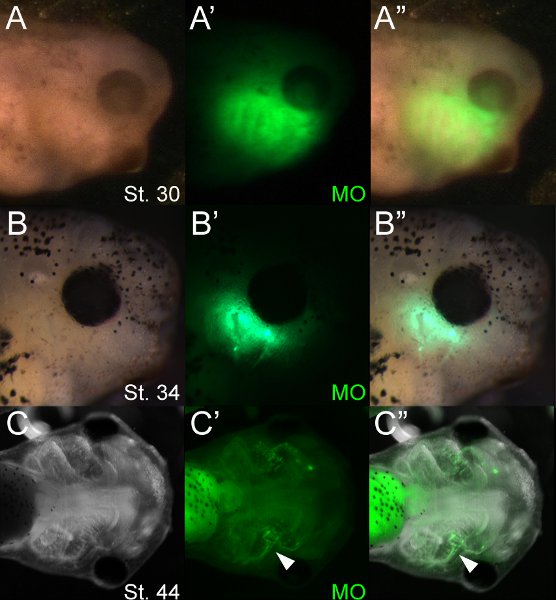
Figura 4 renacuajos Representante 12 (A), 48 (B) y 96 (C) horas después de la electroporación (etapas 30, 34 y 44, respectivamente). (A "B") MO fluorescente se puede visualizar en mesénquima craneofacial en el ciervoes 30 y 34. La fluorescencia se puede detectar en los cartílagos en la etapa 44 (punta de flecha, C '-C "). El intestino es muy autofluorescentes.
Discusión
En este vídeo, hemos demostrado la viabilidad de la entrega de genes mediada por electroporación en el mesénquima facial de los renacuajos Xenopus. El uso de este enfoque, podemos evitar los primeros efectos del desarrollo de la manipulación de la función del gen que nos permite apuntar tejidos específicos en momentos posteriores. Nuestros estudios muestran que la población heterogénea de células mesenquimales craneofacial puede verse afectada, lo que nos permite estudiar el linaje de las células por electroporación, así como los requisitos de la célula autónoma de las proteínas de interés. Combinado con imágenes en vivo, se puede utilizar este método para estudiar la función génica, con el tiempo, durante el desarrollo craneofacial. Este nuevo método pone de manifiesto la maleabilidad de Xenopus para el estudio de la organogénesis. Creemos que este método puede ser adaptado ampliamente para estudiar la morfogénesis y la diferenciación de otros tejidos.
Divulgaciones
Los autores no tienen conflicto de intereses.
Agradecimientos
Estamos muy agradecidos a Nancy Papalopulu y Boyan Bonev de asistencia con la electroporación Xenopus. También queremos agradecer a Marc Dionne para la lectura crítica, Green y Jeremy John Wallingford útil para los debates y los miembros del laboratorio de Liu por su apoyo. Este trabajo fue financiado por becas de la BBSRC (BB/E013872/1) y el Wellcome Trust (081880/Z/06/Z) para KJL.
Referencias
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20, 19-32 (2011).
- Haas, K. Single-cell electroporation for gene transfer in vivo. Neuron. 29, 583-591 (2001).
- Calegari, F. Tissue-specific RNA interference in post-implantation mouse embryos using directional electroporation and whole embryo culture. Differentiation. 72, 92-102 (2004).
- Drinjakovic, J. E3 ligase Nedd4 promotes axon branching by downregulating PTEN. Neuron. 65, 341-357 (2010).
- Falk, J. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC. Dev. Biol. 7, 107-107 (2007).
- Hewapathirane, D. S., Haas, K. Single Cell Electroporation in vivo within the Intact Developing Brain. J. Vis. Exp. (17), e705-e705 (2008).
- Kuriyama, S. Tsukushi controls ectodermal patterning and neural crest specification in Xenopus by direct regulation. of BMP4 and X-delta-1 activity. Development. 133, 75-88 (2006).
- Mende, M., Christophorou, N. A., Streit, A. Specific and effective gene knock-down in early chick embryos using morpholinos but not pRFPRNAi vectors. Mech. Dev. 125, 947-962 (2008).
- Neumann, E. Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo. J. 1, 841-845 (1982).
- Price, S. R. Regulation of motor neuron pool sorting by differential expression of type II cadherins. Cell. 109, 205-216 (2002).
- Grossin, L. Direct gene transfer into rat articular cartilage by in vivo electroporation. Faseb. J. 17, 829-835 (2003).
- Khoury, M. A comparative study on intra-articular versus systemic gene electrotransfer in experimental arthritis. J. Gene. Med. 8, 1027-1036 (2006).
- Takahashi, D. Down-regulation of cathepsin K in synovium leads to progression of osteoarthritis in rabbits. Arthritis. Rheum. 60, 2372-2380 (2009).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Wheeler, G. N., Brandli, A. W. Simple vertebrate models for chemical genetics and drug discovery screens: lessons from zebrafish and Xenopus. Dev. Dyn. 238, 1287-1308 (2009).
- Turner, D. L., Weintraub, H. Expression of achaete-scute homolog 3 in Xenopus embryos converts ectodermal cells to a neural fate. Genes. Dev. 8, 1434-1447 (1994).
Erratum
Formal Correction: Erratum: Electroporation of Craniofacial Mesenchyme
Posted by JoVE Editors on 6/28/2013. Citeable Link.
A correction was made to Electroporation of Craniofacial Mesenchyme. There was an incorrect unit used for the voltage.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados