Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolos para la inoculación dentro de la vagina y toma de muestras en el modelo experimental de ratón de Candida Vaginitis
En este artículo
Resumen
Las principales técnicas que se utilizarán en la evaluación de Candida en un modelo animal experimental se describen. Los métodos permitirá una rápida recolección de muestras vaginales y los linfocitos de los ganglios de drenaje linfático lumbar. Estas técnicas pueden dar lugar a modelos de ratón de otras enfermedades en el tracto genital inferior femenino.
Resumen
Candidiasis vulvovaginal (CVV), causada por especies de Candida, es una infección micótica de la parte baja del tracto genital femenino que afecta a aproximadamente el 75% de las mujeres sanas durante sus años reproductivos 18,32-34. Los factores predisponentes son el uso de antibióticos, diabetes no controlada y la alteración en los niveles hormonales reproductivos debido al embarazo, anticonceptivos orales o terapia de reemplazo hormonal 33,34. VVC recurrente (RVVC), definida como tres o más episodios por año, afecta a un independiente de 5 a 8% de las mujeres sin factores predisponentes 33.
Un modelo experimental de ratón de la CVV se ha establecido y utilizado para estudiar la patogenia y la respuesta del huésped a la mucosa Candida 3,4,11,16,17,19,21,25,37. Este modelo también se ha empleado para evaluar el potencial terapias antifúngicas in vivo 13,24. El modelo requiere que los animales se mantienen en un estado de pseudoestrus para optarIMAL colonización por Candida / infección 6,14,23. Bajo tales condiciones, los animales inoculados se han detectable carga fúngica vaginal durante semanas o meses. Estudios anteriores muestran un paralelo muy alta entre el modelo animal y la infección humana con respecto a las propiedades inmunológicas y fisiológicas 3,16,21. Las diferencias, sin embargo, son la falta de Candida en la flora vaginal normal y un pH neutro vaginal en los ratones.
Este sentido, demuestran una serie de métodos clave en el modelo de ratón que incluyen vaginitis inoculación vaginal, rápida recolección de muestras vaginales, evaluación de la carga de hongos vaginales, y los preparativos para la extracción de tejido celular / aislamiento. Esto es seguido por resultados representativos para los componentes del flujo vaginal lavado, la carga de hongos, y el drenaje de los rendimientos de los ganglios linfáticos de leucocitos. Con el uso de anestésicos, las muestras de lavado se pueden recoger en múltiples puntos de tiempo en los mismos ratones para la evaluación longitudinal de lainfección / colonización. Además, este modelo no requiere de agentes inmunosupresores para iniciar la infección, lo que los estudios inmunológicos en condiciones de host definidos. Finalmente, el modelo y técnica de cada uno introducido aquí podría dar lugar al uso de las metodologías para examinar otras enfermedades infecciosas del tracto genital femenino (bacterianas, parasitarias, virales) y las respectivas defensas locales o sistémicas.
Protocolo
1. Inoculación vaginal por Candida albicans
- Tres días antes de la inoculación, mientras que la restricción de los animales para exponer el abdomen, se inyectan 100 l de aceite de sésamo contiene 0,1-0,5 mg de β-estradiol por vía subcutánea en el abdomen inferior. Introduzca la aguja de 5 a 10 mm lateral a la piel para minimizar la fuga del sitio de inyección.
La administración subcutánea de estrógenos en la parte inferior del abdomen es óptimo en este modelo debido a la proximidad a la zona genital. Las dosis efectivas pueden variar según las cepas de ratón, las edades o los derivados de los estrógenos. En estudios previos utilizando CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), ratones Balb / c (H-2 d), DBA / 2 (H- 2 d), SJL (H-2 s) en ratones de 6-8 semanas de edad, 0,1 mg/100 l era eficaz evidenciado por el engrosamiento de la pared vaginal, la reducción de la mucosidad vaginal yaumento de desprendimiento de las células epiteliales. Por encima de los ratones tratados con estrógenos en esta concentración muestra la colonización vaginal consistente con Candida. Para la inoculación en ratones de otras cepas y edades, un estudio piloto se recomienda para asegurar la eficacia de los estrógenos en las condiciones modificadas y aumentar la dosis de estrógenos si es necesario.
La solución de estrógeno debe estar preparado fresco cada vez que en el día de la inyección. Para asegurar la solubilidad completa de estrógeno en el aceite de sésamo, mezcle la solución con un mezclador de vórtice y el calor de manera intermitente a 37 ° C. Repetir la inyección cada semana durante el período de estudio. - Para preparar el inóculo, añadir un asa de C. albicans blastoconidia de una subcultura de preparación reciente en Sabouraud-dextrosa agar (SDA) en 10 ml de caldo de peptona-Phytone suplementado con 0,1% de glucosa. Incubar el caldo de cultivo para la fase estacionaria durante 18 horas a 25 ° C en un baño de agua agitando.
- Después de la incubación, recoger ºe caldo de cultivo en un tubo cónico de 15 ml y centrifugar a 800 xg durante 5 min. Lavar el pellet dos veces con PBS estéril.
- Enumerar blastoconidia viables en un hemocitómetro de trypan exclusión del colorante azul. Ajustar la concentración de células a 2,5 x 10 6 / ml (o una concentración de inóculo deseado) en PBS estéril.
- Para estabilizar el ratón, mantenga la base de la cola con dos dedos y levante las caderas hacia arriba para que la abertura vaginal se enfrenta hacia usted (Figura 1A). Lo ideal es que el ratón se coloca sobre una superficie plana integrada (por ejemplo, la jaula superior) para que el ratón puede proporcionar resistencia a la moderación cola.
- Colocar 20 l (o el volumen deseado, no será superior a 20 l) de la suspensión de inóculo mediante la inserción de la punta de la pipeta unos 5 mm de profundidad en el lumen vaginal (fig. 1B). Completar este paso tan rápido y suavemente como sea posible para minimizar el estrés en el ratón.
2. Lavados vaginales
- La eutanasia siguiente (o la anestesia), hedad el ratón hacia abajo por la base de la cola con dos dedos para que la abertura de la vagina queda expuesta.
- El lavado del lumen vaginal mediante la introducción de 100 l de PBS estéril con la aspiración repetida y agitación con una punta de la pipeta. La punta de la pipeta puede taparse con las células. Si esto ocurre, prescindir de las células obstruyendo y continuar con el resto de lavaging PBS en la vagina. Recoger el líquido de lavado dentro de un tubo de microcentrífuga.
- Por otra parte, lavados vaginales se puede realizar en ratones anestesiados con anestesia inhalatoria con isoflurano. Para ello, exponer a los ratones para el isoflurano vaporizado hasta que estén completamente sedado (~ 30 seg.). Mantener a los ratones a la baja en la base de la cola y suavemente lavado el lumen vaginal con 50 l de PBS estéril. Asegúrese de evitar la agitación dura con una punta de pipeta para minimizar el trauma de la vagina durante este procedimiento. Ratones sedados debe recuperarse de la anestesia en 30 segundos de exposición al aire del ambiente.
Isofluranopuede ser vaporizado con un vaporizador de isoflurano y el O 2 (preferido) o un sistema estándar de gotas anestésicas cámara cerrada sin el sistema de vaporizador (requiere una estrecha vigilancia del animal mientras está sedado para evitar la dificultad respiratoria).
Lavados vaginales en ratones anestesiados debe ser el método de elección para longitudinal muestras de lavado en los mismos ratones. Lavaging consecutivos no influyen en la evaluación de la carga de hongos en el tiempo 41.
- Por vía húmeda de montaje en los preparativos, la transferencia de 10 l de líquido de lavado en un portaobjetos de vidrio y observar con un aumento de 400-1000x por microscopía de luz. Además, las fracciones celulares del líquido de lavado se puede teñir para examinar las células y morfologías nucleares. De frotis, la transferencia de 10 l de líquido de lavado en un portaobjetos de vidrio y suavemente propagarse a través de la pared exterior de una punta de la pipeta. Preservar las muestras de frotis con fijador CytoPrep y manchas por la técnica de Papanicolaou estándar (prueba de Papanicolaou). Observe a un aumento de × 400 por microscopía de luz.
3. Cuantificación de la carga fúngica vaginal
- En un 96 y de fondo redondo de placa, transferencia del líquido de lavado en un pocillo de la fila superior y 180 l de PBS estéril en los siguientes cinco pozos de la columna (por la placa).
- Hacer 1:10 diluciones seriadas de líquido de lavado vaginal mediante la transferencia de l 20 de los fluidos del pozo al lado de la columna. Mezcle bien con la aspiración de repetir antes de cada transferencia. Diluciones en serie de hasta 12 muestras de lavado (una fila horizontal completa) se pueden realizar simultáneamente con una pipeta de 12 canales.
- A partir de la dilución más baja, de transferencia de 10 l de la muestra en Sabouraud-dextrosa agar (SDA). Revestimiento de hasta 36 muestras se puede realizar en un plato con SDA preparado en la plaza de placas de Petri con cuadrícula y una pipeta multicanal separación ajustable.
- Enumerar las unidades formadoras de colonias (UFC) después de la incubación a 34 ° C fo 48 h.
4. La extracción de tejido vaginal
- Tras el procedimiento de lavado vaginal, ponga el ratón sacrificados en la espalda y saturar el área de la ingle con un 70% de etanol. Con un par de pinzas, levantar el orificio urinario hacia arriba de modo que la abertura de la vagina queda expuesta.
- Insertar un par de pinzas curvas en el lumen vaginal y localizar el cuello del útero. Mientras que mantiene un agarre firme con las pinzas, extraer el cuello uterino a través de la cavidad vaginal (Figura 2A-C).
- Impuestos Especiales de la vagina en la base de la abertura vaginal y luego quitar el cuello de la vagina con una tijera quirúrgica. Tenga en cuenta que el tejido vaginal se involucionado (interior del epitelio del lado de la vagina está expuesta hacia el exterior). El tejido puede ser invertida lateralmente para mantener la orientación original de la vagina o se abre en una hoja haciendo una incisión lateral.
Extirpado tejido vaginal puede ser utilizado para: 1) la extracción de linfocitos collage siguientesnase la digestión (~ 1 × 10 4 / ratón) 40, 2) el aislamiento de células epiteliales después de la digestión dispasa (~ 5 × 10 4 / ratón) 28, 3) preparaciones congeladas o incluidas en parafina para el análisis histológico 25.
5. Linfáticos lumbares escisión nodo
- Tras el procedimiento de lavado vaginal, ponga el ratón sacrificados en la espalda y saturar el abdomen con un 70% de etanol. Haga una incisión lateral a partir de la parte inferior del abdomen hasta el pecho y exponer a los órganos internos. Con un par de pinzas en ambas manos, mueva el intestino hacia arriba de manera que los vasos sanguíneos centrales se hacen visibles.
- Localizar la vena cava inferior y la aorta abdominal. Normalmente, un par de ganglios linfáticos lumbares se pueden identificar junto a la aorta abdominal, que se encuentra a medio camino entre el origen de las arterias ilíacas comunes y renal 39. Estos ganglios linfáticos se pueden distinguir visualmente a partir de tejido adiposo en la textura elásticay son más ligeros y más opaco de color en comparación con el tejido adiposo (Figura 3). Estos ganglios son perceptiblemente más grandes en los animales infectados en comparación con animales no inoculados.
- Los impuestos especiales de los ganglios linfáticos mediante la colocación de microforceps en el nodo y luego tire hacia arriba suavemente para separar del tejido circundante.
6. Aislamiento de células linfoides en una sola célula suspensiones
- La transferencia de los ganglios linfáticos en una pantalla de malla de alambre estéril (aproximadamente 3 x 3 cm 2 en tamaño) colocado dentro de un vaso estéril placa de Petri que contiene aproximadamente 10 ml de solución salina balanceada de Hanks (HBSS) (Figura 4).
- Con la placa de Petri ligeramente inclinadas, de prensa de los ganglios linfáticos en contra de la pantalla con una cabeza de émbolo de la jeringa. Asegúrese de que para romper todos los ganglios linfáticos por lo que el contenido celular de los nodos pasan a través de la pantalla, mientras que los componentes no celulares de los nodos (es decir, las membranas, el estroma, la grasa) se mantienen en la pantalla.
- Utilizando el mismo émbolo y la jeringa, aspire tHBSS que las células que contienen. Lavar la pantalla con ~ 5 ml HBSS y recoger el líquido que queda en un tubo cónico de 15 ml.
- Centrifugar a 800 xg durante 10 min. Aspirar los depósitos de grasa en la parte superior del líquido con una pipeta antes de desechar el líquido. Lavar el pellet de células tres veces con HBSS. Resuspender el precipitado en 1 ml de HBSS y enumerar células viables por exclusión del colorante azul de tripano.
7. Los resultados representativos:
Las fracciones celulares del líquido de lavado vaginal de> 4 días de los ratones inoculados por lo general constan de Candida, las células epiteliales y los infiltrados celulares (Figura 5). Por vía húmeda de montaje en la microscopía, la Candida puede ser identificado visualmente por la presencia de hifas y levaduras (Figura 5). Frotis de líquido de lavado vaginal puede ser teñido por la técnica de Papanicolaou para examinar las células epiteliales y la infiltración de leucocitos, de los cuales las células principales son los neutrófilos identificados por el tri-nuclear lóbulos (Figura 5). Neutrófilos muy pocos, en su caso, se detectan en los ratones inoculados (Figura 5) 41.
Un ejemplo de la carga de hongos vaginales se muestra en la Figura 6. Flujo vaginal lavado recogido en momentos específicos se cultivan para el recuento de UFC (Figura 6). Colonización vaginal / infección con Candida persiste durante semanas en los pacientes tratados con estrógeno ratones inoculados (Figura 6), mientras que Candida no logra establecer la colonización vaginal no tratadas con estrógeno-ratones inoculados (Figura 6). Tratadas con estrógeno-ratones inoculados siguen siendo negativos para Candida lo largo del tiempo (datos no mostrados). Además, los lavados vaginales se puede realizar una sola vez en ratones por separado en cada momento o de forma longitudinal en los mismos ratones bajo anestesia.
Los ganglios linfáticos lumbares son los principales ganglios linfáticos de drenaje de la zona genital y el sitio más relevante para evaluar la respuesta inmune sistémica a un problema vaginal. Note que estos ganglios linfáticos pueden aumentar de tamaño en los ratones inoculados, mientras que las que figuran normalmente muy pequeñas en los ratones inoculados. Leucocitos recuperaciones celulares suelen oscilar entre 8 x 10 5 / ratón inoculado con 5 × 10 6 / ratón inoculado. Además de los ganglios linfáticos lumbares, los ganglios linfáticos inguinales, poplítea y mesentérica también puede ser utilizado.
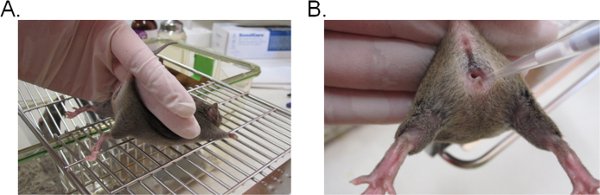
Figura 1. Inoculación vaginal con Candida. A) Un ratón restringido para la inoculación. El ratón es colocado en una jaula de alambre y de inserción en poder de la base de la cola, ligeramente hacia arriba para levantar las piernas y los exponen a la apertura vaginal. La cadera del ratón se pueden estabilizar con la misma mano en su intento de resistirse a la moderación cola. B) Presentación del inóculo en el lumen vaginal. A punta de la pipeta se introduce suavemente unos 5 mm de profundidad en el lumen vaginal. El inóculo suspensión se deposita.
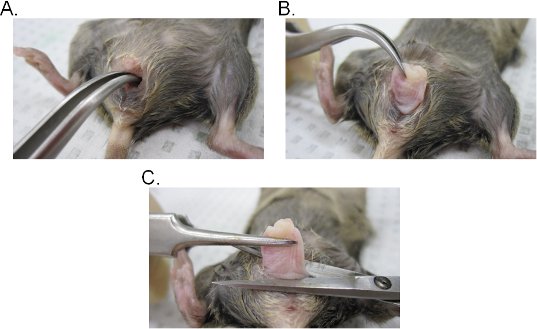
Figura 2. Extracción de tejido dentro de la vagina. AB) Extracción de cuello del útero. El cuello uterino se encuentra con pinzas curvas y expuestos hacia el exterior a través de la cavidad vaginal. Una vez fuera de la cavidad vaginal, el cuello del útero está más tirado hacia fuera para exponer completamente la vagina. C) La extracción de la vagina. La vagina es eliminado de la vulva con una tijera. Una vez separados, eliminar el cuello de la vagina.

Figura 3. Identificación de los ganglios linfáticos lumbares. La ubicación de los ganglios linfáticos lumbares entre los órganos que lo rodean / vasos sanguíneos en las inmediaciones de la pelvis se indica. Una aorta abdominal. B, de la vejiga urinaria. C, la arteria ilíaca común. I, de los intestinos. L, el hígado. R, el recto. S, el bazo. U, úteros.

Figura 4. Los ganglios linfáticos lumbares coloca en un tamiz de malla de alambre. Los ganglios linfáticos están agrupados en la pantalla colocada en una placa de Petri con HBSS. Los ganglios linfáticos se presionan contra la pantalla con un émbolo de la jeringa para obtener células linfoides en una sola célula suspensiones.
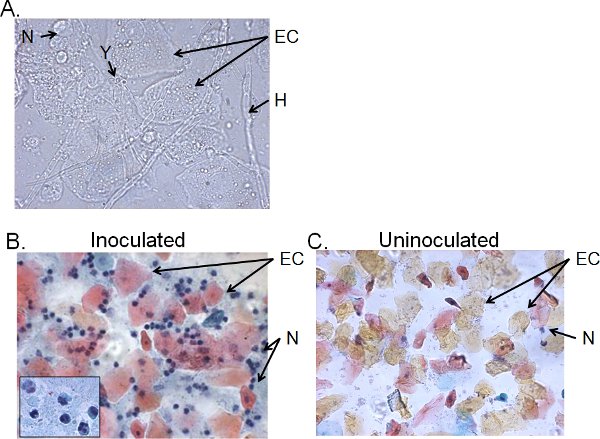
Figura 5. Fracciones celulares de fluido vaginal lavado de los ratones inoculados. Preparaciones A) en húmedo montaje y B) la prueba de Papanicolaou de muestras de lavado vaginal recogido cuatro días después de la inoculación y C) de los ratones inoculados. Se muestran las imágenes a 1000 × (A) o 400 × (B, C) de aumento. La inserción en el B se muestra la morfología nuclear de los neutrófilos a 1000 × vaginal. Candida de la levadura (Y) e hifas (H), las células epiteliales (CE) y neutrohils (N) se indican.
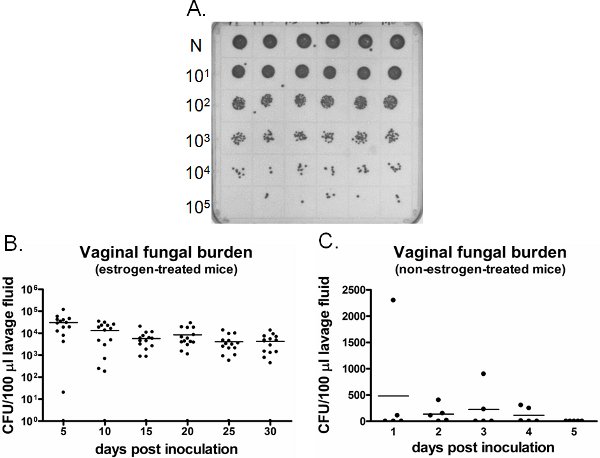
Figura 6. Detectarion de carga fúngica vaginal. A) Las colonias de C. albicans Representante crecido en una placa de SDA. Puro (N) muestras de lavado de seis ratones inoculados diferentes (fila superior) se diluye en serie y se cultivan para el recuento de UFC. B) Cuantificación de la carga fúngica vaginal de estrógeno-tratados y C) los ratones no tratados con estrógenos. UFC/100 l de líquido de lavado de los ratones inoculados se evaluó en intervalos de tiempo indicados.
Discusión
Un modelo experimental de ratón de la vaginitis por Candida se ha establecido y utilizado históricamente para las últimas décadas para estudiar la respuesta del huésped a la mucosa Candida, así como para las pruebas de terapias antifúngicas 3,4,11,13,16,17,19,21,24, 25,37. Los protocolos que aquí se presenta incorpora eficientes y los métodos menos mano de obra, y parece ser uno de los sistemas modelo más optimizada de Candida vaginitis descrito hasta la fecha. Estas técn...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el R01 AI32556 (NIAID, Instituto Nacional de Salud). Este trabajo también fue apoyado en parte por Louisiana vacuna centro y sur de Luisiana Instituto de Investigación de Enfermedades Infecciosas patrocinada por la Junta de Regentes de Louisiana.
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Mujer CBA / J ratones | Charles River Laboratories | 01C38 | 5-6 semanas de edad |
| Candida albicans (3153A) | Colección Nacional de hongos patógenos, Reino Unido | NCPF3153 | |
| Aceite de sésamo | Sigma-Aldrich | S3547 | No tiene que ser pre-esterilizados antes de su uso |
| Β-estradiol 17-valerato | Sigma-Aldrich | E1631 | 0.1-0.5mg en aceite de sésamo |
| Phytone peptona | Becton Dickinson | 211906 | Suplemento con glucosa al 0,1% |
| Solución de azul tripano | Sigma-Aldrich | T8154 | |
| Sabouraud dextrosa agar | Becton Dickinson | 211584 | |
| Colagenasa tipo IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispasa | Invitrogen | 17105-041 | 1,7 U / ml |
| Pantallas de malla de alambre | TWP | 060X060S0065W36T | N º 60 de malla, de acero |
| Solución salina equilibrada de Hanks | Invitrogen | 24020-117 | |
| CytoPrep fijador | Fisher Scientific | 12-570-10 | Conserva diapositivas frotis |
| Papanicolaou EA-65 | EMD Chemicals | 7054X-85 | |
| Tinción de Papanicolaou OG-6 | EMD Chemicals | 7052X-85 | |
| Hematoxilina de Harris Alum | EMD Chemicals | 638A-85 | |
| Isoflurano | Baxter Healthcare | NDC 10019-773-60 | Se utiliza con vaporizador isoflurano o en un sistema cerrado anestésico cámara baja |
Referencias
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados