Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
De alto rendimiento de cristalización de proteínas de membrana Utilizando el Método lipídico Bicelle
En este artículo
Resumen
Bicelles son mezclas de lípidos / anfifilo que mantienen las proteínas de membrana (MP) dentro de una bicapa lipídica, pero tienen un comportamiento de fase única que facilita la selección de alto rendimiento de los robots de cristalización. Esta técnica se ha producido con éxito una serie de alta resolución de estructuras de ambas fuentes procariotas y eucariotas. Este vídeo describe los protocolos para la generación de la mezcla lipídica bicelle, la incorporación de los diputados en la mezcla de bicelle, el establecimiento de ensayos cristalizaciones (de forma manual, así como un robot) y los cristales de la cosecha de la media.
Resumen
Las proteínas de membrana (MP) juegan un papel crítico en muchos procesos fisiológicos tales como el bombeo de moléculas específicas a través de la bicapa de la membrana impermeable de lo contrario que rodea todas las células y orgánulos. Alteraciones en la función del resultado de los parlamentarios en muchas enfermedades y trastornos humanos, por lo tanto, una comprensión compleja de sus estructuras sigue siendo un objetivo fundamental para la investigación biológica. Sin embargo, la determinación de la estructura de los diputados sigue siendo un reto significativo a menudo se derivan de su hidrofobia.
Los diputados tienen importantes regiones hidrofóbicas incrustado dentro de la bicapa. Los detergentes son utilizados para solubilizar las proteínas de la bicapa de la generación de una micela proteína-detergente, que luego pueden ser manipulados de una manera similar a las proteínas solubles. Tradicionalmente, los ensayos de cristalización proceder con una mezcla de proteínas-detergente, pero a menudo se resisten a la cristalización o producir cristales de mala calidad. Estos problemas surgen debido a lala incapacidad del detergente para imitar adecuadamente las dos capas que resulta en una pobre estabilidad y la heterogeneidad. Además, los escudos de detergente de la superficie hidrofóbica del MP la reducción de la superficie disponible para los contactos de cristal. Para evitar estos inconvenientes los parlamentarios se pueden cristalizar en los medios de lípidos, lo que más simula el entorno endógeno, y se ha convertido recientemente en una técnica de novo para la cristalización MP.
Lipídica fase cúbica (LCP) es una bicapa lipídica de tres dimensiones penetrado por un sistema interconectado de canales acuosos 1. Aunque monoolein es el lípido de la elección, los lípidos relacionados, como monopalmitolein monovaccenin y también se han utilizado para hacer LCP 2. Los diputados se incorporan a la LCP, donde se difunden en tres dimensiones y núcleos cristalinos de alimentación. Una gran ventaja de la LCP es que la proteína permanece en un ambiente más nativos, pero el método tiene una serie de inconvenientes técnicos, incluyendo visc altaosity (que requieren aparatos especializados) y las dificultades en la visualización de cristal y la manipulación de 3,4. Debido a estas dificultades técnicas, se utilizó otro medio lipídico para la cristalización-bicelles 5,6 (Figura 1). Bicelles son mezclas de lípidos / anfifilo formado mediante la mezcla de un lípido fosfatidilcolina (DMPC), con un anfifilo (CHAPSO) o un lípido de cadena corta (CDPS). Dentro de cada disco bicelle, las moléculas de lípidos generar una bicapa, mientras que la línea de las moléculas de anfifilo los bordes apolar que proporciona las propiedades beneficiosas de las dos bicapas y detergentes. Es importante destacar que, por debajo de su temperatura de transición, bicelle mezclas de proteínas tienen una viscosidad reducida y se manipulan de una manera similar como solubilizadas en detergente diputados, por lo que bicelles compatible con los robots de cristalización.
Bicelles se han utilizado con éxito para cristalizar proteínas de membrana varios 5,7-11 (tabla 1). Esta colección cada vez mayorde las proteínas demuestra la versatilidad de bicelles para cristalizar tanto alfa como beta helicoidales y los diputados hoja de fuentes procariotas y eucariotas. Debido a estos éxitos y la sencillez de alto rendimiento de la aplicación, bicelles debe formar parte del arsenal de todo cristalógrafo proteínas membrana. En este video, se describe la metodología bicelle y proporcionar un protocolo de paso a paso para la creación de alto rendimiento de los ensayos de cristalización de los diputados purificada mediante robots estándar.
Protocolo
Cristalización Bicelle base se compone de cuatro pasos básicos (Figura 2): i) la elaboración de un lípido bicelle formación: anfifilo mezcla, ii) la incorporación de la proteína purificada en el medio bicelle; iii) los ensayos de cristalización (manual o robotizada), y iv) visualización, cristal de extracción y congelación. Estos pasos se describen en detalle a continuación
1. Preparación de Bicelles
Bicelles se pueden formar en una variedad de lípidos: combinaciones anfifilo y en un amplio rango de concentraciones. Por lo tanto, una composición basada en el anterior éxito inicial de las condiciones, se recomienda (Tabla 1). La mezcla de más éxito es la DMPC: CHAPSO formulación bicelle, que puede ser comprado comercialmente como un premezclado listo para usar la formulación (ver cuadro de los reactivos a continuación) o preparadas en el laboratorio como se describe. Para este ejercicio vamos a preparar 1 ml de 35% DMPC: mezcla CHAPSO en una proporción molar de 2,8:1.
- Pesar 0,26 g DMPC (Sr. 677,9 g / mol), 0,09 g CHAPSO (Sr. 630,9 g / mol) y añadir agua destilada hasta un volumen final de 1,0 ml.
- El porcentaje bicelle puede variar entre 10% -40%, con un DMPC: CHAPSO relación molar que va de 2.6-3.0:1 (Tabla 1).
- Nota: Cuanto mayor sea la concentración bicelle más difícil es la disolución de los lípidos que resulta en una mayor viscosidad de la solución. Sin embargo, un concentrado de formulación bicelle puede ser ventajoso cuando la concentración de proteínas es bajo.
- Disolución de los lípidos para obtener una solución homogénea requiere un esfuerzo considerable, por lo que este paso la mayor parte de tiempo en el método bicelle. Ciclo a través de los siguientes pasos hasta que la DMPC se mezcla por completo:
- Calentar la mezcla a 40 ° C usando un baño de agua o una incubadora y el vórtice de ~ 1 minuto.
- Nota: A medida que los ciclos se llevan a cabo, el calentamiento de la mezcla se traducirá en una estafa similar al gelconsistencia por lo que es difícil de vórtice.
- Enfriar la mezcla de hielo y agitar durante unos minutos. Refrigeración ayuda a licuar la solución por lo que es más fácil de vórtice.
- Nota: A medida que los ciclos se llevan a cabo, la mezcla puede volverse turbia al enfriarse.
- Repita los pasos anteriores (1.2.1 y 1.2.2) hasta que los lípidos se disuelva por completo.
- Nota: Este proceso puede tardar varias horas. Formación Bicelle es indicado por los cambios en el comportamiento de las fases de la DMPC: formulación CHAPSO. Al terminar, la mezcla será un gel transparente en o por encima de la temperatura ambiente y un líquido viscoso en el hielo.
- Calentar la mezcla a 40 ° C usando un baño de agua o una incubadora y el vórtice de ~ 1 minuto.
- La mezcla de bicelle ya está listo para usar y puede ser conservada a -20 ° C para el almacenamiento a largo plazo (hasta 5 años). Debido al riesgo de la hidrólisis del grupo de cabeza de fosfolípidos, que no es recomendable para almacenar bicelles a temperatura ambiente durante largos períodos de tiempo.
2. La incorporación de la proteína en bicelles
La mayoría de las estructuras MP obtenidos a partir de bicelles se cristalizaron en DMPC: CHAPSO concentración bicelle que van desde 2 a 8% con una concentración de proteína de 8 a 12 mg / ml (Tabla 1). Si es posible, pantallas iniciales deben utilizar estas directrices y las concentraciones adicionales pueden ser examinados en la fase de optimización. En comparación con el método de LCP, la incorporación de proteínas con bicelles es un proceso simple (Figura 3), que debe hacerse el mismo día de ensayos de cristalización.
- Descongele la DMPC: CHAPSO mezcla bicelle a temperatura ambiente hasta los cambios de fase de un gel transparente.
- Nota: Varios de congelación y deshielo no afecta el comportamiento bicelle.
- Colocar la mezcla en hielo para licuar y agitar brevemente para restablecer una fase homogénea bicelle. Cuando se coloca en el hielo, la mezcla puede llegar a ser nublado.
- From este punto, mantener la mezcla bicelle y la proteína purificada en el hielo. Esto evitará que la bicelle en una fase líquida por lo que es susceptible de pipeteo.
- Añadir la mezcla de bicelle a la purificada detergente solubiliza proteínas en un 1:4 (V / V) la relación.
- Por ejemplo: 100 l de proteínas bicelle mezcla se obtiene mediante la mezcla de proteína de 80 l con 20 l bicelle. Si la concentración de proteínas es de 15 mg / ml y la concentración bicelle es del 35%, esto le dará una mezcla de proteínas-bicelle incorporado con una concentración de proteínas de 12 mg / ml y una concentración bicelle del 7%.
- Mezclar suavemente el contenido de pipeteo arriba y hacia abajo hasta que la solución se vuelva clara y homogénea.
- Nota: Si aparecen burbujas, una vuelta rápida (30-60 segundos, 13000 rpm, 4 º C) con una centrífuga de mesa puede ayudar a eliminarlas.
- Incubar la mezcla en hielo durante al menos 30 minutos para promover la plena incorporación de proteína de into bicelles. La mezcla de proteínas bicelle ya está listo para los ensayos de cristalización.
3. El establecimiento de ensayos de cristalización
Otras técnicas de cristalización de lípidos como el LCP requieren equipo especializado debido a la alta viscosidad del medio, pero el comportamiento de fase única de bicelles permite la aplicación en prácticamente cualquier formato estándar de la cristalización, la robótica (Figura 3). Ensayos de cristalización puede llevarse a cabo tanto en la horca o sentado formatos soltar con las pantallas de los disponibles en el mercado.
- Si la creación de bandejas manualmente o con un robot de cristalización, mantener la mezcla de proteínas-bicelle en el hielo. Esto evitará que el frío mezcla de proteínas-bicelle y asegurar que la viscosidad de la solución es mínima.
- Ensayos Manual de cristalización - Con una pipeta estándar, la mezcla de proteínas bicelle se puede mezclar con una solución de reserva de la misma manera como realizan normalmenteed de proteínas de membrana soluble o solubilizada en detergente.
- Nota: Mantenga la mezcla de proteínas-bicelle en el hielo durante los ensayos.
- Los ensayos de cristalización robótica - Hemos diseñado estos ensayos para que el robot de cristalización de mosquitos, pero en principio (después de las mismas precauciones), la técnica debe ser compatible con todos los robots de cristalización. Los siguientes consejos se asegurará de que la mezcla de proteínas bicelle se mantiene fresco y con precisión una pipeta por el robot:
- Preenfriar la placa de sujeción de la mezcla de proteínas-bicelle colocándolo en el hielo.
- Pipetear la mezcla de proteínas-bicelle en la placa y seguir manteniendo la placa de hielo. Este plato debe ser el último elemento para ir en el robot antes de comenzar la carrera.
- Puesta en marcha de la bandeja de depósito y las tapas de cristalización en la plataforma de 3 y 5, respectivamente, del robot mosquito.
- Colocar la placa que contiene proteínas bicelle mezcla en la plataforma 4del robot mosquito. Esto asegura que la mezcla de proteínas-bicelle es el último en ser recogidos por el robot y es puesto en libertad inmediatamente.
- Para evitar un calentamiento y aumento de la viscosidad, no se mezclan el depósito con la mezcla de proteínas bicelle.
- Cuando se realizan múltiples pantallas, de inmediato a la placa bicelle en proteínas de hielo para enfriar tan pronto como ya terminada la carrera.
- Volumen de la gota y la relación (proteínas: depósito) pueden ser elegidos como para los ensayos de cristalización convencional. Por ejemplo, los ensayos iniciales de cristal con el robot de mosquitos pueden ser establecidas con 0,25 l de proteínas: mezcla bicelle más 0,25 l embalse.
- Incubar los ensayos de cristal en una cámara a 20 º C. La temperatura es una buena selección y optimización de parámetros debido a que el comportamiento de la fase de bicelles depende de la temperatura.
- Las temperaturas más altas inducen la fase laminar 12 (Figura 1), que tiene la ventaja de pre-organizaciónla proteína en capas. Temperaturas inferiores a 20 ° C pueden ser revisados, pero usted no debe ir por debajo de 4 ° C ya que esto puede causar que los lípidos para precipitar durante largos períodos de tiempo.
- De la misma manera como los ensayos de cristalización tradicionales, los ensayos bicelle deben ser controlados de forma regular para la aparición y crecimiento de cristales. Se recomienda comprobar las bandejas en la 1 ª y 3 º día posterior a la instalación seguido de una inspección semanal.
- Optimización de cristal puede ser llevado a cabo utilizando métodos de rutina utilizados para los cristales de detergentes incluyendo la investigación la red, la detección de aditivos, el cambio de temperaturas, etc Además, el porcentaje bicelle y proteínas: relación bicelle puede variar. Además, bicelles puede ser dopado con lípidos específicos que puedan ser necesarios para la estabilidad de la proteína o la función.
4. Visualización, cristal de extracción y congelación
Dado que los ensayos de cristal con la mezcla de proteínas-bicelle tiene una viscosidad similar a las gotas de detergente en proteínas, la visualización y extracción de cristal es de rutina y se lleva a cabo como las tradicionales configuraciones.
- Visualización: A diferencia de los medios de comunicación LCP que a menudo requiere de alta calidad de iluminación con la luz normal y polarizada para la detección de cristal, la visualización no se vea obstaculizado por bicelles. Gotas de proteínas de colores, así como cristales incoloros pueden ser fácilmente analizados utilizando microscopios estándar y no requiere equipo especial es.
- Bicelles, al igual que otros medios de lípidos, tienden a producir un alto porcentaje de falsos positivos. Un microscopio UV ayuda mucho en la diferenciación de las proteínas a partir de cristales de sal (Figura 4).
- Extracción y congelación: la extracción de cristal y la congelación es relativamente sencillo y no requiere la disolución de los medios de comunicación bicelle alrededores. Además, la fase de bicelle sí ofrece algunos moderados crio-protección.
5. Los resultados representativos:
nt "> Por lo general, tarda 2-3 días para los cristales que aparecen y aproximadamente una semana o más para que puedan crecer a su tamaño máximo. Este fue el caso de bacteriorodopsina y el ratón dependientes de voltaje del canal de aniones 1 (mVDAC1) cristales de 4,8 . Para otras proteínas de membrana que puede tomar varias semanas para que el crecimiento de cristales, lo que es importante continuar monitoreando los ensayos de cristal mucho más allá de las primeras semanas.Al igual que con otros medios lipídicos, bicelles tienden a formar las formas que puede parecer ser cristalina. También se ha observado que conducen a un mayor porcentaje de sal y los cristales de detergente. A UV-microscopio de fluorescencia que detecta el triptófano puede ayudar significativamente a eliminar tales no proteínico de falsos positivos. La figura 4 muestra las formas de lípidos, la sal y cristales de proteínas como se ve en la luz visible y UV para ayudar a distinguir los diferentes resultados que se pueden observar.
83fig1.jpg "/>
Figura 1. Bicelle esquemática. Bicelles se componen de una molécula de bicapa lipídica que forman como DMPC (azul) y un anfifilo como CHAPSO (verde), que protege los bordes hidrofóbica de la bicapa. A medida que la temperatura se incrementa, en forma de disco bicelles someterse a una transformación de fase en un 12 hoja laminar perforada.
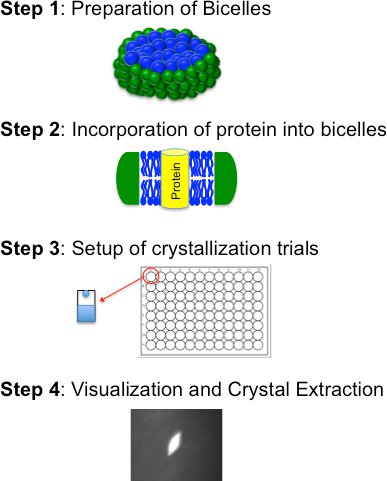
Figura 2. Diagrama de flujo para el método de cristalización bicelle esbozar los cuatro pasos básicos.

Figura 3. Ensayos de cristal puesta en marcha de esquemas. Purificado detergente solubiliza proteínas de la membrana puede ser directamente mezclado con el hielo bicelles simplemente pipetear los contenidos juntos. Después de incubar la mezcla de proteína / bicelle en el hielo para los ensayos de cristalización a 30 minutos,se puede configurar con cualquier formato estándar, incluyendo la robótica.

Figura 4. Visualización de los ensayos de cristal. Imagen visible (arriba) y la imagen ultravioleta (panel inferior) de la (A) la aguja en forma de cristales observados en una condición de la sal solamente. No se puede detectar la fluorescencia de los cristales, una indicación de falsos positivos. (B) en forma de bastón cristal que se forma en una condición de MPD. El cristal de fluorescencia débil pero se encontró que no proteínico usando difracción de rayos X. (C) Crystal observado unas cuatro semanas después de la creación de los juicios. El fuerte fluorescencia bajo luz UV confirma que es un cristal de proteína.
| No. | Proteína | Fuente | Formulación Bicelle | Concentrados de proteínasen | Detergente 1 | Resolución (Å) | Referencia |
| 1 | Bacteriorodopsina 2 | Halobacterium salinarum | 8% DMPC: CHAPSO (2,8:1) | 8 mg / ml | 2.0 | Faham y Bowie, 2002 | |
| 8% DTPC: CHAPSO (3:1) | 8 mg / ml | 1.8 | Faham et al., 2005 | ||||
| 2 | β2-adrenérgico / complejo Fab | Homo sapiens | 8,3% DMPC: CHAPSO (3:1) | 10 mg / ml | DDM | 3.4/3.7 | Rasmussen et al., 2007 |
| 3 | Dependientes de voltaje anión canal 1 | Mus musculus | 7% DMPC: CHAPSO (2,8:1) | 12 mg / ml | LDAO | 2.3 | Ujwal et al., 2008 |
| 4 | Xanthorhodopsin | Salinibacter ruber | 4,2% DMPC, el 5% NM | 4 mg / ml | DDM | 1.9 | Luecke et al., 2009 |
| 5 | Romboidal de la proteasa | Escherichia coli | 2% DMPC: CHAPSO (2.6:1) | 9 mg / ml | Glucósido nonil | 1.7 | Vinothkumar de 2011 |
Un detergente que se usa para la purificación de proteínas de membrana
Dos los lípidos de las membranas nativas morado puede ser llevado a lo largo de durante la purificación
Tabla 1. Resumen de las condiciones de cristalización de estructuras de proteínas de membrana resolver con bicelles.
Access restricted. Please log in or start a trial to view this content.
Discusión
Bicelles son un medio único lipídica que ofrecen un nativo de doble capa como el medio ambiente, mientras se comporta como si solubilizada por detergentes. Esta propiedad ofrece bicelles una clara ventaja sobre otros métodos de cristalización a base de lípidos ya que no hay curva de aprendizaje o el equipo especializado necesario para esta técnica. Una vez bicelles están disponibles, ya sea comercial o preparada en el laboratorio, que puede mezclarse directamente con la proteína purificada y desde este punto en ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría agradecer a los Dres. James Bowie y Faham Salem para proporcionar conocimientos técnicos y la orientación sobre el método y el Dr. bicelle Aviv Paz útil para los debates. Reconocemos Le Du de apoyo experimental. Rachna Ujwal tiene interés financiero en MemX Biosciences LLC, que, sin embargo, no apoyó este trabajo. Este trabajo fue apoyado en parte por subvenciones del NIH (SR1 GM078844).
Access restricted. Please log in or start a trial to view this content.
Materiales

Referencias
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados