Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de ratón de la endometriosis quirúrgicamente inducida por la Auto-trasplante de tejido uterino
En este artículo
Resumen
Una descripción de la inducción quirúrgica de la endometriosis en ratones y ratas por auto-trasplante de tejido uterino de la cascada arterial del mesenterio intestinal.
Resumen
La endometriosis es una enfermedad crónica y dolorosa, cuya etiología permanece desconocida. Además, el tratamiento de la endometriosis puede requerir la extirpación laparoscópica de lesiones y / o la gestión farmacéutica crónica del dolor y los síntomas de la infertilidad. El costo asociado con la endometriosis ha sido estimada en 22 mil millones de dólares por año en los Estados Unidos 1. Para avanzar en nuestra comprensión de los mecanismos subyacentes a esta enigmática enfermedad, los modelos animales han sido empleados. Los primates desarrollan espontáneamente endometriosis y por lo tanto, los modelos de primates más se asemejan a la enfermedad en las mujeres. Modelos de roedores, sin embargo, son más rentables y de fácil acceso 2. El modelo que se describe aquí implica una transferencia autóloga del tejido uterino en el mesenterio intestinal (Figura 1) y se desarrolló por primera vez en la rata 3 y luego a la del ratón 4. El objetivo del modelo de roedores autólogo de endometriosis quirúrgicamente inducido es para imitarla enfermedad en las mujeres. Nosotros y otros han demostrado previamente que el patrón de expresión de genes alterado observado en las lesiones de endometriosis de los ratones o las ratas espejos que se observa en las mujeres con la enfermedad 5,6. Una de las ventajas de realizar la cirugía en el ratón es que la abundancia de cepas de ratones transgénicos disponibles puede ayudar a los investigadores para determinar el papel de determinados componentes importantes en el establecimiento y crecimiento de la endometriosis. Un modelo alternativo en el que extirpar los fragmentos de endometrio humano se introducen en el peritoneo de los ratones inmunodeprimidos también es ampliamente utilizado, pero está limitada por la falta de un sistema inmune normal que se cree que es importante en la endometriosis 2,7. Es importante destacar que el modelo de ratón de la endometriosis inducida quirúrgicamente es un modelo versátil que se ha utilizado para estudiar cómo el sistema inmune 8, 9,10 hormonas y los factores ambientales afectan a 11,12 endometriosis, así como los efectos de la endometriosis en fertility 13 y el dolor 14.
Protocolo
1. La planificación de la cirugía de animales vivos
- Asegúrese de que la aprobación correspondiente se ha recibido para trabajar con animales de laboratorio.
- Para los ratones y permitir que al menos una semana de aclimatación a su nuevo entorno.
- Los ratones hembra que encuentra en la ausencia de exposición a las feromonas masculinas pueden dejar de pedalear, un fenómeno que se conoce como el efecto Whitten 15,16. A seguir adelante ratones transferencia empapados de orina masculina ropa a la jaula de las mujeres cada cinco días. Por otra parte, si descapotable se utilizan jaulas, colocar la jaula femenina entre dos jaulas de los machos para mantener a las hembras en bicicleta con regularidad.
- Asegúrese de que los ratones son el ciclismo mediante el análisis de la citología vaginal al día durante al menos una semana antes de la cirugía (tabla 1) 17.
- Use un lápiz de cera para crear ocho particiones en un portaobjetos de vidrio de modo que los frotis vaginales de varios ratones se pueden recoger.
- Lavar la vagina con 0,2-0,25 ml de solución salina normal o agua destilada con un gotero. Se sUre para colocar el cuentagotas justo en el orificio vaginal, como la estimulación del cuello uterino con el cuentagotas podría causar pseudopreñez. Coloque el lavado vaginal en el portaobjetos de vidrio para el análisis de tipos de células. Las diapositivas se pueden leer fresca (húmeda) o fijos, alternativamente, por una serie de métodos y examinados con un microscopio óptico estándar de 17.
- Recopilar, limpiar y esterilizar todo el equipo necesario para una cirugía exitosa cirugía aséptica (véase la Sección de Materiales) 18.
- Prepare una solución de la buprenorfina para la analgesia en PBS utilizando una técnica estéril para entregar 0,2 mg / kg dosis final. La concentración de la solución de la buprenorfina debe ser 0,0333 mg / ml el supuesto de que el adulto promedio C57BL / 6 del ratón pesa unos 0.025 kg y un volumen de inyección subcutánea de 0,15 ml por ratón. La buprenorfina se puede preparar con anticipación y se almacena en alícuotas. Tenga en cuenta que la buprenorfina es una sustancia controlada de la Lista III que requieren un permiso de la DEA y el registro de inventario detallado.
- Preparar PBS estéril con penicilina (100 U / ml) y estreptomicina (100 mg / ml).
- Sincronizar los ciclos de celo por la transferencia de camas empapados de orina masculina a las jaulas de las mujeres 72 horas antes de la inducción 15.
2. Prepare el área quirúrgica para la cirugía de animales vivos
- Prepare el área quirúrgica como se ha descrito anteriormente 18.
- Prepare el área de preparación mediante el establecimiento de maquinillas eléctricas, ungüento oftálmico, y batas quirúrgicas.
- Prepare el área quirúrgica mediante la colocación de una almohadilla de recirculación de calentamiento de agua en el área quirúrgica para mantener la temperatura corporal durante la cirugía. Coloque una gasa estéril impermeable sobre la plataforma de recirculación de calentamiento de agua. Organizar los instrumentos quirúrgicos, suturas estériles de vidrio placa de Petri, de biopsia, gasa estéril, clips de la herida y la herida de aplicador de clip en el campo quirúrgico estéril.
- Prepare el área de recuperación mediante la colocación de recirculación de almohadillas de calentamiento de agua hasta la mitad under una jaula vacía para permitir que los ratones que se mueven lejos del calor, si así lo desea.
3. Anestesiar y preparar el ratón para la cirugía
- Registrar el peso del ratón y determinar la etapa de celo por la evaluación de la citología vaginal.
- Para la inducción de la anestesia, colocar el ratón en una cámara de anestesia vacío (jaula vacía con tapa sólida que contiene portal de isoflurano). Encienda el isoflurano no reinhalación sistema de anestesia y establecer el vaporizador y el 4% de isoflurano (con una tasa de flujo de oxígeno de 0,5 a 1 l / min).
- Cuando el ratón se encuentra bajo anestesia con isoflurano cambiar el flujo a un cono (30-60 vaina jeringa) y la nariz del ratón el lugar y la boca en el cono en la mesa de preparación. Anestesia adecuada se puede mantener con una menor concentración de isoflurano en el resto de la cirugía (~ 2.5-3.5% isoflurano). Una adecuada profundidad de la anestesia debe ser determinada por una respuesta negativa a los estímulos dedo sujetador.
- Aplicar ungüento oftálmico to evitar la resequedad de los ojos durante la cirugía.
- Usando pequeñas maquinillas eléctricas, afeitar el sitio de la cirugía.
- Desinfectar y preparar el sitio de la cirugía con tres golpes alternos de lavado con clorhexidina y el 70% de etanol.
- Coloque los animales con un campo estéril.
4. La ligadura del útero
- Hacer un pequeño (1 cm) incisión mediana utilizando unas tijeras pequeñas o una hoja de bisturí final 0,5 a 1,0 cm rostral a la abertura de la vagina.
- Inserte las tijeras cerradas en la apertura de tal manera que las hojas se encuentran entre la pared del cuerpo y la pared abdominal. Suavemente contundente disección de la zona alrededor de la incisión por la lenta apertura y cierre de las tijeras de tal manera que la pared abdominal es suficientemente separado de la piel. Resto de las adherencias visibles entre la pared abdominal y la piel alrededor de la incisión puede ser cuidadosamente cortado. La falta de adecuada disección roma de la incisión se hace el cierre de la pared abdominal más difícil.
- F utilizando pequeñasorceps, suavemente localizar el cuerno uterino izquierdo. El útero es el dorsal con el intestino, que es lo que usted verá en principio entrar en el sitio de la incisión. En algunos casos es más fácil de localizar primero el ovario y la almohadilla de grasa de ovario asociado. Tire suavemente hacia arriba en el cuerno uterino y se deslizan una pinza abierta por debajo de ella para servir como un retractor. Si lo desea, tenga en cuenta el aspecto de los ovarios y el útero, en este momento para obtener información adicional con respecto a la etapa de celo en la inducción (Tabla 1).
- Deslice suavemente dos piezas 6-8 cm de 5-0 suturas de seda negro trenzado (sin aguja) por debajo del cuerno uterino estirada.
- Ligar de forma segura la bocina en la unión útero-tubual (justo caudal a la trompa de Falopio) y en la unión útero-cervical (sólo rostral en el cuello uterino) con un nudo cuadrado en cada lugar. Deje los extremos de la sutura por el momento.
- Cortar la sección de cuerno uterino entre las dos ligaduras y el lugar del tejido en una placa de Petri de vidrio estériles contanando ~ 100 l de PBS que contenía penicilina (100 U / ml) y estreptomicina (100 mg / ml). Corte los extremos de la sutura de seda pasado. Si la sutura se afloje o no sangrado es decir, encontrar el tocón y atar otro nudo.
5. Prepare los implantes endometriales desde el útero extirpado
- Mientras que el útero extirpado está siendo manipulada, cubra el abdomen con una gasa estéril y mantener la hidratación con agua estéril a la penicilina y la estreptomicina PBS que contenía, según sea necesario.
- Tira el cuerno uterino extirpado de la grasa.
- Si lo desea, un peso del cuerno uterino extirpado.
- Abra el cuerno uterino mediante la inserción de una hoja de tijeras pequeñas (14 mm longitud de la hoja) en el lumen y deslizar suavemente las tijeras por el cuerno uterino, mientras que la celebración de la bocina con una pinza.
- En el plato de Petri de vidrio, use una biopsia en sacabocados de 2 mm para cortar tres implantes de igual tamaño.
6. Sutura implantes endometriales en la cavidad peritoneal
- Lugar estérile inmediatamente por encima de la gasa de la incisión y completamente mojada con agua estéril PBS con penicilina y estreptomicina.
- Con pequeñas pinzas de suave suavemente encontrar el ciego y el movimiento rostral a lo largo del intestino delgado. Sacar una pequeña (4-5 cm) parte del intestino que es por lo menos dos arterias de distancia desde el ciego y disponerla en forma de abanico sobre la gasa previamente mojado para que la cascada arterial del mesenterio intestinal es claramente visible. Asegúrese de mantener la humedad del intestino en todo momento con solución salina estéril. Nota: no utilizar pinzas con dientes de rata, mientras que el manejo del intestino.
- Use 6-0 sutura ETHILON * negro con un P-1, 11 mm, 3 / 8 círculo, revertir la aguja para suturar el corte suavemente un implante a una arteria de aproximadamente 0,5 cm del intestino.
- Nota: El mesenterio intestinal está cubierto por una fina capa de peritoneo. Tenga cuidado al hacer un pase limpio a través de esta capa, mientras que la sutura alrededor de la arteria. Tire de la sutura a través lentamente y con cuidado de no romper el peritoneo o la rupturala arteria.
- Completar dos nudos de un tiro cada uno, teniendo cuidado de no apretar la sutura muy difícil, ya que esto podría resultar en la pérdida de flujo sanguíneo y posterior necrosis del intestino y la muerte. Recorte de la sutura dentro de 2 mm del implante. Intestino mojado de nuevo para continuar para mantener la hidratación antes de pasar a la próxima implantación.
- Moviendo en una dirección rostral, tire de la siguiente 3-4 cm de intestino y suavemente reemplazar la sección que ya contiene un implante. Ir una o dos arterias de la zona del implante anterior y sutura el implante siguiente. Repita la operación para el implante de terceros.
- Reemplace todo el intestino en la cavidad abdominal.
7. Sham cirugías
- Sham cirugías se realizan con los mismos pasos que las cirugías endometriosis, excepto que no se sutura el tejido del mesenterio intestinal.
- Extirpar el cuerno izquierdo del útero como en el paso 4.
- Implantes endometriales (paso 5) no están preparados en la cirugía simulada. Lacuerno uterino extirpada puede ser desechado o utilizado para otros fines, si lo desea.
- Suturas, tejidos, pero no, se colocan alrededor de tres arterias de la cascada arterial del mesenterio intestinal como en el paso 6.
8. Cierre de la herida quirúrgica
- Asegúrese de que todos los órganos son aproximadamente de vuelta a su posición anatómica.
- Use 5-0 sutura vicryl recubierto de una costura continua sin bloqueo para cerrar la pared abdominal.
- Utilice clips 9 mm para cerrar la herida de la piel.
9. Recuperar animales
- Administrar 0,33 mg / ml de buprenorfina en 0,15 ml/25 g de ratón a través de una inyección subcutánea de una dosis de 0,2 mg / kg. La buprenorfina se administra después de la cirugía para evitar una mayor depresión cardiovascular / respiratoria que puede alargar el proceso de recuperación.
- Seque suavemente el ratón con Kimwipes o toallas de papel si se ha mojado durante la cirugía.
- Ponga el lado ventral de los animales en jaula de partially lo alto de una plataforma de recirculación de agua se calienta hasta que el animal se recupera y se ha recuperado decúbito esternal (a menos de cinco minutos, como el anestésico inhalatorio desaparece rápidamente).
10. Cuidados post-operatorios
- Los ratones deben ser observados cada 15 minutos hasta que son capaces de mantener la posición de decúbito esternal, luego cada hora hasta que recupere su comportamiento normal después de la cirugía.
- Los ratones deben aparecer normales dentro de las 24 horas de cirugía. Los ratones deben ser controlados al día durante siete a diez días en busca de signos de recuperación y buena salud.
- Indicios de que un animal goza de buena salud, el dolor o la angustia incluyen disminución de la actividad, auto-mutilación, aspecto descuidado, o postura encorvada.
- Si un animal no parece estar en buen estado de salud dentro de las 24 horas de cirugía, ya sea administrar buprenorfina (0,2 mg / kg) o la eutanasia de los animales. Si el animal no mejora en 8 horas de la administración de la buprenorfina suplementario hombro animalesd ser sacrificados ya necrosis intestinal es probable.
- Eliminar los clips herida 7-10 días después de la inducción.
- Continuará monitoreando la ciclicidad del estro mediante el examen de citología vaginal para la duración del experimento. Sincronizar los ciclos de estro 72 horas antes de la recolección mediante la transferencia de camas empapados de orina masculina a las jaulas de las mujeres tal como se describe en el paso 1.3.
11. Necropsia y la escisión del tejido
- El momento de la necropsia depende de la pregunta de investigación y se tratará en los resultados representativos y la discusión.
- La eutanasia el ratón por asfixia de dióxido de carbono.
- Recoger la sangre por punción cardiaca con una aguja de calibre 23 en una jeringuilla de 1 cc (si se desea).
- Recoger una muestra para citología vaginal como se describió anteriormente para determinar la etapa del celo en el momento de la recolección 17.
- Cortar el cuerno uterino restante en el útero, las trompas de unión y en el cuello del útero, eliminar la grasa, peso, y el proceso dedeseado (véase 11.14 y 11.15).
- Localizar los puntos de sutura negro alrededor de las lesiones de endometriosis. Fotografía intacta las lesiones de endometriosis, si lo desea.
- Diseccionar cuidadosamente las adherencias que rodea las lesiones de endometriosis con unas tijeras pequeñas y pinzas, teniendo cuidado de no lanza las lesiones. Trabaje con rapidez y con cuidado para evitar la degradación del ARN.
- Medir y registrar la longitud y la anchura de las lesiones de endometriosis con pinzas.
- Impuestos Especiales de la lesiones de endometriosis y el lugar en una toalla de papel humedecida con PBS. Eliminar cualquier tejido del endometrio no de las lesiones. Un stand microscopio de disección o una lupa se puede utilizar para ayudar en la disección.
- Pesar los tres llenos de fluido las lesiones de endometriosis, antes de retirar la sutura.
- Retire con cuidado el hilo de sutura de las lesiones de endometriosis.
- Para el estudio histológico, fijar en formol una lesión llena de líquido endometrial durante dos horas seguido de tres lavados con PBS treinta minutos y el almacenamiento definitivo in 70% de etanol. Deshidratan y parafina embed.
- Lanza dos de las lesiones de endometriosis. Pesar estas otra vez. Dado que los cambios cíclicos hormonales pueden alterar la cantidad de líquido del quiste, esto da una medida del tejido húmedo-peso, además de que el peso del quiste, más el líquido medido en 11,10.
- Para el aislamiento de ARN y estudios de expresión génica, inmediatamente homogeneizar una de las lesiones de endometriosis reventado (o aproximadamente 20 mg de tejido del útero) en solución de lisis vinculante y almacenar a -80 ° C para el futuro de aislamiento de ARN con el kit de RNAqueous (Ambion) u otro método como deseado.
- Para el aislamiento del futuro de la ARN, ADN o proteínas, inmediatamente broche a congelar la segunda lesión de endometriosis reventado (o aproximadamente 20 mg de tejido del útero) en nitrógeno líquido y se almacenan a -80 ° C.
Resultados representante
Las lesiones de endometriosis en el modelo de ratón de la endometriosis inducida quirúrgicamente morfológicamente e histológicamente similares a los observados enlas mujeres. El análisis histológico de la endometriosis en las mujeres y el modelo de ratón indican que las lesiones de endometriosis contienen glándulas endometriales y estroma (Figura 2A). Las lesiones de endometriosis en ratones también contienen macrófagos cargados de hemosiderina, que son una característica común de la endometriosis en las mujeres (Figura 2B) 19.
Las lesiones de endometriosis retirado de los ratones tres días después de la inducción, aparecen inflamados y hemorrágicos (Figura 3). Después de dos a cuatro semanas de las lesiones de crecimiento del endometrio en el modelo de ratón son de aspecto quístico, llena de líquido y rodeada de adherencias peritoneales (Figuras 3B y 3C). En comparación con el peso de la lesión en la inducción, el líquido llenó las lesiones fueron de 306% y 862% mayor a uno y dos meses después de la inducción y lesiones lanceado fueron 51% y más del 172%, respectivamente (Figuras 4A y 4B). Hemos obtenido el líquido consistente y lleno de reventado pesos endometriósicos lesión en un mes posterior a la inducción de más de cinco experimentos diferentes (Figura 5). Un mes después de la defluidos de producción llena (7,44 ± 3,75 mg) y reventado (2,92 ± 1,23 mg) de peso lesión de endometriosis, se correlacionó significativamente (coeficiente de correlación de Pearson = 0,669, p <0,001).
Edad del ratón no afectan al tamaño de la lesión de los ratones entre tres y diez meses de edad. Ni el lleno de líquido o reventado de peso lesión de endometriosis, un mes después de la inducción se correlacionó significativamente con la edad del animal (r = -0,136, p = 0,380 y r = -0,063, p = 0,698, respectivamente).
El útero de ratón pasa por cambios en el tamaño, la retención de líquidos, la proliferación celular y la apariencia debido a la influencia de las hormonas esteroides durante el ciclo estral. Se comparó el peso de las lesiones de endometriosis con el peso de los restantes cuerno uterino intacto de animales en diferentes etapas de celo. No se encontró una correlación significativa entre el peso uterino y llena de líquido o de l lanced endometriosisesion peso en un mes después de la inducción (r = -0,046, p = 0,765 y r = 0,232, p = 0,155, respectivamente).
El patrón de expresión génica observados en las lesiones de endometriosis de ratones refleja en gran proporción a las mujeres con la enfermedad 5. Por tres días después de la inducción de genes que regulan la remodelación de la matriz extracelular, la adhesión celular y la angiogénesis son muy upregulated y muchos de estos genes permanecen upregulated a través de un mes de crecimiento.
Figuras y tablas

Figura 1. Inducción quirúrgico de la endometriosis mediante transferencia autólogo tejido uterino en el ratón. El cuerno uterino izquierdo se liga, eliminado, y abre longitudinalmente para exponer el endometrio. Tres de 2 mm 2 biopsias se preparan y se sutura a cada una arteria en la cascada de la mesente arterial intestinalry. Un mes después de la inducción de las lesiones de endometriosis son llenas de líquido y rodeada por adherencias.
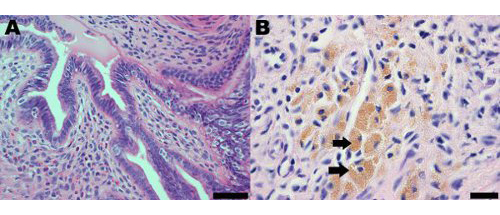
Figura 2 sección hematoxilina y eosina de una lesión endometrial de la modelo de ratón de la endometriosis, un mes después de la inducción demostrando (A) la presencia de glándulas endometriales y estroma;. Barra de escala = 50 micras y (B) los macrófagos cargados de hemosiderina, algunos de los cuales se indican con flechas, la barra de escala = 20 micras.

Figura 3. Las lesiones de endometriosis en el modelo de ratón después de la eutanasia, ya sea tres días después de la inducción (A) o un mes después de la inducción (B y C).
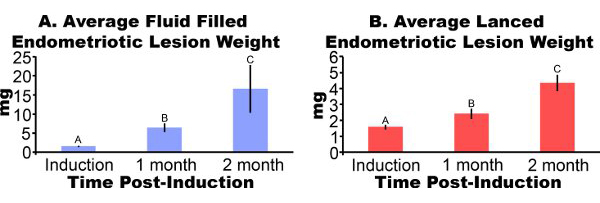
Figura 4. Las lesiones de endometriosis de ratones inducida quirúrgicamente a tener enendometriosis fueron extirpados y pesado en uno o dos meses después de la inducción. Los datos son la media ± SEM. Los datos de registro se transformó y letras distintas indican significación dentro de cada panel por ANOVA de una vía seguida por menos significativo de un solo lado de Fisher comparaciones diferencia Mulitple. (A) como quiste, el líquido llenó las lesiones de endometriosis (N = 10, 7 o 5 para la inducción, un mes o dos meses después de la inducción, respectivamente). (B) reventado las lesiones de endometriosis (N = 10, 8 o 7 para la inducción, un mes o dos meses después de la inducción, respectivamente).
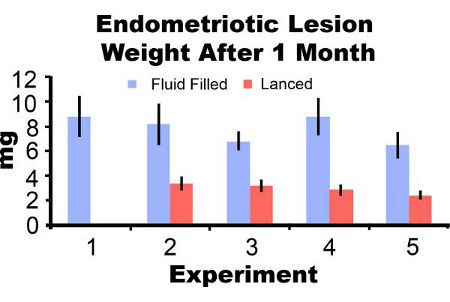
Figura 5. Endometriósicos peso húmedo lesión con líquido y reventado un mes después de la inducción de cinco experimentos diferentes. Los datos son la media ± SEM. Ratones N = 10, 6, 8, 7 y 7 para el fluido de las lesiones y lleno de 0 7, 10, 8, y 8 para las lesiones reventado en el experimento 1, 2, 3, 4 y 5, respectivamente.

Tabla 1. La observación de la etapa del celo por la citología vaginal y el aspecto visual de ovarios y el útero y de inducción.
Aparición de ovario y el útero se depende del tiempo. A continuación, se basa en el sacrificio de alrededor de las 8:00 am de la mañana de cada día del ciclo. Además, las observaciones son subjetivas y comparación de los ovarios y los cuernos uterinos será una mejor estimación de los cuernos uterinos solamente. Estas observaciones tienen el propósito de complementar la información obtenida de las lecturas diarias de la citología vaginal.

Tabla 2. La comparación de la cirugía en el ratón y la rata.
Discusión
Hay varios parámetros críticos que deben tenerse en cuenta al realizar la inducción quirúrgica de la endometriosis en ratones. En primer lugar, la endometriosis es una enfermedad estrógeno dependiente y, como tal, esta cirugía se debe realizar en animales intactos o, alternativamente, en los animales suplementados con ovariectomizadas estrógenos 20. En segundo lugar, la sutura de la biopsia endometrial a la cascada arterial debe realizarse con extremo cuidado. Hemos encontrado que el uso de sólo dos n...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Un agradecimiento especial a Chris Kassotis y Audrey Bailey para la revisión crítica de este manuscrito y al Dr. Scott Korte, Beeman Joseph, Curfman Alison, Kimball Pablo, Neibreggue Bridget, Redel Jacob, Schröder Amy, Steinberg Maija y Winkeler Stacey por su ayuda en la optimización de de este modelo en nuestro laboratorio. El financiamiento fue proporcionado por la capacitación clínica Biodetectives Grant (NIH T90) (KEP) de la Universidad de Missouri Ciencias de la Vida Programa de Licenciatura de Investigación de Oportunidades, MU Consejo de Investigación, Becas de investigación MU Junta y los NIH R21HD056441 (SCN).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | |
| Cera lápiz | Pescador | NC9954135 | |
| Portaobjetos de vidrio | Pescador | 12-550-433 | |
| Cuentagotas | Pescador | S79383 | |
| Microscopio de luz estándar para la evaluación de frotis de citología vaginal | |||
| La buprenorfina HCL c3 (CarJet) 10X1ml | Animal mayordomo de la Salud de suministro | 022891 | |
| Fosfato estéril (PBS) | Gibco | 14040-117 | |
| 10.000 U / ml de penicilina, 10000 mg / ml de estreptomicina en el 0,85% de NaCl | Hyclone | SV30010 | |
| Isoflurano | AbbottSanidad Animal | 05260-05 | |
| El isoflurano no reinhalación anestesia sistema | |||
| Recirculación de agua caliente almohadilla eléctrica | |||
| 30 ml jeringa vaina | Pescador | 14 a 823-16G | |
| Polvo estéril guantes sin | Fisherbrand | 19020558 | |
| Oftálmicos pomada | Productos farmacéuticos importantes | 10033691 | |
| Pequeñas tijeras eléctricas | Wahl | 9861-600 | |
| Clorhexidina matorral | Pescador | NC9863042 | |
| 70% de etanol | |||
| Campo estéril Polylined | Busse Desechables hospital | 696 | |
| Tamaño 3 bisturí | Pescador | 22-079-657 | |
| Número 10 hojas de bisturí | Pescador | 22-079-681 | |
| Pequeñas tijeras quirúrgicas | Roboz | RS-5850 | |
| Pequeña sierra semi-curva con fórceps | Roboz | RS-5135 | |
| 5-0 negro trenzado de sutura de seda | Ethicon | K870H | |
| Esterilizados cristal pyrex Petri | Corning | 70160-101 | |
| 2 mm de biopsia por punción | Miltex | 33-31 | |
| Una gasa estéril | Kendall | 1806 | |
| 6-0 ETHILON * negro sutura monofilamento de nylon | Ethicon | 697G | |
| Portaagujas (opcional) | Mundial de Instrumentos de Precisión | 500023 | |
| 5-0 teñir trenzado recubierto vicryl sutura | Ethicon | J490G | |
| 9mm autoclip herida clips | Becton Dickinson | 427631 | |
| Autoclip aplicador y removedor | Becton Dickinson | 427630 | |
| 23G aguja | Becton Dickinson | 305193 | |
| 1cc jeringa | Becton Dickinson | 301025 | |
| Aumento 5X soporte de vidrio (opcional) | Pescador | 14-648-23 | |
| 10% de formol | Pescador | SF100-4 | |
| Calibrador | Roboz | RS-6466 | |
| Procesamiento / incrustación cassettes | Pescador | 15 a 197-700A | |
| Biopsia de almohadillas de espuma | Pescador | 22-038-222 | |
| RNAqueous ARN Kit de aislamiento | Ambion | AM1912 | |
| Nitrógeno líquido | |||
| Ajustar tapa del tubo de microcentrífuga de la parte superior plana | Pescador | 02-681-240 | |
| La ketamina (opcional) | Simga | K4138 | |
| Domitor (medetomidina clorhidrato) (opcional) | Tocris | 2023 | |
| Antisedan (atipamezol) (opcional) | Sigma | A9611 |
Referencias
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. e. i., Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados