Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Campo eléctrico controlado por migración dirigida de células progenitoras neurales en entornos 2D y 3D
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo muestra los métodos utilizados para establecer entornos 2D y 3D en las cámaras de electrotactic de diseño personalizado, que puede rastrear las células In vivo / ex vivo Con lapso de tiempo de grabación en el nivel de células individuales, a fin de investigar galvanotaxia o electrotaxis y otras respuestas celulares a la corriente directa (DC) los campos eléctricos (EFS).
Resumen
Endógenos campos eléctricos (EFS) de forma natural en vivo y desempeñan un papel fundamental durante el desarrollo del tejido / órgano y la regeneración, incluida la de los 1,2 del sistema nervioso central. Estos FAN endógenos son generados por la regulación celular de transporte iónico en combinación con la resistencia eléctrica de las células y tejidos. Se ha informado de que aplicada EF tratamiento puede promover la reparación funcional de lesiones de la médula espinal en animales y humanos 3,4. En particular, EF-dirigida migración celular se ha demostrado en una amplia variedad de tipos celulares 5,6, incluyendo las células progenitoras neurales (NPC) 7,8. Aplicación de corriente continua (DC) FAN no es una técnica disponible en la mayoría de los laboratorios. Hemos descrito los protocolos de aplicación de los FAN DC a cultivos de células y tejidos previamente 5,11. Aquí presentamos un video de demostración de los métodos estándar basado en una intensidad de campo calculada para crear un 2Dd entornos 3D para los NPCs, y para investigar las respuestas celulares a la estimulación de EF en ambas condiciones de crecimiento de células individuales en 2D, y la porción de la médula espinal organotípico en 3D. El cordslice espinal es un tejido receptor ideal para el estudio del NPC comportamientos ex vivo, post-trasplante, debido a que la organización del tejido citoarquitectura está bien conservada dentro de estas culturas 9,10. Además, este modelo ex vivo también permite que los procedimientos que no sean técnicamente viables para rastrear las células in vivo utilizando lapso de tiempo de grabación en el nivel de células individuales. Es sumamente esencial para evaluar el comportamiento celular no sólo en un entorno 2D, sino también en una condición 3D organotípico que imita el entorno in vivo. Este sistema permitirá a imágenes de alta resolución con cubierta a base de platos de cristal en el tejido o el cultivo de órganos con seguimiento 3D de la migración celular solo in vitro y ex vivo y puede ser un paso intermedio antes de pasar a en vivo paradigmas.
Protocolo
1. Progenitoras neurales de aislamiento de células
- Diseccionar los cerebros enteros de E14-16 ratones y el lugar en frío DMEM/F12 medio basal. Quite todas las meninges con un microscopio anatómica y la transferencia de cerebros en un plato de Petri de 35 mm.
- Use unas pinzas finas para disociar mecánicamente cerebros en fragmentos de tejido y los transfiere a un tubo de 15 ml, centrifugar las muestras a 800 rpm durante 3 minutos para eliminar los residuos.
- Añadir DMEM/F12 que contiene bFGF y EGF y se tritura con una pipeta de 1 ml.
- Pasar la suspensión celular a través de un filtro de células para obtener una suspensión de células individuales.
- Células de la placa en frascos a 2-5 x 10 4 células / ml, a continuación, realizar un medio completo cambian cada 3 días y el paso de las células cada 6 días.
- Después de al menos 5 pasajes, digerir neuroesferas a células individuales usando tripsina y EDTA y crecer en cámaras electrotactic poly-D-lysine/laminin-coated (preparado como se describe a continuación en 2). Utilice el medio de cultivo que contiene N2 suplemento,bFGF y EGF en todo momento para mantener las propiedades de los NPCs.
2. Preparación de la cámara de electrotactic
- Preparar 22 x 11 mm tiras de vidrio mediante la división en autoclave 22 x 22 mm de espesor cubreobjetos no.1 en medio utilizando una pluma de diamantes.
- Crear un vaso independiente y de dimensiones interiores 22 x 10 mm al pegar cuatro verticalmente de pie 22 x 11 mm tiras con grasa de silicona de alto vacío. Permita que los pozos se sequen por completo y se endurecen durante la noche.
- El día siguiente, conecte dos 22 x 11 mm tiras de vidrio, paralelos entre sí dejando un hueco de 10 mm, a la base de una placa de cultivo de 100 mm utilizando grasa de silicona. Sellar la región entre estas tiras mediante la colocación de un 22 x 22 mm cubreobjetos en cada extremo, unido a la parte inferior del plato con grasa en tres lados, pero no el más próximo al centro.
- Coloque el cristal así preparada en la etapa 2,2 sobre la cubierta se desliza de modo que las paredes interiores crear un espacio confinado para la siembralas células en la parte inferior de la placa. A prueba de agua todas las juntas con grasa de silicona. Capa esta región confinada secuencialmente con poli-D-lisina entonces laminina: añadir 1 ml de poli-D-lisina en la cámara y se deja durante 5 minutos para permitir la poli-D-lisina de obligar a la parte inferior de la placa; lavar la cámara con PBS estéril dos veces, luego diluir laminina en PBS estéril para dar 20 mg / ml y utilizar para cubrir la parte inferior de la placa. Dejar a temperatura ambiente durante la noche.
- El día siguiente, las células de la cosecha y preparar 1 ml de suspensión contiene de 1 x 104 células. Retire la laminina de la copa y, lo que permite que se seque por completo, y sustituir con 1 ml de suspensión celular. Poner la cápsula en la incubadora a 37 ° C durante un mínimo de 4 horas para permitir la fijación.
- Una vez que las células son suficientemente confluente eliminar todo el medio de la cámara. Retire con cuidado el vaso bien. Forme un techo sobre las células por amarrando, con grasa de silicona, un autoclave de 22 x 22 mm cubreobjetospuente entre las dos tiras de 22 x 11 mm. Cubrir las células con unas pocas gotas de medio para evitar la desecación.
- Formar un depósito medio de aislamiento en cada extremo de la cámara mediante la creación de dos barreras estancas de grasa de silicona que se ejecutan desde un borde del plato a la otra, sobre el techo de la cámara. Llenar la cámara con un nuevo medio, asegurar un flujo continuo desde el depósito medio una a la otra. Vuelva a colocar el plato a la incubadora durante 12 horas para permitir la recuperación celular.
3. La aplicación de un campo eléctrico a la cámara de electrotactic
- Preparar una tapa para cubrir el plato mediante la perforación de dos orificios, uno colocado sobre cada depósito de la cámara de la migración.
- Sustituir todo el medio en la cámara con medio de cultivo que contiene 25 mM de tampón HEPES y transferir el plato para el sistema de imagen de temperatura controlada. Establecer los parámetros experimentales para time-lapse y grabación multi-posición. Alinear la cámara de manera que el cátodo y el ánodo sona la izquierda y derecha, respectivamente, para asegurar que el vector de EF se extiende horizontalmente como se ve por el microscopio y se registra en el sistema de imagen.
- Llene dos vasos con una solución de Steinberg (58 mM de NaCl, 0,67 mM de KCl, 0,44 mM de Ca (NO3) 2 .4 H 2 0, 1,3 mM MgSO 4 .7 H 2 0 y 4,6 mm Trizma base, pH 7,4). Conectar un vaso de precipitados separado para cada depósito medio utilizando pre-preparadas puentes de vidrio (tubos de vidrio ~ 13 ~ cm de largo y 3 mm de diámetro, y doblado en forma de U por calentamiento en un mechero Bunsen), rellenas con 2% (w / v) Steinberg's-agar solución, que pasa a través de los orificios de la tapa. Complete el circuito eléctrico mediante la colocación de Ag / AgCl electrodos conectados a una fuente de alimentación de CC en cada vaso de precipitados de la solución de Steinberg.
- Ajuste el dial de voltaje en el suministro de energía a 0 y se enciende. Medir la tensión a través de la cámara de electrotactic mientras se sube la tensión de línea, utilizando un medidor de voltaje, y ajustar para adaptarse a los requerimientos experimentales.
- Inicio de lapso de tiempo de grabación. Realizar un cambio de medio y reajustar la tensión, según se requiera, cada hora. Medio fresco, drogas o agentes químicos se pueden añadir a los depósitos según sea necesario. Cuando realizar cambio de medio, dos opciones pueden ser considerados como a continuación:
- Opción N º 1 - Para poner en pausa la grabación de lapso de tiempo temporal, retire con cuidado los puentes de cristal de la cámara para evitar perturbar la tapa cubierta, utilice una pipeta Pasteur esterilizada vuelva a colocar todo el medio con un nuevo medio y colocar los puentes de cristal hacia atrás, a continuación, reanudar la grabación.
- Opción N ° 2 - Alternativamente, hecho a medida tapa cubierta con 4 orificios (dos coloca sobre cada depósito de la cámara de la migración) también se puede utilizar para el propósito de cambio de medio. Dos de vidrio conexión puentes, los otros dos para cambiar medio. Opción 2 permite la grabación continua, sin interferencias durante el cambio de medio.
4. Preparación de la rebanada de la médula espinal organotípico
- Diseccionar Lumbar la columna vertebral de los cables de 2 semanas de edad C57 BL / 6 ratones.
- Cortar la médula espinal en 500 secciones micras de espesor con una picadora de tejidos McIlwain.
- Separe las rebanadas en un microscopio anatómica y seleccionar sectores con intacta sagital / axial de la estructura de la médula espinal.
- Rodajas de placa en una placa de Petri de 35 mm que contiene 30 l Matrigel y colocarlos lo más cerca posible del centro como sea posible y mantenerlos en un 5% de CO 2 incubadora a 37 ° C durante al menos 30 minutos hasta que el Matrigel proteínas se auto-ensamblan para producir una fina película que cubre la superficie de la rebanada de la médula espinal. Es muy importante asegurarse de que Matrigel ha sido montada por completo, se incuba la placa de Petri a 37 ° C durante otros 30 minutos si es necesario.
- Añadir 4-6 ml DMEM/F-12 medio que contiene 25 mM de tampón HEPES y suero fetal de ternera 15-20% muy suavemente de modo que se evite el flujo medio directamente sobre la rebanada. Asegurarse de que la rebanada no está completamente sumergido en el medio, dejando la superficie de los explantes así expuestos ael aire. Cambiar medio dos veces por semana.
5. La inyección de Hoechst 33342 NPCs etiquetados en el segmento de la médula espinal organotípico
- Preparar la suspensión de la APN en el 1 × 10 6 células / l.
- Preincubar la suspensión celular en un medio con 5 Hoechst 33342 mM durante 30 min.
- Utilizar tubo capilar de vidrio a microinyectar 2 l de suspensión en el segmento de la médula espinal lentamente bajo un microscopio. Asegúrese tubo capilar de vidrio pasa a través del Matrigel (parte rosa bajo microscopio) y llegar al interior de la rebanada de la médula espinal (tejido gris bajo microscopio), siendo el interior de la rebanada de la médula espinal por lo menos 30 segundos para evitar la suspensión de células arrollado. Coloque la placa de Petri que contiene parte de la médula espinal en la incubadora (37 º C 5% 2) y se deja durante la noche.
- Al día siguiente, aplicar una EF de 500 mV / mm para el corte de la médula espinal que contiene Hoechst 33342 que llevan la etiqueta de NPCs en la cámara de electrotactic (usando los métodos descritos en3).
6. Los resultados representativos
Cuando NPCs fueron expuestos a una amplia gama de EF fisiológicos que mostraban la migración de células altamente dirigido hacia el cátodo (Figura 1). La misma observación se hizo también en un nivel de células individuales en el modelo de la columna vertebral organotípico rebanada de médula ex vivo, un entorno 3D que imitan las condiciones in vivo (Figura 2).
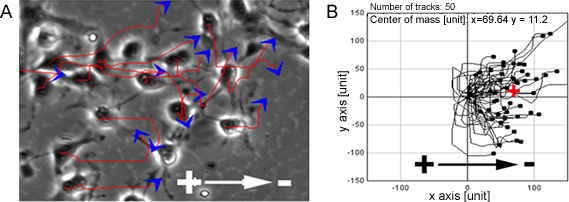
Figura 1. PNJ muestran la migración dirigida de la SSC. PC, mostró una migración altamente dirigido hacia el cátodo cuando se expone a EF, líneas rojas y las flechas azules representan las trayectorias y la dirección de movimiento de las células (A). B muestra las rutas de migración de los NPCs. Bar: 50 m.
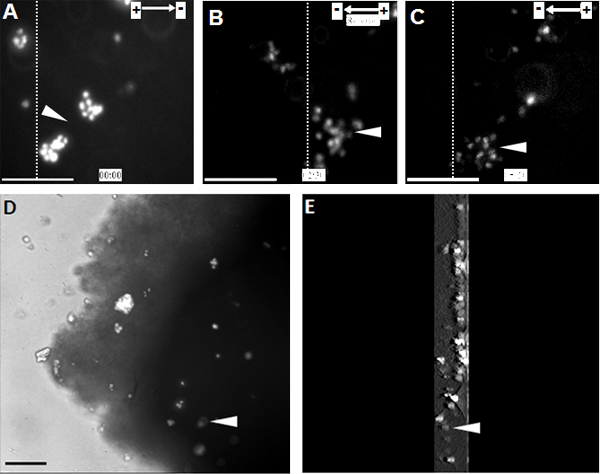
Figura 2. NPC trasplantados muestran migración dirigida hacia el cátodo en la rebanada de la médula espinal organotípico . (A) NPC marcadas con Hoechst 33342 se trasplantaron en la rebanada de la médula espinal organotípico en el punto inicial del tratamiento de EF. NPC migrado direccionalmente hacia el cátodo durante 2,5 horas, momento en el que la polaridad se invirtió EF (B). La alteración de la polaridad EF provocó un drástico cambio de electrotaxis hacia el cátodo nueva (C). (D) Imagen de NPCs trasplantados dentro de la rebanada de la médula espinal en la final de la grabación de lapso de tiempo. (E) Una reconstrucción en 3D de los NPCs trasplantados en el segmento de la médula espinal. 3D secciones de exploración fueron 300 micras de espesor, a partir de la media y que termina en la parte inferior de la rebanada. Las líneas discontinuas indican las posiciones relativas de la misma población de células trasplantadas en el comienzo, la inversión, y los puntos finales del tratamiento FE (A - C, respectivamente). Puntas de flecha indican la misma población de Hoechst 33342 NPCs etiquetados. Bar: 50 m.
Discusión
Los protocolos que utilizamos se basa en estudios previos 5,11. El uso de estos métodos, la cultura estable y eléctrica actuales condiciones se puede mantener mientras se aplica una EF a través de puentes de agar, la solución de Steinberg, y los electrodos de Ag / AgCl, a las células o rodajas cultivadas en cámaras electrotactic diseño personalizado de dimensiones normalizadas y precisa. La profundidad de las cámaras puede ser ajustada para adaptarse a diferentes espesores de la muestra 11,...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Real Sociedad URF subvención UF051616, Reino Unido y el Consejo Europeo de Investigación StG subvención 243.261 BS. El trabajo en el laboratorio de MZ también es apoyado por un Instituto de California de Medicina Regenerativa de subvención RB1-01417.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| FGF-básico humano recombinante | Invitrogen | PHG0026 | 20 ng / ml |
| EGF humano recombinante | Invitrogen | PHG0311 | 20 ng / ml |
| N2-Suplemento (100X) de líquido | Invitrogen | 02048 | |
| Medio DMEM/F12 (glucosa alta) | Invitrogen | 31330-095 | |
| Poli-D-lisina | Millipore | Una-003-E | |
| Natural de laminina de ratón | Invitrogen | 23017-015 | |
| Factor de reducción del crecimiento de la membrana basal de matriz (Matrigel) | BD Biosciences | 354230 | |
| Tampón HEPES | Gibco | 15630 | |
| McIlwain helicóptero del tejido | El Mickle Laboratorio de Ingeniería Co Ltd | TC752-PD | |
| Dow Corning de alto vacío grasa de silicona | Sigma-Aldrich | Z273554 |
Referencias
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados