Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
RNAi mediada por Gene y Derribo
En este artículo
Resumen
En este protocolo se combinan RNAi mediada por silenciamiento de los genes con un En vivo Ensayo para estudiar la diuresis desmontables efectos de los genes de interés tiene sobre la excreción de fluido de mosquitos.
Resumen
Este protocolo vídeo muestra una técnica efectiva para derribar a un determinado gen en un insecto y llevar a cabo un bioensayo de la novela para medir la tasa de excreción. Este método puede utilizarse para obtener una mejor comprensión del proceso de la diuresis en insectos y es especialmente útil en el estudio de la diuresis en los artrópodos se alimentan de sangre que son capaces de tomar grandes cantidades de líquido en un solo harina de sangre.
Esta caída de genes mediante RNAi en combinación con un ensayo in vivo la diuresis fue desarrollado por el laboratorio de Hansen para estudiar los efectos de RNAi mediada desmontables de genes acuaporina en Aedes aegypti, mosquito diuresis 1.
El protocolo está configurado en dos partes: la primera demostración ilustra cómo construir un dispositivo simple inyección de mosquitos y cómo preparar e inyectar dsRNA en el tórax de los mosquitos para la caída de genes mediante RNAi. La segunda demostración ilustra cómo determinarlas tasas de excreción de los mosquitos utilizando un bioensayo in vivo.
Protocolo
Parte I - RNAi mediada desmontables gen en los mosquitos adultos Aedes aegypti. Para panorama experimento véase la figura 1.
1. dsRNA Síntesis
- Sintetizar ARN de doble cadena específicos contra de los genes de ARN de doble cadena de interés y el control. Nota: Se recomienda cebadores en desarrollo para fragmentos de PCR en el intervalo de 300 a 500 pares de bases situadas en el extremo 3 'del ADNc específico y 2 con la secuencia del cebador T7 unido en el extremo 5' (5'-TAA TAC CAG TCA CTA TAG GG-3 '). Singularidad de los fragmentos debe ser confirmado por análisis de BLASTN 3.
- Utilice la Ambion Megascript T7 Alto Rendimiento Kit de transcripción (Ambion, tabla de reactivos) que utiliza la RNA polimerasa T7 para la reacción de transcripción para sintetizar ARN bicatenario. Nota: Los reactivos similares y kits están disponibles en otros lugares.
- Para purificar el ARN bicatenario, precipitar con cloruro de litio siguiendo las instrucciones con el kit de Megascript.
- Después de purificatiónico, disolver el precipitado dsRNA en agua estéril. Para asegurar una viscosidad adecuada para la microinyección, la concentración de ARN bicatenario no debe exceder de 2 g / l.
2. Preparación de la inyección
- Un simple inyector micro puede ser construido mediante el uso de tubos, tijeras, una aguja de metal, una jeringa de 1 ml y 1 ml de una pipeta de plástico de punta (ver Figura 2). El tubo debe ser cortado a ~ 40 cm de longitud. Alternativamente, un inyector automático de micro se puede utilizar como Drummond Nanojet II 4.
- Cortar la punta de la jeringa (cubo de la aguja) en 2 ml de marca de la escala y retirar la cabeza del émbolo de caucho del émbolo.
- Haz un agujero con una aguja de metal en la cabeza del émbolo de caucho y el lugar de la cabeza del émbolo de caucho de nuevo en el cubo de la aguja.
- Coloque el cubo de la aguja en un extremo de la tubería y colocar un 1 ml de punta de pipeta de plástico en el otro extremo, que se utiliza como la boquilla (alternativamente, un 10 ml SyRinge puede ser utilizado para producir la presión de aire necesaria para inyección).
- Colocar una aguja capilar de vidrio en el agujero en la cabeza del émbolo de caucho y romper la punta de la aguja de modo que el ancho es lo suficientemente grande para el líquido fluya a través. Nota: El tamaño óptimo de la punta de la aguja tiene que ser determinada empíricamente - si el ancho de la aguja es demasiado grande esto dará lugar a un trauma y una alta tasa de mortalidad de mosquitos, si la anchura de la aguja es demasiado pequeña, será imposible penetrar el exoesqueleto del mosquito.
- Sumerja la aguja de inyección de la muestra preparada dsRNA y extraer la muestra de líquido en la aguja de inyección por la succión del líquido con la pieza en la boca (o una jeringa). Nota: Este paso es idéntica para todos los reactivos líquidos que se inyectan en los mosquitos, incluyendo tampón PBS, que se utiliza en el protocolo de ensayo in vivo la diuresis (véase más adelante).
3. Recoger y Anestesie mosquitos
- Colectat los mosquitos con un aspirador de potencia de la batería en un vial de recolección. Coloque una tapa sobre el tubo de recolección y coloque el frasco en una plataforma de CO 2 limpia para anestesiar a los mosquitos. Nota: También los mosquitos pueden ser anestesiados en el hielo.
4. Mosquito de inyección
- Abra el tubo de recolección y colocar los mosquitos directamente en la plataforma de CO 2 y espere a que los mosquitos que están anestesiadas.
- Deseche todos los hombres.
- Alinear los mosquitos en el lado para permitir un acceso más fácil para la inyección.
- Coge los mosquitos por las patas o alas para evitar lesiones. También puede utilizar un pincel fino o una pluma para manipular los mosquitos.
- Cuando esté listo para inyectar el mosquito primero, suavemente apoyar un lado del tórax con las pinzas e insertar la punta de la aguja en el otro lado del tórax (Figura 2). Es mejor inyectar en una porción delgada de la cutícula y no empujar la aguja ao profunda en el tórax.
- Una vez que la aguja está en su lugar, sople el líquido en el mosquito. La cantidad deseada se puede determinar mediante la supervisión del menisco de líquido en la aguja. El número de milímetros necesarios para un volumen específico se puede determinar calculando el volumen del cilindro de la aguja capilar de vidrio (πr 2 h). La cantidad efectiva de dsRNA que se utiliza típicamente para la inyección es 1 g.
- Una vez que el líquido se inyecta en los mosquitos, cuidadosamente retraer la aguja. Si se forma un líquido grandes gotas sobre la parte exterior del tórax, el mosquito debe ser desechado. A continuación, repita este proceso con el mosquito que viene.
5. Mosquito recuperación y almacenamiento
- Después de la inyección, colocar los mosquitos en un contenedor para el almacenamiento. Por ejemplo, una cera pinta alineados tazas de cartón (tazas de sopa) con malla revestimiento asegurado con la tapa de cartón. La tapa tiene una porción cortada para la malla que cubre a estar expuesto. Una vez que todo el MOsquitoes se colocan en el recipiente, colocar el recipiente en una cámara de ambiente controlado para la incubación y proporcionar a los mosquitos con una fuente de alimento, tales como bolas de sacarosa al 20% de algodón empapado colocados en la parte superior de la cubierta de malla. Antes de realizar el ensayo de la diuresis vivo, privar a los mosquitos dsRNA inyección de una fuente de agua durante 12 horas para normalizar el estado de hidratación de cada mosquito.
- La eficiencia de gen desmontables dsRNA mediada puede ser variable. El silenciamiento génico podría comenzar un día después de la inyección y puede durar hasta 6 días después de la inyección 4. El tiempo óptimo para alcanzar gen desmontables máxima tiene que ser determinada empíricamente para cada gen utilizado. Generalmente, esperar 3 días después de la inyección de dsRNA antes de proceder.
Parte II - En el ensayo de la diuresis vivo en adultos del mosquito Aedes aegypti
Nota: Este protocolo ha sido desarrollado por los autores yutilizado para RNAi mediada desmontables de las proteínas acuaporinas en el mosquito de la fiebre amarilla Aedes aegypti 1. Para evitar la variabilidad entre los mosquitos individuales, los mosquitos deben ser analizados en los grupos. Por razones técnicas, se recomienda grupos de 5 mosquitos por el tratamiento - no hay una cantidad limitada de tiempo para realizar la medición de peso antes de los mosquitos comienzan a excretar la orina después de la inyección.
6. Recoger y Anestesie mosquitos
- Antes de la recolección de los mosquitos, registrar el peso de un frasco de colección vacía con una tapa con una balanza de precisión analítica. Este vial se utilizará para todas las mediciones subsiguientes.
- Recoger 5 mosquitos hembra en el vial colección pesaron con un aspirador. Coloque la tapa sobre el tubo de recolección y dejar que repose en la plataforma de CO 2 durante varios segundos para anestesiar a los mosquitos.
7. Medición de peso inicial
- Tome tque la medición del peso inicial de los 5 mosquitos colocando el vial de recogida que contiene los mosquitos con la tapa en la balanza de precisión.
- Calcular el peso del grupo de 5 mosquitos tomando el peso de los mosquitos y el vial de recogida con el casquillo y restando el peso del frasco con tapa colección vacía.
- Abra el tubo de recolección y colocar los mosquitos directamente en la plataforma de CO 2 después de registrar el peso de los mosquitos. Si los mosquitos están empezando a despertar en las mediciones de peso, dejar reposar el vial en la plataforma de CO 2 durante varios segundos antes de abrirlo y colocar a los mosquitos en el teclado.
8. Preparación de la inyección
- Configure el inyector de micro siguiendo las instrucciones que figuran en el protocolo de genes mediante RNAi desmontables.
- Colocar una aguja capilar de vidrio en el inyector de micro y romper la punta de la aguja de modo que el ancho es lo suficientemente grande para liquid para fluir a través.
- Sumergir la aguja en tampón PBS y extraer el tampón en la aguja de inyección, la cantidad deseada a utilizar para este protocolo es de 1,25 l de PBS por cada mosquito. Nota: Esta cantidad imita la cantidad media de plasma de la sangre que se toma por un mosquito hembra 5.
9. Mosquito de inyección
- Alinear los mosquitos para permitir un acceso más fácil con el inyector de micro.
- Una vez que la aguja está en su lugar, un golpe de tampón PBS en el mosquito.
- Una vez que el líquido se inyecta en el mosquito, una gotita podría formar en la parte exterior del tórax. Este gota tiene que ser cuidadosamente eliminado antes de la etapa siguiente.
- Repita este proceso de inyección con el mosquito que viene. Con la experiencia, la tasa de supervivencia de los mosquitos será casi el 100% después de la inyección.
10. Los mosquitos de pesaje
- Después de la inyección, coloque suavemente los mosquitos en el tubo de recoleccióny la tapa. Tomar la primera medición del peso de los 5 mosquitos colocando el vial de colección que contiene los mosquitos con la tapa en la balanza de precisión.
- Calcular el peso del grupo de 5 mosquitos tomando el peso de los mosquitos y el vial de recogida con tapa y restar el peso del frasco con tapa colección vacía. Nota: los mosquitos comienzan a excretar la orina a los 2 minutos después de la eliminación de la almohadilla de la anestesia de CO 2, lo que es importante para tomar la medida de peso antes de comenzar a excretar.
- Coloque los mosquitos en un pequeño recipiente donde se comienzan a excretar orina.
11. La segunda y subsiguientes mediciones de peso
Nota: las mediciones de peso de los mosquitos se debe tomar en intervalos de 30 minutos, pero esto se puede ajustar a intervalos cortos o más largos, dependiendo de las tasas de excreción.
- Después de 30 minutos, recoge el Grouwp de 5 mosquitos con un aspirador en el vial de la misma colección con tapa. Tomar la medición siguiente peso de los mosquitos, colocando el vial colección que contiene los mosquitos con la tapa en la balanza de precisión.
- Después de la medición, colocar los mosquitos en el contenedor misma explotación para los próximos 30 minutos.
- Repetir este proceso para una cantidad de tiempo deseado.
12. Mosquito La determinación de la tasa de excreción
- La cantidad total de líquido que se inyecta en el grupo de 5 mosquitos puede ser calculado restando el peso inicial de los mosquitos a partir del peso inmediatamente después de la inyección.
- La cantidad de orina que se excreta por el grupo de mosquitos en un punto específico de tiempo puede ser calculado restando el peso inicial de los mosquitos desde el peso de los mosquitos en el punto de tiempo específico.
- La tasa de excreción en un punto específico de tiempo puede ser calculado por divisiónrepique la cantidad de orina excretada en este punto de tiempo por la cantidad total de líquido inyectado (Tabla 1).
13. Los resultados representativos
RNAi mediada desmontables gen y en el ensayo de la diuresis in vivo han sido utilizados por el laboratorio de Hansen para estudiar los efectos de las acuaporinas en la diuresis Aedes aegypti mosquito. Tres acuaporinas que se expresan en los túbulos de Malpighi Aedes aegypti fueron derribados con efectos significativos en las tasas de excreción en comparación con el control de mosquitos 1. La figura 4 muestra los resultados representativos de un experimento en el que ha sido el ensayo de la diuresis utiliza para comparar las tasas de excreción entre el Aedes aegypti y Culex quinquefasciatus a diferentes temperaturas.
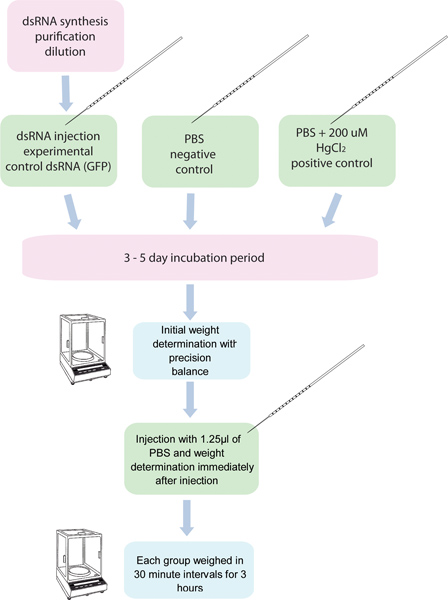
Figura 1. Diagrama de flujo del ensayo ARNi / diuresis. 5 grupos de 10 mosquitos eaCH son inyectados con ARNdc para un gen específico y otros cinco grupos de diez mosquitos son inyectados con el control dsRNA. Otro grupo de mosquitos inyectados con 200 HgCl 2 mM en PBS se utiliza como control positivo. Estos mosquitos se pesan antes de la inyección, y después de la inyección en intervalos de treinta minutos durante 3 horas.
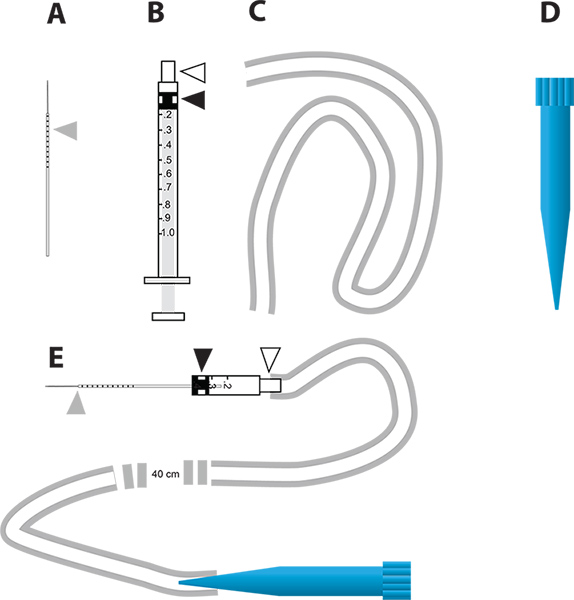
Figura 2. Un sencillo dispositivo de inyección de micro para la caída del gen mediante RNAi y en el ensayo de la diuresis vivo. A. Las agujas capilares de vidrio utilizada para la inyección. El triángulo gris representa los incrementos milimétricas dibujadas en la aguja para indicar la cantidad de inyección de líquido en el mosquito. B. 1 ml jeringa utilizada para construir el inyector de micro. El triángulo blanco representa el cubo de la aguja y el triángulo negro representa la cabeza del émbolo de goma en el émbolo de la jeringa. C. El tubo utilizado para fijar la boquilla parael inyector. D. 1 ml punta de la pipeta desechable (punta azul) que se utiliza como la boquilla del dispositivo de microinyección. E. El dispositivo de microinyección que incorpora partes de AD. Haga clic aquí para ver más grande la figura .
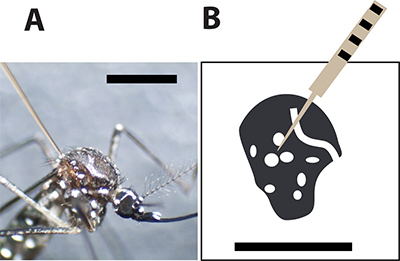
Figura 3. Mosquitos óptimo lugar de la inyección. A. Mujer mosquito Aedes aegypti inyecta con una aguja capilar de vidrio entre las grandes escalas en el tórax. La barra de color negro indica 1 mm para la comparación de tamaño. B. Un dibujo del tórax mosquito hembra y los puntos blancos representan las escamas blancas en el exoesqueleto de los mosquitos. La aguja de inyección debe perforar el mosquito entre los puntos para minimizar la tasa de mortalidad durante la inyección.
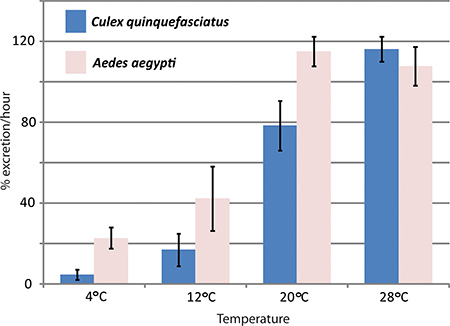
Figura 4. Efectos de la temperaturatura de Culex quinquefasciatus y la diuresis Aedes aegypti. El ensayo se llevó a cabo la diuresis con dos especies de mosquitos, Aedes aegypti y Culex quinquefasciatus, a diferentes temperaturas. La tasa de excreción durante la primera hora después de la inyección se da en tanto por ciento.
| Grupo | TARA (G) | no inyectada (G) | después de la inyección (G) | 1h después de la inyección (G) | peso medio (mg) | cantidad inyectada (L) | cantidad excretada (L) | % Se excreta |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2.6 | 1,02 | 0,34 | 33,3 |
Tabla 1. Aedes aegypti en los resultados de ensayo in vivo de la diuresis. Los datos básicos del ensayo de la diuresis in vivo realizado con el Aedes aegypti hembra del mosquito a 4 ° C.
Discusión
El protocolo utilizado ARNi se ha desarrollado en el laboratorio de Alexander Raikhel en la Universidad de California Riverside 6,7 y es similar a un protocolo publicado por Garver y Dimopoulos 4. El método experimental se muestra en este protocolo de vídeo puede ser utilizado para estudiar los genes implicados en la diuresis de insectos en un entorno en vivo. Los órganos excretores de los insectos, los tubos de Malpighi, han atraído el interés de las generaciones de investigadores co...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Los autores agradecen a Victoria Carpintero por sus comentarios críticos de este protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo o equipo | Empresa | Número de catálogo | Comentarios |
| Megascript T7 Kit de Alto Rendimiento | Ambion, Inc. | AM1334 | |
| Tampón PBS | Sigma-Aldrich | P4417 | |
| Los tubos de plástico | Proveedor local | PVC | |
| 1 ml de plástico de punta de la pipeta | VWR | 83007-376 | Azul extremo |
| 1 ml jeringa | Becton, Dickinson and Company | 309602 | |
| Tijeras | Proveedor local | ||
| La aguja de metal | Carolina Productos Biológicos | 654307 | Tamaño 5 |
| Fly pad | Genesee Científico | 789060 | |
| Aspirador a pilas w / colección vial | UPMA Labs | IPMM 2000 | |
| Pinzas de punta fina | World Precision Instruments | 14095 | |
| Capilares de vidrio agujas | World Precision Instruments | 1B200-6 | |
| Microscopio de disección estéreo | Leica Microsystems | S6D | |
| Balanza de precisión analítica | Mettler Toledo | AB54S | |
| Sacarosa | Sigma-Aldrich | 84097 | |
| Una pinta con cera alineados vasos de cartón | Proveedor local | Fabricado tazas de sopa | |
| Malla de la red | Proveedor local | gasa mosca de plástico |
Referencias
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados