Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Etiquetado de las células madre con Ferumoxytol, uno de nanopartículas de hierro aprobada por la FDA de óxido
En este artículo
Resumen
Se describe una técnica para el etiquetado y el seguimiento de las células madre aprobados por la FDA, superparamagnéticas de óxido de hierro (SPIO), ferumoxytol (Feraheme). Esta técnica de imagen celular que utiliza la resonancia magnética (RM) para la visualización, es fácilmente accesible para su seguimiento a largo plazo y el diagnóstico de engraftments células madre con o sin éxito en los pacientes.
Resumen
Terapias con células madre basado en ofrecer un potencial significativo para el campo de la medicina regenerativa. Sin embargo, aún queda mucho por entender sobre la cinética en vivo de las células trasplantadas. Un método no invasivo para monitorizar repetidamente trasplantado células madre in vivo que permiten a los investigadores a monitorear directamente los trasplantes de células madre y la identificación de los resultados del injerto con o sin éxito.
Una amplia gama de células madre sigue siendo investigado por un sinnúmero de aplicaciones. Este protocolo se centra en tres poblaciones diferentes de células madre: embrionarias de riñón humano 293 (HEK293) las células, las células madre mesenquimales (hMSC) y células madre pluripotentes inducidas (iPS). HEK 293 células derivadas de células embrionarias de riñón en un cultivo con adenovirus 5 esquilada de ADN. Estas células se utilizan ampliamente en la investigación, ya que son de fácil cultivo, crecen rápido y son transfectadas con facilidad. hMSCs se encuentran en la médula ósea de adultos. Estas células can se replican como células indiferenciadas, manteniendo multipotencia o el potencial de diferenciarse en un número limitado de destinos celulares. hMSCs puede diferenciar a los linajes de tejidos mesenquimales, incluyendo los osteoblastos, adipocitos, condrocitos, tendones, músculos, y el estroma de médula ósea. Las células iPS se reprograman genéticamente células adultas que han sido modificadas para expresar los genes y factores similares a las propiedades de la definición de las células madre embrionarias. Estas células son pluripotentes, es decir tienen la capacidad de diferenciarse en todos los linajes de células 1. Ambos hMSCs y las células iPS han demostrado la capacidad regenerativa del tejido in vivo.
La resonancia magnética (RM) junto con el uso de óxido de hierro superparamagnético (SPIO) etiquetas de nanopartículas de células han demostrado su eficacia en el seguimiento in vivo de células madre debido a la resolución anatómica microscópica cerca, un análisis de sangre mayor vida media que permite imágenes longitudinal y la alta SENSIBILIDADy para la detección de células proporcionada por imágenes de RM de las nanopartículas SPIO 2-4. Además, la RM con el uso de SPIOs es clínicamente traducible. SPIOs se componen de un núcleo de óxido de hierro con una capa superficial de dextrano, carboxidextrano o almidón que sirve para contener el núcleo de hierro biorreactivo de componentes del plasma. Estos agentes locales crear inhomogeneidades del campo magnético que conducen a una disminución de la señal en imágenes potenciadas en T2 MR 5. Por desgracia, SPIOs ya no se fabrican. De segunda generación, ultra SPIOs (USPIO), sin embargo, ofrecer una alternativa viable. Ferumoxytol (FerahemeTM) es un USPIO compone de un núcleo de magnetita no estequiométrica rodeado por una capa carboxymethylether sorbitol poliglucosa. El tamaño coloidal, las partículas de 17-30 nm ferumoxytol es determinado por la dispersión de luz. El peso molecular es de 750 kDa, y la capacidad de relajación constante en el campo 2T RM es 58,609 MM-1 seg-1 fuerza 4. Ferumoxytol fue recientemente aprobado por la FDA unas un suplemento de hierro para el tratamiento de la deficiencia de hierro en pacientes con insuficiencia renal 6. Nuestro grupo ha aplicado este agente en un "off label" uso para aplicaciones de etiquetado de la célula. Nuestra técnica demuestra el etiquetado eficiente de las células madre con ferumoxytol que conduce a importantes efectos de la señal de RM de las células marcadas en las imágenes de RM. Esta técnica puede ser aplicada para la monitorización no invasiva de las terapias de células madre en la configuración pre-clínicos y clínicos.
Protocolo
1. Día 1
1) Las células Plate
- Placa hMSC en un matraz T75 en una confluencia del 80% por lo menos 18-24 horas antes de la etiqueta. Consulte la Tabla 1 para la instrucción de las embarcaciones alternativa.
2. Día 2
2) Prepare una solución de etiquetado. Esta preparación etiqueta de un (1) T75 matraz a 80% de confluencia con una concentración de 400 mg Fe / ml. Consulte la Tabla 1 para la instrucción de las embarcaciones alternativa.
- Crear una solución (solución 1) mediante la mezcla de 1 ml de medio libre de suero y 93,1 l de ferumoxytol (stock: 30 mg / ml) en un tubo cónico de 15 ml.
- Crear una segunda solución (solución 2) mediante la mezcla de 1 ml de medio libre de suero y 7 l de sulfato de protamina (stock: 10 mg / ml) en un tubo de 15 ml segunda cónica.
- Permita que cada solución reposar por 5 minutos.
- Agregar las soluciones 1 y 2 juntos. Mezclar cuidadosamente la solución de un nuevo etiquetado. Permita que la solución reposar por 5 minutos para permitir USPIO pro-complejos de sulfato de histamina a la forma.
- Añadir 5 ml de medio libre de suero a la mezcla de 2 ml de SPIO / solución de sulfato de protamina para un volumen final de 7 ml.
3) Preparación de las células de etiquetado
- Aspirar los medios de comunicación de las células.
- Lave suavemente las células una vez con 3.2 ml de pre-calentado Mg / Ca libre de D-PBS o medio libre de suero para limpiarla de las proteínas del suero residual y otros medios de comunicación o de los componentes que puedan perjudicar la absorción del agente de contraste y etiquetado de eficiencia. Aspirar el líquido de enjuague.
4) las células de etiquetas
- Agregue el total de 7 ml de solución de etiquetado para las células.
- Células de lugar en una incubadora (37 ° C / 5% CO 2) y permitir que las células se incuban en la solución de etiquetado durante 4 horas.
- Añadir 700 l de FCS a la solución de etiquetado de las células para lograr una concentración final de suero de 10%. Suero se añade a restablecer el ambiente enriquecido de la que las células están acostumbrados, y para ayudar a minimizing muerte de las células que podrían resultar de un cambio abrupto a la exposición de 24 horas a un medio ambiente libre de suero.
- Permitir que las células se incuban con la solución de etiquetado por un período adicional de 20 horas.
3. Día 3
5) Preparar las células marcadas
- Aspirar la solución de etiquetado de las células.
- Enjuague suavemente las células con 2-3 ml de pre-calentado Mg / Ca libre de D-PBS. Aspirar el PBS. Es importante la utilización de Mg / Ca PBS libre como el Mg y Ca perjudicará a la eficiencia de la tripsina en el siguiente paso.
- Añadir 2 ml de pre-calentado tripsina 0,05% a las células y la inclinación de la botella de ida y vuelta para asegurar toda la superficie del recipiente se cubre con una fina capa de tripsina. Colocar las células en una incubadora (37 ° C / 5% CO 2) y permitir que las células en reposo durante 5-7 minutos o hasta que las células comienzan a desprenderse de la placa. Puede que sea necesario para confirmar la separación bajo el microscopio. Golpee suavemente los lados del frasco si es necesario para facilitar el desprendimiento de la superficie celular.
- Agregar 4 ml de pre-calentado medio completo en el matraz para neutralizar la tripsina. Enjuague suavemente el frasco con la pipeta la tripsina / media / solución de células de arriba a abajo varias veces. Recopilar toda la solución en un tubo cónico de 15 ml. Centrifugar la solución de células a 400 RCF durante 5 minutos.
- Con cuidado aspirar el sobrenadante sin perturbar el sedimento celular. Resuspender las células en 5 ml de los medios de comunicación (que contiene suero o suero libre). Centrifugar la solución de células a 400 RCF durante 5 minutos.
- Repita el lavado de células descritas en el paso 5.5. En total, las células se lavan tres veces para eliminar el agente residual, sin contraste en los medios de comunicación y en la superficie de las células.
- Recuento de células en este punto para alcanzar el recuento de células más precisa, como las células se pierden durante el lavado anterior. Realizar una prueba de viabilidad de las células. Las células están listas para su posterior análisis y la aplicación o experimental. La RM puede llevarse a cabo con T1-W y T2-w parámetros, porque a pesar de ferumoxytol es un agente de contraste T2-w, ferumoxytol también exhibe efectos T1. Representante T2-w parámetros de resonancia magnética que se puede utilizar para la imagen ferumoxytol células marcadas son: secuencias FSE o SE_Multislice con un TR de 2000-2500 ms y un TE de 60 a 80 ms. Para adquirir una imagen T1-w, disminuya el valor de un TE o una secuencia FSE SE_Multislice o utilizar una secuencia GRE con una alta y baja TR TE. La figura 4 muestra un potencial de aplicación in vivo de imágenes etiquetadas de células madre.
4. Los resultados representativos:
Células marcadas demostrar un efecto significativo contraste oscuro o negativo en la T2 de RM y un efecto de contraste brillo o positivo en la T1 de RM (Figura 2). Longitudinal de imágenes de RM y las pruebas de viabilidad a cabo 5 días después de etiquetado demostró que no había señal de RM y un impacto significativo sobre la viabilidad en comparación con los controles de etiqueta (datos no mostrados).
jove_content "> Etiquetada posteriormente las células madre pueden diferenciarse en varios tipos de células o inyectado por vía intravenosa en la investigación in vivo.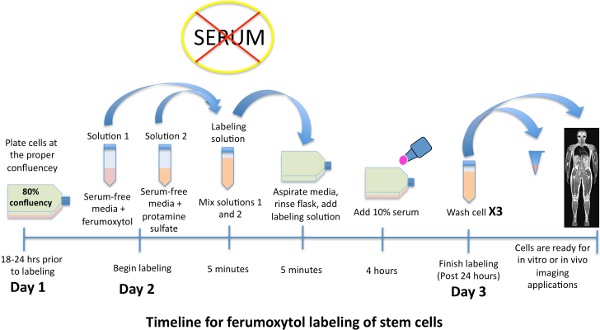
Figura 1. Esquema de la línea de tiempo para el etiquetado de las células madre con nanopartículas de óxido de hierro, ferumoxytol.

Figura 2. Imágenes de RM sagital de las secciones transversales tubos eppendorf thrrough con células de un pellet de células. A) Sin etiquetar los controles. B) Las células marcadas T2 demostrando un importante efecto negativo o agente de contraste en T2 FSE o SE_Multislice de imagen y un efecto del agente de contraste T1 o positivo en la secuencia T1 GRE.
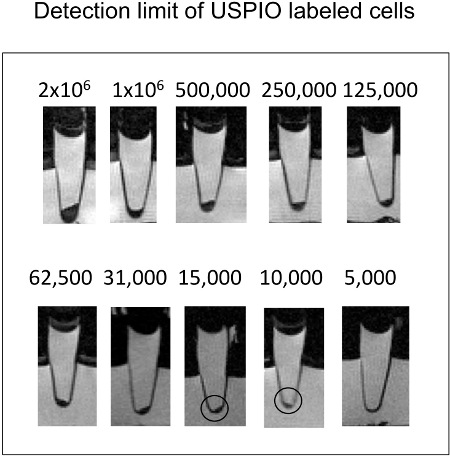
Figura 3. Sagital secciones transversales de los tubos eppendorf con células en células pelpermite. Tan sólo 10.000 células ferumoxytol etiqueta se puede detectar a través de T2-w RM.
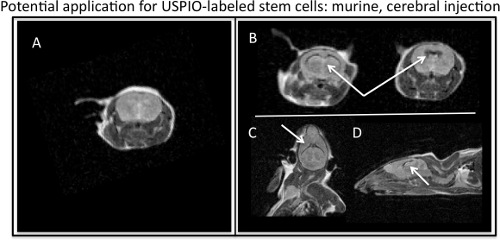
Figura 4. RM de visualización ferumoxytol marcado con células madre inyectadas en murino ventrículos cerebrales. A) Axial, MR imagen de Barin murino sin la inyección de USPIO marcado con células madre. B) axial, C) coronal, y D) imágenes sagitales MR representa el efecto T2, contraste negativo de USPIO marcado con células madre (flechas blancas) se inyecta en el cerebro murino.

Tabla 1. Cantidad adaptaciones para el etiquetado de las células en los vasos alternativa.
Access restricted. Please log in or start a trial to view this content.
Discusión
La mejora de la eficacia de engraftments de células madre es fundamental para el avance de la medicina regenerativa. Una técnica de visualización no invasiva de las células madre in vivo aumenta considerablemente nuestra capacidad de entender los mecanismos que conducen a los resultados de éxito del injerto. Etiquetado magnética para la visualización de la RM, tales como el procedimiento que hemos demostrado, permite el seguimiento en vivo de las células madre con la RM. Marcadas magnéticament...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Todos los colaboradores de este estudio no ofrece revelaciones.
Agradecimientos
Este trabajo fue apoyado por una subvención del Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la piel: 3R01AR054458-02S2.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| D-MEM glucosa alta | Sigma | D5648 | O mediano plazo otra base para la línea deseada de células madre para ser utilizado |
| D-PBS (Ca + +, Mg + + libre) | GIBCO | 14190-144 | |
| Tripsina-EDTA al 0,05% | Invitrogen | 25300-120 | |
| De suero fetal bovino (FBS) | Hyclone | SH30071.03 | |
Ferumoxytol (Feraheme) | AMAG | 59338-0775-01 | |
| Sulfato de protamina | APP Pharm. | 22930 |
Referencias
- Narsinh, K. H., Plews, J., Wu, J. C. Comparison of human induced pluripotent and embryonic stem cells: fraternal or identical twins? Mol Ther. 19, 635-638 (2011).
- Bulte, J. W. In vivo MRI cell tracking: clinical studies. AJR. Am. J. Roentgenol. 193, 314-325 (2009).
- Henning, T. D., Boddington, S., Daldrup-Link, H. E. Labeling hESCs and hMSCs with Iron Oxide Nanoparticles for Non-Invasive in vivo Tracking with MR Imaging. J. Vis. Exp. (13), e685-e685 (2008).
- Tallheden, T., Nannmark, U., Lorentzon, M. In vivo MR imaging of magnetically labeled human embryonic stem cells. Life. Sci. 79, 999-1006 (2006).
- Jung, C. W., Jacobs, P. Physical and chemical properties of superparamagnetic iron oxide MR contrast agents: ferumoxides, ferumoxtran, ferumoxsil. Magn. Reson. Imaging. 13, 661-674 (1995).
- Coyne, D. W. Ferumoxytol for treatment of iron deficiency anemia in patients with chronic kidney disease. Expert. Opin. Pharmacother. 10, 2563-2568 (2009).
- Li, Z., Suzuki, Y., Huang, M. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects. Stem Cells. 26, 864-873 (2008).
- Metz, S., Bonaterra, G., Rudelius, M. Capacity of human monocytes to phagocytose approved iron oxide MR contrast agents in vitro. Eur. Radiol. 14, 1851-1858 (2004).
- Nedopil, A., Klenk, C., Kim, C. MR signal characteristics of viable and apoptotic human mesenchymal stem cells in matrix-associated stem cell implants for treatment of osteoarthritis. Invest. Radiol. 45, 634-640 (2010).
- Kraitchman, D. L., Heldman, A. W., Atalar, E. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation. 107, 2290-2293 (2003).
- Stuckey, D. J., Carr, C. A., Martin-Rendon, E. Iron particles for noninvasive monitoring of bone marrow stromal cell engraftment into, and isolation of viable engrafted donor cells from, the heart. Stem Cells. 24, 1968-1975 (2006).
- Henning, T. D., Sutton, E. J., Kim, A. The influence of ferucarbotran on the chondrogenesis of human mesenchymal stem cells. Contrast. Media. Mol. Imaging. 4, 165-173 (2009).
- Arbab, A. S., Yocum, G. T., Kalish, H. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI. Blood. 104, 1217-1223 (2004).
- Nedopil, A. J., Mandrussow, L. G., Daldrup-Link, H. E. Implantation of Ferumoxides Labeled Human Mesenchymal Stem Cells in Cartilage Defects. J. Vis. Exp. (38), e1793-e1793 (2010).
- Arbab, A. S., Yocum, G. T., Wilson, L. B. Comparison of transfection agents in forming complexes with ferumoxides, cell labeling efficiency, and cellular viability. Mol Imaging. 3, 24-32 (2004).
- Babic, M., Horak, D., Trchova, M. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjug Chem. 19, 740-750 (2008).
- Golovko, D. M., T, H. enning, Bauer, J. S. Accelerated stem cell labeling with ferucarbotran and protamine. Eur. Radiol. 20, 640-648 (2010).
- Lu, M., Cohen, M. H., Rieves, D. FDA report: Ferumoxytol for intravenous iron therapy in adult patients with chronic kidney disease. Am. J. Hematol. 85, 315-319 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados