Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desplegable de proteínas de unión a calmodulina
En este artículo
Resumen
Calmodulina (CaM) pull-down de ensayo es una forma efectiva para investigar la interacción de la CAM con varias proteínas. Este método utiliza CAM-sepharose bolas para el análisis eficiente y específica de la CAM-proteínas de unión. Esta es una importante herramienta para explorar la señalización CAM en la función celular.
Resumen
Calcio (Ca 2 +) es un ion fundamental en la regulación de la función celular a través de una variedad de mecanismos. Gran parte de Ca 2 + señalización está mediada por la proteína de unión a calcio se conoce como la calmodulina (CaM) 1,2. CAM está involucrado en múltiples niveles en casi todos los procesos celulares, incluyendo la apoptosis, el metabolismo, la contracción del músculo liso, la plasticidad sináptica, el crecimiento del nervio, la inflamación y la respuesta inmune. Una serie de proteínas ayudan a regular estas vías a través de su interacción con la CAM. Muchas de estas interacciones dependen de la conformación del CAM, que es muy diferente cuando se une a Ca 2 + (Ca 2 +-CaM) en oposición a su Ca 2 +-estado libre (ApoCaM) 3.
Aunque la mayoría de las proteínas diana se unen Ca 2 +-CAM, sólo ciertas proteínas se unen a ApoCaM. Algunos CAM se unen a través de su coeficiente intelectual es de dominio, incluyendo neuromodulin 4, neurogranina (Ng) 5, y algunas miosinas 7, la función postsináptica 8, 9 y la contracción muscular, respectivamente. Su capacidad para unirse y liberación de CAM en la ausencia o presencia de Ca 2 + es fundamental en su función. Por el contrario, muchas proteínas sólo se unen Ca 2 +-CAM y requieren este enlace para su activación. Los ejemplos incluyen la cinasa de la cadena ligera de miosina 10, Ca 2 + / CaM-quinasas dependientes (CaMK) 11 y fosfatasas (por ejemplo, la calcineurina) 12, y espectrina quinasa 13, que tienen una variedad de efectos directos y aguas abajo 14.
Los efectos de estas proteínas en la función celular a menudo dependen de su capacidad para unirse a la CAM en una Ca 2 +-dependiente. Por ejemplo, hemos probado la relevancia de Ng-CAM vinculante en la función sináptica y cómo las diferentes mutaciones afectan a esta unión. Hemos generado una estafa GFP-etiquetados Ngestructura con mutaciones específicas en el CI en el dominio que iba a cambiar la capacidad de Ng a unirse una webcam en una Ca 2 +-dependiente. El estudio de estas mutaciones diferentes nos dio una gran comprensión de los procesos importantes que intervienen en la función sináptica 8,15. Sin embargo, en estos estudios, es esencial para demostrar que las proteínas mutadas se espera que la unión a CaM alterado.
A continuación, presentamos un método para probar la capacidad de las proteínas que se unen a CAM en la presencia o ausencia de Ca 2 +, con CaMKII y Ng como ejemplos. Este método es una forma de cromatografía de afinidad a que se refiere como una cámara desplegable ensayo. Utiliza CAM-Sepharosa cuentas para poner a prueba las proteínas que se unen a la leva y la influencia de Ca 2 + en este enlace. Es un tiempo considerablemente más eficiente y requiere menos proteína en relación con la cromatografía de columna y otros ensayos. En conjunto, esto proporciona una valiosa herramienta para explorar Ca 2 + / CAM y señalización de las proteínas que, encontrarrestar con la CAM.
Protocolo
Refiérase a la Figura 1 para un esquema básico de principios procedimiento con el homogeneizado. Tiempo estimado de preparación de extractos celulares de elución de la CAM con destino proteínas es de aproximadamente seis a siete horas.
1. Preparación de tejidos
- Inyectar organotípicos rodajas de hipocampo con un virus que contiene un plásmido que expresa la proteína recombinante de interés (en este ejemplo, la proteína verde fluorescente (GFP)-etiquetados Ng) y permitir que el tejido que expresan la proteína durante la noche.
- Aproximadamente 12 a 18 horas después de la inyección viral (dependiendo de la época la expresión viral), se preparan para recoger el tejido. Añadir 1 ml de buffer de la disección (glucosa 10 mM, 4 mM KCl, 26 mm de NaHCO3, 233mM sacarosa, 5 mM MgCl2, 1 mM CaCl 2, y el 0,1% de fenol-rojo, cámaras de gas con 5% de CO 2 95% O 2) a una placa de Petri. Transferencia de cultivo de tejidos / inserción de placa de Petri y añadir 2 ml de búfer disección de la inserción a sumergir el tejido.
- Recolecciónt organotípicos tejido del hipocampo (entre 5 y rodajas de 10), raspando suavemente en el tejido libre de la membrana insertar utilizando un bisturí. En concreto la eliminación de una determinada región de interés (por ejemplo, CA1) es también una opción. Transferir el tejido suspendido a un tubo de microcentrífuga de 1,5 ml con una pipeta Pasteur invertida.
- Centrifugar las muestras a 1.500 rcf durante 1 min para separar el tejido de la memoria intermedia de disección. Retire con cuidado el sobrenadante por aspiración. Asegúrese de no perturbar el sedimento.
- Para cada sector utiliza, agregar 30 a 60 l de tampón de homogeneización (150 mM NaCl, 20 mM Tris pH 7,5, DTT 1 mM, leupeptina 1μg/mL, chemostatin 1μg/mL, antipain 1μg/mL, pepstatina 1μg/mL, y el 1% Triton X -100) a los tejidos y homogeneizar completamente con mortero.
- Con el fin de eliminar los desechos celulares, centrifugar el homogenado restantes a 1.100 rcf durante 10 minutos y retirar con cuidado el sobrenadante por aspiración y evitando la contaminación del sedimento.
- Tomar el 10% del sobrenadante como una muestra de la entrada (muestra 1). Guarde el resto de sobrenadante en hielo durante la preparación de las cuentas de la CaM-sefarosa para su uso en el paso 3.
Nota: El tejido utilizado aquí son organotípicos rodajas de hipocampo. Sin embargo, se podría utilizar las neuronas disociadas o cualquier sistema de cultivo de células. En tal caso, comience por el paso 1.4 después de recoger el tejido de la manera adecuada.
2. Preparación de cuentas de pull-down
En el manejo de las cuentas, es importante para salvar las cuentas y maximizar la eficiencia de las reacciones mediante la prevención de los granos se sequen en los lados del tubo. Para ello, lo mejor es rotar los tubos de su lado, permitiendo que la solución para humedecer los granos en las paredes del tubo, inmediatamente antes de la centrifugación.
- Para cada pull-down, una pipeta 400 l de suspensión Sepharose calmodulina cuentas en un tubo de microcentrífuga de 2 ml con un fla relativamentet-fondo para maximizar el área superficial y la interacción de sus soluciones con las cuentas durante su incubación.
- Centrífuga cuentas en 21.000 rcf durante 30 segundos y retirar con cuidado el sobrenadante por aspiración. Asegúrese de no molestar a las cuentas.
- Para lavar los granos, añadir 100 ml de tampón de homogeneización respectivos que contienen 2 mM CaCl 2 a las que se utilizan para tirar hacia abajo de Ca 2 +-CAM proteínas de unión y 2 mM EDTA (un quelante conocido Ca 2 +) para los granos tirando hacia abajo ApoCaM proteínas de unión. Golpee suavemente el tubo para volver a suspender cuentas y centrifugar a 1.500 rcf durante 1 min. Retire con cuidado el sobrenadante por aspiración, asegurándose de no molestar a las cuentas.
Nota: Para todos los pasos de aspiración, se recomienda utilizar una pipeta de punta que tiene una abertura muy bien (por ejemplo, puntas de carga de gel) para permitir la remoción de la solución sin necesidad de retirar cuentas.
3. CAM-sefarosa unión de las proteínas
- Dividir en dos el sobrenadante que contiene las condiciones de un volumen igual. Dependiendo de su estado, agregar la cantidad adecuada de CaCl 2 o EDTA para su sobrenadante hasta una concentración de 2 mM de cada uno.
- Añadir sobrenadante del paso de 1,7 a cuentas de lavado en tampón de homogeneización correspondientes. Golpee suavemente el tubo para mezclar.
- Incubar las muestras a 4 ° C durante 3 horas en un agitador. Vuelva a suspender cuentas cada 30 minutos o más para aumentar la eficiencia de la unión.
- Tubo de centrífuga que contienen las muestras y los granos en 1500 rcf durante 3 min.
- Tome 50μL del sobrenadante como una muestra de la proteína unida (muestra 2) y retirar con cuidado el resto de sobrenadante por aspiración y descarte.
- Lávese las cuentas tres veces como se describe en el paso 2.3 con 100μL de tampón de homogeneización respectivos.
4. Elución
- Añadir 50μL de tampón de elución (50 mM Tris-HCl pH 7,5, NaCl 150 mM y) con la condición opuesta (10 mM Cacl 2 o EDTA 10 mM) a las perlas. Por ejemplo, las muestras que se homogeneizaron y encuadernado en un tampón que contiene Ca 2 + se eluyen en el tampón de elución que contiene EDTA y viceversa.
Opcional: Calentamiento del tampón de elución de 37 ° C antes de añadir a los granos pueden mejorar el rendimiento.
- Incubar solución con los granos a temperatura ambiente durante 30 minutos en un agitador. Mezclar el golpeando suavemente el tubo de aproximadamente cada 5 minutos.
- Centrífuga cuentas en 1500 rcf durante 3 minutos y retirar con cuidado el sobrenadante de 50μL para la unión a proteínas (muestra 3) por aspiración. Asegúrese de no molestar a las cuentas.
- Añadir buffer de proteína de carga para todas las muestras (es decir, proteínas homogeneizado, no consolidados y consolidados, así como los que siguen vinculados a las cuentas).
Nota: Para maximizar la elución (especialmente en el caso de elución ineficiente), añadir 50μL de tampón de elución correspondiente (por ejemplo, agregar buf contiene EDTAfer de cuentas vinculado en CaCl 2) a las cuentas antes de calentar las muestras para ayudar a eluir cualquier proteína restante atado y repita los pasos descritos en el apartado 4.3 para quitar restantes proteínas unidas.
5. SDS-PAGE y Western Blot
Conducta SDS-PAGE y análisis mediante Western blot de sondeo para la proteína de interés y la sonda de una proteína conocida por obligar a CAM en la condición opuesta, como control positivo.
6. Resultados representante
La Figura 2b muestra un ejemplo de un ensayo CAM-pull-down de pruebas de la unión CAM de GFP-etiquetados en comparación con Ng Ng endógeno. Para ello, las buenas prácticas agrarias-Ng se sobreexpresa en nuestras secciones de hipocampo organotípicos noche a la mañana y el tejido homogeneizado fue. El homogeneizado se incubó con Cam-sepharose bolas en presencia de cualquiera de Ca 2 + o EDTA. Homogeneizado de entrada muestra que la GFP-Ng se expresó además endógeno Ng y Ca 2 + / CaM-quinasa dependiente de II(CaMKII). Como era de esperar sobre la base de la unión conocida de Ng endógena (que se ilustra en la fig. 2A), GFP-etiquetados Ng se eluyó en ausencia de Ca 2 + (proteína EDTA unido) y no consolidados en la presencia de Ca 2 + (Fig. 2B) . En cambio, el control, CaMKII, se eluyó sólo en la presencia de Ca 2 + (proteínas) y fue sin enlazar en su ausencia (EDTA). Esto demuestra que las cuentas de CAM están funcionando correctamente y el eluciones eran eficientes. Lo más importante, esto demuestra que las buenas prácticas agrarias-Ng se une a ApoCaM de una manera similar a la forma endógena, lo que sugiere que la etiqueta de las buenas prácticas agrarias no alteren el funcionamiento de nuestra proteína recombinante.
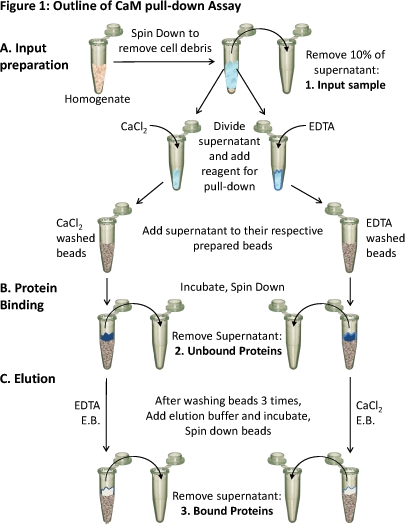
Figura 1. Esquema de la CAM pull-down de ensayo
(A) homogeneizado de tejido se centrifuga para eliminar los restos celulares. Aproximadamente el 10% del sobrenadante se toma como una muestra de la entrada (1). El sobrenadante restante se divide por igual para los diferentescondiciones y los reactivos adecuados (CaCl 2 o EDTA) se añaden a la prueba obligatoria en esas condiciones. Cada sobrenadante (que contiene cualquiera de CaCl2 o EDTA) se carga en el preparado, respectivamente CAM-sepharose bolas y (B) se incuban para permitir la unión. Proteínas no unidos son eliminados (2) y (C) las proteínas unidas (3) se eluyen fuera de las cuentas con tampón de elución (EB), que contiene la condición opuesta a la unión. La composición de proteínas de estas tres muestras de la proteína puede ser analizada mediante SDS-PAGE y Western blot.
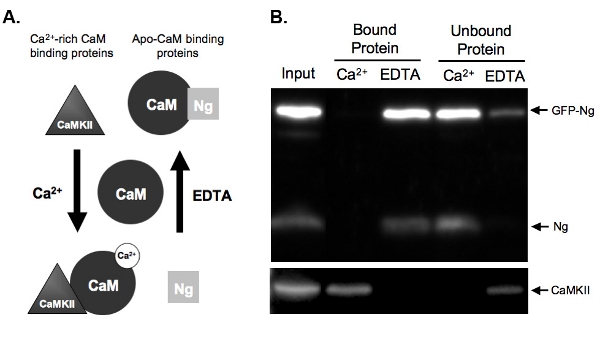
Figura 2. A) Esquema de Ca 2 +-dependiente vinculante CAM y elución en los ejemplos de ensayo de pull-down se dan de dos tipos de proteínas que se unen a una webcam en una Ca 2 +-dependiente. Neurogranina (Ng) representa proteínas que se unen apo-CAM y CaMKII representa las proteínas que se unen al Ca 2 +-ricosCaM. CAM se muestra en su estado disociado antes de la incubación con las proteínas de homogeneizado. Una vez que se incuba en condiciones de alta concentración de Ca 2 + (2 mM) o en presencia de un quelante de Ca 2 +, EDTA (2 mM), las proteínas se unen a CAM en consecuencia. Ng se une CAM en la condición de EDTA, ya que es poco o nada de Ca 2 + presentes, y se eluyó de las perlas de la CaM-sefarosa en presencia de Ca 2 +. CaMKII, sin embargo, se unen a CAM en la presencia de altas cantidades de Ca 2 + y se disocia una vez que el Ca 2 + se quelados.
B) Los resultados de CAM ejemplo desplegable ensayo. Esta cifra demuestra el resultado final previsto de una cam-sefarosa desplegable con las muestras probaron para Ng y CaMKII. Tanto el Ng endógeno y las buenas prácticas agrarias Ng-están presentes en las calles de proteínas unidas a la CAM en la presencia de EDTA. No Ng está obligado cuando las muestras se incuban con la CAM en la presencia de Ca 2 +, lo que demuestra que Ng sólo obliga a apo-CAM. Nuestro control positivo, CaMKII, por el contrario, se une a la CaM en presencia de Ca 2 +.
Discusión
El protocolo al que se utiliza CAM-sepharose bolas para investigar la Ca 2 +-dependencia de la CAM-proteínas de unión. Muchas proteínas se unen una webcam en una Ca 2 +-dependiente. Estas interacciones son de gran importancia dada la cantidad de proteínas de unión a CaM y su papel fundamental en muchas vías de señalización. En este protocolo, la CAM-sepharose bolas se utilizan para separar la CaM proteínas de unión a partir de tejido homogeneizado en la presencia o ausencia de Ca 2 +...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Tiffany de la cereza en su ayuda en la optimización de este protocolo. Este trabajo fue financiado por el Instituto Nacional del Envejecimiento (AG032320), así como el avance de una mejor salud de Wisconsin.
Materiales
| Producto | Empresa | Número de catálogo | Notas |
| Calmodulina-Sepharosa cuentas | GE Healthcare | 17-0529-01 | |
| Anti-alfa CamKII | Sigma-Aldrich | C6974 | |
| Anti-neurogranina | Millipore | 07-425 | |
| Gel Consejos Cargando Pipet | Pescador | 02-707-138 | El uso de la aspiración de sobrenadantes |
| Tubos de microcentrífuga (2,0 ml) | Pescador | 05-408-146 | Uso de todos los pasos que involucran la calmodulina-sefarosa cuentas |
Referencias
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados