Method Article
Producción masiva de Aedes aegypti genéticamente modificados para liberaciones de campo en Brasil
En este artículo
Resumen
Para lograr la supresión de la población de Aedes aegypti utilizando el sistema RIDL® (Liberación de Insectos Portadores de un Letal Dominante), es necesario liberar un gran número de mosquitos machos. Esto requiere el uso de técnicas y tecnología de cría masiva para proporcionar sistemas confiables para obtener el máximo número de mosquitos machos de alta calidad.
Resumen
Se están buscando nuevas técnicas y métodos para tratar de ganar la batalla contra los mosquitos. Los recientes avances en las técnicas moleculares han llevado al desarrollo de nuevos e innovadores métodos de control de mosquitos basados en la Técnica de Insectos Estériles (SIT)1-3. Un método de control conocido como RIDL (Release of Insects carrying a Dominant Lethal)4, se basa en SIT, pero utiliza métodos genéticos para eliminar la necesidad de esterilización por radiación5-8. Una cepa RIDL de Ae. aegypti se probó con éxito en el campo en Gran Caimán9,10; se planea un mayor uso en el campo o está en curso en otros países del mundo.
La cría masiva de insectos se ha establecido en varias especies de insectos y a niveles de miles de millones a la semana. Sin embargo, en los mosquitos, la cría generalmente se ha realizado en una escala mucho más pequeña, con la mayoría de la cría a gran escala que se realiza en las décadas de 1970 y 80. Para un programa ridl es deseable liberar tan pocas hembras como sea posible, ya que muerden y transmiten la enfermedad. En un programa de cría masiva hay varias etapas para producir los machos que se liberarán: producción de huevos, cría de huevos hasta la pupación, y luego clasificación de los machos de las hembras antes de la liberación. Estos machos se utilizan para un programa de control de RIDL, liberados como pupas o adultos11,12.
Para suprimir una población de mosquitos que usan RIDL, es necesario criar a un gran número de adultos machos de alta calidad13,14. A continuación se describen los métodos para la cría en masa de OX513A, una cepa RIDL de Ae. aegypti 8, para su liberación y cubre las técnicas necesarias para la producción de huevos y la cría masiva de machos RIDL para un programa de control.
Introducción
Los mosquitos transmiten muchos patógenos que pueden causar una serie de enfermedades en los seres humanos y el control de estos mosquitos ha sido una batalla continua durante siglos. Las estrategias para controlar insectos basadas en métodos químicos y biológicos han tenido algunos éxitos notables, pero en muchos casos el control no ha sido sostenible a largo plazo. Por ejemplo, Brasil logró la erradicación de Ae. aegypti en los años 50, pero el mosquito ha reinvado en los últimos 40-50 años. Esto puede atribuirse a muchas causas, incluida la resistencia a los insecticidas, el daño ambiental, la mala implementación del programa de control15-20,y la rápida reinvasión sin un monitoreo o respuesta adecuada.
Se están buscando nuevas técnicas y métodos para tratar de ganar esta batalla contra los mosquitos. Los recientes avances en las técnicas moleculares han llevado al desarrollo de nuevos e innovadores métodos de control de mosquitos basados en la Técnica de Insectos Estériles (SIT)1-3. Un método de control conocido como RIDL (Release of Insects carrying a Dominant Lethal)4 se basa en SIT, pero utiliza métodos genéticos para eliminar la necesidad de esterilización por radiación. Se han construido cepas RIDL para varias especies de plagas, incluyendo Ae. aegypti 5-8, Una cepa RIDL de Ae. aegypti se probó con éxito en el campo en Gran Caimán9,10; se planea un mayor uso en el campo o está en curso en otros países del mundo. La supresión de las poblaciones de mosquitos que utilizan RIDL requerirá la cría de un gran número de adultos machos de alta calidad3,14.
Para un programa SIT se considera deseable liberar sólo a los machos; los mosquitos hembra pica y transmiten enfermedades. Además, los machos estériles liberados pueden ser 'distraídos' por las hembras liberadas reduciendo la efectividad del programa. Se demostró que la liberación sólo masculina era 3-5 veces más efectiva que la liberación de sexo mixto en grandes experimentos de campo con moscas de la fruta mediterráneas irradiadas21.
En un programa de cría masiva de RIDL, hay varias etapas para producir los machos para su liberación. La primera es producir los huevos necesarios para la generación de liberación (Figura 1). La siguiente etapa es criar los huevos a través de pupas o adultos, separando las larvas de las pupas y las pupas masculinas de las pupas femeninas. La separación a gran escala de machos de hembras requiere una diferencia entre los sexos en una etapa particular de la vida adecuada para la clasificación masiva22. En Ae. aegypti (y otras especies de mosquitos) hay una diferencia de tamaño significativa entre las pupas macho y hembra que puede ser explotada para técnicas de separación de sexo. Los machos ridl clasificados son liberados en un programa de control como pupas o como adultos11,12.
A continuación se describen los métodos para la cría masiva de OX513A, una cepa RIDL de Ae. Aegypti, para su liberación. Los métodos descritos abarcan las técnicas necesarias para la producción de huevos y machos ridl para un programa de control.
Protocolo
Requisitos insectarios
1. Visión general
- La cría en masa tiene varias fases, cada una de las cuales se realiza en un área distinta de la unidad de cría en masa. La Figura 1 muestra la fase principal de la cría y dónde se producen en la instalación de cría masiva.
2. Consideraciones de bioseguridad para los insectarios
- El proyecto fue aprobado por el comité de ética animal de la Universidad de São Paulo - Brasil y se obtuvieron todos los permisos y aprobaciones necesarias.
- El sistema RIDL utiliza la letalidad condicional; un suplemento dietético (tetraciclina) impide la expresión del sistema RIDL permitiendo que los insectos sean criados en masa; sin tetraciclina los mosquitos mueren. La tetraciclina no se encuentra en los sitios de reproducción de Ae. aegypti en la naturaleza, por lo que cualquier descendencia producida por fugitivos no sobrevivirá. Esto agrega un nivel adicional de seguridad sobre el uso de insectos de tipo salvaje (WT) esterilizados por otros métodos(es decir, radiación).
- Use la entrada de doble puerta, letreros de "Solo personal autorizado" y mosquiteros en el insectario. Cualquier ventana debe estar sellada para evitar la contaminación de la colonia con insectos WT y ayudar a prevenir escapes desde el interior del insectario.
- Las regulaciones y autoridades locales pueden tener requisitos adicionales o alternativos específicos. Póngase en contacto con las autoridades pertinentes para obtener información o orientación en una etapa temprana, y obtener todos los permisos y aprobaciones necesarios antes de establecer la cepa RIDL en un insectario.
- La cría masiva insectaria sólo debe utilizarse para la cría de RIDL. No hay otras cepas o insectos deben estar presentes. Esto es para evitar la contaminación de la cepa RIDL y la contaminación con patógenos que pueden afectar la aptitud y la supervivencia, reduciendo la productividad y la eficacia de los machos liberados.
3. Diseño insectario
- La Figura 2 muestra un plano del insectario utilizado en biofábrica Moscamed en Brasil.
- La temperatura de todas las habitaciones fue de 26 °C ± 2) con una humedad relativa de aproximadamente 70-80% y un ciclo de luz: oscuridad de 12:12 horas utilizando tiras de luz fluorescente.
- Este plano se puede modificar de acuerdo con los requisitos de espacio específicos, por ejemplo, la escala de la versión determinará el tamaño total. Sin embargo, la producción, la cría y clasificación de huevos, el control de calidad (QC) y las liberaciones deben separarse en cuatro áreas distintas: colonia de producción de huevos, generación de liberación, control de calidad y almacenamiento de adultos para su liberación.
- La sala de la Colonia de Producción de Huevos (aproximadamente 20 m2)se utiliza para producir huevos para la generación de liberación.
- El área de Control de Calidad es donde se llevan a cabo experimentos para verificar los procedimientos y la aptitud de la línea RIDL, incluidas las mediciones de la tasa de eclosión, el número de pupas, el tamaño de la pupa y la medición de la efectividad de la clasificación y eliminación de hembras. También se realizan pruebas para la contaminación por WT mediante la comprobación de la presencia de marcador de fluorescencia y fenotipo utilizando ensayos de compensación que miden la letalidad.
- La sala de Generación de Liberación (aproximadamente 36 m2)requiere espacio adecuado para bandejas y la clasificación de larvas y pupas. Las bandejas se mantienen en bastidores de aluminio especialmente diseñados. Se requiere un gran área de trabajo y un fregadero para la crianza y clasificación y otro fregadero grande para el lavado de bandejas y jaulas. Se ha incluido una trampa de captura de filtro en la salida de aguas residuales de los sumideros para mitigar el escape de mosquitos vivos a través de la alcantarilla.
- Toda el agua utilizada para las bandejas se dispone a través de un desagüe, que cuenta con un compartimento que contiene una malla que evita el escape de insectos en cualquier etapa del desarrollo.
- Se requiere un área para el almacenamiento de adultos para su liberación (Almacenamiento de adultos para liberación, Figura 2)que contiene estanterías para contener los dispositivos de liberación mientras los adultos maduran antes de la liberación.
Métodos de producción para la cría en masa ridl:
La Colonia de Producción de Huevos produce los huevos que se utilizan en la Generación de Liberación(Figura 1)para producir adultos. Hay muchas similitudes en los dos métodos de cría, pero también algunas diferencias claras. Los procesos de cría que son los mismos para ambos procedimientos se describen en la sección Colonia de producción de huevos solamente.
Colonia de Producción de Huevos
4. Producción larvaria
La Colonia de Producción de Huevos genera huevos OX513A RIDL homocigóticos8 para la Generación de Liberación. Un alto control de calidad garantiza la viabilidad, la aptitud y la integridad de la cepa de los huevos suministrados.
- El estímulo para la eclosión es la inmersión en agua con un bajo nivel de oxígeno disuelto. Para reducir el nivel de oxígeno en el agua, calentar el agua hasta que hierva e inmediatamente colocar 400 ml en frascos de vidrio de 500 ml (circunferencia de apertura de 74 mm), sujetar la tapa de forma segura y dejar a temperatura ambiente durante varias horas para enfriar.
- Poner 1 g de huevos en un frasco de agua hervida, volver a sesgar y esperar una hora. Transferir el contenido a una bandeja con agua de 2 L y dejar pasar la noche en condiciones insectarias.
- Coloque las larvas eclosionadas en un volumen conocido de agua y revuelva usando un agitador magnético y pulgas durante el tiempo suficiente para tomar alícuotas; agitar vigorosamente o durante un tiempo prolongado daña las larvas y debe mantenerse al mínimo. El volumen estándar utilizado para eclosionar larvas es de 1 L, sin embargo, las densidades de más de 300 larvas / ml son difíciles de contar y pueden ser perjudiciales. Por lo tanto, no eclosione más de unos 300.000 huevos/L de agua.
- Determine la velocidad de eclosión tomando tres alícuotas de 1 ml y colocándolas sobre una hoja de papel absorbente, con una rejilla de 1 cm cuadrados, encima de una esponja absorbente para absorber el exceso de agua. Cuente el número de huevos eclosionados y no incubados de tres cuadrados buscando la tapa faltante de un huevo eclosionado. Se espera una tasa de eclosión alrededor del 80-90%.
- Tomar cuatro alícuotas de 1 ml cada una y colocar en cuatro botes de pesaje negros (las larvas son blancas y por lo tanto más fácilmente visibles sobre un fondo negro) y contar el número de larvas vivas presentes por el ojo; se recomienda el uso de un contador. El número promedio de larvas por ml se utiliza para calcular el volumen de agua a añadir en cada bandeja para obtener el número deseado de larvas por bandeja.
- Puede haber grandes diferencias en la densidad en la que se pueden criar las larvas entre cepas y especies. También es deseable comparar el tamaño de macho adulto RIDL con los machos de tipo salvaje; idealmente quieres similar a los machos RIDL de mayor tamaño que pueden competir con éxito con los machos salvajes. Por lo tanto, para cada cepa ridl es necesario determinar la densidad ideal de larvas y es una compensación contra las limitaciones de espacio para la cría y la escala de producción. Densidades que van desde 0.1-2.5 larva/ml hemos encontrado para ser una buena combinación de producción y calidad; también discutido por Medici23.
- Añadir las larvas a las bandejas. En nuestras instalaciones utilizamos bandejas de unos 53 cm x 37 cm x 8 cm (L x W x H) y la cantidad de agua necesaria para lograr la densidad de larvas para la producción.
- Añadir una solución común de tetraciclina (3 mg/ml en agua) a las bandejas a una dilución de 1:100 para obtener la concentración final requerida de 30 μg/ml.
- Alimente a las larvas con alimentos de peces en escamas(www.sera.de)diariamente, que han sido triturados en un polvo fino. La Tabla 1 muestra el régimen de alimentación típico en mg de alimento por larva y día. Alimentar a las larvas hasta el día apropiado de clasificación en las condiciones insectarias descritas anteriormente.
5. Clasificación de larvas de pupas y pupas macho /hembra
- Clasificar las larvas de las pupas 8 días después de la eclosión separando las larvas de las pupas. Entonces sexo-ordene las pupas para los varones. Un dispositivo conocido como separador de placas24,25 puede clasificar larvas de pupas macho y de pupas hembras. La Figura 3 ilustra el uso de este separador de placas para separar las larvas de las pupas masculinas y femeninas.
- Usando una cuchara de medición con una malla en la parte inferior, calibrarla con 500 pupas o más y usarla para establecer jaulas y estimar la cantidad total de pupas de machos y hembras producidas.
- En el primer día de clasificación (día 8) la mayoría de las pupas son machos, así que coloque las larvas clasificadas de nuevo en una bandeja y vuelva a la parte posterior hasta el día siguiente, cuando la mayoría de las pupas son hembras (Figura 4).
- Repita el proceso de clasificación cada día como se describe en los pasos 2.1-2.3 hasta que todas las larvas hayan pupado o hasta el final de una semana laboral.
- Coloque 1.000 pupas macho (usando la cuchara de medida) en una jaula y el día 9 agregue 3.000 pupas hembras a la misma jaula (usamos tubos de PVC de 30 cm de alto y 30 cm de diámetro adaptados con malla superior y un orificio de acceso con red, pero las jaulas de plástico de 30 cm x 30 cm x 30 cm también están disponibles en BugDorm).
- Permita que los adultos se apareen durante al menos 2 días y proporcionándoles solución de sacarosa (10%) en algodón húmedo ad libitum antes de la alimentación con sangre. Recoja los huevos durante dos semanas (~ dos ciclos gonotróficos) con dos alimentos de sangre a la semana. Esto produce un promedio de 143.000 huevos de una jaula de 3.000 hembras (un promedio de 48 huevos/hembra). Para la producción de 4 millones de huevos a la semana es necesario instalar unas 28 jaulas cada semana.
6. Alimentación de sangre
- Un sistema de alimentación de placas de aluminio suministra sangre a las jaulas dos veces por semana. Se crea una bolsa de sangre en el lado de una placa de aluminio (10 cm x 10 cm x 3 mm) con Parafilm(Figura 5). Para fomentar la alimentación, la sangre se calienta colocando una bolsa de frijoles calentada en la parte superior del alimentador de placas. La bolsa de frijoles consistía en aproximadamente 250 g de granos de trigo en una bolsa de tela, que se calienta durante aproximadamente 10 segundos en un microondas. La sangre que usamos para alimentarse es de un matadero local; como estos animales (principalmente cabras y ovejas) son para consumo humano se prueban para evitar la presencia de patógenos.
- Tres días después de la alimentación con sangre, se proporciona un sitio de oviposición para que las hembras den sus huevos. El sitio de oviposición es un recipiente de plástico redondo lleno de aproximadamente 1/4 con agua y papel de filtro que cubre el interior. Dos días más adelante se quita el sitio de la oviposición. Para obtener la máxima producción de huevos, asegúrese de que el papel de filtro cubra toda la superficie disponible dentro del contenedor y permanezca húmedo.
- Retire el papel de huevo y colóquelo sobre el papel absorbente para que se seque en condiciones insectarias; los huevos requieren un período de acondicionamiento a alta humedad (más del 70%) de al menos 48 horas después de haber sido puesto. Los huevos se pueden dejar en el insectario durante un máximo de 3 meses con una disminución mínima en la tasa de eclosión, siempre y cuando la humedad se mantenga alta25.
- La colonia de producción de huevos debe ser de tamaño suficiente para proporcionar el número de huevos requeridos semanalmente para el programa de liberación. La instalación descrita anteriormente puede producir aproximadamente 4 millones de huevos con 28 jaulas establecidas semanalmente. Se recomienda mantener suficientes huevos almacenados para garantizar al menos 4 semanas de huevos para la generación de liberación y la colonia de producción de huevos.
Generación de versiones
7. Producción larvaria
Los procesos de eclosión, cría y clasificación para la generación de liberación son idénticos al método descrito anteriormente para la colonia de producción de huevos. Sin embargo, la escala de producción es mucho mayor y esto requiere más bandejas y más esfuerzo.
8. Clasificación de larvas, pupas masculinas y pupas femeninas
- La clasificación de larvas, pupas masculinas y pupas hembras es idéntica al método descrito para la producción de huevos.
- Después de clasificar las pupas masculinas, es importante verificar la contaminación de las hembras antes de su liberación; no debe haber más del 1% de mujeres presentes. Tome tres alícuotas de 500 pupas (tres pupas aleatorias que miden cucharas) y cuente el número de pupas hembras presentes. Las hembras pueden ser identificadas ya que son generalmente más grandes que los machos y a partir de las diferencias en la forma del lóbulo genital (Figura 6)27. Si hay más del 1% de mujeres, se debe recurrir a ellos y revisar de nuevo.
- Use solo los machos desde el día 8 y 9 para la liberación; autoclave las larvas y pupas restantes. En Brasil, estos residuos deben ser tratados de la misma manera que los residuos médicos, pero las regulaciones pueden diferir en otros países. No utilice pupas y larvas hembras de la Generación de Liberación para la Colonia de Producción de Huevos debido a las diferencias en el control de calidad, la cría y los riesgos de contaminación de un número mayor, y un menor control de calidad.
Almacenamiento de adultos para liberación: Coloque a los machos en dispositivos de liberación para que emerjan y maduren antes de la liberación. Los detalles de los dispositivos de versión no se tratan en este método. Sin embargo, la capacidad de los dispositivos de liberación que utilizamos es de alrededor de 1.000 machos. Los detalles del método de liberación (dispositivo de versión y sistema de liberación) no se tratan en este método.
Resultados
Los resultados esperados de pupación para la producción se muestran en la Figura 4. Los machos pupan primero, alcanzando su punto máximo el día 8 y las hembras alcanzan su punto máximo el día 9 después de la eclosión. Es importante medir esta curva de pupación para conocer el mejor momento para clasificar machos de hembras.
Los resultados de más de 6 meses de clasificación de pupas machos y hembras muestran que la contaminación femenina en promedio es del 0,02% (Figura 5; SEM = 0,004%). Esta tasa de contaminación representa sólo 400 hembras liberadas durante un mes de liberaciones (aprox. dos millones de machos). La producción actual de huevos por semana es de 4 millones. De ellos, 3,5 millones se incuban para colonias de huevos y producción, y el resto se almacena para su respaldo. Aproximadamente el 11% de los huevos se utilizan para la colonia de producción de huevos y el resto para la generación de liberación. La tasa de eclosión de huevos promedia el 87,3% (SEM = 0,5%) y el rendimiento de pupas macho de larvas L1 promedia 29,5% (SEM = 1,2). Dos millones de larvas se crían cada semana para la colonia de generación de liberación que produce alrededor de 571.000 pupas machos (SEM = 14.000). La mortalidad de las pupas y adultos durante la emergencia y la liberación promedia el 5%, lo que resulta en aproximadamente 543.000 (SEM = 13.000) mosquitos machos adultos liberados por semana. Se anticipa que la producción actual de 4 millones de huevos / semana podría reducirse a ~ 3 millones / semana con una mayor optimización para reducir la pérdida de desperdicio y almacenamiento. En total se necesitan 6 empleados para la producción descrita; cuatro trabajando en la generación de liberación y los dos restantes en la colonia de huevos.
control de calidad
El control de calidad es esencial para mantener la calidad de los adultos, la eficiencia de la crianza, la mano de obra y los costos.
Control del fenotipo transgén
Para verificar la expresión génica de RIDL dos controles se realizan, en primer lugar para comprobar la expresión del marcador de la fluorescencia y en segundo lugar para comprobar la expresión del rasgo de la mortalidad de RIDL en ausencia de tetraciclina. Todas las larvas deben expresar el marcador fluorescente. Para comprobar si el marcador fluorescente se está expresando como se esperaba, se comprueban 2.000 larvas de primer estadio bajo un estereomicroscopio Leica MZFLIII con filtro DsRed2 (Texas Red) para determinar si hay individuos no fluorescentes presentes. Sin tetraciclina se expresa el gen RIDL y esperamos una supervivencia del 3-4% a adultos8. Para comprobarlo, se configura una bandeja adicional para cada lote de liberación sin tetraciclina. La única diferencia con la cría normal es que el alimento se reduce en 2/3 desde el día 6 porque la acumulación de exceso de alimento debido a larvas muertas puede resultar en un crecimiento bacteriano excesivo.
Control de crianza
Cuatro bandejas de la generación de liberación se eligen aleatoriamente para ordenarse y contarse por separado. El número de pupas machos y hembras se registra de cada bandeja cada día (Figura 4). Cualquier desviación del número esperado de machos y hembras indica un problema potencial que podría afectar la producción y / o la aptitud y se puede comparar con la colonia de huevos para ayudar a determinar la fuente de los problemas.
Mediciones de pupas
Se ha demostrado que el tamaño de las pupas está correlacionado con el tamaño adulto28. Como control de calidad para el tamaño adulto, el ancho del cefalotórax se mide de al menos 30 pupas macho por cada día de clasificación de la Generación de Liberación; para la Colonia de Producción de Huevos también se miden pupas hembras. La anchura media del cefalotórax era 1,05 milímetros (SEM 0,005) para los varones lanzados y 1,04 milímetros (SEM = 0,006) y 1,29 milímetros (SEM = 0,006) para los varones y las hembras respectivamente Producción del huevo, colonia; se obtuvieron resultados similares para la cría masiva de Ae. albopictus 24.

Figura 1. Etapas de la cría masiva de mosquitos para su uso en un programa RIDL/SIT. La Colonia de Producción de Huevos tiene un alto nivel de control de calidad para garantizar la calidad de los huevos suministrados a la generación de liberación. Los huevos se crían a través de pupas en la colonia de liberación, donde los machos se clasifican de las hembras. Los adultos masculinos se utilizan para el programa de control ridl.
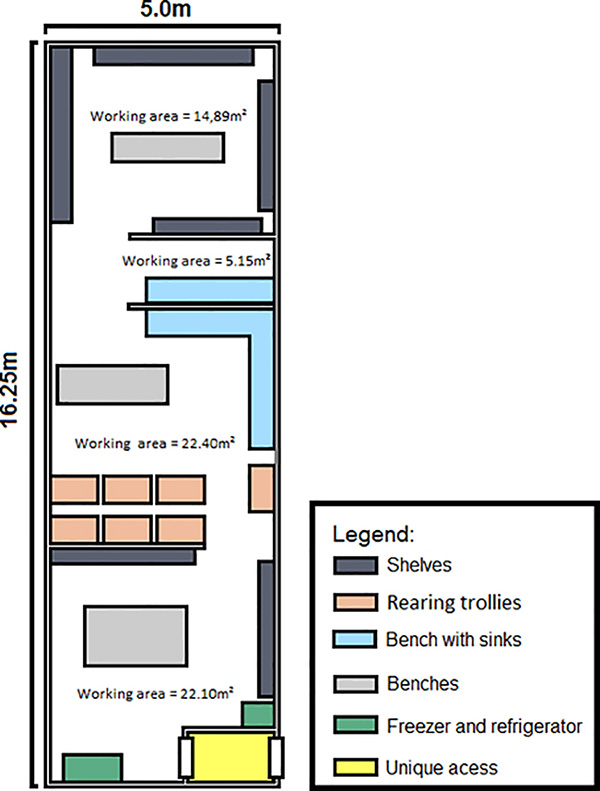
Figura 2. Esquema de la instalación de cría para la producción de machos RIDL para un programa de liberación. Los huevos de alta calidad se producen continuamente en la sala de la Colonia de Producción de Huevos y luego se crían a través de pupas en la sala de Generación de Liberación. Las larvas y pupas se separan y las pupas sexo-se clasifican para los machos. Los machos se colocan en dispositivos de liberación y se les permite madurar a los adultos para su liberación en el almacenamiento de adultos y la sala de liberación.

Figura 3. Separación de larvas, pupas macho y pupas hembras mediante un separador de placas26. El separador de placas utiliza la diferencia de tamaño entre larvas, pupas masculinas y pupas femeninas para clasificar estas tres etapas diferentes de la vida; las larvas tienden a ser más pequeñas que las pupas masculinas que a su vez son más pequeñas que las pupas femeninas. El instrumento consta de dos placas de vidrio; uno se fija a un marco de metal inclinado y el otro se sienta en la parte superior de la primera placa y se puede mover en relación con el primero utilizando cuatro tornillos de ajuste (A). Los cuatro tornillos de ajuste permiten que la placa exterior se ajuste en un ángulo con respecto a la placa posterior, de modo que se forme un espacio en forma de cuña entre las placas, disminuyendo hacia abajo. Las larvas y pupas se vierten entre las placas de vidrio(B)y se lavan suavemente con una manguera de agua(C). Ajustando el ángulo de la placa, se pueden separar larvas, pupas macho y pupas hembra (D). Con el enrojecimiento continuo y el aumento del ángulo de la placa, las larvas se pueden enjuagar primero (en un tamiz), seguido de las pupas masculinas y finalmente las pupas femeninas.
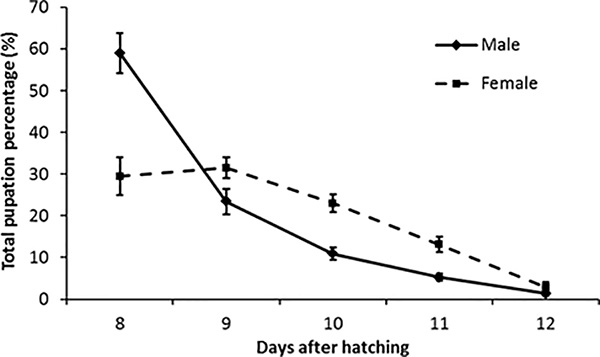
Figura 4. Curvas de pupación para ridl criado en masa Ae. aegypti. Este gráfico muestra el porcentaje promedio de pupación para pupas machos y hembras de RIDL criadas en masa durante 23 semanas de observación con ~ 135,000 pupas recuperadas por semana. Barras de error = error estándar de media, n = 23. En la primera recogida (día 8) recuperamos en promedio un 59% de pupas machos y un 30% de hembras del total de pupas recuperadas de bandejas durante 5 días.
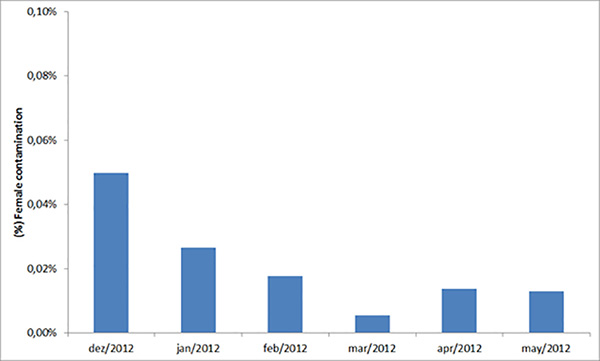
Figura 5. Contaminación media femenina de pupas macho clasificadas. Este gráfico muestra el porcentaje promedio mensual de contaminación femenina durante la clasificación de machos el día 8 después de la eclosión durante un período de seis meses.

Figura 6. Sistema de alimentación de sangre de placa de aluminio. La placa(B)se cubre con Parafilm(A)y la sangre se canaliza en un bolsillo y luego se sella(D). La placa se coloca en una jaula y se calienta colocando una bolsa de frijoles calentada(C)en la parte superior(E).
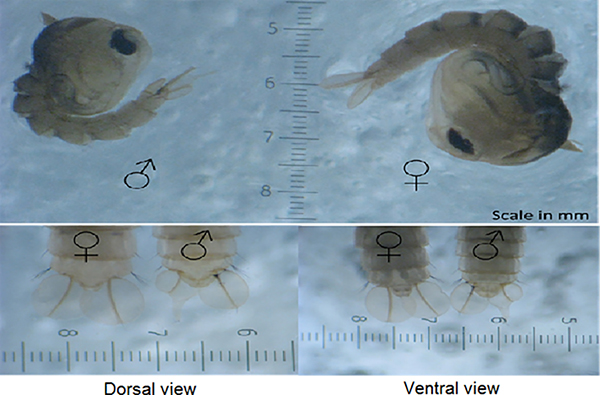
Figura 7. Distinguiendo macho y hembra Ae. aegypti pupae. Ae. aegypti pupae puede ser sexed confiablemente por las diferencias en la forma del lóbulo genital (en el extremo de los segmentos abdominales pupales justo debajo de las paletas). Además, los machos también tienden a ser más pequeños que las hembras.

Tabla 1. Régimen general de alimentación para las larvas de Ae. aegypti RIDL (mg de alimento por larva por día). Para calcular la cantidad real de alimento requerido multiplique por el número total de larvas por bandeja.
Discusión
Ridl es un método eficaz y ambientalmente seguro de controlar los mosquitos3,29-31. La técnica es aplicable a un programa de manejo integrado de plagas y la mayoría de los métodos de control actuales, incluidos los larvicidas, la reducción de sitios de reproducción y los adulticidas, son compatibles con esta tecnología. Este método describe cómo producir hasta 570.000 pupas macho RIDL por semana para su uso en el control de Ae. Aegypti y a nuestro conocimiento esta es la primera descripción de la producción de mosquitos transgénicos en esta escala. Algunos sistemas de producción comparables se desarrollaron para el tipo salvaje Ae. aegypti en los años 1960 y 7025,sin embargo, no ha habido una producción comparable a esta escala desde entonces. En Brasil, alrededor de 11 millones de hombres han sido liberados desde febrero de 2011 hasta febrero de 2012. El número de machos requeridos para que un área dada sea controlada depende de una serie de factores que incluyen el tamaño de la población silvestre, la dispersión de los machos liberados, la supervivencia y la competitividad de apareamiento de los machos después de la liberación, y las condiciones ambientales. Estudios anteriores han demostrado que el RIDL puede reducir una población de mosquitos en al menos un 80%9.
Se necesita un equilibrio entre la optimización de la cría en masa para la escala de producción y el costo frente a la calidad de los machos. Por ejemplo, el aumento de la densidad larvaria puede aumentar la capacidad de producción al reducir el espacio requerido, la mano de obra y el tiempo a la pupación32. Sin embargo, densidades demasiado altas de larvas pueden resultar en machos de vida más pequeña y más corta con capacidad de apareamiento reducida32,33. La calidad de los machos en relación con un programa SIT se evaluará en última instancia por la capacidad de los machos liberados para aparearse con las hembras en el campo. Se requiere una amplia evaluación de campo para evaluar la competitividad del apareamiento en relación con sus contrapartes silvestres9,10. Esto a menudo hace que sea poco práctico evaluar exactamente qué factores hacen que un mosquito macho de "alta calidad". Sin embargo, mantener una producción y una calidad consistentes (en la medida en que se puedan evaluar rutinariamente) en la cría masiva a gran escala es primordial. Esto requiere un alto nivel de vigilancia y estandarización de todos los procesos con pequeñas fluctuaciones que potencialmente tienen un impacto significativo. La alícuota de las larvas L1 es un paso crítico e ilustra este punto. Alícuota el número correcto de larvas en bandejas es esencial para una producción de buena calidad. El régimen de alimentación se adapta con precisión para un número específico de larvas. Muy pocas/muchas larvas resultarán en una alimentación excesiva/insuficiente, lo que influye en la supervivencia de las larvas, el tamaño de las pupas y el tiempo hasta la pupación. Si hay un secreto en el arte de la cría en masa es asegurar que los muchos pequeños pasos en el ciclo de producción se llevan a cabo de manera consistente, precisa y con un alto nivel de control de calidad, como se describe en este documento.
Divulgaciones
Los autores afiliados a Oxitec tienen un empleo y/o participación accionaria en Oxitec Ltd. Oxitec Ltd y la Universidad de Oxford poseen propiedad intelectual relacionada con el tema de este documento.
Agradecimientos
Nos gustaría agradecer a Biofábrica Moscamed Brasil, Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP) y Conselho Nacional de Desenvolvimento Científico e Tecnologia (CNPq) por el apoyo financiero. También quisiéramos dar las gracias a las siguientes personas por su asistencia; Miriam dos Santos, Gildeane Silva, Gessilane dos Santos, Fabio Gonçalves, John Paul Oliveira, Luiza Garziera, José Carlos Valença.
Materiales
| Name | Company | Catalog Number | Comments |
| Vipan Premium | Sera GmbH | 190 | http://www.sera.de/uk/pages/products/product/sera-vipan-3.html |
| Tetracycline | Sigma Aldrich | T7660 | |
| Plate separator | J.W. Hock | 5412 | http://www.johnwhock.com/download/manuals/instr_5412_separator.pdf |
| Parafilm M | Pechiney Plastic packing | PM-996 | |
| Rearing pans for Release generation (53 cm x 38 cm x 8 cm) | Pleion | 0757 | |
| Fluorescent scope | Leica Microsystems | MZ FLIII | http://www.leica-microsystems.com/fileadmin/downloads/Leica%20MZ%20FLIII/Brochures/M1-160-0de.pdf |
| Adult cages | BugDorm | DP1000 | http://bugdorm.megaview.com.tw/bugdorm-1-insect-rearing-cage-30x30x30-cm-pack-of-one-p-29.html |
| Filter paper | CELAB |
Referencias
- Dyck, V., et al. Sterilizing Insects with Ionizing Radiation. Sterile Insect Technique. , Springer. Netherlands. 233-268 (2005).
- Dyck, V., Hendrichs, J., Robinson, A. S., Klassen, W., Curtis, C. History of the Sterile Insect Technique.. Sterile Insect Technique. , Springer. Netherlands. 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases – an analysis. Vector Borne Zoonotic Dis. 10, 295-311 (2010).
- Thomas, D. D., Donnelly, C. A., Wood, R. J., Alphey, L. S. Insect population control using a dominant, repressible, lethal genetic system. Science. 287, 2474-2476 (2000).
- Fu, G., et al. Female-specific insect lethality engineered using alternative splicing. Nat. Biotechnol. 25, 353-357 (2007).
- Fu, G., et al. Female-specific flightless phenotype for mosquito control. Proc. Natl. Acad. Sci. U.S.A. 107, 4550-4554 (2010).
- Gong, P., et al. A dominant lethal genetic system for autocidal control of the Mediterranean fruitfly. Nat. Biotechnol. 23, 453-456 (2005).
- Phuc, H. K., et al. Late-acting dominant lethal genetic systems and mosquito control. BMC Biol. 5 (11), (2007).
- Harris, A. F., et al. Successful suppression of a field mosquito population by sustained release of engineered male mosquitoes. Nat. Biotechnol. 30, 828-830 (2012).
- Harris, A. F., et al. Field performance of engineered male mosquitoes. Nat. Biotechnol. 29, 1034-1037 (2011).
- Bailey, D. L., Lowe, R. E., Dame, D. A., Seawright, J. A. Mass rearing the genetically altered MACHO strain of Anopheles albimanus Wiedemann. Am. J. Trop. Med. Hyg. 29, 141-149 (1980).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malar. J.. 8 Suppl 2 (S4), (2009).
- Alphey, L. Re-engineering the sterile insect technique. Insect Biochem. Mol. Biol. 32, 1243-1247 (2002).
- Wise de Valdez,, R, M., et al. Genetic elimination of dengue vector mosquitoes. Proc. Natl. Acad. Sci. U.S.A. 108, 4772-4775 (2011).
- Macoris Mde,, L,, et al. Resistance of Aedes aegypti from the state of Sao Paulo, Brazil, to organophosphates insecticides. Mem. Inst. Oswaldo Cruz. 98, 703-708 (2003).
- Campos, J., Andrade, C. F. Larval susceptibility of Aedes aegypti and Culex quinquefasciatus populations to chemical insecticides. Rev. Saude Publica. 37, 523-527 (2003).
- Gubler, D. J. Resurgent vector-borne diseases as a global health problem. Emerg. Infect. Dis. 4, 442-450 (1998).
- Harris, A. F., Rajatileka, S., Ranson, H. Pyrethroid resistance in Aedes aegypti from Grand Cayman. Am. J. Trop. Med. Hyg. 83, 277-284 (2010).
- Lima, J. B., et al. Resistance of Aedes aegypti to organophosphates in several municipalities in the State of Rio de Janeiro and Espirito Santo. Am. J. Trop. Med. Hyg. 68, Brazil. 329-333 (2003).
- Paris, M., et al. Persistence of Bacillus thuringiensis israelensis (Bti) in the environment induces resistance to multiple Bti toxins in mosquitoes. Pest Manag. Sci. 67, 122-128 (2010).
- Rendon, P., McInnis, D., Lance, D., Stewart, J. Medfly (Diptera: Tephritidae) genetic sexing: large-scale field comparison of males-only and bisexual sterile fly releases in Guatemala. J. Econ. Entomol. 97, 1547-1553 (2004).
- Papathanos, P. A., et al. Sex separation strategies: past experience and new approaches. Malar. J.. 8 Suppl 2 (S5), (2009).
- Medici, A., et al. Studies on Aedes albopictus larval mass-rearing optimization. J. Econ. Entomol. 104, 266-273 (2011).
- Focks, D. A. An improved separator for the developmental stages, sexes and species of mosquito (Diptera Culicidae). J. Med. Entomol. 17, 567-568 (1980).
- Fay, R. W., McCray, E. M., Kilpatrick, J. W. Mass production of sterilized male Aedes aegypti. Mosquito News. 23, 210-214 (1963).
- Christophers, S. R. Aedes aegypti the yellow fever mosquito: Its life history, Bionomics and Structure. , Cambridge University Press. (2009).
- Jones, J. C. A simple method for sexing living Anopheles Larvae (diptera, culicidae). Ann. Entomol. Soc. Am. 50, 104-106 (1957).
- Koenraadt, C. J. M. Pupal Dimensions as Predictors of Adult Size in Fitness Studies of Aedes aegypti (Diptera Culicidae). J. Med. Entomol. 45, 331-336 (2008).
- Alphey, L., Nimmo, D., O'Connell, S., Alphey, N. Insect population suppression using engineered insects. Adv. Exp. Med. Biol. 627, 93-103 (2008).
- Alphey, N., Bonsall, M. B., Alphey, L. Modeling resistance to genetic control of insects. J. Theor. Biol. 270, 42-55 (2011).
- Atkinson, M. P., et al. Analyzing the control of mosquito-borne diseases by a dominant lethal genetic system. Proc. Natl. Acad. Sci. U.S.A. 104, 9540-9545 (2007).
- Bargielowski, I., Nimmo, D., Alphey, L., Koella, J. C. Comparison of life history characteristics of the genetically modified OX513A line and a wild type strain of Aedes aegypti. PLoS One. 6 (e20699), (2011).
- Bargielowski, I., Alphey, L., Koella, J. C. Cost of mating and insemination capacity of a genetically modified mosquito Aedes aegypti OX513A compared to its wild type counterpart. PLoS One. 6 (26086), (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados