Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
A Cre-Lox P Enfoque de recombinación para la detección de la fusión celular En Vivo
En este artículo
Resumen
Un método para hacer un seguimiento de la fusión celular en los organismos vivos con el tiempo se describe. El enfoque utiliza Cre- LoxP para inducir la expresión de luciferasa en la fusión de células. La señal luminosa generada puede ser detectado en los organismos vivos mediante sistemas de biofotónica imágenes con una sensibilidad de detección de ~ 1.000 células en los tejidos periféricos.
Resumen
La capacidad de dos o más células del mismo tipo de fusible se ha utilizado en los metazoos largo de la evolución para formar muchos órganos complejos, incluyendo el músculo esquelético, hueso y placenta. Los estudios contemporáneos demuestran la fusión de células del mismo tipo que le confiere la función mejorada. Por ejemplo, cuando las células trofoblásticas de la placenta el fusible para formar el sincitiotrofoblasto, el sincitiotrofoblasto está en mejores condiciones para el transporte de nutrientes y hormonas a través de la barrera materno-fetal del trofoblasto sin fundir 1-4. Estudios más recientes demuestran que la fusión de células de diferentes tipos pueden dirigir el destino celular. El "retorno" o la modificación de destino de la célula por fusión alguna vez se pensó que limitarse a los sistemas de cultivo celular. Pero el advenimiento del trasplante de células madre llevó al descubrimiento por nosotros y otros que las células madre pueden fusionarse con las células somáticas in vivo y que la fusión facilita la diferenciación de células madre 7.5. Por lo tanto, la fusión celular es un proceso regulado capable de promover la supervivencia y la diferenciación celular y por lo tanto podría ser de vital importancia para el desarrollo, la reparación de los tejidos e incluso la patogénesis de la enfermedad.
La limitación del estudio de la fusión de células, es la falta de tecnología adecuada para 1) identificar con precisión los productos de la fusión y 2) los productos de la pista de fusión con el tiempo. Aquí se presenta un nuevo enfoque para abordar tanto las limitaciones a través de la inducción de la bioluminiscencia en la fusión (Figura 1);. Bioluminiscencia se puede detectar con alta sensibilidad en vivo 15.08 Utilizamos una construcción que codifica para la luciferasa de luciérnaga (Photinus pyralis) de genes adyacentes a un codón de parada, flanqueada por secuencias loxP. Cuando las células que expresan este gen fusionan con las células que expresan la proteína recombinasa Cre, los sitios loxP se rompen y la señal de parada se extirpa lo que permite la transcripción de la luciferasa. Debido a que la señal es inducible, la incidencia de falsos positivos señales es muy baja. A diferencia de los métodos existentes que utilizan el sistema Cre / LoxP 16, 17, hemos incorporado un "vivo" de detección de señales y por lo tanto pagar por primera vez la oportunidad para hacer un seguimiento de la cinética de la fusión de células in vivo.
Para demostrar el enfoque, los ratones doquier expresar la recombinasa Cre se desempeñó como receptores de las células madre transfectadas con una construcción de expresar luciferasa aguas abajo de un codón de parada floxed. Las células madre fueron trasplantadas a través de la inyección intramiocárdica y después del trasplante de análisis de imagen intravital se llevó a cabo para rastrear la presencia de productos de fusión en el corazón y los tejidos circundantes a través del tiempo. Este enfoque podría adaptarse para analizar la fusión de células en cualquier tipo de tejido en cualquier etapa del desarrollo, la enfermedad o la reparación de tejidos adultos.
Protocolo
1. Transfección de células de donantes
- Las células de la cosecha madre mesenquimales (MSC, derivadas de células madre embrionarias H1 donado amablemente por el Dr. Peiman Hematti, alternativamente, cualquier tipo de célula de cualquier especie la hipótesis de que el fusible en vivo podrían ser empleados) cuando el 70 - 80% confluentes con tripsina 1X (Mediatech, Manassas VA) durante 5 min. inactivar la tripsina con α-MEM medio completo (sin antibióticos, Invitrogen, Carlsbad CA) 18. Centrifugar a 300 xg durante 5 min.
- Aspirar el sobrenadante con cuidado y vuelva a suspender el pellet en 1 ml de PBS 1X y el recuento de las células usando un hemocitómetro.
- La transferencia de 1,5 x 10 6 células en un tubo centrífugo de 1,5 ml. Centrifugar a 300 xg durante 5 min.
- Aspirar el sobrenadante con cuidado. Resuspender el pellet en 300 L de R Buffer (Sistema de neón de transfección, Invitrogen) y 6 mg (2 mg / 5,0 x 10 5 células) del P231-pCMVe betaAc-STOP-luc (Addgene, Cambridge, MA). Coloque 3 ml de tampón E (Invitrogen) en el puerto de atraque de la electroporación por el protocolo del fabricante (sistema de transfección de neón, Invitrogen).
- La transferencia de células plásmido solución a un 100 l punta de pipeta de neón y electroporar con una duración de pulso de 20 ms y una magnitud de 1,500 voltios. Lugar electroporated células en un tubo cónico de 15 ml que contiene 9,7 ml α-MEM medio completo.
- Repita el paso 1,5 y dos veces más células transfectadas piscina para producir un volumen total de 10 ml. Añadir 10 ml de la suspensión de células (1,5 x 10 6 células) a un matraz de 10 ml que contiene T175 α-MEM medio completo. La viabilidad celular después de la electroporación es de aproximadamente 30%, para producir aproximadamente 4,5 x 10 5 células viables por T175.
- Cambiar α-MEM medio completo 24 horas después de la transfección.
- La cosecha, cuando las células transfectadas 70 a 80% confluente (~ 2 - 3 días después de la electroporación). Realizar el recuento de células con un hemocitómetro y resuspender las células a una concentración de 1,0 x 10 6cells/50 L de α-MEM medio completo. Minimizar el tiempo que pasan las células en suspensión para reducir la muerte celular antes de la inyección.
2. Inyección intramiocárdica
- Inducir la anestesia por isoflurano (Phoenix Pharmaceuticals, Inc., St. Joseph, MO) en ratones transgénicos diseñados para expresar constitutivamente recombinasa Cre en todas las células (B6.C-Tg (CMV-cre) 1IGN / J, Jackson Laboratory, Bar Harbor, ME).
- Eliminar el vello de la región torácica con cortar el pelo o la depilación química.
- Intubar con un catéter de calibre 18 (Becton Dickinson & Co, Franklin Lakes NJ) y el lugar en el ventilador del ratón en 120 a 130 respiraciones por minuto, con un volumen de movimiento de 150 mL.
- Realice una incisión lateral en el cuarto espacio intercostal lo que produce una toracotomía.
- Visualizar el corazón, hacer dos inyecciones de 25 l de suspensión de células transfectadas con una jeringa de 1 ml (Temuro Medical Corporation, Somerset, NJ) y aguja de calibre 28 (Becten Dickinson & Co, Franklin Lakes NJ). Para facilitar la inyección intramiocárdica y evitar un daño excesivo al órgano, doblar la cabeza de la aguja a 90 grados.
- Después de la inyección, uso de suturas absorbibles (por ejemplo, vicryl) para cerrar las costillas y las capas musculares. La piel de sutura cierra con nailon 4-0 o seda.
- Permitir el ratón para recuperarse de la anestesia y la extubación.
- Los grupos de control debe incluir los ratones que recibieron inyecciones Cre único medio, los ratones Cre recibir la misma concentración de células no transfectadas y ratones de tipo salvaje que reciben las células transfectadas (alternativamente, los ratones que recibieron células transfectadas Cre que no son propensas a fusionar).
3. Imagen biofotónica
- Cinco a quince minutos antes de exponer, por vía intraperitoneal (IP) inyectar 10 l por gramo de peso del cuerpo del ratón de 15 mg / ml de D-luciferina (Caliper Life Sciences, Hopkinton, MA).
- Inducir la anestesia con isoflurano en ratones a través de un 4% para la inducción de unad 1 - 2% para el mantenimiento.
- Coloque en posición supina en la caja de imágenes con máscara administrar un ratón - 2% para el mantenimiento de la anestesia con isoflurano (Sistema de Xenogen imágenes Biofotonico, Hopkinton, MA). Varios ratones se pueden visualizar al mismo tiempo. Imagen simulada de control del ratón con ratones de experimentación para facilitar la comparación de la señal luminiscente.
- El uso de software de estar de la imagen (Xenogen), establecer el tiempo de exposición adecuado (normalmente 60 segundos, ver Resultados). Establece el área de imagen para adaptarse a los ratones y mantener el área constante a través de imágenes para evitar cambios en la sensibilidad. Fijar la altura de sujetos a 4,5 cm.
- Adquirir la señal de luminiscencia de intensidad correspondiente a ratón o ratones en el campo de vista y guardar los archivos sin modificar la imagen. Imágenes del proceso para eliminar la señal de fondo que corresponde a un control o un ratón no manipulado. Valores de intensidad por encima del fondo corresponden a células fusionadas dentro del animal. Análisis de la intensidad puede ser llevado a cabo utilizando el software de vida de la imagen (Xenogen) o software de código abierto de análisis de imagen de origen. Typically, una región de interés (ROI) es seleccionado para comparar los datos de intensidad entre los animales y los experimentos.
4. Resultados representante
Para determinar la sensibilidad del sistema de imágenes Biofotonico Xenogen, una línea celular que expresa constitutivamente la luciferasa (LUC-231-D3H1, Xenogen) fue entregado en el miocardio de C57/Bl6 ratones (Jackson Laboratory). Las células fueron inyectadas en concentraciones de 1 x 10 6, 1 x 10 3, o 1 x 10 1 en las células. Seis horas después del parto, células, los ratones fueron inyectados por vía intraperitoneal con la luciferina y la imagen utilizando el sistema de Xenogen. Una señal específica podría ser detectada con 1.000 células (2 de 6 ratones imágenes, la figura 2), pero la detección es más fiable con 10.000 células (6 de 6 ratones imágenes). Es importante destacar que este estudio también sirvió para establecer una correlación aproximada entre el número de células que expresan luciferasa y la intensidad de la señal.
Para demostrar la utilidad del protocolo descrito en la detección y el seguimiento de la fusión de células, las MSC se transfectaron con el plásmido LoxP-Stop-LoxP-luciferasa (Addgene) y entregados al miocardio de Cre-expresando ratones. Aproximadamente una semana después de la entrega de células, los ratones fueron estudiados primero utilizando el sistema de Xenogen sin D-luciferina de la inyección. Como era de esperar, sin el sustrato enzimático, no se detectó señal de intensidad (Figura 3). A continuación, D-luciferina se inyectó por vía intraperitoneal y una señal correspondiente a la intensidad de la luciferasa y por lo tanto la fusión celular fue detectado en dos de los cuatro ratones estudiados. Una señal similar se detectó una semana más tarde (Figura 3), lo que sugiere MSC-junto productos de fusión se pueden mantener en vivo. En este caso, el estudio se suspendió para permitir la evaluación del corazón y los tejidos circundantes, pero uno podría imaginar a largo plazo Los análisis y las imágenes más frecuentes para seguir el mantenimiento, la proliferación de unad tal vez la migración de productos de fusión en los ratones.
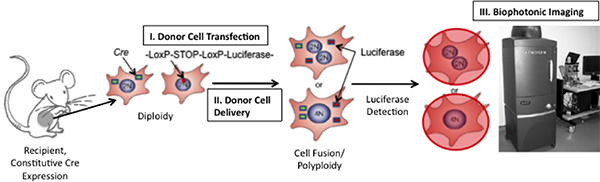
Figura 1. Esquemática de la técnica para detectar la fusión de células in vivo. Si la fusión entre Cre-que expresan las células de ratón y células trasplantadas expresar un plásmido floxed luciferasa se produce, la luciferasa se expresa. Luciferasa se pueden detectar mediante la inyección del sustrato enzimático, D-luciferina, en el ratón y el ratón de imágenes usando un sistema de Xenogen imágenes Biofotonico (Adaptado de 19)
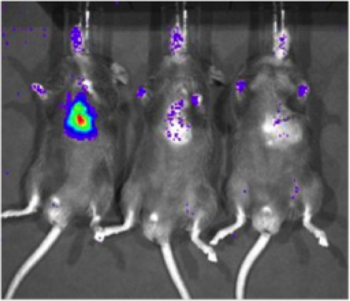
Figura 2. Sensibilidad de la detección de la luciferasa que expresan las células en el tejido cardíaco con la imagen biofotónica. Una línea celular que expresa constitutivamente la luciferasa (LUC-231-D3H1, Xenogen) fue entregado al espacio intramiocárdica de C57/Bl6 ratones en varios números de celular total. Imágenes representativas de los ratones receiving 1 x 10 6, 1 x 10 3 y 1 x 10 1 en las células (de izquierda a derecha) se muestran, las imágenes se llevó a cabo aproximadamente 6 horas después de la inyección.
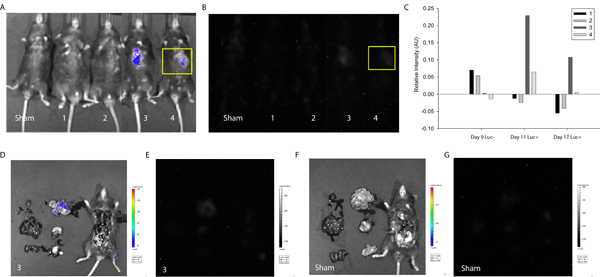
Figura 3. La cuantificación de la luminiscencia en Vivo indicativo de la fusión celular. MSC fueron transfectadas con el LoxP-Stop-LoxP-Luciferase plásmido y se entregan en el miocardio de Cre-expresando ratones. Aproximadamente una semana y dos semanas después de la entrega de células, los ratones Cre fueron estudiados mediante el sistema de imagen Xenogen Biofotonico para medir la intensidad de la luminiscencia indicativo de la fusión celular. (A) Superposición de la fotografía y la intensidad de la luminiscencia de la farsa y ratones 1-4 (de izquierda a derecha) 17 días después de la entrega de la célula. (B) la intensidad de la luminiscencia de la farsa y ratones 4.1 (de izquierda a derecha) 17 días después de la entrega de la célula. Una región de interés ha sido seleccionada (amarillo), correspondiente a la zona de inyección y la intensidad de levels se determinaron utilizando ImageJ (gratuito) de software 20. (C) La intensidad de la luminiscencia se normalizó a la misma región de interés en la farsa del ratón para todas las condiciones experimentales. En una semana, los ratones 3 y 4 muestran la señal de luminiscencia positiva que sugiere la fusión espontánea de una célula del ratón y el MSC trasplantado. La señal persistía en el ratón 3 en dos semanas. Para determinar órgano-específicas de localización de la señal correspondiente al ratón de 3, de la cavidad torácica fue expuesto y de los órganos extirpados primaria y la imagen. (D) Superposición de la fotografía y la intensidad de la luminiscencia de las 3 del ratón. Tenga en cuenta la localización de la intensidad de la señal en el intestino delgado. (E) La intensidad de la luminiscencia de las 3 del ratón. (F) de superposición de la fotografía y la intensidad de la luminiscencia de la farsa del ratón. (G) La intensidad de la luminiscencia de la farsa del ratón.
Discusión
El método aquí descrito permite, por primera vez, la identificación y el análisis discreto temporal de la fusión de células en los organismos, incluyendo a los animales pequeños. El enfoque combina Cre-loxP recombinación con el posterior análisis de imagen biofotónica. El enfoque puede ser objeto de seguimiento no sólo la fusión entre células, sino también la fusión virus-célula y por lo tanto podría ser útil para el seguimiento de las infecciones virales. Análisis de imágenes es rápida y es posible...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer al Dr. Peiman Hemmati (Departamento de Medicina de la Universidad de Wisconsin-Madison) para ofrecer generosamente los CSM H1, y el Dr. Tim Hacker, Dr. Gouqing canción y la Sra. Jill Koch, de la Universidad de Wisconsin, la fisiología cardiovascular Fondo central para la realización de cirugías de ratón. Este trabajo fue apoyado por la Fundación Nacional de Ciencia a través de una Beca de Investigación de Postgrado de Brian Freeman y NIH R21 HL089679.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Neon sistema de transfección | Invitrogen, Carlsbad, CA | MPK5000 | |
| Neon 100 Kit l | Invitrogen, Carlsbad, CA | MPK10025 | Contiene Buffer R y E |
| a-MEM en polvo | Invitrogen, Carlsbad, CA | 12000-022 | |
| De suero fetal bovino (FBS) | Hyclone, Logan UT | SH30070.03 | |
| B6.C-Tg (CMV-cre) 1IGN / J | Jackson Laboratory, Bar Harbor, ME | 006054 | |
| 10 veces la tripsina | Fisher Scientific, Forest Lawn, NJ | MT-25-054-Cl | |
| L-glutamina | Fisher Scientific, Forest Lawn, NJ | 25030-081 | |
| D-luciferina | Caliper Life Sciences, Hopkinton, MA | 122796 | |
| Xenogen Imaging System Biofotonico | Caliper Life Sciences, Hopkinton, MA | IVIS del espectro | |
| Sodio Biocarbonate | Sigma Aldrich, St. Louis, MO | S6014-500G | |
| No esenciales Aminoácidos | Invitrogen, Carlsbad, CA | 11140-050 |
Referencias
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados