Method Article
En electroporación in vivo de Morpholinos en la retina de pez cebra adultos
En este artículo
Resumen
Un método para derribar condicionalmente la expresión de una proteína de destino en la retina del pez cebra adulto se describe, lo que implica la inyección intravítrea morfolinos antisentido y electroporating ellos en la retina. La proteína resultante es derribado por varios días, lo que permite realizar pruebas de función de la proteína en la regeneración o la retina intacta.
Resumen
Muchos devastadora enfermedad ocular hereditaria a la ceguera progresiva e irreversible, porque los humanos no pueden regenerarse morir o enfermas neuronas de la retina. Por el contrario, la retina del pez cebra adulto posee la capacidad resistente de regeneración espontánea neuronal cualquier clase que se pierde en una variedad de diferentes modelos de daño en la retina, incluyendo la punción la retina, la ablación química, la temperatura alta concentración, y el tratamiento de luz intensa 1-8. Nuestro laboratorio ampliamente caracterizado la regeneración de los fotorreceptores después del tratamiento con luz intensa y constante interior neuronas de la retina después de la inyección intravítrea ouabaína 2, 5, 9. En todos los casos, residente de las células de Müller volver a entrar en el ciclo celular para producir células progenitoras neuronales, que siguen proliferando y migran a la capa adecuada de retina, donde se diferencian en las neuronas deficientes.
Nos caracteriza cinco etapas diferentes durante la regeneración de la dama de luzretina de GED que se destacaron por respuestas celulares específicas. Hemos identificado varios genes expresados diferencialmente en cada etapa de la regeneración de la retina mediante el análisis de microarrays de ARNm 10. Muchos de estos genes son también críticos para el desarrollo ocular. Para probar la función de cada gen candidato / proteína en la regeneración de la retina, que es necesario desarrollar un método para limitar condicionalmente la expresión de una proteína única candidata a veces durante la regeneración de la retina adulta.
Oligos morfolinos son ampliamente utilizados para estudiar la pérdida de la función de proteínas específicas durante el desarrollo del pez cebra, Xenopus, pollo, ratón, y 11-14 en xenoinjertos de tumores humanos. Estos pares de bases modificadas con oligonucleótidos complementarios de secuencias de ARN para bloquear tanto el empalme o traducción del ARN diana. Morfolinos son estables en la célula y puede eliminar o "caída" expresión de la proteína de tres a cinco días 12.
En este caso,se describe un método eficiente para la expresión de proteínas caída de destino en la retina del pez cebra adulto. Este método emplea lisamina etiquetados con morfolinos antisentido que se inyectan en el vítreo del ojo de pez cebra adulto. Con unas pinzas electrodo, el morfolino entonces electroporated en todos los tipos de células de la retina dorsal y central. Lisamina proporciona la carga en el morfolino para la electroporación y pueden ser visualizadas para determinar la presencia de la morfolino en las células de la retina.
Caída condicional en la retina se puede utilizar para examinar el papel de proteínas específicas en diferentes momentos durante la regeneración. Además, este enfoque puede ser utilizado para estudiar el papel de proteínas específicas en la retina en buen estado, en procesos como la transducción visual y el procesamiento visual en las neuronas de segundo orden.
Protocolo
1. Morfolino preparación:
- Todos los oligos morfolinos deben ser diseñados y ordenados a través de GeneTools (Philomath, OR). Utilizamos la carga positiva lisamina etiquetados morfolinos para conducir los morfolinos electroporated hacia el electrodo negativo. Hemos intentado, sin éxito, objetivo con carga negativa con fluoresceína etiquetados morfolinos para el electrodo positivo con esta técnica. Diluir 300 nmol de morfolino en 100 l de agua libre de nucleasa para obtener una solución 3 mM. Alícuota del morfolino en varios tubos de microcentrífuga sellada en parafina. Almacene lejos de la luz a temperatura ambiente.
- Determinar la concentración morfolino mediante la dilución de 5 l de morfolino (o agua para diluir el morfolinos como un espacio en blanco) en 95 l de HCl 0,1 N. La longitud de onda del espectrofotómetro (λ) a 265 nm. Calcular la constante de su morfolino mediante la siguiente ecuación:
Constante = peso molecular en particular a su morfolino X 1000/molar absorbancia. - Va a encontrar el peso molecular y los datos de absorbancia molar de la "Oligo Propiedades" que acompañan a cada hoja de morfolino. Analizar el espacio en blanco para verificar las lecturas de referencia y tomar las lecturas de cada diluida morfolino. Multiplicar la absorbancia a 265 nm de cada morfolino por su constante y determinada por el factor de dilución para obtener la concentración en ng / ul. Divida este número por el peso molecular para determinar la concentración en mM. Diluir el morfolino, si es necesario, a una concentración de trabajo.
2. Eliminar la capa de la córnea exterior:
- 6-12 meses anestesiar pez cebra adulto mayor en tricaína o 2-fenoxietanol a 1,0 mg / ml en el tanque de agua de pez cebra.
- Envuelva el pez cebra en un húmedo pedazo de toalla de papel, que cubre las branquias, pero dejando el ojo expuesto. El pescado envuelto se coloca bajo un estereoscopio y la ampliación se incrementa hasta que el diámetro del ojo se llena aproximadamente un tercio deel campo visual (Figura 1).
- Utilizando Dumont # 5 pinzas, agarre la córnea exterior cerca de la fisura óptica. Este tejido es de color rojo y está etiquetada como "OC" en la Figura 1. Hay una que sobresale del labio o de la flecha marcada "CL". Tirar a un ángulo bajo (es decir, 10 grados) a través del ojo para eliminar la córnea exterior. Con la práctica, esto se puede completar en un solo movimiento. Si la hoja de pinzas, volver a agarrar el pañuelo y tirar de nuevo en un ángulo bajo hasta que sea removido. Una córnea muy unido puede causar que el ojo se desprendió de la toma cuando se tira. Usted puede mantener los ojos se conviertan en desplazadas por estabilizarse con otro conjunto de pinzas.
3. Incisión en la córnea y la inyección de morfolino:
- Inmediatamente después de la eliminación de la córnea exterior, hacer una pequeña incisión en la córnea, donde el alumno cumple con los iris (Figura 2). Esto se hace usando un zafiro hoja de bisturí (ver Materiales).
- Carga 0,5 l de la solución 3.0 mM morfolino en un Hamilten jeringa equipada con un medidor de 33 extraíble, romo extremo de la aguja (ver Materiales). Pipeta de arriba y abajo para eliminar las burbujas de aire en la línea. Con cuidado, inserte la aguja en el humor vítreo a través de la incisión (Figura 2). No inserte la aguja demasiado lejos o que se perfore la retina o desplazar la lente.
- Inyecte lentamente la solución morfolino en el espacio vítreo. Dependiendo de la edad de los peces, el espacio vítreo celebrará ~ 0,5 l. Usted debe visualizar vítreo incoloro se escape de la incisión, ya que es desplazada por la solución morfolino. Inyectar hasta una pequeña cantidad de fugas de solución morfolino fuera de la incisión. Que claramente debe visualizar el lisamina etiquetados con morfolino dentro del ojo.
- Después de la inyección, el retorno a los peces en el tanque de recuperación. Por lo general, sólo se inyectan en el ojo izquierdo, con el ojo derecho como un control no inyectadas, pero la electroporación de los dos ojos es posible.
4. Electroporación:
- Siguientela inyección de aproximadamente 10 peces, volver a anestesiar a los peces una inyección y lo envuelve en un pedazo de toalla de papel humedecida, apenas cubriendo las branquias, pero dejando el ojo expuesto. La transferencia de los peces a una placa de Petri. Póngase guantes de látex o similares para evitar la exposición a la anestesia. Mientras que suavemente la celebración de los peces en el fondo del plato, llenar el recipiente con la anestesia (Figura 3, panel izquierdo).
- Un electrodo de platino de 3 mm de diámetro de la placa (ver Materiales) se localiza en los pulsos de electroporación de aproximadamente la mitad de la retina. Por lo general blanco de la retina dorsal. Presione suavemente el electrodo positivo a la baja en la mitad ventral del ojo. Con la córnea exterior removida, el ojo es fácil de girar, dejando al descubierto la parte dorsal del globo ocular.
- Mientras sigue presionando hacia abajo en la parte ventral del ojo, colocar el electrodo negativo cercano (~ 1 - 2 mm) de la media expuesta dorsal del ojo. Tenga cuidado de no tocar el electrodo negativo directamente a los ojos, lo que resultará en dañosla retina dorsal. Una vez que determine la distancia adecuada entre los electrodos, utilice el tornillo de ajuste en el mango de los electrodos para mantener que se propagan cuando electroporating. Esto evita que el electrodo negativo una distancia óptima del globo ocular cuando el electrodo positivo se presiona hacia abajo en su posición.
- Electroporar del ojo usando una Electroporador CUY21 de onda cuadrada (ver Materiales). Los parámetros de electroporación se debe establecer en dos períodos consecutivos de 50-ms pulsos, a los 75 V, con una pausa de 1 segundo entre los pulsos.
- Volver a los peces del tanque. Por lo general comienzan el protocolo para la constante de luz inducida por la degeneración de la retina inmediatamente después de la electroporación.
5. Los resultados representativos:
- Durante 3-5 días después de la electroporación (dependiendo de la estabilidad de la morfolino), la etiqueta lisamina se puede visualizar en todas las capas de la retina en la retina seccionado (Figura 4). Esto sirve como una confirmación de la presencia dela etiqueta morfolino.
- Podemos lograr caída proteína completa hasta 3-5 días después de la electroporación, dependiendo de la eficacia de la morpholino (Figura 5). Por lo general, durante los estudios de tratamiento con luz, cosechamos los ojos a las 3 o 4 días después de la electroporación morfolino. Esto se hace mediante la eliminación de todo el ojo con unas pinzas Dumont # 5B con extremos curvos (Figura 6; Materiales) y procesamiento de los tejidos por inmunohistoquímica 15. Al igual que con cualquier otra técnica de derribo, una demostración de caída eficiente debe ser demostrado con el fin de validar el fenotipo. Por lo tanto, se sugiere la obtención de antisueros para la proteína de interés. Alternativamente, si el anticuerpo no está disponible y el morfolino está dirigido a cualquiera de los aceptor de empalme o zona del donador en el pre-ARNm, se bloqueará el empalme eficiente de los ARNm. En este caso, es posible el uso de la transcriptasa inversa-PCR para amplificar las secuencias de acompañamiento en el ARN morphant y determinar la eficacia de bloquear el splic normalespatrón de ing.
- Cuando la retina se seccionan desde nasal a temporal en el eje ventral dorsal, las casillas sombreadas azul (Figura 6) representan las áreas de la retina que son a menudo dañados por el evento en sí electroporación. La caja de color rosa sombreada representa el área que se presentará la morfolino en células de la retina por la electroporación.

Figura 1. Esquema que representa la eliminación de las capas epiteliales de la córnea. El panel izquierdo muestra las principales características estructurales del ojo, incluyendo la lente (L), el humor vítreo (Vit), la retina (R), la córnea exterior (CO), la córnea interna (IC), y la protrusión de la córnea ( CL). La orientación del ojo se muestra en la parte inferior derecha de la primera placa y la etiqueta es anterior (A), posterior (P), dorsal (D) y ventral (V). El color rojo indica la córnea externa que se retira. La segunda bandeja El demuestra cómo las pinzas se utilizan para captar la protrusión corneal y para tirar de la córnea exterior a través de los ojos en un ángulo bajo (tercer panel). El panel derecho muestra cómo un segundo par de pinzas se pueden utilizar para estabilizar el ojo mientras tira de la córnea.

Figura 2. Esquema de los pasos involucrados en la inyección intravítrea de morfolino. Una pequeña incisión en el ojo donde el alumno cumple con los iris (panel izquierdo). La diferencia resultante debe ser lo suficientemente grande para una aguja de calibre 33, que se llena con la solución de morfolino, que se insertará (panel central). Inyecte lentamente 0,5 l de solución en el humor vítreo (panel derecho). Usted debe visualizar una pequeña cantidad de solución vítrea salir de la incisión en el humor vítreo está parcialmente sustituida por con-lisamina etiquetados morfolino (panel derecho).
ig3.jpg "/>
Figura 3. Esquema del procedimiento de electroporación en general. El pez anestesiado, que se inyecta por vía intravítrea con el morfolino, se envolvió en una toalla de papel húmeda (panel izquierdo). La toalla de papel debe cubrir las branquias, pero no obstruir la vista (panel central). Presione suavemente el electrodo positivo hacia abajo en la parte ventral del ojo, permitiendo que la mitad dorsal del ojo a girar fuera de la cuenca. Colocar el electrodo negativo de aproximadamente 1 mm de la media dorsal de los ojos y comenzar la electroporación (panel derecho).

Figura 4. Imagen confocal comparar una retina electroporated intravítrea sin la inyección de un morfolino lisamina-etiquetados (A), y en la retina una inyección intravítrea y electroporación con el morfolino lisamina-etiquetados (B). La etiqueta lisamina se encuentra en todas las capas de la retina y los tipos de células. ROS, barra exteriorsegmentos, ONL, la capa nuclear externa, capa de INL, nuclear interna, GCL, capa de células ganglionares.
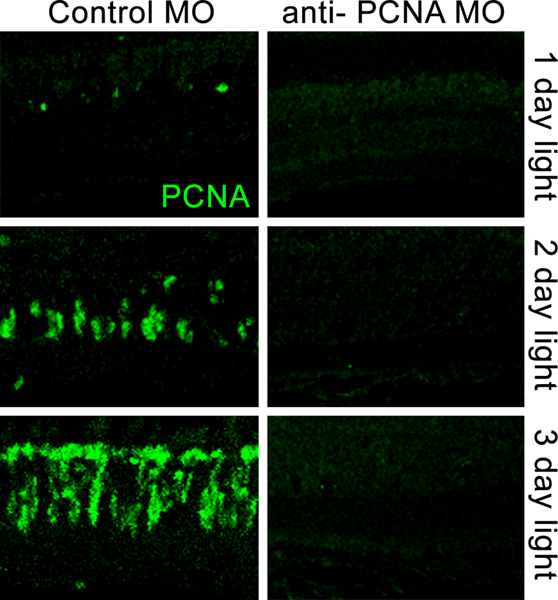
Figura 5. Confocal de imágenes comparando inmunolocalización PCNA en las retinas de electroporación con un morfolino control (panel izquierdo) y las retinas de electroporación con un morfolino anti-PCNA (paneles de la derecha) antes de la luz de la muerte inducida por las células fotorreceptoras. Adaptada a la oscuridad pez cebra adultos albinos fueron colocados en una luz intensa constante por 1, 2, ó 3 días después de la electroporación de la morfolino. El control de morfolino no reprimir la expresión de PCNA aumento en las retinas dañadas por la luz. El morfolino anti-PCNA eficiente derribaron la expresión de PCNA proteínas a través de tres días de daño constante de luz intensa.

Figura 6. Esquema (izquierda) muestra la enucleación del ojo para pLABORACIÓN y muestras criostáticas, que se realiza a lo largo del eje dorsal ventral. La caja de color rosa con sombra (derecha) muestra la región de la retina con la mayor cantidad de caída de proteínas utilizando esta técnica. Las casillas sombreadas azules representan áreas que son más a menudo dañados por el caso de la electroporación. La orientación del ojo tiene la etiqueta anterior (A), posterior (P), dorsal (D) y ventral (V).
Discusión
Recientemente, dos análisis de microarrays examinado los cambios de expresión génica que se produjeron durante la regeneración de la retina, ya sea de luz dañados o un parche quirúrgicamente extirpada la retina 10, 16. Ambos estudios revelaron que numerosos genes mostraron cambios significativos en la expresión, ya sea aumentando o disminuyendo, es probable que se requieren para los diferentes eventos que se producen durante la regeneración de la retina, como la re-entrada de la células de Müller en el ciclo celular, continuó la proliferación y migración de la progenitores neuronales de la capa dañada la retina, y la diferenciación de las células progenitoras neuronales en el tipo de célula neuronal correcto. Mientras que una comparación directa de estos dos conjuntos de datos de microarrays revelan genes candidatos que pueden estar implicados en estos procesos celulares, en última instancia, estos genes y sus proteínas codificadas deben ser probados para determinar si son necesarias para la regeneración neuronal. A continuación, describimos un poderoso pérdida de la función de enfoque de la conditioFinalmente las proteínas caída de interés en la retina del pez cebra adulto. Esta técnica se ha utilizado para estudiar tanto las proteínas extracelulares e intracelulares, así como moléculas de señalización, factores de transcripción y las proteínas necesarias para la replicación del ADN 17-19. Por lo tanto, este método ha contribuido enormemente a nuestra comprensión de los mecanismos moleculares que subyacen a la regeneración de la retina adulta de pez cebra.
Hemos probado varios parámetros de electroporación (voltaje, el número de pulsos, el tiempo entre los pulsos) antes de un protocolo de éxito se logró. Un informe anterior de electroporating morfolinos en la regeneración de la aleta caudal del pez cebra utiliza 10 pulsos a baja tensión (15 V) 20. Debido a que la retina del pez cebra adulto está rodeado por varias capas de células y no es fácilmente accesible a los electrodos de pinza, los parámetros utilizados en la aleta no tuvieron éxito en la eficiencia electroporating morfolinos en la retina adulta. Por el contrario, un alto voltaje (100 V) a menudo resulted en la muerte de los peces. Recientemente, cinco pulsos de 80 V se describe a electroporar plásmido de ADN en la retina del ratón recién nacido cachorro 21. Se encontró que un poco menos intensa dos pulsos de 75 V como resultado de la electroporación con éxito de los morfolinos en la retina del pez cebra adulto con una supervivencia del 100% de los peces tratados. Además, hemos descubierto que la eliminación de la mayoría de los exteriores (o externo-la mayoría de) los componentes de la córnea aumentado considerablemente la eficiencia de la electroporación. Aumentar el número de pulsos pueden eliminar la necesidad de la eliminación de este tejido, pero también puede causar mayor daño a los tejidos. Los numerosos estudios demostraron que el control de estos parámetros no causó la muerte de importantes células de la retina o alterar las respuestas celulares específicos observados durante la regeneración de los fotorreceptores 19. Ganancia de función de los estudios no son posible en la actualidad con esta técnica in vivo, debido a nuestra incapacidad para electroporar constantemente grandes ácidos ribonucleico en todos los retinal células. Sin embargo, el éxito de electroporating plásmidos en la retina del ratón in vivo y la retina del pez cebra en los explantes sugiere que sigue siendo una posibilidad en el pez cebra 21, 22.
Una de las ventajas de esta técnica es la electroporación aparece para introducir de manera eficiente la morfolino en todos los tipos de células de la retina diferente. Sin embargo, una debilidad potencial es que la electroporación de manera eficiente la entrega morfolino en sólo las regiones dorsal y la retina central. Un evento de electroporación segundo hacia la mitad ventral de la retina ocasiona la focalización adecuada a todas las capas, pero a menudo resulta en daños. Esta restricción espacial probablemente se debió a la forma y la colocación de los electrodos. El uso de electrodos especialmente diseñados con forma de copa que se podrían colocar alrededor de los ojos puede mejorar esta debilidad. Esta restricción espacial de la entrega morfolino limita el uso de esta técnica y se opone a la utilización de un éxito del ensayoh como el análisis de ERG que requieren una evaluación global de la retina. Cabe señalar que al igual que con cualquier experimento morfolino, es recomendable confirmar los resultados con un segundo, que no se superponen morfolino a la meta del mRNA. En algunos casos, es posible electroporar también dos diferentes al mismo tiempo morfolinos para derribar la expresión de dos proteínas diferentes. Hemos demostrado esto por derribar la expresión tanto de la pax6a y proteínas Pax6b, individualmente y en combinación 18.
A pesar de que demostró el uso de esta técnica con nuestro modelo de daño de la luz, es probable que se podría utilizar para estudiar la regeneración en los modelos de otros daños o 2-8 para examinar la función de las proteínas de la retina en buen estado. Por ejemplo, la electroporación de morfolinos podría ser utilizado para derribar la expresión de canales específicos o moléculas de transducción de señales en el ganglio o células amacrinas y luego estudiar la función de estas señalesvías en el procesamiento visual. Sin embargo, como morfolinos sólo afectan a la traducción de la nueva proteína, uno tendría que esperar hasta el recambio de proteínas endógenas se produce antes de un ensayo se pudo realizar. Dependiendo de la estabilidad de la proteína, que puede durar desde unas horas a 18 días.
Divulgaciones
No tenemos nada que revelar
Agradecimientos
Los autores desean agradecer a los Freimann Life Science Center y el Centro de Investigación para el personal de pez cebra para su cuidado y mantenimiento del pez cebra.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| CUY21-EDIT o CUY21-SC de onda cuadrada electroporador | Protech Internacional | CUY21EDIT o CUY21SC | Tanto las unidades de trabajo para este protocolo |
| 3 mm de diámetro de electrodos de paleta | Protech Internacional | CUY 650-P3 | |
| Morfolino | GeneTools, LLC | Morfolino debe ser diseñado a medida para la proteína de interés | |
| 2-fenoxietanol | Sigma | 77861-1L | Anestesia diluida 1:1000 en los peces de agua del sistema de procedimiento, 1:500 para la eutanasia |
| Dumont # 5 pinzas | Mundial de Instrumentos de Precisión | 14095 | Cualquier # 5 pinzas con el trabajo |
| Dumont # 5B pinzas con puntas en ángulo | Mundial de Instrumentos de Precisión | 500234 | Se utiliza para la eutanasia después de enucleación del ojo |
| Zafiro hoja, lanza de doble filo, 1 mm de ancho, con mango de un cuchillo de zafiro | Mundial de Instrumentos de Precisión | Hoja: 500314 Mango: 500317 | |
| Hamilton jeringa con extraíble 33 calibre romo extremo de la aguja | Hamilton empresa | Jeringa: 87930 Aguja: 7762-06 | Se retira la aguja que viene con la jeringa y vuelva a colocar con 33 de calibre romo extremo de la aguja |
Referencias
- Fausett, B. V., Gumerson, J. D., Goldman, D. The proneural basic helix-loop-helix gene ascl1a is required for retina regeneration. J. Neurosci. 28, 1109-1117 (2008).
- Fimbel, S. M., Montgomery, J. E., Burket, C. T., Hyde, D. R. Regeneration of inner retinal neurons after intravitreal injection of ouabain in zebrafish. J. Neurosci. 27, 1712-1724 (2007).
- Hitchcock, P., Ochocinska, M., Sieh, A., Otteson, D. Persistent and injury-induced neurogenesis in the vertebrate retina. Prog. Retin. Eye Res. 23, 183-194 (2004).
- Raymond, P. A., Barthel, L. K., Bernardos, R. L., Perkowski, J. J. Molecular characterization of retinal stem cells and their niches in adult zebrafish. B.M.C Dev. Biol. 6, 36-36 (2006).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Wolburg, H. Time- and dose-dependent influence of ouabain on the ultrastructure of optic neurones. Cell Tissue Res. 164, 503-517 (1975).
- Wu, D. M., Schneiderman, T., Burgett, J., Gokhale, P., Barthel, L., Raymond, P. A. Cones regenerate from retinal stem cells sequestered in the inner nuclear layer of adult goldfish retina. Invest. Ophthalmol. Vis. Sci. 42, 2115-2124 (2001).
- Yurco, P., Cameron, D. A. Responses of Muller glia to retinal injury in adult zebrafish. Vision Res. 45, 991-1002 (2005).
- Vihtelic, T. S., Soverly, J. E., Kassen, S. C., Hyde, D. R. Retinal regional differences in photoreceptor cell death and regeneration in light-lesioned albino zebrafish. Exp. Eye Res. 82, 558-575 (2006).
- Kassen, S. C., Ramanan, V., Montgomery, J. E., Burket, C. T., Liu, C. G., Vihtelic, T. S., Hyde, D. R. Time course analysis of gene expression during light-induced photoreceptor cell death and regeneration in albino zebrafish. Dev. Neurobiol. 67, 1009-1031 (2007).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene 'knockdown' in zebrafish. Nat. Genet. 26, 216-220 (2000).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- London, C. A., Sekhon, H. S., Arora, V., Stein, D. A., Iversen, P. L., Devi, G. R. A novel antisense inhibitor of MMP-9 attenuates angiogenesis, human prostate cancer cell invasion and tumorigenicity. Cancer Gene Ther. 10, 823-832 (2003).
- Thummel, R., Kassen, S. C., Enright, J. M., Nelson, C. M., Montgomery, J. E., Hyde, D. R. Characterization of Muller glia and neuronal progenitors during adult zebrafish retinal regeneration. Exp. Eye Res. 87, 433-444 (2008).
- Cameron, D. A., Gentile, K. L., Middleton, F. A., Yurco, P. Gene expression profiles of intact and regenerating zebrafish retina. Mol. Vis. 11, 775-791 (2005).
- Craig, S. E., Thummel, R., Ahmed, H., Vasta, G. R., Hyde, D. R., Hitchcock, P. F. The zebrafish galectin Drgal1-l2 is expressed by proliferating Muller glia and photoreceptor progenitors and regulates the regeneration of rod photoreceptors. Invest. Ophthalmol. Vis. Sci. 51, 3244-3252 (2010).
- Thummel, R., Enright, J. M., Kassen, S. C., Montgomery, J. E., Bailey, T. J., Hyde, D. R. Pax6a and Pax6b are required at different points in neuronal progenitor cell proliferation during zebrafish photoreceptor regeneration. Exp. Eye Res. 90, 572-582 (2010).
- Thummel, R., Kassen, S. C., Montgomery, J. E., Enright, J. M., Hyde, D. R. Inhibition of Muller glial cell division blocks regeneration of the light-damaged zebrafish retina. Dev. Neurobiol. 68, 392-408 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci U.S.A. 101, 16-22 (2004).
- Kustermann, S., Schmid, S., Biehlmaier, O., Kohler, K. Survival, excitability, and transfection of retinal neurons in an organotypic culture of mature zebrafish retina. Cell Tissue Res. 332, 195-209 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados