Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microscopia intravital del bazo: Análisis cuantitativo de la movilidad del parásito y el flujo sanguíneo
En este artículo
Resumen
Se muestra el método para realizar microscopía intravital del bazo con las buenas prácticas agrarias parásitos de la malaria transgénicos y la cuantificación de la movilidad del parásito y el flujo de sangre dentro de este órgano.
Resumen
El advenimiento de la microscopía intravital en modelos experimentales de roedores malaria ha permitido grandes avances en el conocimiento de 1,2 interacciones parásito-hospedador. Por lo tanto, de imágenes in vivo de parásitos de la malaria durante el pre-eritrocítica etapas han puesto de manifiesto la entrada activa de los parásitos en los ganglios linfáticos de piel 3, el desarrollo completo del parásito en la piel 4, y la formación de un merosoma hepatocitos derivados para asegurar la migración y liberación de merozoítos en el torrente sanguíneo 5. Por otra parte, el desarrollo de parásitos individuales en los eritrocitos se ha documentado recientemente con imágenes 4D y desafió a nuestra visión actual de la exportación de proteínas de la malaria 6. Por lo tanto, la imagen intravital ha cambiado radicalmente nuestra visión sobre los acontecimientos clave en el desarrollo de Plasmodium. Desafortunadamente, los estudios del paso dinámico de parásitos de la malaria a través del bazo, un órgano linfoide importante exquisitamente adaptados para borrar rojos infectados bcélulas lood faltan debido a limitaciones técnicas.
Utilizando el modelo murino de la malaria Plasmodium yoelii en ratones Balb / c, hemos puesto en marcha imágenes intravital del bazo e informó de una remodelación diferencial de la misma y la adherencia de los glóbulos rojos parasitados (pRBCs) a las células de la barrera de origen fibroblástico en la pulpa roja durante la infección con el parásito no letales línea P.yoelii 17X en lugar de las infecciones con el P.yoelii línea 17XL letal parásito 7. Para llegar a estas conclusiones, una metodología específica con ImageJ software libre fue desarrollado para permitir la caracterización de la velocidad en tres dimensiones el movimiento de un solo pRBCs. Los resultados obtenidos con este protocolo permite determinar el tiempo de la velocidad, la direccionalidad y la residencia de los parásitos en el bazo, todos los parámetros de abordar la adherencia en vivo. Además, se presenta la metodología para la cuantificación del flujo sanguíneo mediante microscopía intravital y el uso de DIFdiferentes colorantes para comprender mejor la estructura del complejo de la microcirculación del bazo.
Ética declaración
Todos los estudios con animales se realizaron en las instalaciones de animales de la Universidad de Barcelona, de acuerdo con las directrices y los protocolos aprobados por el Comité Ético de Experimentación Animal de la Universidad de Barcelona UB-CEEA (Protocolo n º DMAH: 5429). Mujer ratones Balb / c de 6-8 semanas de edad se obtuvieron de Charles River Laboratories.
Protocolo
Este método fue utilizado en la investigación en el 7.
1. Animales la infección con la proteína verde fluorescente (GFP) parásitos transgénicos
- P. yoelii-GFP líneas transgénicas de 17X y 17XL se han generado utilizando los mismos vectores, apuntando a la estrategia y los protocolos descritos en otra parte de P. berghei 8. Que expresan el mutante tres variantes de la GFP 9 bajo el promotor ubicuo de P. berghei factor de elongación 1 (Pbeef1a), que dirige la expresión constitutiva de GFP de parásito citosol durante todo el intra-eritrocítica del ciclo de desarrollo.
- Se inyecta por vía intraperitoneal los animales con los glóbulos rojos parasitados (pRBCs) de P. yoelii-GFP líneas transgénicas 17XL y 17X obtenidas de la sangre de la cola de ratones donantes en el 5-10% de parasitemia y se diluyeron en PBS. Utilizar una dosis de 5x10 5 pRBCs / ratón para llegar a una parasitemia periférica de 1% a los 3 días post-infectide (pi).
- En el día 3 pi, compruebe que la parasitemia de ratones infectados con ambas líneas de parásitos es el mismo al hacer un frotis de sangre con una gota de sangre cola seguida de tinción Giemsa y observación al microscopio óptico con un objetivo de aceite de 100x. Parasitemia se estima calculando el porcentaje de glóbulos rojos en pRBCs total en tres campos ópticos de aproximadamente 300 glóbulos rojos.
- Control de los animales inyectados con FITC glóbulos rojos puede ser utilizado para caracterizar el movimiento de estas células en el bazo normal.
2. Etiquetado de los glóbulos rojos con FITC y la inyección a los animales control
- Recoger 1 ml de sangre total a través de punción cardíaca de un ratón Balb / c en 200 l de PBS que contenía ácido etilendiaminotetracético (EDTA) (100 g / L, pH 7,4) y lavar el sedimento de glóbulos rojos en PBS / EDTA (0,1 g / L, pH 7,4) a través de la centrifugación a 300 xg durante 5 minutos (min) a temperatura ambiente (TA).
- Resuspender 200 l de la pastilla de glóbulos rojos en 300 ymu, l de PBS / EDTA (0,1 g / L, pH 8) que contiene FITC (10 g / L) y se incuba durante 2 horas a temperatura ambiente en la oscuridad con agitación suave. Después de ese tiempo, se retira el sobrenadante y las células se lavan cinco veces (300 xg, 5 min, RT) en PBS / EDTA (0,1 g / L, pH 7,4).
- Para los experimentos in vivo, diluir 10 l de la FITC pellet de glóbulos rojos en 200 l de PBS y se inyecta por vía intravenosa a ratones Balb / c con el fin de alcanzar el 1% FITC-glóbulos rojos en la circulación.
3. Los procedimientos quirúrgicos
- Preparar anestésicos inyectables compuesto de 100 mg / kg de ketamina y 5 mg / kg de dosis por Midazolam en función del peso del animal. Se inyecta por vía intraperitoneal los ratones con una dosis de anestesia. Readminister la mitad de la dosis cada 30 minutos para mantener el ratón a tiempo completo anestesiados.
- Mantenga el ratón cálido y comprobar que el ratón está completamente anestesiado (por lo general después de 50-20 min) apretando la pata antes de proceder.
- Parafacilitar la administración intravenosa de sustancias durante el transcurso del experimento, canular la vena de la cola del ratón mediante una cánula de 27G. Comprobar que la aguja se encuentra bien posicionada dentro de la vena mediante la inyección de 20 a 50 l de tampón salino y sellado con cinta adhesiva. Si se obstruye, repetir la canalización aguas arriba de la vena. Tenga cuidado de no introducir burbujas de aire.
- Exponer la parte inferior del bazo a través de una pequeña incisión en la piel y la musculatura en la parte dorsal izquierda del animal. Coloque el bazo, donde se observa el movimiento aliento menos y aplicar PBS sobre la superficie expuesta a mantenerla limpia el pelo del ratón e hidratada.
- Sellar un cubreobjetos de 60x24mm con el pegamento de cianoacrilato (Super Glue-3 Loctite) en la piel que rodea el bazo para permitir la visualización.
4. Imágenes de los parásitos que viven en el bazo
- Experimentos de microscopía intravital se llevaron a cabo en una Leica TCS SP5-microscopio confocal (LeicaMicrosystems, Heidelberg, Alemania) equipado con un sistema de incubación con control de temperatura, una inmersión 63x APO glicerol objetivo (NA 1.3), un escáner de resonancia a 8000 líneas / s, y una de argón (488 nm) y HeNe (594 nm, 633 nm) láser. Láseres adicionales, como diodo azul (405 nm) y diodo de la bomba-de estado sólido (561 nm), puede ser necesaria para la excitación de las sondas en la Tabla 1.
- Colocar el animal sobre la platina del microscopio con la cubierta-se deslizó hacia abajo, el bazo con el objetivo. Una vista general de la estructura de la microcirculación del bazo pueden ser opcionalmente visualizar utilizando un objetivo de 20x. Contraste RBC reflexión será útil para seleccionar las diferentes regiones de interés para la imagen a mayor aumento después.
- Enfoque de las regiones seleccionadas de interés con el lente objetivo 63x de inmersión de glicerol con autofluorescencia del tejido. Parásitos se observan buenas prácticas agrarias que pasa a través de las diferentes áreas del bazo.
- La fluorescencia se registraron en dos cha diferentesnnels (excitación / emisión de longitud de onda 488/505-580 nm para FITC / GFP y 488/570-630 nm para la autofluorescencia del tejido) con el conjunto de orificio de 3,0 unidades de Airy. RBC reflexión (488/480-495 nm), junto con los tintes fluorescentes para etiquetar los vasos sanguíneos (ver Tabla 1), se utilizan para obtener información adicional sobre la zona se va a examinar y en los experimentos del flujo sanguíneo se describe a continuación.
- Captura imágenes a través de cinco Z-pilas cubriendo una profundidad de 8 m, debido a las tres dimensiones del órgano, a una velocidad de 8 kHz para generar videos de 1,5 min.
- Grabar videos de las diferentes zonas del bazo para el análisis cuantitativo.
5. Microscopia intravital de la microvasculatura del bazo y la adquisición de imágenes para la medición del flujo sanguíneo
- Vital sondas fluorescentes disuelto en solución salina isotónica se puede inyectar a la vena de la cola durante el experimento a la imagen de la penetración vascular y el aumento en la estructura del bazo. Una listade las sondas y su aplicación se presentan en la Tabla 1 10.
- Para etiquetar el sistema vascular con fluorescente dextrano, prepare 1 mg de 70 kDa de dextrano marcado con Texas Red en 100 l de tampón salino.
- Utilice la vena de la cola canulado para inyectar el fluorescente dextrano para el animal se va a examinar.
- Establecer los vasos en posición horizontal, en la dirección de barrido láser, por la rotación de campo de la óptica (que no afectan la velocidad). El uso y la línea xy xt modos de escaneado en la luz central del vaso. Activar el análisis bidireccional con un promedio de 32 líneas a una velocidad de 8 kHz para obtener una imagen de 512x512 píxeles.
- Adquirir imágenes de los vasos en tres canales diferentes (excitación / emisión de longitud de onda 488/505-580 nm, 594/605-660 nm, 488/480-495 nm para FITC / GFP, Red de dextrano-Texas y la reflexión de eritrocitos, respectivamente).
- Tomar imágenes de los vasos con diámetros diferentes y más de las diferentes fases del ciclo cardiaco para compensar las fluctuaciones. En estas imágenes, las rayas resultantes de las células en movimiento se utiliza para cuantificar el flujo de sangre 11.
6. De procesamiento de imágenes y análisis cuantitativo de la movilidad del parásito utilizando el software ImageJ
- Crear un vídeo en tiempo real a partir de la secuencia de imágenes generadas con el software ImageJ (versión 1.39o, Wayne Rasband, NIH, www.macbiophotonics.ca ).
- Abra el archivo ". Lif" archivo en ImageJ mantener "xyzct" secuencia y canales separados.
- Registro de información útil a partir del archivo de metadatos: dblvoxelX-voxel de ancho, dblvoxelY-voxel de altura, dblvoxelZ voxel-profundidad-y el intervalo entre el marco consecutivos Z-marcos y entre las pilas. Esta información será utilizada para la calibración.
- Resta autofluorescencia (canal 2) a las imágenes de las buenas prácticas agrarias-parásito (canal 1). Filtro de las imágenes con desenfoque gaussiano = 1. Por favor recuerde que el uso de filtro de desenfoque gaussiano en las imágenes tiene que ser declarado para PUBLICACIOns. Guarde el archivo "animal1_m1_substract.seq".
- Un vídeo de color Z con código se crea como material de apoyo para el análisis cuantitativo de la movilidad del parásito, ya que facilitará la identificación de una sola partícula de las partículas muy rápidas y caracterización Z-movimiento.
- Convertir la pila en la imagen 5D, con la tercera dimensión es la dimensión Z y la cuarta es el tiempo. Ofrece un color diferente a cada Z y superposición.
- Proyecto de todos los Z con su máxima intensidad en todos los marcos de tiempo para crear un vídeo en color Z-codificado. Guardar como "animal1_m1_Z_color.avi".
- Clasificar y etiquetar todas las partículas que aparecen en los cuadros por primera vez 10 de la de vídeo en función del número de fotogramas de residencia (de 1 a 10). En cada vídeo, 20 de partículas se realizará un seguimiento después de las proporciones obtenidas. En total, 120 parásitos se cuantifica a partir de 3 animales, en los seis videos / animal que representan las diferentes zonas del bazo.
- Informe de los marcos de residencia en cada Zy sobre toda la película para todos los que las partículas se pueden cuantificar.
- Realizar 4D (x, y, z, t) el seguimiento manual de partículas usando el plugin MTrackJ (escrito por E. Meijering). Abra el archivo "animal1_m1_substract.seq" como imagen 5D y establecer las propiedades de la imagen con la información registrada antes de píxeles de ancho, altura, profundidad (en micras) y el intervalo de pila (en segundos). Configurar las opciones de seguimiento de la siguiente manera: "pasar a la próxima vez" y "aplicar locales cursor brillante centroid/25x25pixel". Configurar la visualización: "mostrar origen", "Mostrar imagen", "Mostrar pista activa", "mostrar sólo las pistas presentes en los canales actuales", "mostrar sólo los puntos de trayecto en el momento actual".
- Añadir una pista para cada partícula. Considere la posibilidad de movimiento en el eje Z sólo si el desplazamiento es superior a 6 micras (diámetro medio de un GRP). Siga las partículas durante un máximo de 100 marcos.
- Guardar la x, y, z, t las coordenadas medidas de la pista como "animal1_m1_p1". Xls.
- Medidas para el desplazamiento (D = SQRT ((x finales-X inicial) 2 + (y final-y Inicial) 2 + (z final,-z inicial) 2), longitud del camino (P = Σ n = 0 → SQRT final ((x n x n-1) 2 + ( y n +1 y n-) 2 + (z n +1, n z) 2) con n que indica la posición de cada momento; velocidad media y tiempo de residencia puede ser calculado usando los valores de x, y, z, t coordenadas seguimiento calibrado de acuerdo a los datos registrados. Direccionalidad de las partículas se define como el cociente entre el desplazamiento vs longitud del camino, con valores cercanos a 1 lo que indica el movimiento dirigido y valores cercanos a 0 indican el movimiento restringido 12. Una plantilla para el cálculo se facilita cerrado.
7. Cálculo del caudal volumétrico de sangre
- El flujo de sangre volumétrica se calcula como Q = V * π * D v 2 / 4, con V, la velocidad de los eritrocitos en la sección transversal unaº D v, el diámetro de la luz del vaso 11.
- Para el cálculo de V, medir los ángulos (θ) de cinco rayas de partículas que muestra la reflexión luminosa (RBC) y cuatro rayas de partículas de color verde fluorescente (GFP-GRP) en cada imagen utilizando el software ImageJ xt. Lumen medir diámetros de vasos en la imagen xy.
- La velocidad se expresa como V = 1/tan (θ) * D e / D v para normalizar los eritrocitos (D e = 6 m) y diámetros de luz del vaso.
- Cuantificar un mínimo de tres vasos de diferentes diámetros y cinco imágenes xt para cada buque.
8. El análisis estadístico
- Por la direccionalidad trama de análisis estadístico, la velocidad media y tiempo de residencia como distribuciones de la densidad y el uso de la prueba de igualdad de las medianas en STATA (IC10) para evaluar las diferencias entre las dos líneas de parásitos.
9. Resultados representante
Intravital imaging de parásitos GFP en el bazo reveló diferencias en la movilidad entre las dos cepas de parásitos. El análisis cuantitativo de los parámetros de movilidad de los parásitos solo redujo la velocidad indicada, la falta de direccionalidad y el tiempo de residencia aumentó de parásitos de los ratones infectados con la cepa de 17X. Por otra parte, el flujo sanguíneo en los vasos volumétricos no se vio alterada entre las cepas 7. El procedimiento técnico se presenta en la Figura 1A. Figura 1B muestra una vista general de un bazo normal de un ratón inyectado con glóbulos rojos marcados con FITC, con un zoom en la pulpa roja y la otra a un recipiente (Figura 1B, zoom 1 y 2, respectivamente). Vasculatura se evidenció mediante la inyección de 70 kDa dextrano-Texas Red, junto con el contraste de reflexión eritrocitos. Otros colorantes fluorescentes resumen en la Tabla 1 se puede utilizar para obtener información sobre el órgano que se explora, como Hoechst (Figura 1C, 1D).
Imágenes en tiempo real de los parásitos de la cepa 17XL y 17X se presenta en el cine 1 y 2,con algunos 17X-GRP (Movie 2) que muestran un comportamiento círculo rodante. El análisis cuantitativo de los parámetros de la movilidad se ha logrado a través del seguimiento de los parásitos individuales con la ayuda de imágenes en color Z-codificado. Figura 2A muestra un Z-proyección de una pila de color Z-codificado, donde la partícula en movimiento aparece rodeado en diferentes planos. Figura 2B y 2C representan las pistas de diferentes parásitos de la infección 17X y 17XL, respectivamente. Los resultados de la direccionalidad y el tiempo de residencia de todas las partículas cuantificadas se presentan como un mapa de distribución de la densidad de población de parásitos en la figura 2D y 2E, respectivamente. Para controlar el flujo de sangre en el bazo mediante microscopía intravital, las rayas en las imágenes obtenidas xt de la luz central de los vasos que resulta del movimiento de eritrocitos se midió para calcular la velocidad 11. Las imágenes muestran a una exploración de xy de un vaso (Figura 2F) con el correspondiente análisis xt línea (Figura 2 G).
| Problema fluorescentese | Localización | Un fotón de excitación (nm) | Dos fotones de excitación (nm) | Emisión detectada (nm) | Cantidad / ratón de peso |
| Hoechst 33342 | Membrana permeable de unión al ADN de la sonda. Que las etiquetas de los núcleos de las células (vivas y muertas) después de la inyección por vía intravenosa. | 405 | 800 | 410-480 | 12,5 g / Kg |
| Yoduro de propidio | Membrana impermeant de unión al ADN de la sonda. Que las etiquetas de los núcleos de las células con membranas comprometidas (apoptosis y necrosis). | 561 | 800 | 570-650 | 250 mg / Kg |
| 70.000 peso molecular de dextrano-fluorescentes (FITC, Texas Red) | Fase líquida marcador que aumenta el contraste de plasma. | FITC 488 Texas Red 594 | 800 | 500-540 600-650 | 50 mg / Kg |
| La fluoresceína sódica | Mayor parte en fase líquida marcador de albúmina que mejora el contraste de plasma. | 488 | 800 | 500-540 | 2 mmol / Kg |
| Azul de Evans | Mayor parte en fase líquida marcador de albúmina que mejora el contraste de plasma. | 633 | ª | 645-700 | 20 mg / Kg |
| Rodamina R6 | Sonda de vital importancia que se acumula en la mitocondria activa. Que las etiquetas de las células de endotelio y la circulación de blanco después de la inyección intravenosa. | 561 | 800 | 570-650 | 25 mg / Kg |
| Fluospheres-1micron diámetro | Cuentas que se uptaken por las células con actividad fagocítica. | 488 | 800 | 500-540 | ª |
| Alexa488 marcado IIβ fibrina cadena de anticuerpos específicos | Sondeo que las etiquetas de fibrina cadena IIβ | 488 | 800 | 500-540 | 0,3 mg / Kg |
Tabla 1. Sondas fluorescentes para la microscopía intravital. Vital tintes fluorescentes con diferentes localizaciones que se pueden utilizar para la etiqueta del bazo en vivo. Excitación / emisión (Exc / em) va a ser utilizado con un fotón (o microscopio de dos fotones) se proporcionan. La dosis indicada se disuelve en 0.1 a 0.2 ml de solución tampón salina y se inyecta a la vena de la cola del ratón. [Nd: no determinado en este estudio.
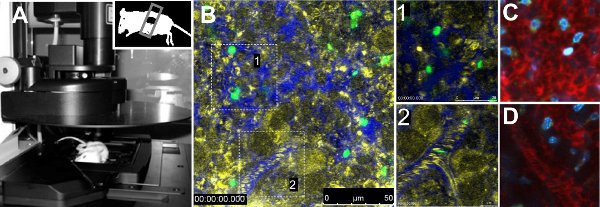
Figura 1. Microscopía intravital del bazo. A. Leica TCS SP5-microscopio confocal con un ratón colocado en la platina del microscopio. El ratón tiene la parte inferior del bazo expuestos y se sella con un cubre. B. Imagen de un área representativa del bazo de un animal no infectado inyectados con FITC los glóbulos rojos y70 kDa dextrano-Texas Red para visualizar los vasos. Reflexión (amarillo), dextrano (azul) y FITC-los glóbulos rojos (color verde) se muestran. Estallidos de cuadros blancos representan libre circulación (1) y cerca de circulación (2) áreas. Libre circulación (C) y cerca de circulación (D) se tiñeron con kDa dextrano 70 (rojo) y Hoechst 33342 (azul).
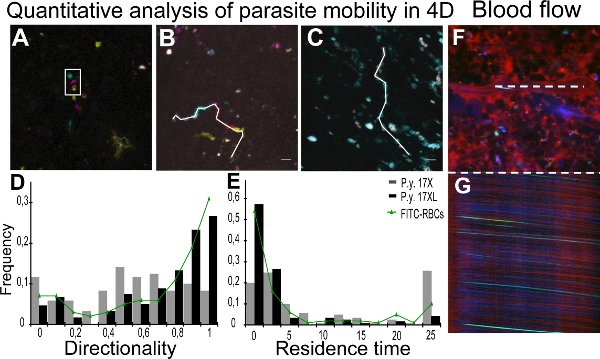
Figura 2. Cuantificación de la movilidad del parásito y el flujo sanguíneo. AC. El análisis cuantitativo del movimiento de partículas en las cuatro dimensiones (4D) se facilita mediante el uso de un código de colores de procesamiento de imágenes. Seguimiento de A. se realizó con la información de profundidad a partir de imágenes de color Z-codificado, representado con proyección de intensidad máxima de cinco diferentes profundidades. Blanco rectángulo representa la misma partícula en diferentes Z en un momento determinado. Diferentes posiciones se deben a los lapsos de tiempo entre la adquisiciónde las diferentes imágenes Z. Código de fondo:. Amarillo (0 m), naranja (2 m), rosa (4 m), azul (6 m), verde (8 m) B, las proyecciones de C. El tiempo de movimiento de las partículas en cada intervalo de tiempo como de colores: gris (0 a 2,4 seg), cian (2.4 a 4.8 seg), magenta (4.8 a 7.0 seg), rojo (7,0 a 9,4 seg) y amarillo (9.4 a 11.8 segundos). La línea blanca representa 4D seguimiento manual de las partículas de 17X (11,8 s) (B) y 17XL (4,8 seg) (C) parásitos GFP utilizando MTrackJ. D, E. Distribución de la densidad de las partículas de las buenas prácticas agrarias en los valores de la direccionalidad (D) y tiempo de residencia (E). Los datos corresponden a 120 partículas de cada línea de parásitos y 100 glóbulos rojos marcados con FITC a partir de tres experimentos independientes analizaron con la prueba de la igualdad de las medianas. Las medianas son 17X/17XL/FITC-RBCs 0.53/0.75/0.85 (D) y 4.61/0.67/0.9 s (E). Las diferencias entre las dos líneas en Rong> (D) y (E) son estadísticamente significativas (P <0,001). Las diferencias entre los glóbulos rojos marcados con FITC y parásitos 17XL no son estadísticamente significativas (P> 0,05). F, G. Bazo mediciones del flujo sanguíneo. Representación de la xy la imagen (F) y xt de la imagen (G) a partir de una línea de exploración de la cavidad central del mismo buque (línea blanca). Bazo embarcación que muestre plasma con kDa dextrano 70 (rojo), GRP (verde) y la reflexión de eritrocitos (azul).
Películas 1 y 2. Time-lapse imágenes de microscopía intravital del bazo murino infectado con 17XL (1) o 17X (2) GFP-transgénicos parásitos en un 10% parasitemia (Z-máxima de proyección). Parásito y la autofluorescencia del tejido se muestran en verde y rojo respectivamente. Las barras de escala representan el 10 micras y el intervalo de tiempo es en segundos.
v "> Haga clic aquí para ver la película 1.
Haga clic aquí para ver la película 2.
Discusión
La aplicación de la microscopía intravital del bazo en este modelo la malaria roedores abrió la posibilidad de investigar el paso dinámico de los parásitos a través de este órgano, que hasta ahora ha sido considerado un "recuadro negro", debido a consideraciones técnicas. Aquí, un gran esfuerzo se puso a adaptar un método cuantitativo que permite el análisis comparativo de las líneas de parásito diferente en los niveles individual y poblacional. En contraste con otros tejidos y células que había...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Estamos especialmente agradecidos a S. Graewe y Heussler V. para la formación inicial y continua de entrada en la microscopía intravital de parásitos de la malaria, a J. Burns para la donación de las buenas prácticas agrarias parásitos transgénicos, A. Bosch (Unidad de Confocal, CCIT-UB, IDIBAPS) de asistencia en el análisis de imágenes y la cuantificación y P. Astola de asistencia técnica. Damos las gracias a R. Tous y Caralt I. para la producción de video. MF es un beneficiario de una beca de postgrado de la Generalidad de Cataluña. HAP es un profesor de investigación ICREA. Trabajo en el laboratorio de HAP es financiado por el Programa de la Comunidad Europea Séptimo Programa Marco (FP7/2007-2013) en virtud de acuerdo de subvención N ° 242095, por la privada Fundación Cellex (Cataluña, España), y por el Ministerio español de Ciencia e Innovación ( SAF2009-07760).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Leica TCS SP5-microscopio confocal | Leica Microsystems, Heidelberg, Alemania | TCS SP5-N º de serie. 5100000419 | |
| La ketamina (Ketolar 50 mg / ml) | Pfizer | 631028 | |
| Midazolam 15 mg / 3 ml | Normon | 838193 | |
| 70.000 MW dextrano, conjugado con Texas Red | Las sondas moleculares | D1830 | |
| Isotiocianato de fluoresceína, isómero I (FITC) | Sigma | F7250 | |
| Hoechst 33342 | Sigma | H1399 | |
| Giemsa | Sigma | GS1 | Solución de trabajo es del 10% en agua destilada |
| Super Glue-3 Loctite | Loctite | 9975-0880 |
Referencias
- Amino, R., Menard, R., Frischknecht, F. In vivo imaging of malaria parasites--recent advances and future directions. Curr. Opin. Microbiol. 8, 407-414 (2005).
- Heussler, V., Doerig, C. In vivo imaging enters parasitology. Trends. Parasitol. 22, 192-195 (2006).
- Amino, R., Thiberge, S., Blazquez, S., Baldacci, P., Renaud, O., Shorte, S. Imaging malaria sporozoites. in the dermis of the mammalian. 2, 1705-1712 (2007).
- Gueirard, P., Tavares, J., Thiberge, S., Bernex, F., Ishino, T., Milon, G. Development of the malaria parasite in the skin of the mammalian host. Proc. Natl. Acad. Sci. U. S. A. 107, 18640-18645 (2010).
- Sturm, A., Amino, R., van de Sand, C., Regen, T., Retzlaff, S., Rennenberg, A. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science. 313, 1287-1290 (2006).
- Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T. W., Spielmann, T. Development and host cell modifications of Plasmodium falciparum blood stages in four dimensions. Nat. Commun. 2, 165-165 (2011).
- Martin-Jaular, L., Ferrer, M., Calvo, M., Rosanas-Urgell, A., Kalko, S., Graewe, S. Strain-specific spleen remodelling in Plasmodium yoelii infections in Balb/c mice facilitates adherence and spleen macrophage-clearance escape. Cell. Microbiol. 13, 109-122 (2011).
- Linden, M. v. a. n. d. e. r., R, . A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein. 173, 33-38 (1996).
- Dunn, K. W., Sandoval, R. M., Kelly, K. J., Dagher, P. C., Tanner, G. A., Atkinson, S. J. Functional studies of the kidney of living animals using multicolor two-photon microscopy. Am. J. Physiol. Cell. Physiol. 283, C905-C916 (2002).
- Zhong, Z., Petrig, B. L., Qi, X., Burns, S. A. In vivo measurement of erythrocyte velocity and retinal blood flow using adaptive optics scanning laser ophthalmoscopy. Opt. Express. 16, 12746-12756 (2008).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Bowdler, A. J. . The complete spleen. , (2002).
- Grayson, M. H., Hotchkiss, R. S., Karl, I. E., Holtzman, M. J., Chaplin, D. D. Intravital microscopy comparing T lymphocyte trafficking to the spleen and the mesenteric lymph node. Am. J. Physiol. Heart. Circ. Physiol. 284, H2213-H2226 (2003).
- Khandoga, A. G., Khandoga, A., Reichel, C. A., Bihari, P., Rehberg, M., Krombach, F. In vivo imaging and quantitative analysis of leukocyte directional migration and polarization in inflamed tissue. PLoS. One. 4, 4693-4693 (2009).
- Weiss, L., Geduldig, U., Weidanz, W. Mechanisms of splenic control of murine malaria: reticular cell activation and the development of a blood-spleen barrier. Am. J. Anat. 176, 251-285 (1986).
- Swirski, F. K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Grayson, M. H., Chaplin, D. D., Karl, I. E., Hotchkiss, R. S. Confocal fluorescent intravital microscopy of the murine spleen. J. Immunol. Methods. 256, 55-63 (2001).
- Bajenoff, M., Glaichenhaus, N., Germain, R. N. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados