Method Article
Entrega y transfección de genes en células humanas de cáncer de páncreas con factor de crecimiento epidérmico receptor dirigidos a base de gelatina Nanovectors Ingeniería
En este artículo
Resumen
Tipo B a base de gelatina sistema nanovectors ingeniería (gens) fue desarrollado para la entrega de genes sistémicos y transfección en el tratamiento del cáncer de páncreas. Por la modificación con el receptor de factor de crecimiento epidérmico (EGFR) péptido específico en la superficie de nanparticles, podrían dirigir a los receptores EGFR y la liberación del plásmido en la reducción de medio ambiente, tales como altas concentraciones de glutatión intracelular.
Resumen
Más de 32.000 pacientes son diagnosticados con cáncer de páncreas en los Estados Unidos por año y la enfermedad se asocia con una mortalidad muy alta 1. Existe la urgente necesidad de desarrollar nuevas estrategias terapéuticas clínicamente traducible que pueden mejorar en las estadísticas de supervivencia triste de pacientes con cáncer de páncreas. Aunque la terapia génica en el cáncer ha demostrado una gran promesa, el gran reto es el desarrollo del sistema de suministro seguro y eficaz, que puede conducir a la expresión del transgén sostenido.
La gelatina es una de las biopolímero natural más versátil, ampliamente utilizado en productos alimenticios y farmacéuticos. Estudios anteriores de nuestro laboratorio han demostrado que el tipo B de gelatina podría física encapsular ADN, que conserva la estructura superenrollado de la eficacia de transfección de plásmidos y la mejora en la entrega intracelular. Por tiolación de gelatina, los grupos sulfhidrilo pueden introducirse en el polímero y se fbonos orm disulfuro dentro de las nanopartículas, que estabiliza el enlace disulfuro todo el complejo y una vez que se ha roto debido a la presencia de glutatión en el citosol, la carga útil sería liberado 2-5. Poli (etilenglicol) (PEG)-modificada GENS, cuando se administra en la circulación sistémica, permite la circulación de largo tiempo y se dirige preferentemente a la masa tumoral, debido a la hiper-permeabilidad de la vasculatura por el aumento de la permeabilidad y el efecto de retención de 6. Los estudios han demostrado la sobre-expresión del receptor del factor de crecimiento epidérmico (EGFR) en Panc-1 las células humanas de adenocarcinoma pancreático 7. A fin de combatir activamente el cáncer de páncreas líneas celulares, el péptido específico de EGFR se conjugó en la superficie de la partícula a través de un espaciador PEG 8.
La mayoría de las terapias anti-tumorales de genes se centran en la administración de los genes supresores de tumores, como el p53 de tipo salvaje (wt-p53), para restaurar la función pro-apoptótica en las células de 9 10. En el cáncer de páncreas, la mayoría de las células con mutaciones en la proteína p53, que causa la pérdida de actividad de apoptosis. Con la introducción del peso de p53, la apoptosis puede ser reparado y además desencadena la muerte celular en células de cáncer 11.
Con base en los fundamentos anteriores, hemos diseñado EGFR objetivo péptido modificado con nanopartículas de gelatina tiolada para la entrega del gen p53 en peso y la eficiencia de la entrega y evaluación de transfección en células Panc-1.
Protocolo
1. Preparación de ADN plásmido encapsulado EGFR nanopartículas de gelatina
- Síntesis de tiolada gelatina
- Tiolada gelatina fueron sintetizados como método anterior 2-5, por la conjugación covalente con 2-iminotiolano de grupos amino primarios de tipo B de gelatina. 1 gramo de gelatina se disuelve en 100 ml de agua desionizada y se incubaron con 20 mg de clorhidrato de 2-iminotiolano a temperatura ambiente durante 15 horas.
- Reactivo que no ha reaccionado se elimina por diálisis contra 5 mM solución de HCl, 1 mM seguido por una solución de HCl durante 3 horas cada una. Purificado tiolada gelatina fue liofilizado y almacenado a 4 ° C para su uso posterior.
- Preparación de ADN que contienen nanopartículas
- 200 mg tiolada gelatina se disuelve en el agua y el pH de la solución se ajustó a 7 por adición de 0,2 M de NaOH. 1mg de ADN y se mezclaron suavemente con una solución de gelatina.
- Etanol enfriada se añadió lentamente a la mezcla, mientras quesolución en agitación a alta velocidad. Las nanopartículas se forman cuando la composición del disolvente cambió a 75% solución hidroalcohólica.
- Las nanopartículas fueron más reticulado por adición lenta de 0,1 ml de un 8% (v / v) de glioxal. Reactivos sin reaccionar se inactiva con 0,5 ml de solución 0,2 M de glicina.
- Las nanopartículas se centrifugar a 16.000 rpm durante 30 minutos. Los sedimentos se lavaron con agua desionizada dos veces y nanopartículas purificadas fueron liofilizadas y almacenadas a 4 ° C.
- Modificación superficial de nanopartículas
- Las nanopartículas se suspendieron en tampón fosfato 0,1 M (pH 7,4) con una concentración de 10 mg / ml y se incubaron con 2 veces el peso de metoxi-PEG-succinimidil éster carboxi metil (mPEG-SCM, de 2.000 MW Da) o carboxi maleimida-PEG-succinimidilo metílico (MAL-PEG-SCM, de 2.000 MW Da) durante 2 horas a temperatura ambiente con agitación lenta.
- Pegilado nanopartículas fueron recogidos con ultra-centrifugación a 16.000 rpm durante 30 minutoss. Los sedimentos se lavaron con agua desionizada dos veces y nanopartículas purificadas fueron liofilizadas y almacenadas a 4 ° C.
- MAL-PEG-SCM nanopartículas modificadas se suspendieron en 0,1 M de tampón fosfato (pH 6,5) con una concentración de 10mg/ml y se incubó con 10% del peso del péptido específico EGFR (YHWYGYTPQNVI-GGGGC) durante 6 horas a temperatura ambiente con agitación lenta.
- Péptido nanopartículas modificadas fueron recogidos con ultra-centrifugación a 16.000 rpm durante 30 minutos. Los sedimentos se lavaron con agua desionizada dos veces y nanopartículas purificadas fueron liofilizadas y almacenadas a 4 ° C.
2. Caracterización de EGFR nanopartículas
- Tamaño de las partículas y la medición del potencial zeta
Las nanopartículas se suspendieron en agua con una concentración de 1mg/ml. La suspensión se analizó mediante Zetasizer Nano (Malvern Inc). Análisis de tamaño de partículas se lleva a cabo en un ángulo de dispersión de 90 grados a 25 °C. El potencial zeta se midió a los parámetros por defecto de la constante dieléctrica índice de refracción y la viscosidad del agua a 25 ° C. - Microscopía Electrónica de Barrido
Nanopartículas liofilizadas fueron montados en el monte de muestras de aluminio y recubierto por pulverización catódica con paladio para mejorar la conductividad y minimizar la acumulación de cargos. Las muestras fueron observadas en la morfología de la superficie bajo una emisión de campo Hitachi 4800 microscopio electrónico de barrido a 3 kV. - Espectroscopio de electrones para el análisis químico (ESCA)
Liofilizado formulación de control, nanopartículas modificadas pegilado y péptidos fueron analizadas por ESCA. Se llevó a cabo en la ESCA Centro Nacional de Análisis de la superficie de Problemas Biomédicos (NESAC / BIO) de la Universidad de Washington (Seattle, WA).- Las muestras se colocaron en ultra alto vacío y con un bajo de energía haz de rayos X, lo que indujo una emisión de fotoelectrones secundaria de la superficie.
- Al graficar el número de electrones detectados en función de binding de energía, picos observados espectro se asignó a cada uno de los componentes químicos.
- Análisis de alta resolución de los espectros C1s se llevó a cabo para determinar la composición química exacta de los hidrocarburos (CC o CH a 285mV), éter (CO) en 286.4mV) y carbonilo (C = O a 288,1 mV), y la composición relativa de cada función fue determinada por el área bajo la curva.
- Estabilidad del plásmido encapsulado
La estabilidad del plásmido de ADN encapsulado fue confirmada mediante la ejecución del ADN extraído de prefabricados de geles. Las nanopartículas fueron digeridos con 0,2 mg / ml de la proteasa que contienen PBS (30 min a 37 ° C) y 0,2 U / ml ADNasa (10 minutos a temperatura ambiente) por separado, de forma simultánea o secuencial. Las muestras fueron cargados en un 1,2% en gel de agarosa (GP) (E-Gel, Invitrogen, CA) a una concentración de 100ng/well en un volumen de 18μL por pocillo. Plásmido desnudo se ha cargado como el control y el gel se ha ejecutado a 75 V durante 30 minutos. Kodak Digital de rayos X de la muestra (DXS) del sistema se utiliza para visualizar bANDS con transluminescence UV. - Determinación de la carga de plásmido
Plásmido nanopartículas encapsuladas fueron suspendidas a 1mg/ml y se digirió con la proteasa 0.2mg/ml a 37 ° C durante 30 minutos. Solución fue centrifugada a 13.000 rpm durante 10 minutos y el sobrenadante se recogió y la prueba de concentración de plásmido con Picogreen ensayo (Invitrogen). Relación de encapsulación se calcula dividiendo la concentración de plásmido encapsulado con la carga inicial del 0,5% (w / w).
3. En estudios de transfección in vitro en Panc-1 células del cáncer pancreático
- Condiciones de cultivo celular
Panc-1 y Capan-1 líneas de adenocarcinoma de células pancreáticas, adenocarcinoma de ovario SKOV3 línea celular y el NIH-3T3 murino línea celular de fibroblastos se obtuvieron de la ATCC. Panc-1 y NIH 3T3-se cultivaron con DMEM suministrado con L-glutamina, Pen estreptococos y 10% de suero fetal bovino a 37 ° C y 5% de CO 2, mientras que Capan-1 requiere DMEM suministra 20% de suero fetal bovino.SKOV3 fue cultivada en RPMI-1640 se suministra con suero fetal bovino al 10%. - Western blot para la expresión de EGFR
- Lisados de células se obtuvieron de 2 millones de células y se analizó la concentración de proteínas totales con BCA (Pierce). NIH-3T3 se utilizó como control negativo y SKOV3 se utilizó como control positivo de la expresión de EGFR.
- 10 mg de extracto de proteína total se ha ejecutado en prefabricados de sodio dodecil sulfato-poliacrilamida electroforesis en gel (SDS-PAGE) en el sistema de 135V durante 90 minutos.
- Posteriormente, el gel se transfirió a una membrana de PVDF por iBlot seco Sistema Blotting (Invitrogen).
- Membrana se bloqueó con leche descremada al 5% en solución salina que contiene Tween-Tris (TBS-T) durante 1 hora a temperatura ambiente.
- Membrana se corta y se incubaron con 1:1000 dilución de primaria conejo actina beta-anticuerpos y 1:1000 dilución de anticuerpos primarios de conejo EGFR por separado la noche a 4 ° C.
- Membrana se lavó dos veces conTBS-T y se incubaron con diluciones de 1:2000 secundario anti-conejo peroxidasa de rábano picante conjugada con IgG en TBS-T durante 1 hora a temperatura ambiente.
- Después de enjuagar el exceso de anticuerpos con TBS-T y el agua, 4 ml de sustrato ECL (Pierce, Rockford, IL, EE.UU.) y se incubó con las membranas durante 5 minutos.
- Bandas de quimioluminiscencia se visualiza entonces con Kodak Digital de rayos X de la muestra (DXS) del sistema.
- Estudios de viabilidad celular con diferentes formulaciones
- Panc-1 células fueron cultivadas en placas de 96 pocillos a 10.000 células por pocillo en 200μL de DMEM suplementado durante la noche.
- El crecimiento medio fue reemplazado con medio libre de suero que contienen diferentes concentraciones de nanopartículas con 0, 0,5, 1, 2, 4, 6 mg / ml. 1mg/ml PEI, un polímero catiónico citotóxicas, se utilizó como control positivo.
- Las células fueron tratadas con nanopartículas de 200μL durante 6 horas y luego se reemplaza con 20μL reactivo MTS y completa 100μLmedios de cultivo.
- Después de la incubación después de 3 horas a 37 ° C en CO2 al 5%, la absorción del producto formazan se midió a 490nm con Biotek SynergyHT lector de placas (Winooski, VT).
- La viabilidad de las células por ciento se expresa como la relación de absorción de las células de polímero tratados en relación con el control negativo (0mg/ml) multiplicado por 100 y se representan en función de las concentraciones de polímero.
- Estudios de células tráfico
- Rodamina B isotiocianato (RBITC) se utilizó para conjugar en tiolada gelatina por reacción con el grupo amino. Después de la diálisis y liofilización, RBITC etiquetados tiolada gelatina se utiliza para la preparación de las nanopartículas.
- Antes de desolvatación, 25μL PicoGreen se mezcló con 1 mg de plásmido por 1 minuto y plásmidos marcados se agregaron a la solución de gelatina. Diferentes formulaciones se realizaron siguiendo el método anterior.
- Panc-1 células fueron cultivadas en placas de 6 pocillos de vidrio que contiene los cubres con 200.000 células per bien. Después de un crecimiento durante la noche, 2 ml de nanopartículas etiquetados fueron tratados en cada pocillo con una concentración de 1mg/ml en medio libre de suero.
- Después de diferentes puntos de tiempo, desde 15 minutos a 6 horas, medio fue reemplazado con medio de cultivo que contiene 1μg/ml de Hoest 33342 (Invitrogen) durante 15 minutos de incubación a temperatura ambiente. 2 ml de solución de paraformaldehído al 4% fue reemplazado en cada pocillo para fijar las células. Las células fueron lavadas dos veces con PBS.
- Coversilps fueron montados en portaobjetos de vidrio. El escaneo láser confocal de microscopía de fluorescencia se utilizó para tomar imágenes de las celdas.
- Determinación cuantitativa de la eficacia de transfección mediante microscopía de fluorescencia con pEGFP-N1 nanopartículas encapsuladas
- pEGFP-N1 plásmidos fueron encapsulados en nanopartículas y suspendido en el medio libre de suero con una concentración equivalente a plásmidos 10μg por ml para tratamientos posteriores.
- Panc-1 células fueron cultivadas durante la noche en placas de 6 pocillos contaiNing vidrio cubreobjetos con 200.000 células por pocillo. 2 ml de pEGFP-N1 plásmidos nanopartículas encapsuladas fueron tratados en cada pocillo. 20 microgramos de plásmidos se mezclaron con 20μl Lipofectina, reactivos de transfección lípido catiónico, y fue utilizado como control positivo, mientras que las células no tratados fueron utilizados como control negativo.
- Las células fueron incubadas con diferentes formulaciones de 6 horas.
- Medio fue reemplazado con medio de cultivo y las células fueron transfectadas después de las 24, 48, 72 y 96.
- Después después de la transfección, el medio fue reemplazado con medio de cultivo que contiene 1μg/ml de Hoest 33342 (Invitrogen) y se incuban con las células durante 15 minutos a temperatura ambiente.
- Cubreobjetos fueron montados en portaobjetos de vidrio y la expresión de GFP en las células se observó con el microscopio de fluorescencia. Contraste de interferencia diferencial (DIC) y las imágenes de fluorescencia Olympus BX61 adquiridos mediante microscopio e imágenes digitales fueron procesadas con el software Image J.
- Determinación cuantitativa de la eficacia de transfección mediante ELISA con pEGFP-N1 nanopartículas encapsuladas
- pEGFP-N1 plásmidos fueron encapsulados en nanopartículas y suspendido en el medio libre de suero con una concentración equivalente a plásmidos 10μg por ml para tratamientos posteriores.
- Panc-1 células fueron cultivadas durante la noche en placas de 6 pocillos con 200.000 células por pocillo. 2 ml de pEGFP-N1 plásmidos nanopartículas encapsuladas fueron tratados en cada pocillo. 20 microgramos de plásmidos se mezclaron con 20μl Lipofectina, reactivos de transfección lípido catiónico, que fue utilizado como control positivo y las células no tratadas se utilizaron como control negativo.
- Las células fueron incubadas con diferentes formulaciones de 6 horas.
- Medio fue reemplazado con medio de cultivo y las células fueron incubadas durante post-24, 48, 72 y 96.
- Después después de la transfección, lisados de células se obtuvieron de cada pozo y se analizó la concentración de proteínas totales con BCA (Pierce).
- placa y se coaTed con 100μl de diluciones 1:1000 de anticuerpos monoclonales anti-GFP anticuerpos en cada pocillo. Después de 2 horas de incubación, la placa se lavó con PBS-0.5% (w / v) de Tween-80 durante 4 horas.
- 300μl buffers TBS bloqueo se añadieron a cada pocillo y se incuba durante 2 horas. A continuación, la placa se lavó con PBS-0.5% (w / v) de Tween-80 durante 4 horas.
- 30μg de proteínas de cada grupo se agregaron a la placa y se incuba durante la noche a 4 °. A continuación, la placa se lavó con PBS-0.5% (w / v) de Tween-80 durante 4 horas.
- 100μl de diluciones 1:2400 de la secundaria de anticuerpos anti-GFP en relación con la fosfatasa alcalina se añadió a cada pocillo y se incuba durante 1 hora. A continuación, la placa se lavó con PBS-0.5% (w / v) de Tween-80 durante 4 horas.
- 100μl sustratos de fosfatasa alcalina se añadió a cada pocillo y se incuba durante 30 minutos a 1 hora. La placa se midió con BioTek lector de placas Sinergia HT de absorbancia a 405 nm.
- Concentración expresada GFP fue reportado como nanogramos por milligrams de proteína total.
- Determinación cuantitativa de la eficacia de transfección mediante RT-PCR con el plásmido en peso de nanopartículas encapsuladas p53
- P53 en peso de los plásmidos fueron encapsulados en nanopartículas y suspendido en el medio libre de suero con concentración equivalente a 10μg ml de plásmido por más tratamientos.
- Panc-1 células fueron cultivadas durante la noche en placas de 6 pocillos con 200.000 células por pocillo. 2 ml de plásmidos p53 en peso de nanopartículas encapsuladas fueron tratados en cada pocillo. 20 microgramos de plásmidos se mezclaron con 20μl Lipofectina, reactivos de transfección lípido catiónico, que fue utilizado como control positivo y las células no tratadas se utilizaron como control negativo.
- Las células fueron incubadas con diferentes formulaciones de 6 horas.
- Medio fue reemplazado con medio de cultivo y las células fueron post-incubaron durante 48 horas.
- ARNm se extrae de cada pozo mediante el uso de High Pure ARN Kit de aislamiento (Roche, Indianapolis, IN) y se mide con Nanodrop 2000 (Thermo Científico, Wilminton, DE).
- RT-PCR se realizó mediante el uso de QIAGEN en un solo paso RT-PCR kit (QIAGEN, Valencia, CA). Cebadores para p53, Bax, Bcl-2, beta-actina, DR5, Apaf-1, PUMA, survivina fueron sintetizados por Eurofins GTM Operon (Huntsville, AL).
- Los productos de PCR fueron evaluados con la electroforesis en gel y los píxeles de las bandas de cDNA fueron analizados con el software ImageJ.
- Determinación cuantitativa de la eficacia terapéutica con el peso de p53 palsmid nanopartículas encapsuladas
- Peso-p53 plásmido fue encapsulado en las nanopartículas y suspendido en el medio libre de suero con concentración equivalente a plásmidos 10μg por ml para su posterior tratamiento.
- Panc-1 células fueron cultivadas durante la noche en placas de 6 pocillos con 200.000 células por pocillo. 2 ml de plásmidos p53 en peso de nanopartículas encapsuladas fueron tratados en cada pocillo. 20 microgramos de plásmidos se mezclaron con 20μl Lipofectina, reactivos de transfección lípido catiónico, que fue utilizado como control positivo y las células no tratadas seutilizó como control negativo.
- Las células fueron incubadas con diferentes formulaciones de 6 horas.
- Medio fue reemplazado con medio de cultivo y las células fueron incubadas durante post-24, 48, 72 y 96.
- Condensación de la cromatina / permeabilidad de la membrana / Kit muertos apoptosis de las células (Invitrogen, Carlsbad, CA) se utiliza para etiquetar las células apoptóticas, células necróticas y células vivas con diferentes tintes.
- iCys Imaging Research citómetro de CompuCyte (Westwood, MA) fue utilizado para analizar y comparar los niveles de apoptosis después del tratamiento. Con base en las imágenes microscópicas de fluorescencia, las intensidades de todos los colores, fue grabado y trazar la curva cuenta y los porcentajes para las diferentes poblaciones se calcularon.
- En comparación con el control negativo, lo que significa que no existía ningún tratamiento para las células, las células apoptóticas veces los cambios se calcularon a cabo y que figuran en el gráfico.
- 3.8.8 Apo-ONE caspasa-3 Homogénea / 7 kit de ensayo (Promega, Madison, WI) se utilizó para examinar la pro-apoptóticos actividad después de la transfección de peso-p53 plásmido. 1mg/ml PEI se utilizó como control negativo para eliminar toda la actividad apoptótica. Después después de la transfección, las células fueron tratadas con rodamina 110, bis-(N-CBZL-aspartil-L-glutamil-L-valil-L-aspártico amida de ácido; Z-DEVD-R110), que es un sustrato de la caspasa 3 / 7, para un máximo de 18 horas.
- La placa se midió con BioTek lector de placas Sinergia HT de fluorescencia a 490/520 nm. Con base en la intensidad de la fluorescencia verde, pro-apoptóticos actividad puede ser evaluada.
4. Resultados representante
1. Síntesis y Chatacterization de las nanopartículas dirigidas EGFR
EGFR objetivo péptido modificado con nanopartículas fueron sintetizados como el esquema mostrado en la figura 1. Las nanopartículas preparadas por desolvatación se caracteriza por el tamaño de partícula y potencial zeta. La tarifa media el tamaño y la superficie de las partículas preparados a partir de gelatinas tioladacon diferentes grados de tiolación se enumeran en la Tabla 1. Los diámetros de partícula medio de diferentes nanopartículas fueron entre 150-250 nm. Tiolada nanopartículas más pequeñas en comparación con el tamaño de las nanopartículas de gelatina, podría, debido a la formación de puentes disulfuro dentro de las partículas. Con modificaciones en la superficie, tamaños de las nanopartículas se han incrementado. Los potenciales zeta de las diferentes formulaciones alrededor de -20 mV. Con el análisis SEM, el tamaño, morfología de la superficie y la forma esférica de las nanopartículas se observaron y que corresponden a resultados Zetasizer. La eficiencia de ADN de carga en las nanopartículas de gelatina y tiolada nanopartículas de gelatina fueron superiores al 95% (Tabla 1).
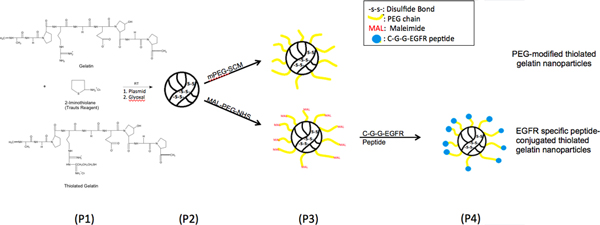
Figura 1. Esquema de reacción química, que ilustra la modificación de la superficie de las nanopartículas de gelatina con tiolada de crecimiento epidérmico factor receptor (EGFR) péptido de unión a través de un poli (etilenglicol) (PEG) espaciador.
Caracterización de las nanopartículas
| Formulación | Nanopartículas de diámetro (nm) | Zeta potencial (mV) | ADN plásmido eficiencia de carga (%) |
| Gel NP | 151,4 ± 23,5 | -17,1 ± 5,23 | 95,6 ± 2,2 |
| SH-Gel NP | 132,6 ± 17,9 | -24,6 ± 5,16 | 97,0 ± 3,8 |
| SH-Gel-PEG | 179,0 ± 30,9 | -22,3 ± 9,50 | 95,8 ± 6,5 |
| SH-Gel PEG péptido | 230,8 ± 41,5 | -18,1 ± 4,02 | 94,8 ± 5,1 |
Tatabla 1. El tamaño de partícula, carga superficial, y la eficiencia de encapsulación de ADN plásmido de control y EGFR nanopartículas de gelatina y gelatina tiolada.
De alta resolución C 1S exploraciones de la espectroscopia de electrones para el análisis químico (ESCA) se utilizó para analizar los componentes de la superficie tiolada gelatina (SH-Gel NP), modificado con PEG tiolada gelatina (SH-Gel PEG) y EGFR objetivo de péptidos modificados tiolada gelatina nanopartículas (SH-Gel PEG péptido). Los resultados en la Tabla 2 muestra las intensidades máximas de la CH (hidrocarburos), CO (éter), y C = O (carbonilo) en grupos de 285,0, 286,3 y 288,1 eV, respectivamente. La señal de CO éter se ha incrementado después de PEG modificación y disminución después de la conjugación de péptidos. Mientras que la composición de nitrógeno ha disminuido después de la modificación y el aumento de PEG después de la modificación de péptidos, que confirmó la presencia de EGFR de metas de péptido en las nanopartículas. Análisis ESCA ha confirmado PEG y modificación de la superficie de péptidos.
Espectroscopia de electrones para el análisis químico de la composición de la superficie nanopartículas
| Formulación | C 1s (%) | O 1s (%) | N 1s (%) |
| SH-Gel NP | 59,3 ± 0,8 | 22,9 ± 0,5 | 12,9 ± 0,1 |
| SH-Gel-PEG | 58,2 ± 0,6 | 28,0 ± 1,2 | 9,5 ± 0,7 |
| SH-Gel PEG péptido | 56,7 ± 0,8 | 25,9 ± 0,7 | 12,3 ± 0,6 |
| Formulación | CC (%) | CO, N (%) | C = O (% ) |
| SH-Gel NP | 51.5 | 26.6 | 21.9 |
| SH-Gel-PEG | 17.1 | 63.1 | 19.8 |
| SH-Gel PEG péptido | 33.1 | 42.8 | 24.1 |
Tabla 2. C 1S de alta resolución de las exploraciones de la espectroscopia de electrones para el análisis químico (ESCA)
Con el fin de examinar la estabilidad de encapsulado plásmido, las nanopartículas fueron tratados con proteasa o por separado DNAsa, simuntaneously o secuencialmente. Después de la electroforesis, los resultados en la Figura 2 han demostrado que el plásmido de ADN encapsulado en todas las nanopartículas están protegidos por las nanopartículas y el ADN estable, comparable a la del plásmido desnudo. Estos estudiado han demostrado que todas estas nanopartículas podrían encapsular y preservar la estructura del plásmido después de encapsulación.
/ Files/ftp_upload/3612/3612fig2.jpg "/>
Figura 2. Estabilidad del plásmido de ADN encapsulado en tiolada gelatina, modificado con PEG tiolada gelatina, y EGFR péptido modificado tiolada nanopartículas de gelatina por electroforesis en gel de agarosa. Las nanopartículas fueron tratados con 0,2 mg / ml de la proteasa para probar la encapsulación de ADN plásmido dentro de la matriz de nanopartículas
2. Línea de base la expresión de EGFR en células del cáncer pancreático
Dos líneas de células de páncreas humano adenocarcinoma (PANC-1 y Capan-1) fueron analizados por Western blot para la expresión de EGFR. Adenocarcinoma de ovario humano (SKOV3) y fibroblastos murinos ((NIH-3T3), las células fueron elegidos como controles positivos y negativos, respectivamente. Beta-actina se analizó como el control de las proteínas de carga. Panc-1 en las células han demostrado una mayor expresión de EGFR en comparación con Capan-1 y esta línea celular se utilizó para los siguientes estudios in vitro
3. Citotoxicidad de Control y Surface-Modificado tiolada nanopartículas de gelatina
Con el fin de evaluar la interacción celular de las nanopartículas, los ensayos de citotoxicidad se llevaron a cabo después del tratamiento con nanopartículas. Basándose en los resultados en la Figura 3, el control y las nanopartículas de superficie modificada eran relativamente seguro y biocompatible en células Panc-1, incluso en concentraciones elevadas, con respecto al PEI. Los siguientes estudios se llevaron a cabo con nanopartículas de 1mg/ml.
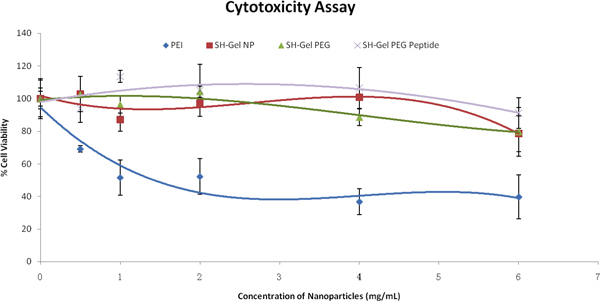
Figura 3. Porcentaje de viabilidad celular en función de las concentraciones de formulación de nanopartículas en células Panc-1 según la evaluación de tetrazolio tinte (MTS) de ensayo
4. Mediada por receptores de las células de captación de células Panc-1
Para confirmar la accesibilidad de la superficie de EGFR de metas de péptidos y mediada por receptores de captación endocítica de las nanopartículas, un sistema diseñado por el etiquetado de cada component con fluorescencia diferentes para la visualización de la absorción de las nanopartículas y el tráfico de las células. Con este sistema de etiquetado, el plásmido de ADN, nanopartículas y núcleo de la célula pudieron ser identificados. El escaneo láser confocal de microscopía de fluorescencia se utilizó para tomar imágenes en diferentes momentos, de 15 minutos a 6 horas. Al comparar las imágenes de las diferentes formulaciones, péptido nanopartículas de gelatina conjugado demostró que la absorción rápida y la liberación del plásmido en 30 minutos. Este resultado demostró que el EGFR péptido conjugado con nanopartículas se sometieron a la endocitosis equipadas con una interacción rápida entre el péptido específico de EGFR y los receptores EGFR en la superficie celular, que era mucho más rápido, en comparación con otras nanopartículas, que fue objeto no específico endocitosis.
Estudio de tráfico celular
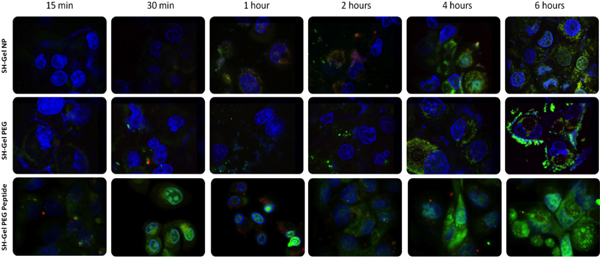
Figura 4. Microscopía de fluorescencia confocal unalysis de ADN encapsulado en la absorción de nanopartículas y el tráfico de células Panc-1. (Rojo = rodamina marcado con nanopartículas, verde = PicoGreen marcado con el plásmido de ADN, y azul = núcleo marcado con DAPI). La potencia del láser fue de 7 veces menos en los últimos cuatro dígitos del panel inferior.
5. Cualitativo y cuantitativo de transfección in vitro con el aumento de proteína verde fluorescente
ELISA en la Figura 5 y el análisis de fluorescencia microscópica en la figura 6 se utilizan para medir la eficiencia de las buenas prácticas agrarias tranfection cualitativa y cuantitativa en células Panc-1 tras la administración de modificar, modificado con PEG y EGFR péptido modificado con nanopartículas de gelatina tiolada. Plásmidos entregado por EGFR nanopartículas resultó en el mayor nivel de expresión de GFP a las 48 horas con respecto a otros controles, incluyendo un complejo de ADN-Lipofectina.
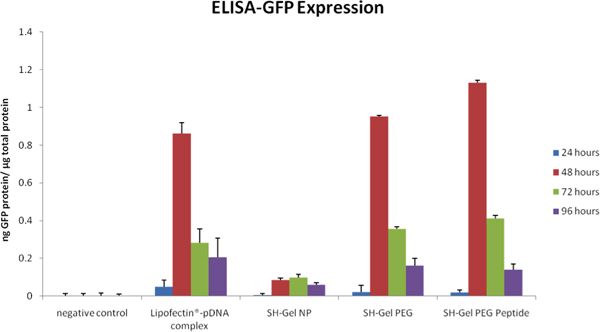
Figura 5. GFP expresión unnalyzed por ELISA se representan en función del tiempo después de la administración del plásmido de ADN en el control de las nanopartículas y EGFR.
Fluorescencia microscópica Análisis para la transfección de GFP
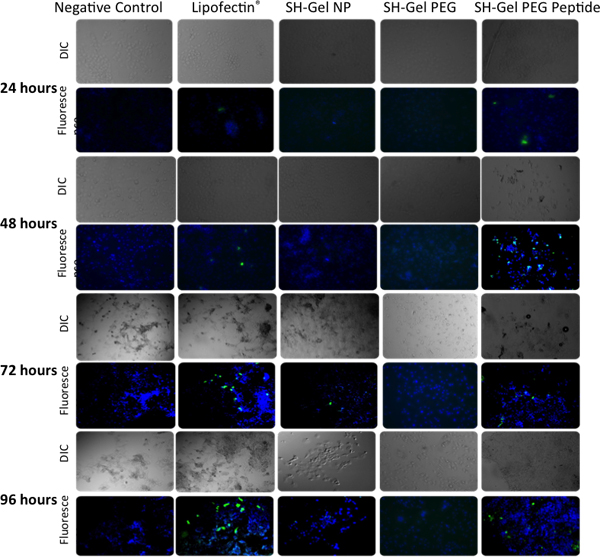
Figura 6. Análisis cualitativo de la expresión de la proteína verde fluorescente en células Panc-1 por microscopía epifluoresence después de 24, 48, 72 y 96 horas después de la transfección con EGFP-N1. Lipofectina-ADN se utilizó como control positivo.
6. En Tranfection Vitro con p53 plásmido en células Panc-1
De tipo salvaje plásmidos p53 PORF-hp53, con EF-1α / HTLV promotor híbrido se obtuvieron de E. coli y encapsulados en nanopartículas para estudiar el efecto terapéutico de apoptosis. Panc-1 células fueron tratadas con partículas durante 6 horas y después de la transfectadas para otros 24, 48, 72 y 96 hora.
Dado que p53 puede inducir apoptosis en las células y con el fin de cumplir esta función, muchos factores de transcripción aguas abajo estarían involucrados y regulados directamente por la expresión de p53 en peso. Entre ellos, Bax, caspasa-3, caspasa-9, DR5, PUMA y Apaf-1 se incrementaron en un reguladas por la expresión de p53 y Bcl-2, mientras que, survivin se redujeron regulado. Con el fin de examinar los niveles de estos factores de transcripción, el ARNm fue extraído de células Panc-1 después de 48 horas después de la transfección y se utiliza para la RT-PCR. Los productos fueron evaluados con la electroforesis en gel y las bandas fueron analizados con ImageJ. Con base en los resultados mostraron en la figura 7, survivin disminuyó significativamente con el tratamiento de EGFR objetivo tiolada nanopartículas de gelatina en comparación con otros tratamientos, no hay cambio evidente se observó en Bcl-2, Bax y la expresión de la caspasa-3, caspasa-9, DR-5, PUMA y Apaf-1increased con el tratamiento de nanopartículas dirigidas.
les/ftp_upload/3612/3612fig7.jpg "/>
Figura 7. Los niveles de mRNA de los factores de aguas abajo de la expresión de p53 en peso se compararon mediante la RT-PCR después de 48 horas después de la transfección.
Después de la transfección en peso de p53, condensación de la cromatina / permeabilidad de la membrana / Dead kit de apoptosis de las células se utilizó para diferenciar las células apoptóticas, células necróticas y células vivas con diferentes tintes. iCys Imaging Research citómetro de CompuCyte (Westwood, MA) fue utilizado para analizar y comparar los niveles de apoptosis después del tratamiento. En comparación con el control negativo, las células apoptóticas veces los cambios se calcularon a cabo y que figuran en la Figura 8. EGFR objetivo tiolada nanopaticles gelatina que mostró la mayor población de células apoptóticas después de después de la transfección. Análisis de la caspasa 3 / 7 actividad también mostró que las nanopartículas de EGFR había internalización rápida y mayor nivel de actividad de apoptosis en células Panc-1.
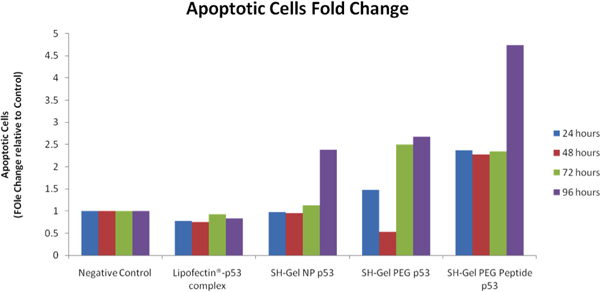
Figura 8. El análisis de citometría de pro-apoptóticos actividad en el control de peso-p53 transfectaron células Panc-1 con imágenes iCys ° citómetro
Discusión
Control y EGFR dirigidos nanopartículas de gelatina tiolada se prepararon con la encapsulación de ADN eficiente y la estabilidad. El tamaño de las partículas de todos estos sistemas estaban en el rango de 150-250 nm de diámetro. El potencial zeta se ha demostrado que este sistema es un sistema un poco negativo. Con el análisis SEM, el tamaño de las nanopartículas eran los mismos con el resultado de Zetasizer. Análisis ESCA pudo confirmar PEG y modificación de la superficie de péptidos.
Western blot mostraron que células Panc-1 tenía una alta expresión los niveles de EGFR y esta línea celular se utilizó para los estudios in vitro. Tanto el control y las nanopartículas de superficie modificada eran relativamente menos citotóxico en células Panc-1 en comparación con el PEI.
Estudios de células tráfico mostró una rápida aceptación y la liberación del plásmido de EGFR nanopartículas en células Panc-1. La entrega de la reportera de ADN con plásmidos que expresan EGFR nanopartículas resultó en niveles más altos deLas buenas prácticas agrarias en relación con otros controles, incluyendo un complejo de ADN-Lipofectina expresión. Con el mismo sistema, la transfección con el plásmido wt-p53 activa la vía apoptótica aguas abajo y la apoptosis inducida rápido en células Panc-1.
Estos resultados preliminares sugieren que el EGFR nanopartículas de gelatina tiolada puede servir como un sistema de ADN parto seguro y eficaz para la terapia génica como tratamiento para el cáncer de páncreas.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este estudio fue apoyado por la Alianza del Instituto Nacional del Cáncer en el Centro de Nanotecnología para el Cáncer para el cáncer Nanotecnología Excelencia (CCNE) de subvención U54-CA151881.
Materiales
| Name | Company | Catalog Number | Comments |
| Type B gelatin, Bloom 225 | Sigma-Aldrich | G9391 | |
| 2-iminothiolane hydrochloride | Sigma-Aldrich | I6256 | |
| pEGFP-N1 plasmid | Elim Biopharm | N/A | |
| pORF-hp53 E. coli | Invitrogen | porf-hp53 | |
| Glyoxal solution (40wt. % in H2O) | Sigma-Aldrich | 128465 | |
| Glycine | Sigma-Aldrich | 410225-250G | |
| QIA filter Plasmid Mega kit | Qiagen | 12281 | |
| Beckman LE 80K Ultracentrifuge | Beckman Coulter Inc. | N/A | |
| FreeZone 6 Liter Console Freeze Dry Systems | Labconco Corp. | 7753020 | |
| mPEG-SCM, MW 2,000 Da | Laysan Bio Inc. | mPEG-SCM-2K-1g | |
| MAL-PEG-SCM, MW 2,000 Da | Jenkem Technology | A5001-1 | |
| Zetasizer Nano | Malvern Instruments | Zetasizer Nano ZS | |
| Hitachi 4800 field emission scanning electron microscope | Hitachi | S-4800 UHR FE-SEM | |
| Quant-iT PicoGreen dsDNA Reagent and Kits | Invitrogen | P7589 | |
| Lipofectin Transfection Reagent | Invitrogen | 18292011 | |
| DMEM | Mediatech, Inc. | 10 013 CM | |
| RPMI | Mediatech, Inc. | 50 020 PB | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific, Inc. | 23225 | |
| iBlot Dry Blotting System | Invitrogen | IB1001 | |
| XCellSureLock Mini-Cell and XCell II Blot Module Kit CE Mark | Invitrogen | EI0002 | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific, Inc. | 32109 | |
| Kodak Digital X-ray Specimen (DXS) System | Kodak | N/A | |
| CellTiter 96 AQueous One Solution Cell Proliferation Assay (MTS) | Promega Corp. | G3580 | |
| BioTek SynergyHT plate reader | BioTek | N/A | |
| Nanodrop 2000 | Thermo Fisher Scientific, Inc. | N/A | |
| One-step RT-PCR kit | Qiagen | 210212 | |
| Chromatin Condensation/Membrane Permeability/Dead Cell Apoptosis Kit | Invitrogen | V23201 | |
| Apo-ONE Homogeneous Caspase-3/7 Assay kit | Promega Corp. | G7790 | |
| Hybaid PCR Sprint Thermal Cycler | Thermo Fisher Scientific, Inc. | N/A | |
| EGF Receptor Antibody | Cell Signaling Technology | 2232 | |
| β-Actin Antibody | Cell Signaling Technology | 4967 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Mouse Monoclonal GFP Antibody | Novus Biologicals | NB600-597 | |
| Goat Polyclonal GFP antibody (Alkaline Phosphatase) | Novus Biologicals | NB600-1502 | |
| Phosphatase Substrate Kit | Thermo Fisher Scientific, Inc. | 37620 |
Referencias
- Vimalachandran, D. Genetics and prevention of pancreatic cancer. Cancer. Control. 11, 6-14 (2004).
- Kommareddy, S., Amiji, M. Preparation and evaluation of thiol-modified gelatin nanoparticles for intracellular DNA delivery in response to glutathione. Bioconjug. Chem. 16, 1423-1432 (2005).
- Kommareddy, S., Amiji, M. Poly(ethylene glycol)-modified thiolated gelatin nanoparticles for glutathione-responsive intracellular DNA delivery. Nanomedicine. 3, 32-42 (2007).
- Kommareddy, S., Amiji, M. Antiangiogenic gene therapy with systemically administered sFlt-1 plasmid DNA in engineered gelatin-based nanovectors. Cancer. Gene. Ther. 14, 488-498 (2007).
- Kommareddy, S., Amiji, M. Biodistribution and pharmacokinetic analysis of long-circulating thiolated gelatin nanoparticles following systemic administration in breast cancer-bearing mice. J. Pharm. Sci. 96, 397-407 (2007).
- Kaul, G., Amiji, M. Tumor-targeted gene delivery using poly(ethylene glycol)-modified gelatin nanoparticles: in vitro and in vivo studies. Pharm. Res. 22, 951-961 (2005).
- Bardeesy, N., DePinho, R. A. Pancreatic cancer biology and genetics. Nat. Rev. Cancer. 2, 897-909 (2002).
- Li, Z. Identification and characterization of a novel peptide ligand of epidermal growth factor receptor for targeted delivery of therapeutics. FASEB. J. 19, 1978-1985 (2005).
- McCormick, F. Cancer gene therapy: fringe or cutting edge. Nat. Rev. Cancer. 1, 130-141 (2001).
- Green, D. R., Kroemer, G. Cytoplasmic functions of the tumour suppressor p53. Nature. 458, 1127-1130 (2009).
- Barton, C. M. Abnormalities of the p53 tumour suppressor gene in human pancreatic cancer. Br. J. Cancer. 64, 1076-1082 (1991).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados