Method Article
Microarrays de polímeros de alto rendimiento para el descubrimiento de Biomateriales
En este artículo
Resumen
Una descripción de la formación de un microarray de polímero utilizando una técnica de fotopolimerización en el chip. La caracterización rendimiento de alta superficie mediante microscopía de fuerza atómica, las mediciones de ángulo de contacto del agua, de rayos X y espectroscopía de fotoelectrones de tiempo de vuelo espectrometría de masa iónica secundaria y un ensayo de adhesión celular también se describe.
Resumen
La mezcla es una operación unitaria que combina dos o más componentes en una mezcla homogénea. Este trabajo consiste en mezclar dos corrientes viscosas líquidas utilizando un mezclador estático en línea. El mezclador es un diseño en dos y se recombinan-que emplea flujo de cizallamiento y extensionales para aumentar el contacto interfacial entre los componentes. Un prototipo dividida y se recombinan-(SAR) mezclador se construyó mediante la alineación de una serie de finas cortadas con láser de poli (metacrilato de metilo) (PMMA) placas mantiene en su lugar en un tubo de PVC. Mezcla en este dispositivo se ilustra en la fotografía en la figura. 1. Colorante rojo se añadió a una porción del fluido de prueba y se utiliza como el componente minoritario que se mezcla con el mayor (sin teñir) componente. En la entrada de la mezcladora, la capa de inyección de líquido trazador se divide en dos capas a medida que fluye a través de la sección de mezcla. En cada sección de mezcla posterior, el número de capas horizontales se duplica. En última instancia, la única corriente de colorante se dispersa uniformemente Throughout la sección transversal del dispositivo.
El uso de un fluido de prueba no newtoniano de 0,2% de Carbopol y un fluido trazador dopado de composición similar, la mezcla en la unidad se visualizaron usando imágenes por resonancia magnética (MRI). La RM es una sonda experimental muy potente de química molecular y el medio ambiente físico, así como la estructura de la muestra en las escalas de longitud de micras a centímetros. Esta sensibilidad ha dado lugar a una amplia aplicación de estas técnicas para caracterizar propiedades físicas, químicas y / o biológicas de materiales que van desde humanos a los alimentos a los medios de comunicación poroso 1, 2. El equipo y las condiciones utilizadas aquí son adecuadas para líquidos de formación de imágenes que contienen cantidades sustanciales de RMN 1 H móviles tales como agua ordinaria y líquidos orgánicos incluyendo aceites. Tradicionalmente MRI ha utilizado súper imanes conductores que no son adecuados para ambientes industriales y no portátil dentro de un laboratorio (Fig. 2). Los recientes avances in la tecnología de imanes han permitido la construcción de grandes volúmenes imanes industrialmente compatibles adecuados para flujos de proceso de imagen. Aquí, MRI proporciona espacialmente resueltas concentraciones de los componentes en diferentes posiciones axiales durante el proceso de mezcla. Este documento de trabajo en tiempo real de la mezcla de fluidos altamente viscosos vía distributiva mezcla con una aplicación para productos de cuidado personal.
Protocolo
1. Preparación de fondo de bajo ensuciamiento
- Pesar 2 g de poli (metacrilato de hidroxietilo) (pHEMA) (Sigma - cultivo de células de prueba) en un tubo de centrífuga de 50 ml. Disolver en 50 ml de 95% (v / v) de etanol en agua. Esto suele tardar de 24 horas de tratamiento con ultrasonidos.
- Dip-capa de epoxi-funcional portaobjetos de vidrio (Genetix) con la solución de pHEMA. Los grupos epoxi rápidamente se forman enlaces covalentes con el recubrimiento pHEMA. Recubrimiento por inmersión se consigue sujetando el portaobjetos de vidrio con unas pinzas y sumergir el portaobjetos en la solución. Típicamente 5 mm de la corredera se deja sin recubrir, que es útil para la orientación de la diapositiva y también puede actuar como un control positivo como una superficie adherente. El portaobjetos se retira entonces de la solución de pHEMA durante un período de 1 s, se invierte y se deja secar en una posición casi horizontal por 10 min antes de colocar en un soporte de diapositivas.
- Los portaobjetos recubiertos PHEMA se dejan en condiciones atmosféricas durante 1 semana para permitir la evaporación completa del tél disolvente.
2. Preparación de la solución de monómero
- Pesar 120 mg del fotoiniciador 2,2-dimetoxi-2-fenil acetofenona y añade a 3 ml de dimetilformamida (DMF) para hacer una solución de fotoiniciador 4% (w / v). Esto se hace mejor fresco antes de cada ciclo de impresión, por lo que la masa y el volumen de la solución se puede variar para adaptarse a la cantidad de solución de fotoiniciador se requiere. La solución es estable hasta un mes.
- Soluciones de monómero se hacen añadiendo 1 parte de la solución de fotoiniciador a 3 partes del monómero puro. Esto se consigue mediante pipeteo 5 l de solución de fotoiniciador y 15 l de monómero en una placa de fuente 384 también. Un volumen total de 20 l es ideal para la formación de manchas. Los mayores volúmenes requieren adicional secante antes de manchas uniformes pueden ser producidas. Los volúmenes más pequeños puede resultar en carga incompleta de la clavija.
- Este método está actualmente limitado a la utilización de monómeros de acrilato / metacrilato que son solubles en DMF por virtue de éstos que son las únicas combinaciones que se han explorado; acrilamidas y otros disolventes es probable que sean susceptibles al proceso de impresión. Para lograr la concentración de monómero sugerido (75% w / w) monómeros líquidos también son necesarias, aunque las concentraciones más bajas de monómero puede ser utilizado para monómeros sólidos (la concentración de monómero reducido no parece alterar negativamente la química de la superficie del polímero resultante sin embargo, es probable que el peso molecular y temperatura de transición vítrea es alterado). Monómeros altamente volátiles también son difíciles de usar debido a la rápida evaporación del monómero antes de la etapa de curado UV cuando la polimerización. Dependiendo del número de soluciones de monómero una carrera puede llegar a tardar hasta 6 horas y hacia el final de los monómeros volátiles de ejecución se habrá evaporado desde la placa de fuente. Uso de monómeros volátiles puede lograrse mediante enfriamiento de la etapa de impresión y usando tiradas cortas solamente.
- Con la excepción de unos pocos monómeros hidrófilos altamentetal como poli (etileno glicol) acrilato, la disolución de los puntos de polímero resultantes en tampones acuosos no se ha observado, por lo tanto, el uso de un monómero de reticulación no es necesario, aunque no está excluida.
3. Polímero de microarrays formación
El procedimiento típico para la formación de polímero microarray se representa esquemáticamente en la figura 1.
- Formación Microarray se consigue usando un robot de contacto (BioDot) utilizando una etapa de XYZ (Figura 2). Pernos ranurados de 220 m de diámetro se utilizan (Arrayit 96B). Todos los pasadores se deben limpiar por ultrasonidos en diclorometano durante 10 minutos antes de la tirada de impresión y del mismo modo el soporte de pasador también debería ser limpiado.
- Clavijas se cargan en el soporte, secante y se desliza la matriz se han cargado y luego toda la cámara se llena con argón para reducir el nivel de oxígeno por debajo de 2000 ppm, que es suficientemente bajo para evitar la extinción de los radicales de polimerización por el oxígeno. La humedad es maintained entre un 30-40%. Incluyendo la humedad permite la pHEMA a hincharse para permitir que el polímero formado a interpenetrarse la capa de PHEMA y convertirse físicamente atrapado a la superficie 2.
- La tirada se inicia. Cada ciclo consta de:
- Carga de la muestra de la placa de la fuente. Los pasadores se bajan a las soluciones a una velocidad de 25 mm / s, realizada en solución de 2,5 s y entonces se retiró a una velocidad de 25 mm / s (Figura 2).
- Pasadores deben ser borrados antes de imprimir para eliminar la solución de monómero desde el exterior de la clavija. Posteriormente entrega monómero se produce a partir de la parte quilled del pasador para lograr la formación de manchas consistente. La secuencia secante utilizado consta de 33 contactos con un portaobjetos de vidrio limpio. Para las cuatro primeras posiciones del número de contactos es de 10, 5, 4 y 3 respectivamente. Los siguientes cuatro posiciones 2 contactos se realizan y en los últimos 3 posiciones 1 contacto se hace. Tiempo de contacto total para cada contacto es de 10 ms y el enfoque y la velocidad de retirada es de 175mm / s. En este punto las manchas formadas deben tener una forma consistente y geometría. El fracaso en este punto indica pins sucias o contaminantes de polvo en las soluciones de monómero.
- Las soluciones de monómero se imprimen sobre los portaobjetos de vidrio recubiertos PHEMA (Figura 2). Uno se hace contacto por punto en un movimiento de pasador de 175 mm / s y el tiempo de contacto de 10 ms, que dependiendo de la viscosidad y la energía superficial de la solución de monómero da un diámetro del punto medio de 400 micras. Típicamente 3 replicar arrays se imprimen en cada portaobjetos de vidrio y un total de 10 muestras se imprimen en una sola corrida. Esto equivale a 30 puntos por ciclo.
- Los clavos se lavó en DMF. 2,5 l de DMF fresco se proporciona para la ejecución de lavado completo. Los clavos se lavó en un baño de flujo con agitación.
- Concurrente con el lavado, los portaobjetos recién impresas son irradiadas con un UV de onda corta (365 nm) fuente a una densidad de 30 mV / cm 2 para la duración del período de lavado que dura 30 s.
- Laespués de todas las soluciones de monómero se imprimen las matrices son irradiadas con UV (365 nm) para 10 min adicionales.
- Las matrices recién impresos se mantiene a baja presión (<50 mTorr) durante 1 semana para eliminar el monómero no polimerizado y disolvente.
4. Alto rendimiento caracterización de la superficie (HTSC)
Un esquema general de las técnicas de HTSC se muestra en la Figura 3. Central para el enfoque automatizado, de alto rendimiento es la alineación de los microarrays de polímero con el aparato de caracterización. En todos los casos, esto se logra utilizando una cámara que ofrece una vista superior de la matriz. Inicialmente, la matriz se hace girar para alinearse con el movimiento XY de la etapa. Una mancha esquina de la matriz se encuentra y designó coordenadas específicas. La posición de cada punto de polímero se puede predecir usando las dimensiones de la matriz.
- Ángulo de contacto del agua (WCA) mediciones
- WCA mediciones se realizan usando el método de la gota sésil en unautomatizado Krüss DSA 100 instrumentos. Una sola gota de agua con un volumen de ~ 400 pL se dispensa utilizando un cabezal de impresión piezo impulsado en cada punto de polímero. El diámetro de una mancha de polímero es típicamente de 300 micras y el diámetro de la base de la gotita de agua en el lugar de polímero es típicamente 100 m, por lo tanto, sólo una medición se puede conseguir por mancha polímero.
- Una etapa XY permite el posicionamiento automático de cada punto de polímero bajo el cabezal de impresión 7. Esto se consigue utilizando una cámara situada encima de la muestra que proporciona una vista superior de la matriz. Inicialmente, la posición de la cámara debe ser ajustada para alinear la dispensación de la gotita de agua en el centro de la vista de la cámara y, a continuación la matriz se puede alinear el cabezal de impresión.
- Una cámara de alta velocidad registra el perfil lateral de la gotita al chocar contra la superficie y evaporando posteriormente. El marco que captura el impacto inicial de gota se utiliza para medir el ángulo de contacto. Un círculo está montado en la profi gotale y el ángulo de contacto determinado subsecuentemente.
- La hora del vuelo espectrometría de masa iónica secundaria (TOF-SIMS)
- La muestra se cargó en el escenario. Esto implica en primer lugar que reviste el escenario con lámina de Al limpio, que ayuda con compensación de carga, y luego sosteniendo el carro en su lugar mediante el uso de fichas de tornillo de metal.
- Etapa de muestra se coloca en la cámara de transferencia de la ToF-SIMS y les permite extraer hacia abajo hasta 1,6 x 10 -6 mbar. La muestra se transfiere entonces a la cámara de análisis principal, que tiene típicamente una presión de vacío de 1,0 x 10 -8 mbar.
- TOF-SIMS mediciones se llevan a cabo utilizando un instrumento ION-TOF IV maneja mediante un monoisotópico Bi 3 + fuente de iones primario operado a 25 kV en modo "agrupados". Un haz pulsado 1 pA ion primario se rastered sobre el área de análisis, con iones secundarios tanto positivos como negativos recogidos de un área de 100 x 100 m de cada punto de polímero en el microarray para una 10-second tiempo de adquisición. Masas de iones se determinaron utilizando una alta resolución de Tiempo de Vuelo analizador permitiendo asignación masa exacta. La resolución de masa típico (en m / z 41) era un poco más de 6000. Electrones de baja energía (20 eV) se utiliza para compensar la carga de la superficie causada por el haz de iones con carga positiva primaria en las superficies aislantes 8.
- Microscopía de fuerza atómica (AFM)
- Un gran etapa AFM con una etapa automatizada se requiere para el análisis de las matrices sobre el portaobjetos de vidrio. Un microscopio de dimensiones o ICON es ideal para este propósito.
- La muestra se coloca en el escenario y la posición del escenario se aloja a la esquina superior derecha de la matriz.
- La posición de la esquina inferior izquierda de la matriz se encuentra, lo que permite que la posición de todos los otros puntos para ser interpolados.
- Una lista de posición se genera y se introduce en la función de auto-muestreo del software.
- Mediciones de AFM se realizan usando un instrumento Nanoscope 3000A en el aprovechamiento de mode. Puntas de silicio con una frecuencia de resonancia de aproximadamente 300 kHz y una fuerza constante de 40 N / m se utilizan (Tap300Al, Sensores de presupuesto). Regiones 5x5 mu m del polímero se miden 9.
- La raíz cuadrada media (RMS) de rugosidad se mide a través de esta región para cada imagen usando el software de procesamiento por lotes SPIP. Cada imagen está inicialmente aplanada antes de las mediciones de rugosidad.
- Todas las imágenes requieren una visualización manual para identificar artefactos de formación de imágenes que pueden necesitar ser retirado de mediciones de rugosidad. Durante esta etapa de imágenes también pueden clasificarse en función de características de superficie común 9.
- Espectroscopía de rayos X de fotoelectrones (XPS)
- Un microarray de diapositivas está fijado a una barra de muestra usando cinta de doble cara y posteriormente cargado en la cámara de muestra de un instrumento Kratos Axis Ultra XPS.
- Entra en la cámara de muestra y esperar hasta que llegue a una presión inferior a 10 -8 Torr.
- La operación apropiadaparámetros, tales como un monocromado fuente de rayos X (Al, 1486,6 eV), ánodo de potencial y la corriente (10 kV y 15 mA), tamaño de la abertura (110μm), la energía de paso (80 eV para escaneado de ancho y 20 eV para exploración de alta resolución) están seleccionado. La fuente de rayos X se enfoca utilizando dos esquinas opuestas de la micromatriz y la optimización de la señal de oxígeno de la muestra. Las posiciones X e Y de los puntos individuales se determina y registra como una lista de posiciones.
- Un gráfico de programa está escrito y luego ejecutar para la adquisición de datos, incluyendo las exploraciones de ancho y escaneos de alta resolución para elementos específicos.
- La espectroscopia Raman
- Los espectros Raman se toman para cada punto de polímero usando un microscopio Raman LabRAM HR (Horiba Jobin Yvon). Inicialmente, la señal Raman es calibrado utilizando una oblea de silicio y el desplazamiento Raman de Si a 520,7 cm -1.
- La muestra se coloca entonces en la etapa y el foco del láser (longitud de onda = 523 nm) se ajusta para maximizar el desplazamiento Raman CHa 2950 cm -1.
- La posición del centro del punto de la parte superior izquierda en el microarray se establece como el origen y un mapa de la micromatriz se configura utilizando la función de matriz en el software labRAM HR.
- 10 espectros se adquieren de forma acumulativa para cada muestra con un tiempo de irradiación de 0,5 s.
5. Ensayo bacteriano
La matriz puede estar expuesto a muchas diferentes ensayos biológicos, incluyendo la conexión y la proliferación de las células madre, otros tipos de células y bacterias 3,10,4. Aquí se describe un ensayo de unión bacteriana, que se muestra esquemáticamente en la Figura 4.
- Una cepa bacteriana transformada con GFP expresada plásmido se cultivaron durante la noche a 37 ° C en 10 ml de medio LB en un tubo Falcon de 50 ml con agitación a 200 rpm.
- La DO 600 del cultivo bacteriano se mide y se cultivo durante la noche suficiente se inocula en 15 ml de medio RPMI-1640 medio definido para dar como resultadoen una final OD 600 de 0,01.
- Las matrices son prelavados en agua destilada esterilizada durante 10 minutos para eliminar componentes solubles de las matrices (monómero sin polimerizar, oligómeros y disolvente)
- Diapositivas lavados de la matriz se coloca en una placa de Petri limpia y esteriliza UV durante 10 min.
- Una diapositiva con la matriz se coloca en una placa de Petri y 15 ml de los inoculados RMPI-1640 multimedia se añade. Al mismo tiempo otro portaobjetos se coloca en una placa de Petri y se incubaron con no innoculatd RPMI-1640 como un control.
- Los portaobjetos se incubaron a 37 ° C durante 72 horas con agitación a 60 rpm.
- Los portaobjetos se lavaron dos veces con 15 ml de PBS estéril.
- Los portaobjetos se lavaron dos veces con 15 ml de agua destilada estéril.
- Los portaobjetos son secados al aire.
- Los portaobjetos se formó una imagen usando un escáner GenePix autocargador 4200AL (Molecular Devices, EE.UU.) con un láser de excitación 488 nm y filtro de emisión estándar azul (510-560nm). Un representante polímero imagen autofluorescencia esse muestra en la Figura 2. Esto debe hacerse tan pronto como sea posible para evitar el deterioro de la GFP. Si esto no es posible, las células deben ser sometidos a la fijación. Además, la inclusión de apropiados controles positivos con una respuesta bacteriana conocida es imprescindible para poder normalizar los resultados y permitir experimentos realizados en días diferentes a ser cuantitativamente comparable. La intensidad total de fluorescencia de las manchas de polímero se adquiere utilizando GenePix Pro 6 software (Molecular Devices, EE.UU.). Esto se hace para los dos carros incubados con bacterias y los medios de comunicación sólo. Para encontrar la fluorescencia debido al crecimiento de las bacterias de la fluorescencia en el medio de control se resta de la fluorescencia medida en el portaobjetos se incubaron con bacterias.
- Además, los portaobjetos se tiñeron por 20 mM SYTO17 tinte de ácido nucleico (Invitrogen, Reino Unido) a temperatura ambiente durante 30 minutos y se formó una imagen usando un Carl Zeiss LSM 700 Microscopio de barrido láser con ZEN 2009 software de imagen (Carl Zeiss, Alemania). La cobertura de las bacteriasen la superficie se determina utilizando la imagen de código abierto J 1,44 software (Instituto Nacional de Salud, EE.UU.).
6. Los resultados representativos
Las condiciones de impresión se han optimizado para imprimir los microarrays de la más alta calidad de polímero. La humedad debe mantenerse entre 30-40%. La exfoliación de las manchas de polímero en medios acuosos se observó con frecuencia para arrays impresos a una humedad por debajo de 30%, lo que sugiere que esta humedad es insuficiente para hinchar la capa de PHEMA y permitir el atrapamiento físico del polímero al sustrato. La humedad se puede aumentar posterior de modificar el diámetro de los puntos de polímero, pero esto depende de la química del monómero. Por ejemplo, en volúmenes iguales de solución de polimerización se imprimieron y como la humedad se aumentó de 40 a 80% del diámetro de la mancha se redujo de 430 micras a 370 micras para un monómero que contiene un glicol de etileno hidrófilo mientras fracción igual volumen de un moNomer que contiene un carbono alifático hidrofóbico estructura de anillo el diámetro de punto aumentó de 290 micras a 350 micras (Figura 5).
El grado de polimerización puede controlarse utilizando la espectroscopia Raman para medir el C = C desplazamiento Raman que se detecta en 1640 cm -1, que debe ser normalizado con el cambio de C = O Raman a 1720 cm -1. Los espectros Raman se midió para manchas de polímero polimerizado por exposición UV variada (Figura 6). El C = C: C = O ratio disminuyó a medida que la exposición UV aumentó de 0 a 50 s, después de lo cual no disminución adicional en el C = C: C = O ratio se observó con irradiación UV adicional (Figura 6). Los espectros Raman se midieron también para los puntos de polímero obtenidas a nivel variado O 2 y el C = C 7A cambio Raman se observó como el nivel de O 2 se redujo a 2000 ppm, sin embargo no se observó una mayor reducción de un nivel de O 2 por debajo de este (figura ). La espectroscopía Raman también demostró la capacidad de la extracción de vacío step para eliminar el monómero no polimerizado. Antes de la extracción de vacío del C = C desplazamiento Raman fue mayor para el polímero polimerizado a 3300 ppm en comparación con 2000 ppm (Figura 7A), sin embargo, después de la extracción de vacío de la altura del desplazamiento Raman es indistinguible (Figura 7B), lo que sugiere todo el monómero no polimerizado se ha eliminado durante la etapa de extracción de vacío. En resumen, las condiciones de polimerización incluyen una humedad del 30-40%, la exposición UV superior a 50 s en un nivel por debajo de O 2 2000 ppm con una etapa de extracción de vacío después de la impresión durante 7 días.
Después de la extracción de impresión y vacío el éxito de la polimerización de los puntos de polímero puede ser evaluada por microscopía de luz simple para identificar y morfologías anómalas terreno. Típicamente, los spots deberán aparecer circular y uniforme, como se muestra en la Figura 8 en el lado izquierdo. La causa probable de que un cambio en la geometría es un pasador dañado o sucio. Para un pequeño número de combinaciones de monómero que hemos observado manchas deformes, por correoEJEMPLO una ubicación céntrica con un satélite de pequeños puntos, que se muestran en la Figura 8 a la derecha, o una forma de huevo frito, donde hay un lugar central en la parte superior de los grandes, planas spot. Esto puede ser causado por la separación de fases antes de la impresión en relación con las diferencias en la tensión de la viscosidad, la hidrofilia, la volatilidad o la superficie de los monómeros y sugiere que la combinación de monómero no es compatible con este formato. Mapeo químico adicional de las manchas de polímero mediante técnicas tales como ToF-SIMS es también un paso de control de calidad importante y necesario a veces para determinar la distribución de composiciones químicas de los materiales a través de las manchas y la matriz. Esta técnica puede identificar excesiva difusión de algunos materiales que no son visibles por microscopía de luz y determinar la separación de fases dentro de los puntos individuales de polímero.

Figura 1. Esquemático que representa las diversas etapas implicadas en la formación de un poLymer lugar.
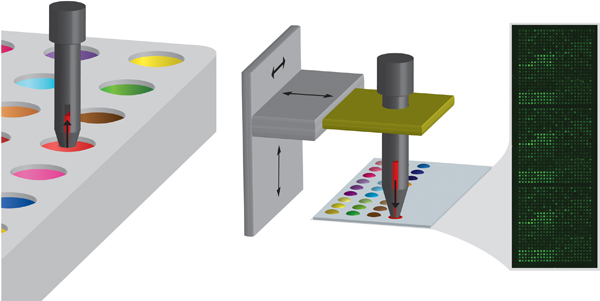
Figura 2. Esquema de la metodología de impresión pasador que implica inicialmente la carga del pasador con el monómero en una placa de fuente y luego depositar el monómero sobre un sustrato mediante la toma de contacto. El pasador está controlado por un brazo robótico XYZ. El recuadro muestra una imagen típica de la autofluorescencia de una matriz después de la producción.

Figura 3. Esquema destacando las técnicas asociadas con HTSC y también bioensayos aplicados al estudio de microarrays de polímero.

Figura 4. Esquema del ensayo de unión bacteriana.
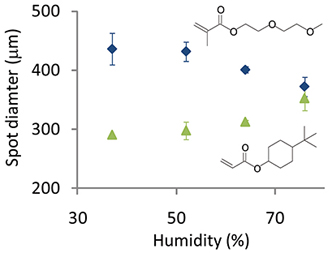
Figura 5. Pdiámetro olymer planas impresas en humedad variada por dos monómeros diferentes: 4-terc-butilciclohexilo y acrilato de di (etilenglicol) etil éter metacrilato.
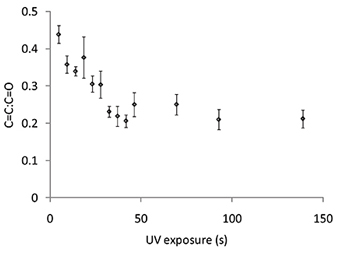
Figura 6. La relación de la intensidad Raman para el C = C desplazamiento Raman a 1640 cm -1 y el C = O de desplazamiento Raman de 1720 cm -1 de manchas de polímero de acrilato de 4-terc-butilciclohexilo con la exposición UV variada. Las barras de error igual a una desviación estándar (n = 3).
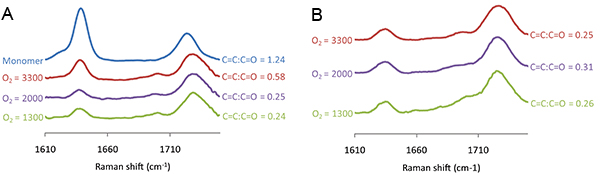
Figura 7. Los espectros Raman medido para las manchas de polímero de acrilato de 4-terc-butilciclohexilo impreso en variados niveles de O 2, se indica a la izquierda de cada espectro, antes (A) y (B) después de la extracción al vacío. La relación de la intensidad Raman para el C = C desplazamiento Raman a 1640 cm -1 y el C = O de desplazamiento Raman de 1720 cm -1 se muestra a la derecha de cada espectro.

Figura 8. Una imagen de microscopía de luz de dos puntos de polímeros. El punto en la izquierda muestra un lugar bien formado, mientras que el lugar de la derecha es un ejemplo de un lugar que contiene una distribución muy desigual de monómero. La barra de escala es de 500 m.
Discusión
Microarrays de polímero han sido utilizados con éxito para el descubrimiento de nuevos materiales por cientos de detección de la novela de polímero en un ensayo biológico e identificar 'hit' materiales que posteriormente pueden ampliarse a dispositivos útiles. En este caso, la caracterización de la superficie se describe se puede emplear con posterioridad a la prueba biológica y exclusivamente en el 'golpe' materiales para estudiar los materiales con mayor detalle. Esta estrategia puede ser de interés si HTSC no está disponible para el experimentador emplear este enfoque. Sin embargo, para utilizar completamente microarrays de polímero para estudiar las interacciones de material biológico-toda la gama de cientos de materiales deben ser analizados antes de los ensayos biológicos usando metodologías HTSC, que posteriormente se pueden utilizar para observar generales estructura-función de las tendencias.
La impresión por contacto se apoya en el perno de metal se deslice hacia arriba y hacia abajo libremente dentro del soporte de pasador. Limpieza y Pin pin titular es lo más importante es asegurarse de printing se produce con éxito y debe llevarse a cabo con rigor. Antes de comenzar una impresión ejecutar el movimiento apropiado de la clavija dentro del soporte de pasador se puede probar mediante la realización de una marcha en seco, sin monómeros presentes. La etapa de limpieza debe continuar hasta que el movimiento se consigue pin reproduciblemente.
Pensamiento considerable debe ir en el diseño de la mezcla de monómeros. Con el fin de producir fácilmente una biblioteca combinatoria de polímeros, cientos de copolímeros se forman mezclando una monómeros pocos en diferentes proporciones. Típicamente producir 576 bibliotecas miembros ya que esto forma una matriz 24 x 24, que es adecuada para la geometría de un portaobjetos de vidrio. Con el fin de producir una biblioteca combinatoria que explora el espacio más combinatoria el método más sencillo es mezclar 24 monómeros pairwise en la relación 2:1. Alternativamente, la inclusión de los gradientes de composición dentro de la matriz son útiles para permitir las observaciones de las tendencias, lo que permite composiciones óptimas de monómero a ser determined. Como un ejemplo de este 22 monómeros se pueden utilizar como primer componente en una mezcla de co-monómero que se diluyó secuencialmente con 1 de 6 segundos componentes. Si 5 diluciones se utilizan, por ejemplo mezclando los componentes primero y segundo en proporciones de 90:10, 75:25, 50:50, 25:75 y 10:90, esto resultaría en 488 soluciones de copolímero únicas. Para llevar el total a 576, repeticiones de los homopolímeros de los monómeros usados pueden ser introducidos, que a menudo es una muestra de referencia importante. 576 soluciones de monómero debe ser dispensado en 2 384 placas de pocillos. Para la programación del robot que es más fácil tener dos placas idénticas en términos de la posición de los monómeros, por lo tanto, las soluciones de monómero se debe dividir de manera uniforme entre las dos placas.
Una cantidad significativa de tiempo se pueden guardar en la preparación de las placas de código mediante el uso de pipetas multicanal, y el diseño de placas de origen debe ser determinado con el fin de explotar el uso de las pipetas multicanal.
Para lograr HTSC automatizado de las matrices de la posición de la mancha debe ser correctamente alineado con el aparato de caracterización. Normalmente, el paso de una serie de acrilato es 500-1000 micras y el diámetro del punto de polímero es de 300 m. La mayoría de las etapas XY tienen una resolución por debajo de 10 micras, con lo que la tolerancia es adecuada para el aparato de caracterización de la superficie de forma fiable acceder a las posiciones de la matriz una vez que las dimensiones correctas se han introducido para el software de posicionamiento de la muestra. La limitación para el posicionamiento automatizado es, de hecho, la precisión de la impresión de la matriz. Para garantizar la precisión de la impresión es importante para evitar el movimiento del sustrato en la etapa de impresión ya sea mediante una succión o abrazaderas de resorte, junto con las dimensiones apropiadas de diapositivas (nota que tanto un tamaño de EE.UU. y UE portaobjetos estándar existen).
ToF-SIMS es una técnica extremadamente sensible superficie que se observó ninguna contaminación en muestras. Así, máximo cuidado debe tomarsepara evitar el contacto con la superficie. Las muestras sólo deben ser manipulados, pero la superficie de interés no en contacto con, con guantes limpios (preferiblemente polietileno) y con pinzas recién limpiadas. Por lo general se lava con cloroformo y hexano. Almacenamiento de las muestras antes de las mediciones se realiza mejor en un soporte de muestras que contiene las diapositivas, aparte, por ejemplo la. 5 soporte de diapositivas o 20 soporte de diapositivas
Las matrices están diseñados específicamente para ser compatible con muchos formatos de ensayos biológicos y lecturas, es decir, el sustrato utilizado es un portaobjetos de microscopio ideal para escáneres de fluorescencia y microscopios de luz. Esto significa que el formato es muy adecuado para explorar muchos materiales biológicos interacciones. Además, el formato permite a cientos de materiales que se proyectarán en paralelo. Esto permite que muchos materiales que se proyectarán más que los métodos convencionales mediante el cual es monitoreada cada nuevo material química individualmente. El mayor alcance de las interacciones biológicas materiales permitens para la elucidación de los mecanismos de las interacciones superficiales biológicas, así como encontrar el material óptimo para una aplicación dada.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
La financiación de la Wellcome Trust es amablemente reconocido (número de concesión 085245/Z/08/Z). La nanotecnología Nottingham y el Centro de Nanociencia es amablemente reconocido por dar acceso al sistema Raman y de la Agencia de Desarrollo de East Midlands para la financiación de este equipo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Catálogo / Número de modelo | |
| Diapositivas epoxi | Genetix | K2652 | |
| Póngase en contacto con impresora | BioDot | XYZ3060 Plataforma | |
| Perno del metal | Arrayit | 946MP6B | |
| TOF-SIMS instrumento | ION-TOF | ||
| XPS instrumento | Kratos | ||
| WCA aparato | Krüss | DSA 100 | |
| AFM | Bruker | Dimension Icono | |
| RPMI-1640 medio de cultivo celular | Sigma-Aldrich | R0883 | |
| SYTO17 | Invitrogen | S-7579 |
Referencias
- Hook, A. L., Anderson, D. G., Langer, R., Williams, P., Davies, M. C., Alexander, M. R. High throughput methods applied in biomaterial development and discovery. Biomaterials. 31, 187-198 (2010).
- Anderson, D. G., Levenberg, S., Langer, R. Nanoliter-scale synthesis of arrayed biomaterials and application to human embryonic stem cells. Nature Biotechnology. 22, 863-866 (2004).
- Mei, Y., Saha, K., Bogatyrev, S. R., Yang, J., Hook, A. L., Kalcioglu, Z. I., Cho, S. W., Mitalipova, M., Pyzocha, N., Rojas, F., Van Vliet, K. J., Davies, M. C., Alexander, M. R., Langer, R., Jaenisch, R., Anderson, D. G. Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells. Nature Materials. 9, 768-778 (2010).
- Pernagallo, S., Wu, M., Gallagher, M. P., Bradley, M. Colonising new frontiers-microarrays reveal biofilm modulating polymers. Journal of Materials Chemistry. 21, 96-101 (2011).
- Yang, J., Mei, Y., Hook, A. L., Taylor, M., Urquhart, A. J., Bogatyrev, S. R., Langer, R., Anderson, D. G., Davies, M. C., Alexander, M. R. Polymer surface functionalities that control human embryoid body cell adhesion revealed by high throughput surface characterization of combinatorial material microarrays. Biomaterials. 31, 8827-8838 (2010).
- Urquhart, A. J., Anderson, D. G., Taylor, M., Alexander, M. R., Langer, R., Davies, M. C. High throughput surface characterisation of a combinatorial material library. Advanced Materials. 19, 2486-2491 (2007).
- Taylor, M., Urquhart, A. J., Zelzer, M., Davies, M. C., Alexander, M. R. Picoliter water contact angle measurement on polymers. Langmuir. 23, 6875-6878 (2007).
- Urquhart, A. J., Taylor, M., Anderson, D. G., Langer, R., Davies, M. C., Alexander, M. R. TOF-SIMS analysis of a 576 micropatterned copolymer array to reveal surface moieties that control wettability. Analytical Chemistry. 80, 135-142 (2008).
- Hook, A. L., Yang, J., Chen, X., Roberts, C. J., Mei, Y., Anderson, D. G., Langer, R., Alexander, M. R., Davies, M. C. Acrylate polymers with hydro-responsive topography. Soft Matter. 7, 7194-9197 (2011).
- Pernagallo, S., Unciti-Broceta, A., Diaz-Mochon, J. J., Bradley, M. Deciphering cellular morphology and biocompatibility using polymer microarrays. Biomedical Materials. 3, (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados