Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de la muestra de
En este artículo
Resumen
El perfil de metabolómica Mycobacterium tuberculosis Se determina después de crecimiento en cultivos de caldo. Las condiciones se pueden variar para probar los efectos de los suplementos nutricionales, agentes oxidantes, y agentes contra la tuberculosis en el perfil metabólico de este microorganismo. Procedimiento para la preparación del extracto es aplicable tanto para 1D 1 H y 2D 1 H- 13 C análisis de RMN.
Resumen
Mycobacterium tuberculosis es la principal causa de mortalidad en los seres humanos a escala mundial. La aparición de ambos múltiples (MDR) y ampliamente-(XDR) de las cepas resistentes a los medicamentos amenaza con descarrilar los esfuerzos actuales de control de la enfermedad. Por lo tanto, existe una necesidad urgente de desarrollar fármacos y vacunas que son más eficaces que los disponibles actualmente. El genoma de M. tuberculosis se conoce desde hace más de 10 años, sin embargo hay importantes lagunas en nuestro conocimiento de la función de los genes y la esencialidad. Muchos estudios han utilizado desde entonces el análisis de la expresión génica a nivel transcriptomic y proteómicos para determinar los efectos de las drogas, oxidantes, y las condiciones de crecimiento en los patrones globales de expresión génica. En última instancia, la respuesta final de estos cambios se refleja en la composición metabólico de la bacteria incluyendo unos pocos miles de productos químicos de bajo peso molecular. Comparando los perfiles metabólicos de tipo salvaje y cepas mutantes, o bien no tratados o treated con un fármaco particular, puede efectivamente permitir la identificación del blanco y puede conducir al desarrollo de nuevos inhibidores con actividad antituberculosa. Del mismo modo, los efectos de dos o más condiciones en el metaboloma también se puede evaluar. Resonancia magnética nuclear (RMN) es una poderosa tecnología que se utiliza para identificar y cuantificar los intermediarios metabólicos. En este protocolo, los procedimientos para la preparación de M. extractos celulares tuberculosis para análisis de RMN se describen metabolómico. Los cultivos de células se cultivan en condiciones apropiadas y contención requerido nivel de bioseguridad 3, 1 recolectadas, y se sometieron a lisis mecánica, manteniendo las temperaturas frías para maximizar la conservación de los metabolitos. Los lisados celulares se recuperó, se filtró esterilizada, y se almacena a temperaturas ultra-bajas. Partes alícuotas de estos extractos celulares se sembraron en agar Middlebrook 7H9 para unidades formadoras de colonias para verificar la ausencia de células viables. Tras dos meses de incubación a 37 ° C, si no vicolonias capaces se observan, las muestras se retiran de la instalación de contención para el procesamiento aguas abajo. Los extractos se liofilizaron, se resuspendieron en tampón deuterado y se inyectó en el instrumento de RMN, la captura de los datos espectroscópicos que se somete después a análisis estadístico. Los procedimientos descritos se pueden aplicar por tanto de una dimensión (1D) de RMN 1 H y de dos dimensiones (2D) 1 H-13 C análisis de RMN. Esta metodología proporciona más fiable identificación de pequeño peso molecular metabolito y análisis cuantitativos más fiables y sensibles de las composiciones de extracto de células metabólicas que los métodos cromatográficos. Las variaciones del procedimiento descrito después de la etapa de lisis celular también se puede adaptar para el análisis proteómico paralelo.
Protocolo
1. Protocolo de Texto
Este protocolo pone de manifiesto la adaptación de la metodología de RMN para M. tuberculosis (Clase agente III). Por lo tanto, las prácticas de bioseguridad de nivel 3 (BSL3) deben ser seguidos cuando se realiza M. tuberculosis investigación en un laboratorio certificado anualmente. La exposición a aerosoles generados en laboratorio es el riesgo más importante encontrado por el personal que trabaja con estos microorganismos. Los siguientes procedimientos se llevan a cabo en nuestra institución y las variaciones pueden existir basadas en las recomendaciones del Comité Institucional de Bioseguridad. Equipo de protección personal comunes consistirá en un traje Tyvek, gorra bouffant, botas, respirador N95, protección para los ojos, las mangas y un doble par de guantes de nitrilo. Trabajos que supongan M. culturas tuberculosis y / o manipulaciones con abierta M. tuberculosis contenedores se realiza en el tipo A2 o B2 gabinete de seguridad biológica. Cubierto de plástico papel absorbente se coloca en el wTrabajando superficie. Todos los materiales / suministros, para ser eliminados o retirados de la instalación debe ser colocado en dos bolsas de bioseguridad y descontaminado en autoclave. Las superficies de trabajo y los equipos utilizados en el gabinete (FastPrep-24 lisis homogeneizador, espectrofotómetro, el cubo de hielo, etc) deben ser desinfectados después de cada sesión de trabajo con un 1% Amphyl (agente tuberculocida, bactericida, fungicida y virucida). M. culturas tuberculosis deben estar bajo doble contención para el transporte a grandes equipos situados fuera de la cabina de seguridad biológica, tales como congeladores, incubadoras, centrífugas y frigorífico. La centrifugación se lleva a cabo con las tazas de seguridad cerradas y juntas tóricas tubos con tapa de rosca. Para el análisis adicional fuera del laboratorio BSL3, extractos libres de células se filtró a través de un filtro de 0,2 micras o microorganismos muertos de calor a 95 ° C durante 15 min. 2 Las muestras se colocan en placas para verificar la ausencia de unidades formadoras de colonias antes de la retirada de los recipientes.
- Transferir 110 ml de Middlebrook 7H9 medios completos que contienen polisorbato 80 (Tween 80 para evitar la formación de grumos) caldo (MADC-TW) o un medio adecuado a un matraz Erlenmeyer de 250 ml. Cultivos por triplicado se crecer rutinariamente por condición cuando se utiliza 13 C-metabolitos, y diez culturas idénticas se cultivan para 1D perfiles 1 H RMN. Durante dos condiciones (por ejemplo, con y sin adición de fármaco), volumen doble de la cultura por réplica se puede cultivar y se dividió en dos culturas idénticas. Todas las recetas de reactivos y la solución se proporcionan al final del protocolo.
- Inocular el caldo con 0,150 ml de M. tuberculosis glicerol al 50% de valores (dejar descongelar en hielo). Ver Nota 1 a continuación.
- Dejar que el cultivo crezca a 37 ° C con agitación a 100 rpm durante aproximadamente 6 días (OD 600 0,6 a 0,8). Ver Nota 2 a continuación.
- Si no hay antibióticos, adiciones o tratamientos alternativos se necesitan otros, los cultivos están listos para ser cosechados. Si se usan tratamientos, continuardirectamente al paso 5. Quitar una muestra de 0,5 ml de cada matraz, transferir a un tubo de microcentrífuga y el lugar a 4 º C para la titulación de la cultura y de control de calidad: pruebas de contaminación, análisis fenotípico, pruebas de PCR. Ver Nota 3 a continuación. En este punto, continúe con el paso 6.
- Eliminar matraces de agitador y realizar el tratamiento deseado (por ejemplo, añadir fármaco o metabolito). Place matraces de nuevo en el agitador e incubar durante un período adicional (por ejemplo, 6-18 h). Al final de este tiempo, tomar otra alícuota de 1,0 ml y determinar OD 600. Quitar una muestra de 0,5 ml de cada matraz, transferir a un tubo de microcentrífuga y el lugar a 4 º C para la titulación de la cultura y control de calidad.
- Culturas colocar en hielo durante 5 min. Después de este paso, dejar las células sobre hielo durante todo el protocolo restante. Cultivos de cosecha por centrifugación a 2.000 xg y 4 º C durante 15 min en tubos de 50 ml usando una centrífuga de sobremesa. Cada cultivo se requieren cuatro tubos con 25 ml cada uno (un total de 100 ml se requiere para obtener una adecuada relación señal-ruido para 2D 1 H-13 C experimentos de RMN, donde se requiere sólo 50 ml por cultivo para los experimentos 1D 1 H RMN).
- Lavar cada sedimento celular dos veces con helado de ddH O 2 (aproximadamente 15 ml de la primera vez y 10 ml de la segunda vez) por los parámetros de centrifugación descrito anteriormente. Para el segundo lavado, se combinan las partes alícuotas de 10 ml en el mismo tubo antes del hilado. Resuspender el sedimento celular en un volumen final de 1,0 ml ddH 2 O (necesidad de ajustar para la celda volumen de píldora). Si una única suspensión de células libres de aglutinación se desea en este paso, las células pueden ser brevemente sonicó y / o pasar a través de una aguja de calibre 27-tres veces. Alternativamente, el pellet de células se pueden congelar a -80 º C y se almacenaron hasta su procesamiento posterior. En este último caso, gránulos congelados se descongelaron en hielo antes de la resuspensión. Resuspender los sedimentos celulares en un volumen final de 1,0 ml ddH 2 O como se ha indicado anteriormente.
- Taxisr la suspensión 1,0 ml de células a un tubo de 2,0 ml tapón de rosca que contiene lisis Matriz B (0,1 mm de esferas de sílice). Coloque el homogeneizador FastPrep-24 lisis dentro de la cabina de bioseguridad. Poner las muestras en el soporte de la muestra, asegurando la retención habló placa en la parte superior del tubo. Procesar las muestras durante 60 segundos en el homogeneizador a una velocidad de 6 m / s.
- Girar las muestras en una microcentrífuga a 15.000 xg y 4 º C durante 10 min con los desechos sedimento celular y las células intactas.
- Retirar la muestra de sobrenadante y se pasan a través de un filtro de jeringa (0,2 m) en un tubo estéril. Placa 0,1 ml de la muestra (o una parte representativa de la muestra, como por ejemplo 10%) en agar MADC para verificar que no hay células viables. Los investigadores también pueden llevar a cabo más de una etapa de filtración y / o verificar la presencia de células viables en los extractos utilizando vivos-muertos procedimientos de tinción con el fin de prevenir o identificar cualquier posibles preocupaciones de bioseguridad. Congelar las muestras en un baño de hielo seco-etanol para almacenara -80 ° C hasta que están listos para ser liofilizadas y procesadas en una instalación de RMN.
- Después de 2 meses, comprobar placas para verificar la ausencia de unidades formadoras de colonias. Si la UFC no se encuentran, se pueden tomar muestras de laboratorio BSL3. Un análisis más detallado se lleva a cabo en una instalación de RMN estándar, que normalmente sirve de múltiples usuarios y no opera bajo requisitos de contención específicos.
- Liofilizar las muestras a sequedad, a continuación, volver a suspender en 0,7 ml de tampón de RMN y transferir a un tubo de microcentrífuga. Centrifugar durante 3 min a 13.000 x g. Retirar 0,6 ml y transferir a un tubo de RMN de 5 mm. Alternativamente, las muestras liofilizadas podrían ser enviados a un centro externo como no biopeligrosos muestras regulares.
- Los datos de RMN se recoge inmediatamente. A pesar de todas las precauciones, enzimas activas puede estar aún presente y la muestra no es normalmente estable durante largos períodos de tiempo. Los cambios en el espectro de RMN son notables cuando las muestras se dejan a temperatura ambiente o a 4 ° C para más de 1 semana. Además, la recogida de datos de RMN se alterna entre cultivos tratados y no tratados de drogas, donde las muestras son seleccionadas aleatoriamente de cada categoría. Esto evita desviaciones innecesarias debido a una categoría particular tenía un retraso mayor antes de los espectros de RMN fueron recogidos. Un sesgo en los datos que ocurriría si los espectros de RMN para todas las muestras no tratadas se recogieron primero, y luego seguido por las muestras tratadas con fármaco. Si las muestras no pueden ser inmediatamente analizados por RMN, las muestras deben almacenarse en tubos de 1 ml Eppendorf a -80 ° C.
- Después de insertar las muestras en un cambiador de calibración de instrumentos BACS-120 muestra, lo que implica un paso de rutina pocos, como el bloqueo, calce, ajustar y optimizar la longitud del pulso de 90 °, es necesario para maximizar la calidad de los resultados. Una sola muestra se utiliza para calibrar la longitud de pulso 90 ° y afinar el instrumento para las muestras restantes. Bloqueo, calzas, y RMN de recolección de datos para cada muestra se automatiza using ICONNMR y gradshim.
- Un 1D 1 H espectro de RMN se obtuvieron utilizando el Bruker zgesgp secuencia de pulsos con supresión de agua utilizando esculpir excitación. Un total de puntos de datos de 32k con un ancho de barrido de 5482.5Hz, escaneos 128, y 16 barridos ficticios se utilizan. A 2D 1 H-13 C espectro HSQC se recopilan con el Bruker hsqcetgp secuencia de pulsos. Un total de 2048 puntos de datos con un ancho de barrido de 5000,0 Hz se recoge a lo largo de la dimensión directa 1 H, y 64 puntos de datos con un ancho de barrido de 18864,9 Hz a lo largo de la dimensión C 13 indirectos. El espectro se recoge con 128 exploraciones y 16 escaneos ficticias para obtener buena señal a ruido.
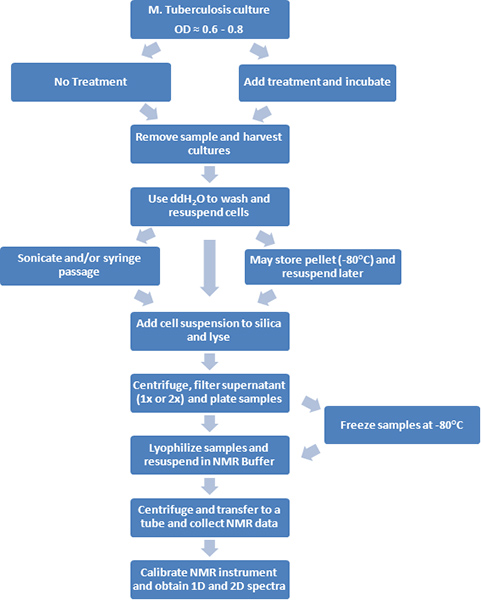
Figura 1. Un diagrama de flujo de los procedimientos experimentales se representa.
RMN búfer
De la solución de 50 mM de fosfato de potasio buffer con TMSP mM 50:
- 2,17 g de K 2 HPO 4 (fosfato de potasio dibásico)
- 1,70 g de KH 2 PO 4 (fosfato de potasio monobásico)
- 7,86 mg de sodio-3-Trimethylsilylpropionate (TMSP-2 ,2,3,3-D 4 (D, 98%))
- Disolver en 500 ml de "100%" D 2 O
- La solución final debe ser a un pH 7,2 (sin corregir)
MADC-TW o MOADC-TW (1 L)
- 4,7 g de caldo Middlebrook 7H9 base de
- 900 ml ddH 2 O
- 2 ml de glicerol
- Mezclar los componentes y autoclave durante 25 min. Líquido frío al tacto y añadir las siguientes soluciones:
- 100 ml de ADC al preparar MADC o 100 ml OADC al preparar MOADC
- 2,5 ml 20% de Tween 80 (alternativamente, 1 ml de no metabolizable Tyloxapol 20%)
- 10 ml 1% cicloheximida
ADC (1 L)
- 20 g de D (+)-Glucosa
- 50 g de BSA FracciónV
- 8,5 g de NaCl
- 800 ml ddH 2 O
- Disolver juntos, ajustar el volumen a 1 L y se esteriliza con 0,2 micras filtro. Almacenar a 4 ° C.
Alternativamente, para preparar OADC (1 l), añadir todos los componentes listados anteriormente, más 50 ml de ácido oleico 1% (receta a continuación hace un lote de 250 ml). Disolver juntos, ajustar el volumen a 1 L y se esteriliza con 0,2 micras filtro. Botella necesita ser envuelto en papel de aluminio y se almacena a 4 ° C.
- 2,5 g Ácido oleico
- 250 ml de NaOH 0,2 M
- Descongelar ácido oleico (solidifica al refrigeración) por calentamiento a 55 ° C durante 10 min y añadir a la solución de NaOH y calor con agitación durante 60 min. Almacenar en botellas de vidrio estériles que se envuelven en papel de aluminio. Botellas sello con parafilm y se almacena a 4 º C.
Si lo prefiere, puede comprar BD BBL Middlebrook comercial ADC o enriquecimiento OADC con catalasa.
1% cicloheximida (100 ml)
- 1 g cicloheximida
- 100 ml ddH 2 O
Disolver y esterilizar con filtro de 0,2 micras. Almacenar a 4 ° C. Precaución: cicloheximida es tóxico para manejar con extremo cuidado.
20% (v / v) de Tween 80 (100 ml)
- 20 ml de Tween 80
- 80 ml ddH 2 O
Alternativamente, pesar 20 g de Tween 80 (aproximadamente 18,9 ml, densidad de 1,06 g / ml), para preparar 20% w / v solución. Calor de la solución a 55 ° C durante 30 min para disolver y mezclar completamente. Esterilizar líquido con un filtro de 0,2 micras. La tienda de la solución final a temperatura ambiente.
20% (v / v) de Tyloxapol (100 ml)
- 20 ml Tyloxapol
- 80 ml ddH 2 O
Alternativamente, pesar 20 g de tiloxapol (aproximadamente 18,2 ml, densidad 1,1 g / ml), para preparar 20% w / v solución. Calor de la solución a 55 ° C durante 30 min a dissolve y mezclar completamente. Esterilizar líquido con un filtro de 0,2 micras. La tienda de la solución final a temperatura ambiente.
Nota 1: stocks de glicerol de M. tuberculosis se preparan usando el siguiente protocolo.
Media de M. tuberculosis
- Crecer M. tuberculosis en 50 ml MADC a la saturación (OD 600 = 1,5 a 2,0) a 37 ° C bajo condiciones de agitación (100 rpm). Dependiendo de la cepa, esta se llevará a 7-14 días.
- Girar las muestras a 2.000 xg, a 4 ° C durante 15 min para cultivo de sedimento. Eliminar el sobrenadante.
- Resuspender en 6 ml de glicerol estéril al 50%.
- Dividir en partes alícuotas de 1,5 ml en 4 Corning viales criogénicos y la etiqueta apropiada.
- Inmediatamente los viales de congelación de flash en etanol / hielo seco y se almacena a -80 ° C.
Nota 2: Inocular la cepa H37Rv (-80 ° C almacenadas hasta 1,5 años de edad) en 70 ml de MADC medios de comunicación produce un OD 600 </ Sub> de aproximadamente 0,6 después de 5 días de crecimiento a 37 ° C bajo condiciones de agitación (100 rpm) en un agitador Innova 40.
Nota 3: Para probar la contaminación cultura, los investigadores pueden inocular una alícuota de la cultura en un medio rico estándar y verificar la ausencia de crecimiento después de la incubación durante la noche. Rutinariamente, los cultivos se sembraron en agar MADC para observar la morfología de colonia y examinar al microscopio de contraste de fase. Si se desea, los cultivos se puede verificar mediante PCR utilizando cebadores IS 6110 como se ha descrito. 3
2. Los resultados representativos
Una muestra que está bien preparado producirá un espectro de RMN similar a la representada en la Figura 2. Este espectro es una representación de la M. tuberculosis de tipo salvaje piscina metabólico. Los metabolitos identificados son directa o indirectamente relacionada con la vía D-alanina. Además, la magnitud de pico de intensidad es proporcional a las concentraciones de metabolitos presentesen el extracto celular. Por lo tanto, los cambios en las intensidades máximas entre cultivos no tratados, tratamiento farmacológico, y cepas mutantes pueden indicar perturbaciones en los metabolitos y las vías metabólicas. El M. tuberculosis 1D 1 H espectros de RMN se obtuvieron en un espectrómetro Bruker Avance 500 MHz equipado con una triple resonancia, criosonda gradiente eje Z. El espectro contiene ca. 400 picos, de los cuales fue posible identificar y cuantificar 40-50 metabolitos, incluyendo aminoácidos, precursores de nucleótidos, y productos intermedios de ácido cítrico y glicolíticas. Un cambiador de BACS-120 muestra con software Bruker icono se utiliza para automatizar la recopilación de datos de RMN. 1D 1 H espectros de RMN se obtuvieron utilizando la escultura de excitación 4 para eliminar eficazmente el disolvente y mantener una línea de base plana, eliminando cualquier necesidad de recogida de línea de base que puede inducir artefactos en el posterior análisis de componentes principales (PCA) o parcial ortogonal al análisis discriminante cuadrados (OPLS- DA). A 1D 1 H espectro de RMN se obtiene a 25 ° C con un ancho espectro de 5482,5 Hz y los puntos de datos de 32K. Un total de 16 exploraciones simuladas y escaneos 128 se utilizaron para obtener el espectro. El ACD Labs RMN 1D software procesador se utilizó para semi-automática procesar toda la 1D 1 H espectros RMN. Los espectros fueron transformada de Fourier, por etapas, y se hace referencia al pico TMSP (0,0 ppm). El paquete de software NMRPipe se utilizó para procesar individualmente el 2D 1 H-13 C espectros de RMN y se analizaron con NMRDraw. El Bruker FID archivo de datos se convirtió primero a un formato de archivo reconocible por NMRPipe y entonces el espectro fue transformada de Fourier, corrección de fase, y llena cero. Los picos de RMN observados en el espectro 1D 1 H RMN y 2D 1 H-13 C RMN espectro se asignan a los metabolitos específicos utilizando 1 H y 13 C tolerancias de desplazamiento químico de 0,05 ppm y 0,50, respectivamente, y el Madison Metabolómica Consorcio de base de datos (MMCD ), 5 la BioMagResBank, 6 y la base de datos metaboloma humano. 7 Específicamente, los espectros de RMN 1D y 2D son manualmente pico a dedo, donde la lista de pico de los desplazamientos químicos de RMN se sube a la base de datos metaboloma humano. Los metabolitos identificados por la Base de Datos metaboloma humano se asignan al espectro de RMN basado tanto en la maximización del número de juego resonancias de RMN y perteneciente a una red metabólica. Cada compuesto o metabolito típicamente tiene múltiples pares CH y resonancias de RMN correspondientemente múltiples. Así, cuanto más de estas resonancias de RMN que se observan en el espectro de RMN experimental, más probable es que el metabolito está presente. Del mismo modo, la identificación de múltiples metabolitos asociados con la misma vía aumenta la probabilidad de asignaciones correctas. La presencia de los metabolitos y las vías metabólicas se verifican con la Enciclopedia de Kyoto de genes y genomas (KEGG) 8 y las bases de datos MetaCyc. 9 Mycobacterium smegmATIS es un sistema modelo útil para M. la tuberculosis y otras micobacterias patógenos. Como se ha descrito en otra parte, las muestras de M. smegmatis también podrían verse interrumpidas por sonicación. 10
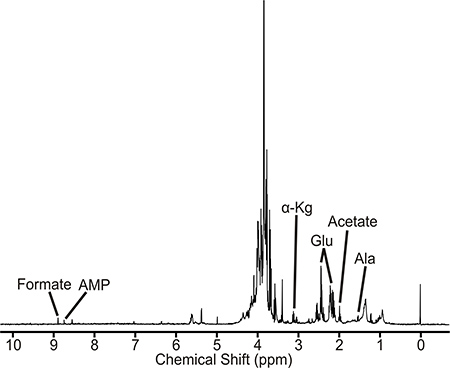
Figura 2. 1D 1 H espectro de RMN de extracto de Mycobacterium tuberculosis celular. Picos de RMN asociados con metabolitos representativos están etiquetados. Las abreviaturas son las siguientes: fosfato de AMP, adenosina mono; α-KG, α-cetoglutarato; Glu, glutamato, y Ala, alanina.
Discusión
Un gran número de estudios han analizado los perfiles transcriptomic y proteómicos de M. tuberculosis bajo una variedad de ensayos in vitro e in vivo. 11-16 En última instancia, los cambios en la expresión génica y la actividad enzimática conducen a variaciones en las concentraciones de las pequeñas moléculas de peso molecular. La descripción completa de estos compuestos constituye el metaboloma. Por lo tanto, los efectos de las drogas y las diferentes condiciones ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a todos los miembros de los laboratorios del Dr. Barletta y Powers Dr. útiles comentarios durante el desarrollo del protocolo. Damos las gracias a Wendy Austin útil para los debates y correcciones del manuscrito. El trabajo que se describe en este manuscrito fue financiado por becas piloto de semillas para cada investigador mencionado anteriormente de la Universidad de Nebraska-Lincoln Center Biología redox (padre subvención # 017675 2P20RR CNRR, D. Becker, PI). Además, agradecemos a la Dra. Ofelia Chacón para el suministro de fondos de la subvención R21 (1R21AI087561-01A1) para suministros de investigación y de apoyo a sueldo parcial Sr. Halouska para estandarizar técnicas de RMN incluyen en esta publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / Equipo | Empresa | Número de catálogo | Comentarios |
| ADC Enriquecimiento | BD BBL Middlebrook | 212352 | |
| BACS-120 Cambiador de muestras | Bruker | ||
| RMN Bruker Avance | Bruker | 500 MHz | |
| Albúmina de suero bovino | Fisher Scientific | BP1600-100 | Fracción V |
| Centrífugo | Beckman Coulter | Allegra X-15R | Benchtop |
| Tubos de centrífuga | Corning | 430291 | 50 ml estéril de polipropileno |
| Viales criogénicos | Corning | 430488 | 2,0 ml estéril de polipropileno |
| Cycloheximide | AG Scientific | C-1189 | Tóxico |
| D (+) - Glucosa | ACROS | 41095-0010 | |
| Óxido de deuterio | Sigma Aldrich | 617385 | |
| Erlenmeyer Flask | VWR | 89095-266 | Base de estéril, planas, policarbonato, 0,22 m tapa de la membrana PTFE con ventilación |
| Frasco de Flash Freeze | VWR | 82018-226 | 750 ml |
| Secador en frío | VWR | 82019-038 | 4,5 l de sobremesa |
| Glicerol | GibcoBRL | 15514-029 | |
| Incubadora | New Brunswick | Innova 40 | Benchtop agitador |
| Lisis Matriz B | MP Biomedicals | 6911-100 | |
| Lisis de la máquina | MP Biomedicals | FastPrep-24 | |
| Microcentrífuga | Eppendorf | 5415D | Benchtop |
| Microcentrífuga | Beckman Coulter | Microfuge 22R | Benchtop |
| Middlebrook 7H9 caldo | Difco | 271310 | |
| Tubos de RMN | Norell | ST500-7 | 5 mM |
| El enriquecimiento OADC | BD BBL Middlebrook | 212351 | |
| Ácido Oleico | Sigma | O1008 | |
| Fosfato de potasio dibásico | VWR | BDH0266 | |
| Fosfato de potasio monobásico | VWR | BDH0268 | |
| Rotor - Microfuge 22R | Beckman Coulter | F241.5P | Sellado y polipropileno |
| Rotor - Allegra X-15R | Beckman Coulter | SX4750 | Con bio-certificados cubiertas |
| Cloruro de Sodio | Fisher Scientific | S271-3 | |
| Sodio-3-trimethylsilylpropionate-2 ,2,3,3-D4 | Cambridge Isótopos | DLM-48 | |
| Espectrofotómetro | Beckman Coulter | DU-530 | |
| Cubetas | Línea de vida | LS-2410 | 1,5 ml de poliestireno, 2 lados claros |
| Jeringa | Becton Dickinson | 309585 | Estéril, 3 ml Luer-Lok |
| Filtro de jeringa | Nalgene | 190-2520 | 0,2 micras acetato de celulosa estéril |
| Tween 80 | Fisher Scientific | BP338-500 |
Referencias
- Larsen, M. H., Biermann, K., Tandberg, S., Hsu, T., Jacobs, W. R. Genetic Manipulation of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 2 (2007).
- Larsen, M. H., Biermann, K., Jacobs, W. R. Laboratory Maintenance of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 1 (2007).
- Clarridge, J. E., Shawar, R. M., Shinnick, T. M., Plikaytis, B. B. Large-scale use of polymerase chain reaction for detection of Mycobacterium tuberculosis in a routine mycobacteriology laboratory. J. Clin. Microbiol. 31, 2049-2056 (1993).
- Nguyen, B. D., Meng, X., Donovan, K. J., Shaka, A. J. SOGGY: solvent-optimized double gradient spectroscopy for water suppression. A comparison with some existing techniques. J. Magn. Reson. 184, 263-274 (2007).
- Cui, Q. Metabolite identification via the Madison Metabolomics Consortium Database. Nat. Biotechnol. 26, 162-164 (2008).
- Ulrich, E. L. BioMagResBank. Nucleic Acids Res. 36, 402-408 (2008).
- Wishart, D. S. HMDB: the Human Metabolome Database. Nucleic Acids Res. 35, 521-526 (2007).
- Kanehisa, M. KEGG for linking genomes to life and the environment. Nucleic Acids Res. 36, 480-484 (2008).
- Karp, P. D. Expansion of the BioCyc collection of pathway/genome databases to 160 genomes. Nucleic Acids Res. 33, 6083-6089 (2005).
- Halouska, S. Use of NMR metabolomics to analyze the targets of D-cycloserine in mycobacteria: role of D-alanine racemase. J. Proteome. Res. 6, 4608-4614 (2007).
- Boshoff, H. I. The transcriptional responses of Mycobacterium tuberculosis to inhibitors of metabolism: novel insights into drug mechanisms of action. J. Biol. Chem. 279, 40174-40184 (2004).
- Mehaffy, C. Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis. Proteomics. 10, 1966-1984 (2010).
- Schnappinger, D. Transcriptional Adaptation of Mycobacterium tuberculosis within Macrophages: Insights into the Phagosomal Environment. J. Exp. Med. 198, 693-704 (2003).
- Schnappinger, D., Schoolnik, G. K., Ehrt, S. Expression profiling of host pathogen interactions: how Mycobacterium tuberculosis and the macrophage adapt to one another. Microbes. Infect. 8, 1132-1140 (2006).
- Shui, W. Quantitative proteomic profiling of host-pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids. J. Proteome. Res. 8, 282-289 (2009).
- Talaat, A. M., Lyons, R., Howard, S. T., Johnston, S. A. The temporal expression profile of Mycobacterium tuberculosis infection in mice. Proc. Natl. Acad. Sci. U.S.A. 101, 4602-4607 (2004).
- Forgue, P. NMR metabolic profiling of Aspergillus nidulans to monitor drug and protein activity. J. Proteome Res. 5, 1916-1923 (2006).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22, 245-252 (2004).
- Shin, J. H. NMR-based Metabolomic Profiling in Mice Infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238-2247 (2011).
- Jaki, B. U., Franzblau, S. G., Cho, S. H., Pauli, G. F. Development of an extraction method for mycobacterial metabolome analysis. J. Pharm. Biomed. Anal. 41, 196-200 (2006).
- de Carvalho, L. P. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17, 1122-1131 (2010).
- de Carvalho, L. P. Activity-based metabolomic profiling of enzymatic function: identification of Rv1248c as a mycobacterial 2-hydroxy-3-oxoadipate synthase. Chem. Biol. 17, 323-332 (2010).
- Marrero, J., Rhee, K. Y., Schnappinger, D., Pethe, K., Ehrt, S. Gluconeogenic carbon flow of tricarboxylic acid cycle intermediates is critical for Mycobacterium tuberculosis to establish and maintain infection. Proc. Natl. Acad. Sci. U.S.A. 107, 9819-9824 (2010).
- Tang, Y. J. Central metabolism in Mycobacterium smegmatis during the transition from O2-rich to O2-poor conditions as studied by isotopomer-assisted metabolite analysis. Biotechnol. Lett. 31, 1233-1240 (2009).
- Kweon, O. A polyomic approach to elucidate the fluoranthene-degradative pathway in Mycobacterium vanbaalenii PYR-1. J. Bacteriol. 189, 4635-4647 (2007).
- Hasan, M. R., Rahman, M., Jaques, S., Purwantini, E., Daniels, L. Glucose 6-phosphate accumulation in mycobacteria: implications for a novel F420-dependent anti-oxidant defense system. J. Biol. Chem. 285, 19135-19144 (2010).
- Soga, T. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J. Proteome Res. 2, 488-494 (2003).
- Metz, T. O. The future of liquid chromatography-mass spectrometry (LC-MS) in metabolic profiling and metabolomic studies for biomarker discovery. Biomark Med. 1, 159-185 (2007).
- Ludwig, C., Viant, M. R. Two-dimensional J-resolved NMR spectroscopy: review of a key methodology in the metabolomics toolbox. Phytochem. Anal. 21, 22-32 (2010).
- Simpson, R. J., Inglis, J. . Proteins and Proteomics: A Laboratory Manual. , 425-595 (2003).
- Beste, D. J., McFadden, J. System-level strategies for studying the metabolism of Mycobacterium tuberculosis. Mol. Biosyst. 6, 2363-2372 (2010).
- Rhee, K. Y. Central carbon metabolism in Mycobacterium tuberculosis: an unexpected frontier. Trends Microbiol. , (2011).
- Who. Health Organization. Anti-tuberculosis Drug Resistance in the World: Report No. 4. , (2008).
- Jassal, M., Bishai, W. R. Extensively drug-resistant tuberculosis. Lancet Infect Dis. 9, 19-30 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados