Method Article
Preparación Individual Drosophila Huevos Cámaras de Imágenes en directo
En este artículo
Resumen
La Drosophila Cámara de huevo es un excelente modelo para estudiar los mecanismos de localización del mRNA. Con el fin de capturar los eventos dinámicos que subyacen a los procesos de localización, imágenes de alta resolución rápida de tejido vivo se requiere. Aquí, se presenta un protocolo para la disección y la imagen de las muestras en vivo con una interrupción mínima.
Resumen
Imágenes de células vivas es una importante técnica se aplica a una serie de tejidos de Drosophila usados como modelos para investigar temas como la especificación del eje, la diferenciación celular y organogénesis 1. La correcta preparación de las muestras experimentales es crucial, a menudo descuidado, paso. El objetivo de la preparación es para garantizar la relevancia fisiológica y establecer las condiciones óptimas de imagen. Para mantener la viabilidad del tejido, es fundamental para evitar la deshidratación, el deterioro de la hipoxia, sobrecalentamiento o el medio 2.
La cámara de Drosophila huevo es un sistema bien establecido para examinar las cuestiones relativas, pero no limitado, a patrón del cuerpo, la localización del mRNA y la organización citoesquelética 3,4. Para cámaras de huevo primeros y mediados etapa, el montaje en el aceite de hidrocarburo halogenado es bueno para la supervivencia en que permite la libre difusión de oxígeno, evita la deshidratación y la hipoxia y tiene excelentes propiedades ópticas para microscopía. Imenvejecimiento de las proteínas fluorescentes es posible mediante la introducción de transgenes en la cámara de huevos o de inyección física de ARN, proteínas marcadas o anticuerpos 5-7. Por ejemplo, la adición de MS2 construcciones en el genoma de los animales permite la observación en tiempo real de ARNm en el oocito 8. Estas construcciones permiten en el etiquetado de ARNm in vivo mediante la utilización de la interacción MS2 bacteriófago bucle ARN vástago con su proteína de la cubierta 9.
Aquí, se presenta un protocolo para la extracción de los ovarios, así como aislar ovarioles individuales y las cámaras de huevos de la hembra de Drosophila. Para una descripción detallada de Drosophila oogenesis véase Allan C. Spradling (1993, reeditado en 2009) 10.
Protocolo
1. Drosophila antes de la preparación para la disección (Según E. Gavis, la Universidad de Princeton)
- Deseche los adultos a partir de una botella con baja densidad sin semillas y la transferencia de la botella a 25 ° C antes de su experimento. Una vez que nuevos adultos han comenzado a surgir, esperar dos días.
- Tomar un vial que contiene aproximadamente 10 ml de la mosca de alimentos sólidos y agregar 0,5-0,7 gramos de levadura seca (ver tabla) en un ángulo de 45 grados. No cubra toda la superficie del alimento mosca con levadura.
- Añadir unas cuantas gotas de agua a la levadura, suficiente para hidratar (Figura 1A). Coloque el vial a 45 grados y permitir que unos 3 minutos para que la levadura para absorber el agua (Figura 1B).
Nota: Como alternativa, mezcle una levadura pega en un recipiente aparte y añadir la pasta para el vial con una espátula.
- Anestesiar las moscas en el vial mediante la inyección de gas CO 2. Cuando se deja de mover, inclinar las moscas inconscientes sobre el CO 2 mosca plataforma para la clasificación (fig. 1C).
- Aislar 10-15 hembras y 5 machos del genotipo deseado bajo un microscopio de disección con un pincel de punta fina (Figura 1D). Los machos son evidentes por la presencia de cláspers, una estructura que sobresale oscuro, en su posterior.
- Añadir moscas seleccionados al vial yeasted (Figura 1E). Lugar a 25 ° C durante 24-60 horas. Incubar durante períodos de tiempo más cortos para un mayor porcentaje de jóvenes a mediados de cámaras de la etapa de huevo y períodos más largos de tiempo para fines de cámaras de la etapa de huevo.
2. Drosophila disección ovario
- Coloque una pequeña gota de aceite en un halocarbono N º 1,5, 22 x 50 mm cubreobjetos (Figura 2A). Establecer el cubreobjetos preparada para el lado donde no estará en el camino.
- Anestesie las moscas en la yeasted vil mediante la inyección de gas CO 2 y la punta en una plataforma de CO 2.
- Utilice bien afilados de nariz unas pinzas para agarrar un individuo gordo hembra en la parte anterior del abdomen (no entre los díase el abdomen y el tórax) (Figura 2B-C).
- Mantenga a la hembra con las pinzas y ver en un microscopio de disección, aproximadamente 2-3 cm por encima del cubreobjetos preparada.
- Aún sosteniendo en la parte anterior, utiliza un segundo conjunto de fórceps para extraer el tejido en el extremo posterior de la hembra (Figura 2D). Nota: tejido intestinal generalmente se tire a cabo con el extremo posterior. Limpie el tejido extraído de las pinzas.
- Mientras mantiene la hembra en la parte anterior, utilice las pinzas para apretar suavemente limpiadas o un masaje en el abdomen, trabajando desde la parte anterior hacia la parte posterior. Masajea el abdomen de la misma manera como la eliminación de pasta dentífrica desde el extremo de un tubo.
- Dos estructuras opacas grandes serán empujados desde el abdomen y la palanca en el extremo de la pinza (Figura 2E-F). Estos son los ovarios pareados.
- Toque los ovarios en el aceite de halocarbonos en la diapositiva a continuación.
- Repita la disección de 1-2 veces para dar un total de 4-6 ovarios en el aceite en el cubreobjetos (Figure 2G).
3. Ovarioles aislamiento
Nota: Cada ovario contiene cerca de 16 ovarioles compuestas de 6 a 10 cámaras de huevos de las diferentes etapas dispuestas como cuentas de un collar 10.
Nota: Antes de aislar los ovarioles, ajustar la fuente de luz en el microscopio de disección, para que la iluminación afecta a un ángulo bajo a la muestra. Esto da contraste a la muestra y permite la visualización de las cámaras de huevo jóvenes etapa.
- En el aceite, separar los dos ovarios mediante la eliminación del tejido de conexión en el extremo posterior (etapas de edad) con fórceps cerrada (Figura 3A).
- Orientar un ovario individual con las más antiguas etapas en la etapa de la izquierda y más joven de la derecha. Las cámaras de la etapa juvenil de huevo en el ovario son transparentes y constituyen el extremo más puntiagudo del ovario.
- Con un par de pinzas en la mano dominante, agarre suavemente la parte posterior de un ovario, de preferencia por los restos de ºe tejido conectivo. Mientras sostiene el ovario en su lugar con las pinzas, utilice una sonda de disección (o una aguja de tungsteno) para desentrañar ovarioles individuales (Figura 3B-D).
Nota: ovarioles individuales se rompe entre las etapas de los jóvenes (germario a la etapa 10), como las etapas más antiguas son demasiado grandes para ser separado del ovario completo.
Nota: La punción un oocito etapa tardía con la sonda de disección se traducirá en el citoplasma fugas en el aceite y hacer la extracción de ovarioles individuales muy difícil. Si un óvulo última etapa se perfora, se mueven a un ovario fresco.
- Una vez que el ovariola está libre de los ovarios, el uso de la sonda de disección para arrastrarlo al centro de la gota de aceite y orientar en la orientación deseada para el experimento. Nota: ovarioles en el aceite se asiente y se adhieren al vidrio.
- Repita este proceso (3.3 a 3.4) hasta que no haya 15-25 ovarioles individuales. Nota: Esto puede requerir la disección de multípara-le ovarios. Todo el proceso debe tener menos de 15 minutos.
Nota: Es aconsejable para diseccionar cada uno de los ovarios de varias moscas en lugar de la disección de los ovarios de un menor número de moscas para aumentar el número n de moscas para el experimento.
Nota: El manejo brusco de la ovariola dará lugar a los ovocitos no saludables y pueden dar lugar a artefactos en el experimento.
Nota: Los ovocitos comenzará a mostrar cambios fenotípicos debido al estrés 40 minutos después de ser diseccionado por el ovario (comparar Figura 7E a la F).
- Una vez ovarioles están en una orientación adecuada (Figura 3E), utilice la sonda de disección y pinzas cerradas para mover el exceso de tejido ovárico del aceite. Este material puede ser borrado de las pinzas en una toalla de papel.
4. De aislamiento individuales finales cámaras estado de huevo (De acuerdo con E. Gavis, la Universidad de Princeton)
- Con un par de pinzas en el dominPor la hormiga, sujete la parte posterior de un ovario aislado, preferentemente por los restos del tejido conectivo. Mientras sostiene el ovario en su lugar con el fórceps, introducir la sonda de disección en el extremo posterior del ovario cerca de las pinzas (Figura 4A). Evite perforar las cámaras de huevos mediante la inserción de la sonda entre finales de cámaras de la etapa de huevo.
- Tire de la aguja de disección a través del ovario hasta que sale en las cámaras de huevos en fase inicial (Figura 4B). Cuando se hace correctamente, la sonda se eliminará el tejido conectivo y la celebración de las finales de ovarioles cámaras de huevo etapa en su lugar.
- Repita el paso 4.2 hasta que los ovarioles se extienden sobre el cubreobjetos. Nota: Cuando las cámaras de huevo ya no están apilados uno encima de otro, este paso es completa.
- Utilizando la sonda de disección, separar los oocitos finales para permitir la formación de imágenes fácil (Figura 4C).
Nota: La punción de un ovocito, mientras que la disección de finales de cámaras de la etapa de huevo no es tan condenando al igual que con la disección de iovarioles INDIVIDUALES para los más jóvenes.
Nota: Para la etapa de huevo 14 cámaras, utilice las pinzas para agarrar los apéndices dorsales para la orientación.
5. Inyección de la preparación
Nota: Para la inyección de ovocitos etapa intermedia, orientar la ovarioles perpendicularmente al eje longitudinal de la hoja de la cubierta.
- Encienda el microscopio de imagen [en nuestro caso un Core DeltaVision de precisión aplicada] y cargar los ajustes de imagen apropiadas (Figura 5A-B).
- Encienda el aparato de inyección (Figura 5).
- Cargar la aguja de inyección con una punta de carga (Figura 5D-E). Soluciones para ser inyectados se deben centrifugar brevemente a alta velocidad para evitar los depósitos que podrían bloquear la aguja de inyección.
- Coloque la aguja de inyección de carga en el inyector. Tenga cuidado de no romper la aguja (Figura 5F).
- Para ayudar con agujas destapan, coloque un pequeño trozo de vidrio de 2x10 mm a partir de un corte o una quebrada cubreobjetost un lado de la gota de aceite que contiene los ovarioles. Asegúrese de que este fragmento de vidrio está cubierto de aceite. Este vidrio servirá para embestir al extremo de la aguja en su contra por romper o destapar la aguja.
6. La inyección de ARN fluorescente
Antes de comenzar: Establecer el aparato de inyección y micro-manipulador tales controles que la aguja de inyección se coloca sobre el centro del campo de visión.
- Montar la muestra que se inyecta en la platina del microscopio.
- Seleccione el objetivo de 20x. Superiores o inferiores objetivos de ampliación también se puede utilizar.
Nota: Si utiliza una etapa automatizado con capacidad de punto de visita es recomendable para marcar toda la etapa de 8-9 ovocitos para la inyección antes de empezar. Esto permite por visitar fácil y la inyección de oocitos seleccionados.
- Baje la aguja de la inyección hasta que toque el aceite. Centro de la punta de la aguja sobre la lente del objetivo.
- Vueltafrente a las luces de la habitación y enciende la luz brillante del campo del microscopio. Seleccione el primer punto (ovocitos) en la lista de los puntos marcados. Mientras mira a través de los oculares, se centran en el ovocito (Figura 6).
- Baje la aguja de forma manual hasta que esté en el mismo plano de enfoque como el ovocito y el próximo visible para el ovocito.
- Usando los controles de manipulador, mover la punta de la aguja de la inyección hasta que esté en el interior del ovocito. Un movimiento rápido apuñalar a menudo más que un avance lento. Una vez dentro, expulsar un pequeño volumen de la aguja y evaluar los efectos visuales, repetir según sea necesario. Si la inyección es correcta, el citoplasma en el interior del oocito serán desplazados, si esto no es aparente, la repetición. No es necesario que la imagen de la fluorescencia para determinar si el material ha sido inyectada. Después de la inyección, retire la aguja desde el interior del ovocito (Figura 6B-G).
- La cantidad precisa de fluido que se inyecta es difícil de cuantificar. Para aumentar el volumen inyectado, adyuª de la presión o el tiempo del pulso de inyección, romper la punta de la aguja para aumentar la apertura de un poco o usar pulsos repetidos de la inyección.
Nota: El proceso de inyección completa debe tener menos de 10 segundos cuando se ejecuta correctamente. Amplia punzante o persistentes con la aguja en su interior de los ovocitos dará lugar a graves daños a la cámara de huevos.
- Antes de seleccionar el oocito marcado siguiente, elevar la aguja de inyección suficientemente alta en el aceite para no ponerse en contacto con oocitos otros en la ruta del viaje.
- En el ovocito nuevo, repita el paso 6.6. Continúe de esta manera hasta que todos los ovocitos necesarios se inyectan.
Nota: Si se comete un error mientras se inyecta, pasar a la siguiente marca de ovocitos. No pierda el tiempo en los ovocitos dañados.
Nota: La aguja puede obstruirse durante una sesión de la inyección. En este caso, mover la aguja adyacente a la pieza rota de vidrio en el aceite sobre el cubreobjetos. Ingenioh, el vidrio y la aguja en el mismo plano focal, suavemente incrustar la aguja en el vaso (Figura 6H). Prueba de que la aguja se unclogged pulsando el botón de inyección y ver si cualquier líquido sale de la punta de la aguja.
- Cuando todos los oocitos se han inyectado, mover manualmente la aguja hacia arriba, fuera del aceite y orientarlo hacia fuera de la trayectoria del haz para el microscopio. Asegurarse de que se trata en una orientación segura, para evitar daños en los ojos.
Nota: Si un largo período de tiempo transcurrido entre el aislamiento de huevos de cámara y la inyección de ovocitos, óvulos, será difícil para inyectar y muestran cambios fenotípicos asociados con el estrés. Problemas similares pueden surgir con el manejo brusco de los ovocitos o la inyección de volúmenes de exceso (compare las figuras 6I, J, K).
7. Vivir el diseño experimental de imágenes
- Seleccione el ovocito inyecta por primera vez en la lista. Prueba de que la inyección era el interior del ovocito por la imagen un fotograma de la fluorescencia (unas en la Figura 6G).
- Configure los parámetros experimentales, entre ellas: la longitud de onda de excitación, la trayectoria de emisiones, el tiempo de excitación, Z-pila y el tiempo entre las colecciones. Nota: Para obtener más información sobre esto, vea Parton R., et al. (2010) 2.
- Reúne el conjunto de datos.
8. Los resultados representativos
In vitro sintetizado Alexa-546 GRK ARN se inyecta en un Me31B :: GFP huevo cámara (Figura 7A). El ARN se localiza en la parte anterior dorsal del oocito y forma un tapón alrededor del núcleo (Figura 7B). Para más ejemplos de la localización del ARN ver MacDougall N., et al. (2003) 11.
Ovocitos etapa de mediados y finales que expresan la proteína fluorescente etiquetados (Tau-GFP, Figura 7C) o los sistemas de etiquetado de ARN (GRK * mCherry, la figura 7D) se pueden obtener imágenes sin inyección.

Figura 1.

Figura 2.
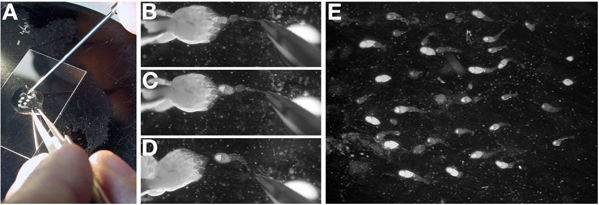
Figura 3.
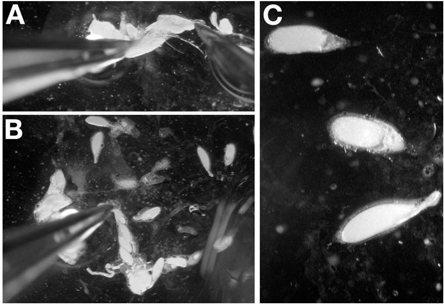
Figura 4.

Figura 5.
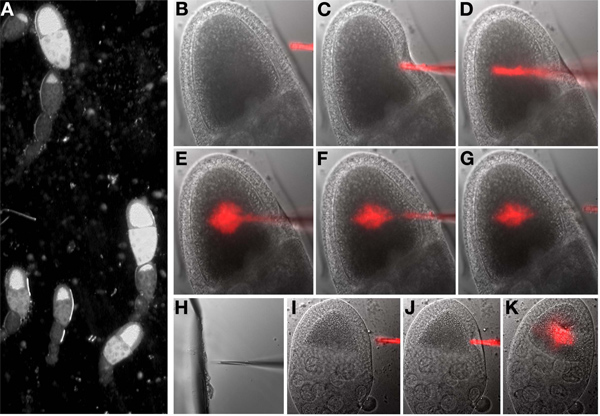
Figura 6.
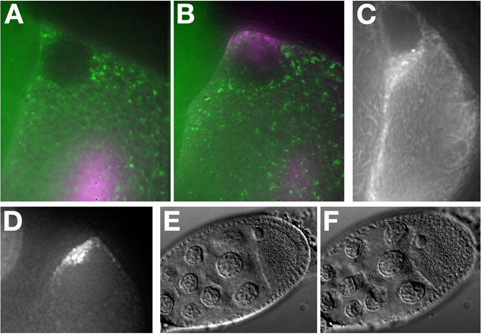
Figura 7.
Discusión
Imágenes de células vivas es un ensayo de gran alcance para el examen de los procesos celulares en tiempo real. Además de la simple observación de campo brillante, la adición de marcadores fluorescentes a las proteínas y ARN de interés ha llevado a muchos avances. Aquí hemos descrito un protocolo de oocitos de imagen de vida individuales que pueden ser utilizados en combinación con los ensayos genéticos y bioquímicos.
En este protocolo, también se explica cómo manipular experimentalmente los ovocitos mediante una inyección de vida. Existen muchas posibilidades para el material a inyectar, incluyendo sintetizado in vitro del ARN marcadas fluorescentes para ensayar la capacidad de una estructura secundaria de ARN directa localización (bola y Davis, no publicado) y anticuerpos que inhiben la función de las proteínas 6. El trabajo futuro es probable que vea la introducción de componentes de etiquetado y otras maquinaria celular de ovocitos de vida que permitan a los mecanismos moleculares a ser probado.
t "> Para preservar la viabilidad y la salud de los tejidos es esencial cuando se trabaja con células vivas. En este protocolo, señalamos una serie de medidas que pueden conducir al estrés de la cámara de huevos. Por ejemplo, a pesar de petróleo fue superior para obtener imágenes, la cultura extendida en el aceite puede provocar estrés en la cámara de huevos. Esto puede ser fácilmente controlados en la exposición de campo claro mediante el examen de la morfología nuclear y la posición, la membrana de los ovocitos que se distorsionan y la ampolla bajo estrés (comparar Figura 7E (átona) para Figure7F ( hizo hincapié en)). Etapa 9 cámaras de huevos muestran la localización del ARN y la migración de borde de la celda 12 horas sobre múltiples. Sin embargo, una etapa de 7.8 cámara de huevos comenzará a mostrar efectos negativos en el aceite de carbón de halo después de aproximadamente 40 minutos de los ovarios que son removidos de la de sexo femenino. cámaras de última hora de huevo, estadio 11 a 14, pueda desarrollarse con normalidad, ya sea en aceite o medios acuosos debido a la secreción de la cáscara del huevo de las células de los folículos en estas 13 etapas. Ha sido reported que la adición de insulina al medio de insectos acuosa puede mantener la etapa 9 ovocitos para un máximo de 6 horas y 14 germaria hasta 14 horas 15. En todos los casos, las maniobras agresivas de la cámara de huevos debe evitarse, ya que hace hincapié en los ovocitos y reduce su viabilidad. Imagen menos cámaras de huevos y el cuidado para el tratamiento de cada uno con cuidado es la mejor manera de asegurar la viabilidad óptima.Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue financiado por una Beca de Investigación Wellcome Trust Principal I. Davis.
Materiales
Las herramientas utilizadas en la disección debe ser limpio, pero no necesitan ser esterilizados en autoclave. Limpie las herramientas con EtOH y dejar que se sequen antes de empezar.
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Punta de pincel fino pintura (Artistas Sable, redondo, de tamaño 00 o 0) | Disponible en la mayoría de los medios materiales de arte | Un cepillo de buena calidad es importante | |
| Halocarburos Products Corporation, de la Serie 95 | Halocarburos Products Corporation, 887 Kinderkamack Road, River Edge NJ 07661 | Distribuidor europeo: Solvadis (GMBH) Asegúrese de oxigenar haciendo burbujear aire a través del aceite. | |
| Cubreobjetos-No. 1,5, 22 x 50 mm | Internacional-No1-VWR Cat = 631-0137-22-50mm | Menzel-Glaser-22-40mm-400-070T MNJ | |
| Dumont N º 5 - Dumostar | Herramientas de Bellas Ciencia | 11253-20 | "Biologie" punta también es bueno, pero más frágil |
| La disección de la sonda | Herramientas de Bellas Ciencia | 10140-01 | |
| Microscopio de disección | Olimpo | SZ61 | |
| Plataforma de CO2 | Disponible a través de http://www.flystuff.com / (Una división de Genesee Científico) | 59-114 (789.060 Dutscher) | Distribuidor europeo: Dutscher www. dutscherscientific. com / También es relativamente fácil de construir tu propia mosca almohadillas |
| KIMCARE | Kimbery Clark-KIMCARE-médicos toallitas | KLEW3020 | |
| Microscopio-DeltaVision | Applied Precision | DC-CORE | |
| Micromanipulador | Burleigh Micromanipuladores Dinámica de Grupo Lumen inc. 2260 Argentia Road, Mississauga, Ontario, Canadá L5N 6H7 | Burleigh PCS-5000 series, el TS-5000-300 | http://www.ldgi-burleigh.com / (Anteriormente Exfo) |
| Aparatos de inyección | Tritech Research, Inc. 2961 Ave. los Veteranos Los Angeles, CA 90064 | Minj-1 | Modificado con un soporte para tomar Eppendorf Femptotips |
| Aguja de inyección | Eppendorf estéril Femtotips I y II | 930000043 | Puntas diferentes son mejores para diferentes aplicaciones |
| Cargando consejos 20ul | Eppendorf | 5242956.003 | |
| Levadura seca activa | La levadura Fleischmann | # 2192 |
Referencias
- Arias, A. M. Drosophila melanogaster and the development of biology in the 20th century. Methods Mol. Biol. 420, 1-25 (2008).
- Parton, R. M., Valles, A. -. M., Dobbie, I. D., Davis, I., Goldman, R. D., Swedlow, J. R., Spector, D. L. Pushing the Limits of Live Cell Imaging in Drosophila. Live Cell Imaging: A Laboratory. , 387-418 (2010).
- Johnston, D. Moving messages: the intracellular localization of mRNAs. Nat. Rev. Mol. Cell Biol. 6 (5), 363-375 (2005).
- Jansen, R. mRNA Localization: Message on the Move. Nat. Rev. Mol. Cell Biol. 2, 247-256 (2001).
- Van De Bor, V., Hartswood, E., Jones, C., Finnegan, D., Davis, I. gurken and the I factor retrotransposon RNAs share common localization signals and machinery. Dev. Cell. 9 (1), 51-62 (2005).
- Delanoue, R., Herpers, B., Soetaert, J., Davis, I., Rabouille, C. Drosophila Squid/hnRNP helps Dynein switch from a gurken mRNA transport motor to an ultrastructural static anchor in sponge bodies. Dev. Cell. 13 (4), 523-538 (2007).
- Jaramillo, A. M., Weil, T. T., Goodhouse, J., Gavis, E. R., Schupbach, T. The dynamics of fluorescently labeled endogenous gurken mRNA in Drosophila. J. Cell. Sci. 121 (Pt. 6), 887-894 (2008).
- Forrest, K. M., Gavis, E. R. Live imaging of endogenous mRNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159-1168 (2003).
- Bertrand, E. Localization of ASH1 mRNA particles in living yeast. Mol. Cell. 2 (4), 437-445 (1998).
- Spradling, A. C., Bate, M., Martinez-Arias, A. Developmental genetics of oogenesis. The Development of Drosophila melanogaster. 1, 1-70 (1993).
- MacDougall, N., Clark, A., MacDougall, E., Davis, I. Drosophila gurken (TGFalpha) mRNA localizes as particles that move within the oocyte in two dynein-dependent steps. Dev. Cell. 4 (3), 307-319 (2003).
- Tekotte, H., Tollervey, D., Davis, I. Imaging the migrating border cell cluster in living Drosophila egg chambers. Dev. Dyn. 236 (10), 2818-2824 (2007).
- Weil, T. T., Parton, R., Davis, I., Gavis, E. R. Changes in bicoid mRNA anchoring highlight conserved mechanisms during the oocyte-to-embryo transition. Curr. Biol. 18, 1055-1061 (2008).
- Prasad, M., Jang, A. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nat. Protoc. 2 (10), 2467-2473 (2007).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados