Method Article
Visualización de los propioceptores
En este artículo
Resumen
Un método para inmunoteñir y visualizar los órganos chordotonal en larvas y pupas de Drosophila melanogaster Se describe.
Resumen
La propiocepción es la capacidad de detectar el movimiento o la posición de las partes del cuerpo, respondiendo a los estímulos que surjan dentro del cuerpo. En moscas de la fruta y otros insectos propiocepción es proporcionada por los órganos sensoriales especializados denominados órganos chordotonal (chos) 2. Al igual que muchos otros órganos en la Drosophila, Chos desarrollan dos veces durante el ciclo de vida de la mosca. En primer lugar, las larvas de Chos desarrollan durante la embriogénesis. Entonces, los Chos adultos comienzan a desarrollarse en los discos imaginales de larvas y continuar diferenciándose durante la metamorfosis.
El desarrollo de Chos larvas durante la embriogénesis se ha estudiado ampliamente 10,11,13,15,16. La pieza central de cada uno de Cho es una unidad sensorial compuesto de una neurona y una célula scolopale. La unidad sensorial se estira entre dos tipos de células accesorias que se adhieren a la cutícula a través de células especializadas de la epidermis de fijación 1,9,14. Cuando se mueve una larva de la mosca, el desplazamiento relativo de la ecélulas pidermal apego lleva a una extensión de la unidad sensorial y la consiguiente apertura de determinados receptores potenciales transitorios (vanilloides TRPV) canales en el segmento exterior de la dendrita 8,12. La señal provocada se transfiere luego a la locomotora circuito central generador de patrones en el sistema nervioso central.
Chos múltiples han sido descritos en la mosca adulta 7. Estos se encuentran cerca de las articulaciones de los apéndices de moscas adultas (patas, alas y cabestros) y en el tórax y el abdomen. Además, varios cientos de Chos en conjunto forman el órgano de Johnston en la antena para adultos que transducen acústica en energía mecánica 3,5,17,4.
En contraste con el amplio conocimiento sobre el desarrollo de Chos en etapas embrionarias, se sabe muy poco acerca de la morfología de estos órganos durante las etapas larvales. Además, con la excepción de Chos femorales 18 y el órgano de Johnston, nuestro conociGE sobre el desarrollo y la estructura de Chos en la mosca adulta es muy fragmentaria.
A continuación se describe un método para la tinción y visualización de Chos en larvas de tercer estadio y pupas. Este método puede ser aplicado junto con herramientas genéticas para caracterizar mejor la morfología y entender el desarrollo de las diversas Chos en la mosca.
Protocolo
Antes de empezar
- Crecer las culturas mosca deseados. Conservar los viales con poca gente (alrededor de 30 moscas por vial de 50 ml). Que las moscas ponen sus huevos sólo por un día en cada vial. Esto proporcionará el suministro de larvas de una alimentación suficiente y les permita alcanzar su tamaño máximo antes de arrastrarse fuera de la comida. Conservar los viales en la temperatura adecuada hasta que las larvas comienzan a deambular en la pared del vial.
- Preparar un stock fresca de tampón fosfato salino (PBS) y PBT (0,1% en PBS Tween). Mantenga 10 ml de PBS sobre el hielo.
- Preparar 1-5 ml de fijador (formaldehído al 4% en PBT) y mantener en hielo. Usamos formaldehído embotellada 37-38% como una solución madre.
1. La disección y fijación de las larvas
- Elige una larva de tercer estadio vagar de la pared del frasco y colocarlo en una caída de 50 l de helado de PBS en una placa de la disección Sylgard (hecho de Sylgard 184 kit de elastómero de silicona, Dow Corning Corporation en unplaca de cultivo de tejidos).
- Mantenga la larva, dorso hacia arriba, cerca de los ganchos de la boca, usando unas pinzas finas (Dumont # 5 fórceps), y se adhieren un alfiler entomológico (minutien, 0,1 mm, acero inoxidable) a través del cerebro de la larva.
- Tome el extremo posterior de la larva con las pinzas, tire suavemente y estirar la larva con suavidad a lo largo. Pegue otro número de identificación de insectos entre los dos espiráculos posteriores.
- Usando tijeras resorte cortar dos incisiones horizontales en la pared del cuerpo (perpendicular al eje antero-posterior), cerca de los pasadores anterior y posterior.
- Usando las tijeras de resorte cortar la pared del cuerpo de larvas a lo largo de la línea media dorsal de la parte anterior a la incisión posterior.
- Retire los órganos internos (intestino, las glándulas salivales, los túbulos de Malpighi, etc) y la tráquea usando unas pinzas finas. Lave suavemente una o dos veces con PBS.
- Agarra las aletas del cuerpo dos de la pared con unas pinzas, se extienden hacia fuera y el pin a la placa con dos pasadores de insectos por cada lado.
- Retire el PBS y añadir 50 l de solución de fijación (4% de formaldehído en PBT). Incubar 20 minutos a temperatura ambiente.
- Retire el fijador. Lavar dos veces con PBS. Tire de los pasadores de los insectos. Con unas tijeras de cortar la cabeza de primavera las larvas y la cola dejando un filete rectangular. Transferir el tejido fijado a un tubo Eppendorf refrigerada con PBS.
- Una vez que un número suficiente de larvas se fijan, uno puede continuar directamente a la tinción de anticuerpos. Si la tinción inmediata no se desea, las larvas fijo se debe lavar 3 veces, 5 minutos cada uno, con 95% de etanol y se almacena en 95% de etanol a -20 ° C.
2. La disección y fijación de las pupas
Parte I
- Asistir a los viales como para la fijación de las larvas, hasta que las larvas comienzan a pupariate. Examine todas las larvas de los viales de horas y la marca que han pupariated. Deje que el pupas marcado el desarrollo de 30-40 horas a 24 ° C, o las horas de 24-27 a 29 ° C.
- Con unas pinzas finas tomar pupas de 20-30 ºe adecuada para su edad y ponerlos en una porcelana oscura de múltiples y plato de disección. Tenga cuidado de no dañar los tejidos de interés.
- Extracto de las pupas de la caja de pupa. Comience por despegar el opérculo y continuará hasta que la pupa es libre. Ponga la pupa en un pozo lleno de PBT. Continúa la extracción de todo el pupas. Pasos 2,4-2,6 debe hacerse en pequeños lotes de cinco pupas a la vez.
- Coloque cinco pupas sobre una superficie plana entre los pozos de la placa de disección. Usando un cuchillo disección micro cortar la punta de la cabeza y el extremo posterior del abdomen (alternativamente, es posible utilizar dos pares de pinzas para desgarrar orificios en ambos extremos de las pupas).
- Mantenga la pupa en el lugar usando unas pinzas finas y usar una jeringa de 1 ml para lavar los órganos internos de la pupa, mediante la inyección de PBT a través de la abertura anterior.
- Lave la disección brevemente pupa por inmersión en un pozo lleno de PBS y avanzar en el fijador frío en un tubo Eppendorf en hielo.
- Incubar toda la noche (ON) a 4 ° C.
Parte II
- Deseche el fijador y lavar las pupas tres veces, a 5 minutos cada uno, con PBT. Mantenga las pupas lavado en hielo.
- Llene dos pocillos de la placa de disección con PBT. El uso de un polietileno Pasteur pupas pipeta de transferencia varios a uno de los pozos.
- Mover una pupa en un momento en el segundo pozo. El uso de dos pares de pinzas afiladas con puntas perfectamente alineadas, despegue la cutícula transparente pupa del ala: asegurar la pupa en el fondo del pozo con un par de pinzas, y suavemente romper la cutícula con el segundo par de pinzas. Una vez que la cutícula se rompe, quítelo del ala. Tenga cuidado de no desconectar el ala de la pupa. Después de despegar la cutícula de la hoja ala, continuar el pelado de la cutícula de la bisagra ala (donde las alas se encuentran Chos).
- Después de despegar la cutícula del ala, se puede intentar despegar la cutícula pierna de una manera similar.Muchas piernas es probable que se pierde en el proceso, pero a pesar del bajo rendimiento, este paso es muy recomendable, ya que mejora grandemente la tinción de Chos piernas. Los Chos de la haltera y en el abdomen pueden ser visualizados sin más despegando la cutícula.
- Coloque el 'pelado' pupa en un tubo Eppendorf lleno de metanol y mantener a temperatura ambiente. Seguir despegando la cutícula de todo el pupas, y añadirlos al mismo tubo. Al menos 10 pupas muy bien pelados se deben recoger para cada tinción.
- Retire el metanol y lavar tres veces, a 5 minutos cada uno, con un 95% de etanol. Pupas fijo se puede mantener durante largos periodos de tiempo en el 95% de etanol a -20 ° C.
3. La inmunotinción de larvas y pupas
- Lavar el tejido fijado con PBT tres veces, 30 minutos cada una, a temperatura ambiente. Las larvas se pueden lavar con agitación suave en una placa giratoria. Las pupas se lavan sin agitación.
- Vuelva a colocar el PBT con tampón de bloqueo (PBT + 5% nsuero de cabra ormal) y se incuba a 4 ° C.
- Retire el amortiguador de bloqueo y se incuba con anticuerpos primarios (diluida en solución amortiguadora de bloqueo) a 4 ° C.
- Lavar cuatro veces con PBT tal como se describe en el paso 3.1.
- Retire el PBT y se incuba con anticuerpos secundarios (diluida en solución amortiguadora de bloqueo) a 4 ° C.
- Lavar dos veces con PBT y una vez con PBS como se describe en el paso 3,1.
- Vuelva a colocar la PBS por el medio de montaje (Dako Medio fluorescente de montaje (Dako Cytomation, Glostrup, Dinamarca) y se incuba a 4 ° C en ON.
4. Montaje de larvas
- Las larvas se montan sobre un portaobjetos de microscopio en una gota de medio de montaje con su cutícula hacia abajo y los músculos del cuerpo de la pared hacia arriba. Ponga una pequeña gota de medio de montaje en un cubreobjetos limpio y lo utilizan para cubrir la preparación. No aplique ningún tipo de presión sobre las larvas montado.
5. Montaje de las pupas
- Prepare dos portaobjetos de microscopiocon una gota de medio de montaje, uno para la disección y el segundo para el montaje.
- Ponga pupas varias en una de las diapositivas.
- Usando tijeras resorte retirar la cabeza y la parte posterior del abdomen.
- Separe la parte dorsal del tórax de la mitad ventral mediante la reducción de entre las alas y las piernas.
- Colocar las partes del cuerpo disecados de la pupa en el portaobjetos de microscopio segundos en una gota de solución de montaje. Asegúrese de que las alas y las piernas se estiran y tratar de minimizar la superposición de los tejidos tanto como sea posible.
- Ponga una gota de medio de montaje en un cubreobjetos y se coloca sobre la muestra. No aplique presión sobre la muestra montada.
6. Los resultados representativos
Un ejemplo de inmuno-teñidos de Chos tercera larva se muestra en la Figura 1. Este ejemplo muestra un segmento bien estirado abdominal en la que siete de los ocho Chos son claramente visibles. Las neuronas son de laboratorioELED con MAb22C10 (1:20, obtenido a partir de los Estudios del Desarrollo del Banco hibridoma en la Universidad de Iowa), la tapa, el ligamento, la tapa con el apego y las células del ligamento están marcadas con anti-αTub85E (1:10, Klein et al,. 2010). Secundaria anticuerpos para tinción fluorescente Cy3 fueron, o Cy5-conjugado anti-ratón/conejo (1:200, Jackson ImmunoResearch Laboratories). Las muestras fueron vistos usando microscopía confocal (LSM 510, Zeiss).
Un grupo de Chos ala en la vena ventral radial de un 35 horas de edad, crisálidas se muestra en la Figura 2.

Figura 1 (A) Representación esquemática de los seis tipos de células que constituyen un órgano único: Ch. De fijación de cabeza (CA), la tapa (C), scolopale (S), las neuronas (N), el ligamento (L) y inserción del ligamento (LA ). El órgano LCh5, en el que se agrupan en cinco Chos, se extendía por todo el grupo de músculos laterales transversales (LT1-4). El músculo longitudinal lateral (LL1), ventrales músculos longitudinales (VL1-4) y el músculo lateral oblicua (LO1) también se ilustran. Las células del tendón se muestran como esferas marrones (Tomado de Klein et al., 2010). (B) Un segmento abdominal de un tercio larva vistos en un aumento de 10X. Siete de los ocho Chos presentes en cada segmento abdominal son evidentes: cinco órganos de los laterales que conforman el órgano pentascolopidial (LCh5), un solo órgano lateral (LCh1) y uno de los dos ventrales (Chos VChB). Las neuronas (N) de los Chos se marcan con el marcador neuronal MAb 22C10 (rojo). El ligamento (L), la tapa (C) y las células de fijación (Los Angeles, CA) están marcadas con anti-αTub-85E (azul). Las células de cabeza y de los ligamentos son, además, una etiqueta con un reportero GFP Cho específico de albergar un elemento regulador del locus Dei (Nachman et al, datos no publicados).
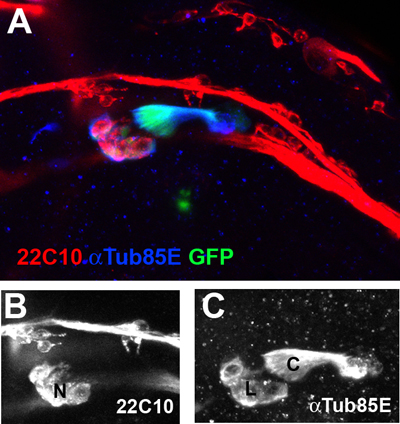
Figura 2. Los órganos de las alas chordotonal en la vena radial ventral, son vistos con un aumento de 40X. Las neuronas (N) están marcados con los marcadores neuronales 22C10 (Rojo, B). El ligamento (L) y la tapa (C) Las células son co-marcadas con anti-anticuerpos (αTub85E Azul, C) y una Cho-específica del transgén GFP reportero (Nachman et al, datos no publicados).
Discusión
El protocolo se describe en este video proporciona una manera de visualizar Chos propioceptivas durante las etapas de larva y pupa. Los estudios sobre la estructura y el desarrollo de Chos propioceptivos han sido hasta ahora limitada principalmente a las fases embrionarias y larvarias discos imaginales. Por lo tanto, muchos aspectos de las etapas posteriores del desarrollo, de Chos tanto larvas y adultos, siguen siendo en gran parte desconocido. El protocolo descrito, junto con herramientas comunes de genética en Drosophila, se puede utilizar para identificar y estudiar nuevos genes y vías que intervienen en las etapas posteriores del desarrollo de Chos. Este protocolo se ha optimizado para la visualización de Cho, pero puede ser adaptado para la tinción de otros tejidos, tales como las alas pupal 6.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a los Estudios del Desarrollo del Banco hibridoma en la Universidad de Iowa para el envío de anticuerpos. Este trabajo fue apoyado por una beca (N º 29/08) de la Fundación Ciencias de Israel. Como también es apoyado por una beca de investigación de la DFG (Deutsche Forschungsgemeinschaft).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / instrumento | Empresa | Número de catálogo | Comentarios |
| Dumont # 5 (o # 55) con fórceps, Biologie la punta | FST | 11252-20 o 11252-10 (O pinzas similares) | |
| Austerlitz pasadores de acero inoxidable de insectos, minutiens 0,1 mm | Roboz Co Instrumental Quirúrgico | RS-6083-10 | |
| Sylgard 184 kit de silicona de elastómero | Dow Corning Corporation | 240.4019862 | |
| Vannas micro tijeras (en línea recta, de 7.5 cm, hoja de 3 mm) | COMO Mdeizintechnik GmbH | 11-590-00 | Tijeras Vannas de primavera con especificaciones idénticas se pueden comprar en Roboz instrumental quirúrgico Co. |
| Agitador orbital - Rotamax-120 | Heidolph | N / A | |
| Dako fluorescente Medio de Montaje | Dako Cytomation, Glostrup, Dinamarca | DK-5302392 | |
| X10 PBS formulación | 2 gr / KCl iluminado, 2 gr / lit KH 2 PO 4, 80 gr / lit NaCl, 21,7 gr / lit Na 2 HPO4.7H 2 O | La calidad de PBS es crítico para el éxito de este protocolo | |
| PBT | X1 PBS + 0,1% de Tween 20 | ||
Referencias
- Brewster, R., Bodmer, R. Origin and specification of type II sensory neurons in Drosophila. Development. 121, 2923-2936 (1995).
- Caldwell, J. C., Miller, M. M., Wing, S., Soll, D. R., Eberl, D. F. Dynamic analysis of larval locomotion in Drosophila chordotonal organ mutants. Proc. Natl. Acad. Sci. U.S.A. 100, 16053-16053 (2003).
- Eberl, D. F. Feeling the vibes: chordotonal mechanisms in insect hearing. Curr. Opin. Neurobiol. 9, 389-393 (1999).
- Eberl, D. F., Boekhoff-Falk, G. Development of Johnston's organ in Drosophila. Int. J. Dev. Biol. 51, 679-687 (2007).
- Eberl, D. F., Hardy, R. W., Kernan, M. J. Genetically similar transduction mechanisms for touch and hearing in Drosophila. J. Neurosci. 20, 5981-5988 (2000).
- Egoz-Matia, N., Nachman, A., Halachmi, N., Toder, M., Klein, Y., Salzberg, A. Spatial regulation of cell adhesion in the Drosophila wing is mediated by Delilah, a potent activator of βPS integrin expression. Dev Biol. 351, 99-109 (2011).
- Field, L. H., Matheson, T. Chordotonal organs of insects. Advances in Insect Physiology. 27, 1-228 (1998).
- Gong, Z., Son, W., Chung, Y. D., Kim, J., Shin, D. W., McClung, C. A., Lee, Y., Lee, H. W., Chang, D. J., Kaang, B. K. Two interdependent TRPV channel subunits, inactive and Nanchung, mediate hearing in Drosophila. J. Neurosci. 24, 9059-9066 (2004).
- Inbal, A., Volk, T., Salzberg, A. Recruitment of ectodermal attachment cells via an EGFR-dependent mechanism during the organogenesis of Drosophila proprioceptors. Dev. Cell. 7, 241-250 (2004).
- Jarman, A. P., Grau, Y., Jan, L. Y., Jan, Y. N. atonal is a proneural gene that directs chordotonal organ formation in the Drosophila peripheral nervous system. Cell. 73, 1307-1321 (1993).
- Jarman, A. P., Sun, Y., Jan, L. Y., Jan, Y. N. Role of the proneural gene, atonal, in formation of Drosophila chordotonal organs and photoreceptors. Development. 121, 2019-2030 (1995).
- Kim, J., Chung, Y. D., Park, D. Y., Choi, S., Shin, D. W., Soh, H., Lee, H. W., Son, W., Yim, J., Park, C. S. A TRPV family ion channel required for hearing in Drosophila. Nature. 424, 81-84 (2003).
- Klein, Y., Halachmi, N., Egoz-Matia, N., Toder, M., Salzberg, A. The proprioceptive and contractile systems in Drosophila are both patterned by the EGR family transcription factor Stripe. Dev. Biol. 337, 458-470 (2010).
- Matthews, K. A., Miller, D. F., Kaufman, T. C. Functional implications of the unusual spatial distribution of a minor alpha-tubulin isotype in Drosophila: a common thread among chordotonal ligaments, developing muscle, and testis cyst cells. Dev. Biol. 137, 171-183 (1990).
- Okabe, M., Okano, H. Two-step induction of chordotonal organ precursors in Drosophila embryogenesis. Development. 124, 1045-1053 (1997).
- Rusten, T. E., Cantera, R., Urban, J., Technau, G., Kafatos, F. C., Barrio, R. Spalt modifies EGFR-mediated induction of chordotonal precursors in the embryonic PNS of Drosophila promoting the development of oenocytes. Development. 128, 711-722 (2001).
- Todi, S. V., Sharma, Y., Eberl, D. F. Anatomical and molecular design of the Drosophila antenna as a flagellar auditory organ. Microsc. Res. Tech. 63, 388-399 (2004).
- zur Lage, P., Jarman, A. P. Antagonism of EGFR and notch signalling in the reiterative recruitment of Drosophila adult chordotonal sense organ precursors. Development. 126, 3149-3159 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados