Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y cultivo de células neuronales de ratas embrionarias: un protocolo rápido
En este artículo
Resumen
Se describe un método rápido para aislar y cultivar las neuronas del hipocampo y la corteza a partir de embriones de roedores. Este protocolo nos permite realizar experimentos en los que los cultivos neuronales casi puros son necesarios.
Resumen
Estamos describiendo un método rápido para disociar y la cultura de las neuronas del hipocampo o la corteza a partir de embriones de rata E15-17. El procedimiento se puede aplicar con éxito para el aislamiento de ratón y humanos neuronas primarias y progenitores neurales. Neuronas disociadas se mantienen en medio libre de suero hasta varias semanas. Estos cultivos pueden ser utilizados para nucleofection, inmunocitoquímica, la preparación de ácidos nucleicos, así como la electrofisiología. Mayores cultivos neuronales también pueden ser transfectadas con una tasa de eficiencia bueno por transducción lentiviral y, menos eficiente, con fosfato de calcio o basados en lípidos métodos tales como lipofectamina.
Protocolo
1. Poly-D-lisina (PDL): Preparación
- Añadir 5 ml de ddH estéril 2 O a 5 mg de PDL para obtener una solución madre de 1 mg / ml.
- Mezcle la solución stock de pipetear varias veces.
- Usar inmediatamente o almacenar poli-D-lisina solución a 2-8 ° C.
2. Poly-D-lisina (PDL): revestimiento de plástico placas de cultivo de células
- Diluir la solución madre de PDL con estéril O ddH 2 a la concentración final de 10 g / ml.
- Pipeta suficiente solución en un plato de 60 mm para cubrir el área cultivo de superficie (3 ml para un plato mm 60).
- Roca suavemente para asegurar un recubrimiento de la superficie de cultivo.
- Incubar las placas revestidas a temperatura ambiente (TA) durante la noche.
- Al día siguiente, por lo general el día de la disección, se retira la solución de poli-D-lisina por aspiración y se lava brevemente con 3 ml de ddH estéril O. 2 Repita este paso. Tras el segundo lavado, eliminar el agua completamente por aspiración.
- Las placas pueden ser almacenadas a 4 ° C durante hasta tres semanas.
3. Poly-D-lisina (PDL) y laminina: Preparación y revestimiento de vidrio de dos cámaras de diapositivas
- Mezcla PDL (1 mg / ml) y laminina (1 mg / ml) en soluciones madre estéril O ddH 2 a la concentración final de 10 y 5 ug / ml, respectivamente.
- Pipeta suficiente solución en los pocillos de un vidrio de dos cámaras de diapositivas para cubrir el área de superficie de cultivo (1 ml para cada pocillo de un vidrio 2 también de dos cámaras de diapositivas).
- Roca suavemente para asegurar un recubrimiento de la superficie de cultivo.
- Incubar las placas revestidas a TA durante la noche.
- Al día siguiente, retire la solución de revestimiento de poli-D-lisina-laminina mediante aspiración y lavar suavemente dos veces con 1 ml de agua estéril ddH 2 O. Tras el segundo lavado, eliminar el agua completamente por aspiración.
- Cámara de diapositivas se puede almacenar a 4 ° C durante hasta tres semanas.
Nota: Cualquier diapositiva cámara de vidrio se pueden recubrir following este protocolo. A menudo utilizamos las diapositivas de dos cámaras, ya que cada diapositiva proporciona la configuración del control de la prueba experimental (por ejemplo, no se trata en comparación con tratamiento, en comparación con untransfected transfectadas).
4. Disección neuronal y Cultura
- Calentar los siguientes reactivos en un baño de agua 37 ° C:
- TrypLE Express en su original botella de 100 ml.
- Neurobasal/B27 medio completo (véase I cuadro). El volumen calentado depende del número de platos para ser chapado (por ejemplo 30 ml de diez placas de 60 mm chapados).
- Añadir 3 ml de solución fría de hibernación E para cuatro placas de 60 mm y 13 ml de cultivo a un tubo de 15 ml BD Falcon polipropileno de alta claridad cónica.
- Añadir 25-30 ml de medio de disección en frío (véase el cuadro II, el Dr. Olimpia Meucci, comunicación personal) para cada uno de los tres platos de 100 mm cultura. Estas placas, que contienen un gran volumen de medio, se utiliza para lavar los embriones inmediatamente después de sula eliminación de las bolsas amnióticas (medidas 4.7 y 4.8).
- La eutanasia de una rata E17 cronometrado embarazada de CO 2 de acuerdo con la Política de Servicios de Salud Pública de Cuidado Humano y Uso de Animales de Laboratorio y bajo un cuidado de los animales y el uso institucionalmente aprobó el protocolo.
- Rociar con el abdomen inferior 70% de EtOH y corte medial a través de la piel y los músculos con un par de tijeras que exponen el útero y los embriones.
- Retire todos los fetos y colóquelos en un recipiente estéril de 100 mm plato que contiene un exceso de medio de disección en frío (25-30 ml, véase el paso 4.3).
- Cortar los embriones con un pequeño par de tijeras de saco amniótico y colocarlos en el segundo plato de 100 mm que contenían medio de disección fría.
- Lavar los embriones a temperatura ambiente inclinando suavemente el plato 100-mm durante 5-10 segundos. Luego, transferir los embriones lavados al plato mm tercera 100 que contiene el medio de disección. Dos lavados en medio de un exceso suelen ser suficientes para eliminar todos los rastros de sangre. Sin embargo, si ncopcuando fuere necesario, lavar una vez más con una nueva de 100 mm, plato que contiene 25-30 ml de medio de disección en frío.
- Utilizando una pinza estereomicroscopio y curvos, extraer el cerebro de cada embrión de rata tirando de la piel y el cráneo. Coloque todo el cerebro en uno de los platos de 60 mm (por lo general, con no más de 5 cerebros por plato) con Hibernate fría E. Mantener estas placas de hielo.
- Tome un plato a la vez y, en virtud de un microscopio de disección, separar los hemisferios y aislar a la eliminación de las cortezas cerebrales del cerebro medio y las meninges.
- Opcional: los cerebros de corte a lo largo de la línea media, extraer los hipocampos, y siga el siguiente procedimiento para aislar las neuronas del hipocampo.
- Recoge todas las cortezas disecados en una de 15 ml tubo transparente cónica que contiene 13 ml de frío Hibernate E. Dejar las cortezas cerebrales en el hielo hasta que todas las disecciones se han completado. Debido a su pequeño tamaño, diseccionaron hipocampos se pueden recoger en un tubo Eppendorf de 1,5 ml en lugar de un tubo de 15 ml. Si se desea, en este paso o cortezashipocampos se puede colocar en un vial que contiene criotubo 1 ml de Hibernar E + 2% B27 + gentamicina (50 mg / ml) + Fungizone (250 ng / ml) en la proporción de 2-4 cortezas o 2-4 hipocampos por vial. El tejido cerebral se puede almacenar a 4 ° C en la oscuridad durante hasta una semana (más tarde los tiempos no han sido probados todavía). Cuando sea necesario, utilice unas pinzas finas para transferir el tejido cerebral a un tubo de 15 ml que contiene Hibernate E y luego seguir el protocolo de abajo para aislar a las neuronas.
- Transferir el tubo a una campana de cultivo de tejidos. Permitir las cortezas se depositen en el fondo del tubo y luego retirar con cuidado el sobrenadante.
- Añadir 13 ml de fresca E Hibernar al tubo cónico de 15 ml, permiten cortezas se depositan en el fondo del tubo y retire cuidadosamente el sobrenadante. Repita este paso 2 veces más y, después del último lavado, retire con cuidado todos los medios de comunicación.
- Enzimáticamente digerir cortezas cerebrales mediante la adición de 1-2 ml (dependiendo del número de cortezas; utilizar menos para el aislamiento del hipocampo) de Tr cálidosypLE Express. Sellar la tapa del tubo con Parafilm y flotar el tubo en un baño de agua a 37 ° C durante 10 minutos.
- Rocíe el tubo con etanol al 70% antes de abrir la tapa y añadir 10 ml de Hibernate E. Permita que las cortezas para ubicarse en la parte inferior del tubo y eliminar el sobrenadante. Repita este paso tres veces para vaciar TrypLE Express. En el último paso, retirar con cuidado todos los medios de comunicación.
- Suavemente triturar (4-5 veces) las cortezas en 2 ml de medio completo Neurobasal/B27 utilizando un pulido al fuego Pasteur de vidrio (aproximadamente 1 mm de diámetro). Tenga cuidado para evitar las burbujas.
- Repetir otro 4-5 veces con una estéril Pasteur de vidrio más pequeña pipeta de diámetro (es decir, una pipeta de 1.2 a 3.4 mm de diámetro). No utilice una pipeta Pasteur o menor que este va a destruir las células.
- Permita que las piezas restantes de tejido (por lo general muy pocos, si los hubiera) para resolver.
- Transferir la parte superior de una sola célula suspensión a un nuevo tubo de 15 ml, dejando tras de piezas colocadas de tejido. Pielther diluir la suspensión de células hasta 10-12 ml con Neurobasal/B27 medio completo.
- Mezclar bien y diluir las células para contar mediante la adición de 10 l de suspensión de células a 490 l de solución de conteo 50x (ver tabla III) en un tubo de 1,5 ml de Eppendorf.
- Células de placas sobre placas recubiertas PDL en la densidad de 5,0 x 10 4 / cm 2. Si nucleofection se va a realizar, se recomienda placas las células a una concentración superior (8-10 x 10 4 / cm 2).
- Normalmente, diseccionar 9-10 fetos por experimento, ya que aproximadamente 13 x 10 6 neuronas se derivan de cada feto E17. Si el número de embriones son necesarios, asegúrese de que todo el procedimiento no durará más de dos horas.
- Si se desea, 24 horas después del aislamiento, 10 M de citosina-β-D-arabinofuranosido (AraC) se puede añadir a cada plato, con el fin de prevenir la proliferación glial. Sin embargo, este paso no es necesario ya que Neurobasal/B27 medio inhibe la proliferación glial, Según las recomendaciones del fabricante (Invitrogen / Gibco).
- Las neuronas pueden ser utilizados para los experimentos después de 4-5 días in vitro, aunque el tiempo exacto depende de la etapa diferenciación deseada. Tenemos neuronas cultivadas para hasta 4 semanas sin una disminución significativa en la supervivencia (Figura 1).
- Para el cultivo prolongado, sustituya medio de cultivo cada semana con recién preparada Neurobasal/B27 medio completo.
5. Los resultados representativos
Las neuronas cultivadas en cámara de diapositivas de cristal puede ser sometido a inmunocitoquímica. Figura 1 muestra una imagen típica de una neurona cortical fijado después de cinco días de cultivo y immunolabeled con anti-MAP-2 anticuerpo para mostrar los procesos neuronales.
La figura 2 muestra una imagen representativa de una neurona del hipocampo de rata después de 3 semanas en cultivo. La morfología neuronal de una célula completamente diferenciada se destaca por el MAP-2 immunolabeling (MAP-2 marcador neuronal, el clon de anticuerpo monoclonal de ratón AP-20, Gene Tex, Irvine, CA), siguiendo un procedimiento estándar que se describió anteriormente 1. Las imágenes se visualizan con la Nikon Eclipse E400 microscopio vertical de fluorescencia equipado con cámara de agua EXI (Qimaging), motor del eje Z, y SlideBook5 adquisición / deconvolución software (Imagen Inteligente Innovations, Inc., Denver, CO). Una serie de imágenes tridimensionales de cada imagen individual se deconvoluted a una imagen bidimensional y se resolvieron mediante el ajuste de la señal de corte a la intensidad máxima cerca de aumentar la resolución.
La Figura 3 muestra la pureza de los cultivos neuronales. Proteína lisados se obtuvieron a partir DIV7 cultivos neuronales de rata (CTX) y de un caso de glioblastoma humano (MBG). Como era de esperar, el lisado neuronal es muy positivo para la proteína neuronal MAP-2 y negativa para el marcador de astrocitos GFAP, mientras que el lisado de proteínas GBM es negativa fo MAP-2 y positivas para GFAP.
Aunque en el protocolo que hemos estado usando Hibernate E durante varios años como medio de disección y aclarado, recientemente, hemos explorado un uso adicional y muy práctica de la misma para preservar los tejidos del cerebro para su uso posterior. La Figura 4 muestra un par de días in vitro 5 (DIV5) la cultura de las neuronas corticales de rata aisladas de cortezas mantenerse a 4 ° C durante una semana en Hibernate E + B27 después de la disección original de los embriones. Las neuronas se cultivaron sobre un vidrio de dos cámaras de diapositivas recubierta con PDL y laminina como se describió previamente. La imagen adquirida se deconvoluted utilizando SlideBook5 adquisición / software de deconvolución como se ha descrito anteriormente (Figura 2).

Figura 1. Imagen representativa de una neurona cortical nucleofected con pmaxGFP (Amaxa, Lonza, Walkersville, MD) y immunolabeled con MAPA-2 De anticuerpos, de color rojo. Magnificación original 100x.
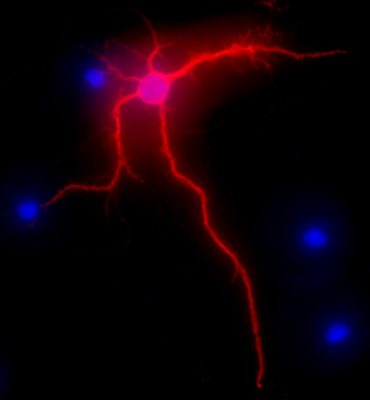
Figura 2. Imagen representativa muestra MAP-2 inmunomarcación, en rojo, de las neuronas del hipocampo después de 3 semanas en cultivo. DAPI, en azul, muestra los núcleos celulares. Magnificación 40x original.

Figura 3. Western blot que muestra la pureza de los cultivos celulares neuronales. 30 g de proteína lisados de rata y humanos neuronales MBG se separaron por electroforesis y se sometió a análisis Western blot siguiendo procedimientos estándar 1. Anti-MAP-2 era un conejo policlonal de Señalización Celular (Danvers, MA), anticuerpo anti-GFAP era un anticuerpo monoclonal de ratón de Chemicon (Millipore, Billerica, MA), y el anticuerpo monoclonal de ratón anti-GRB2 anticuerpo era de Transduction Laboratories (BD Sparks, MD). GRB2 se usó como un control de carga.

Figura 4. Imágenes representativas de los cinco días in vitro (DIV5), las neuronas corticales de rata obtenidos a partir de cortezas que quedan en hibernación E + B27 a 4 ° C durante una semana después de la disección. A) Fase de contraste de las neuronas cultivadas en un vaso de doble cámara de diapositivas. Magnificación original 20X. B) La inmunofluorescencia muestra la expresión de MAP-2 en los procesos neuronales, en verde, el cultivo fue negativo para el marcador de astrocitos GFAP. DAPI, en azul, indica que los núcleos celulares. Magnificación 40x original.
Discusión
El método de disección y cultivo de las neuronas del hipocampo de rata y cortical aquí descrito permite la realización de experimentos utilizando cultivos neuronales casi puros cultivadas en un medio químicamente definido (Figura 3). Aunque los protocolos para el cultivo de las neuronas casi puros en medios libres de suero han sido descritas previamente 2,3,4, hay cambios importantes realizados en nuestro método. A diferencia de los protocolos tradicionales (es decir, Banker et al.)
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a Jonna Ellis por su asistencia editorial. El proyecto descrito fue apoyada por el premio número R01MH079751 (IP: F. Peruzzi) del Instituto Nacional de Salud Mental. El contenido es responsabilidad exclusiva de sus autores y no representa necesariamente las opiniones oficiales del Instituto Nacional de Salud Mental o los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Concentración | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 mM |
Tabla I. Neurobasal/B27 medio completo.
| Reactivo | Concentración |
| Glucosa | 16 mM |
| Sacarosa | 22 mM |
| HEPES | 10 mM |
| NaCl | 160 mM |
| KCl | 5 mM |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0,22 mM |
| Gentamicina | 50 g / ml |
| Fungizone | 250 ng / ml |
| pH | 7.4 |
| Osmolaridad | 320-330 mOsm |
Tabla II. Disección medio.
| Reactivo | Volumen (l) |
| Neurobasal/B27 medio completo | 240 |
| Trypan mancha azul del 0,4% | 250 |
| Total | 490 |
Tabla III. Contando 50x solución.
| Reactivo | Empresa | Cat. número |
| Hibernate E | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| La gentamicina sulfato | Sigma Aldrich | G1264 |
| Glutamax 200 mM | Gibco, Invitrogen | 35050 |
| TrypLE expreso w / o rojo fenol | Gibco, Invitrogen | 12604 |
| Citosina-β-D-arabinofuranosido clorhidrato de | Sigma Aldrich | C6645 |
| Poli-D-lisina | Sigma Aldrich | P6407 |
| La laminina 1 mg / ml | Millipore | CC095 |
| HEPES | Sigma Aldrich | H3375 |
| Trypan mancha azul del 0,4% | Gibco, Invitrogen | 15250 |
Tabla IV. Reactivos específicos.
| Equipo | Empresa | Cat. número |
| Microscopio estéreo | Olimpo | SZ61 |
| Pinzas Grandes | FST | 11022-14 |
| Una pinza fina | Moria | MC40B |
| Micro pinzas de punta fina | Moria | MC31 |
| Afiladas tijeras | Roboz | RS-6820 |
| Micro tijeras de disección | FST | 91460-11 |
| Micro Tijeras de disección curvas | FST | 14067-11 |
| Vidrio 2-cámara portaobjetos | Lab-Tek | 154461 |
| Placas de 60 mm | BD Falcon | 353002 |
| Placas de 100 mm | Corning | 430167 |
| 15 ml tubos | BD Falcon | 352099 |
| 1,5 ml de la crio-tubo vial | Nunc | 375353 |
Tabla V. Equipos específicos.
Referencias
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados