Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Diferenciación dirigida de células madre pluripotentes inducidas hacia los linfocitos T
En este artículo
Resumen
Generación de linfocitos T de madre pluripotentes inducidas (iPS) a las células da un enfoque alternativo de la utilización de células madre embrionarias para células T basada en la inmunoterapia. El método muestra que mediante la utilización de cualquiera In vitro O En vivo Sistema de inducción, las células iPS son capaces de diferenciarse en los linfocitos T, tanto convencionales como antígeno específico.
Resumen
La transferencia de células adoptivo (ACT) de antígenos específicos de células CD8 + linfocitos T citotóxicos (CTL) es un tratamiento prometedor para una variedad de tumores malignos 1. CTL puede reconocer las células malignas mediante la interacción con los antígenos tumorales receptores de células T (TCR), y citotoxinas liberación de citoquinas, así como para matar las células malignas. Se sabe que menos disociados y central-memoria como-(denominado altamente reactivo) CTL son la población óptima para ACT basado en inmunoterapia, porque estos CTL tienen un potencial proliferativo alta, son menos propensos a la apoptosis que las células más diferenciadas y tienen un mayor capacidad para responder a las citoquinas homeostáticos 2-7. Sin embargo, debido a las dificultades en la obtención de un elevado número de linfocitos T citotóxicos tales de los pacientes, hay una necesidad urgente de encontrar un nuevo enfoque para generar altamente reactivos Ag-CTLs específicos para el éxito a base de ACT-terapias.
TCR transducción del vástago auto-renovablecélulas para la reconstitución inmune tiene un potencial terapéutico para el tratamiento de enfermedades 8-10. Sin embargo, el enfoque para obtener células madre embrionarias (CME) de los pacientes no es factible. Aunque el uso de células madre hematopoyéticas (HSC) con fines terapéuticos ha sido ampliamente aplicado en la clínica de 11-13, las CMH se han reducido la capacidad de diferenciación y proliferación, y las CMH son difíciles de crecer en cultivo celular in vitro 14-16. La tecnología reciente de células iPS y el desarrollo de un sistema in vitro para la entrega de genes son capaces de generar células iPS de pacientes sin ningún tipo de abordaje quirúrgico. Además, como CME, las células iPS poseen la capacidad proliferativa indefinida in vitro, y se ha demostrado que se diferencian en células hematopoyéticas. De este modo, las células iPS tienen un mayor potencial para ser utilizado en el ACT basado en inmunoterapia en comparación con los CES o HSCs.
Aquí, se presentan métodos para la generación de linfocitos Tcitos de las células iPS in vitro y en vivo de la programación de antígenos específicos de linfocitos T citotóxicos de las células iPS para la promoción de la vigilancia del cáncer inmunológico. La estimulación in vitro con un ligando muesca impulsa la diferenciación de células T a partir de células iPS, y TCR resultados de transducción de genes en células iPS diferenciadores en antígenos específicos de células T in vivo, lo cual impide el crecimiento del tumor. De este modo, demostramos antígeno específico de la diferenciación de células T a partir de células iPS. Nuestros estudios proporcionan un enfoque potencialmente más eficientes para la generación de antígenos específicos de linfocitos T citotóxicos para las terapias basadas en ACT y facilitar el desarrollo de estrategias terapéuticas para las enfermedades.
Protocolo
1. Cultivo Celular
- Preparación de células alimentadoras irradiados SNL76 / 7 (irSNL76 / 7) para el cultivo.
SNL76 / 7 células generalmente se mantienen en 10% de suero fetal bovino (SFB) de Eagle Modificado por Dulbecco (DMEM) medios de comunicación.- Un plato de cultivo o matraz se recubre con un 0,1% de solución de gelatina en 37 ° C; incubadora durante 30 minutos antes de recuperarse SNL76 / 7 células de nitrógeno líquido.
- Cuando SNL76 / 7 células alcanzan la confluencia, las células se tripsinizaron apagado, se centrifuga a 400 g durante 5 min y se resuspendieron en medio fresco.
- Resuspendidas SNL76 / 7 células se irradiaron en un irradiador 60 Co con una dosis de 5000 rads.
Enfoque alternativo, las células SNL76 / 7 podría ser sustituido por fibroblastos de embriones de ratón (MEF) y mitomicina inactivación-podría reemplazar la irradiación. - Después de la irradiación, las células se centrifugaron a 400 g durante 5 min y se resuspendió en 10% dimetilsulfóxido (DMSO) tampón de FBS congelación, en alícuotacrioviales y conservados en nitrógeno líquido para uso futuro.
- Preparación de OP9-DL1 células para la diferenciación in vitro.
OP9-DL1 células se mantiene generalmente en un 20% de SFB α-medio esencial mínimo (α-MEM) los medios de comunicación. Cuando llegan a las células confluencia se dividirá en una dilución 1:5. - Preparación de células de timoma E.G7.
E.G7 células de timoma se mantiene generalmente en FBS al 10% de Roswell Park Memorial Institute medio (RPMI) -1640 medios. Al llegar a la confluencia, las células se dividen en una dilución de 1:10. - Mantenimiento general de IPS y TCR-transduced células iPS.
- Una placa de cultivo se cubrirá con el 0,1% de solución de gelatina en 37 ° C durante 30 minutos antes de la siembra de células irSNL76 / 7 alimentadoras un día antes de la recuperación o la división de las células iPS.
- Para IPS división células, las células se tripsinizaron apagado, se centrifuga a 400 g durante 5 min y se resuspendió en 15% de SFB medios DMEM.
- IPS TrypsinizedLas células se incubaron en un plato de cultivo fresco durante 30 minutos en 37 ° C incubadora antes de la siembra en plato fresco celular irSNL76 / 7 alimentador prerrevestida para excluir las células diferenciadas y células alimentadoras de residuos.
- Después de la incubación, 4 x 10 6 células se sembraron en una placa de cultivo de 100 mm.
2. En Programación in vitro
- En el sistema de cocultivo in vitro.
- En el día 0, las células iPS 5x10 4 se sembraron sobre una placa de cultivo de 100 mm que contiene confluente OF9-DL1 monocapa celular en FBS 20% α-MEM medios.
- En el día 3, los medios de cultivo se cambió por otras nuevas.
- En el día 5, las células se tripsinizaron fuera y se centrifuga a 400 g durante 5 min antes de la incubación en un plato de cultivo de 100 mm fresco durante 30 minutos en 37 ° C incubadora.
- Células flotantes se recogieron y se contaron, 5x10 5 células se transfieren a un cultivo frescoplato que contiene confluente OF9-DL1 monocapa celular en FBS 20% α-MEM medios. Citoquinas mFlt-3L (concentración final: 5 ng / ml) se añadió en la cultura.
- En el día 8, las células poco adheridas se pipetear suavemente hacia abajo.
- Se lava la capa de alimentación OP9-DL1 con 10 ml de PBS una vez más para obtener la máxima recuperación de la parte diferenciadas las células iPS.
- Después de cosechar las células de la cocultivo, las células se centrifugaron a 400 g durante 5 min y se resuspendió en 20% de SFB alfa-MEM medios suplementados con mFlt-3L (5 ng / ml) y MIL-7 (1 ng / ml).
- Las células se transfieren a una placa de cultivo de 6 pocillos recubiertos con confluentes OP9-DL1 células. Por lo general, las células iPS recuperados de una placa de cultivo de 100 mm se transfirió a un pocillo de la placa 6-bien.
- A partir del día 10, los medios de cultivo se puede cambiar en cualquier otro día (20% de SFB α-MEM medios supplemented con mFlt-3L (5 ng / ml) y MIL-7 (1 ng / ml)).
- Placas de cultivo recubiertas con alimentador OF9-DL1 células se cambiaron en 4-6 días, dependiendo del crecimiento de las células alimentadoras.
- En la maduración in vivo de células iPS parcialmente diferenciadas.
- En el Día 22 de cocultivo, las células iPS se tripsinizaron apagado, se centrifuga a 400 g durante 5 min y se incubaron en un plato de cultivo fresco en 37 ° C durante 30 minutos.
- Células flotantes se recogen, pasa a través de 70 micras colador de nylon para excluir grupos de células que podrían causar embolia pulmonar a los ratones y se lavó tres veces en PBS frío.
- Las células se resuspendieron en PBS con una concentración de 1.5x10 7 células / ml.
- Las células se mantienen en hielo antes de la inyección.
- Antes de la inyección iv a través de la vena de la cola, los ratones se coloca bajo una luz infrarroja para dilatar la vena de la cola.
- Después de la vena dilatation, 200 l suspensión de células o células 3x10 6 se transfiere a un adoptiva de 4 semanas de edad B6.129S7-Rag1 tm1Mom / J del ratón a través de su vena de la cola. Tres semanas son permitidos para la maduración in vivo de la parte diferenciadas las células iPS.
- Evaluación.
- Los cambios morfológicos de las células diferenciadas y las tasas de recuperación de las células. Figura 1.
- En diferentes días de cocultivo con células OP9-DL1, imágenes de células vivas se tomarán bajo el microscopio convencional.
- Tasas de recuperación de células se calcula basándose en el número de células que cosechadas a partir de cultivo.
- Citometría de flujo análisis de los cambios de marcadores de superficie. Figura 2a.
- En diferentes días de cocultivo, las células se eliminará de cultivo por tripsinización y se lavó con PBS frío antes de proceder a la tinción de la superficie celular.
- Antes de teñir el ingenioh diferentes anticuerpos conjugados con fluorocromo, las células se bloquearon por bloqueador Fc 24G2 en 4 ° C durante 20 minutos.
- Después de 20 minutos de tinción en 4 ° C, las células se lavaron tres veces en PBS frío antes del examen de citometría de flujo.
- La activación de células in vitro diferenciadas iPS la figura 2b..
- Un día antes del ensayo de activación, precapa una placa de 24 pocillos con anti-CD3 (concentración final: 4 mg / ml, en PBS) a 4 ° C durante la noche.
- El día 22 de co-cultivo, las células iPS derivadas células T se recogerá a partir de la cultura y se lavó con PBS antes de la estimulación con una placa recubierta con anti-CD3 y soluble anti-CD28 anticuerpos (concentración final: 4 mg / mL).
- La incubación se llevó a cabo en 37 ° C, 5% de CO 2 incubadora durante 40 horas y luego Befeldin A se añadió en cultivo durante otras 4 horas.
- Al final de cocultivo, las células serán Harlavó creados, y bloqueado por bloqueador Fc como se describió anteriormente. Células bloqueados se tiñeron para los marcadores de superficie como la cadena Vβ CD8 y TCR mediante el uso de anticuerpos conjugados con fluorocromos.
- Después de la tinción de la superficie celular, las células se fijará mediante el uso de formaldehído al 4% y permeabilized mediante el uso de equipo de BioLegend de permeabilizante.
- Después de permeabilización, las moléculas intracelulares como la IL-2 y IFN-γ se tiñeron mediante fluorocromo anticuerpos conjugados.
- Antes de examen de citometría de flujo final, las células se lavaron tres veces en PBS frío para excluir anticuerpos excesivas.
- La maduración en Rag-/ - ratones.
- Después de tres semanas de desarrollo in vivo, Rag-/ - ratones se sacrificaron, el bazo y los ganglios linfáticos serán removidos de los ratones.
- Las células individuales se procesan a través de avería mecánica. Los glóbulos rojos se lisaron mediante un tampón de lisis y ACKmononucleocitos se recogió y se lavó dos veces en PBS frío.
- Después del lavado, las células se bloquearon con bloqueador Fc 24G2 en 4 ° C durante 20 minutos y al final de bloqueo, las células se tiñeron con diferentes fluorocromo conjugados anti-CD3, anti-CD4, anti-CD8 y los anticuerpos anti-TCRβ en 4 ° C durante 20 minutos.
- Al final de la tinción, las células se lavaron tres veces en PBS frío antes del examen de citometría de flujo.
- Los cambios morfológicos de las células diferenciadas y las tasas de recuperación de las células. Figura 1.
3. En Programación in vivo
- Generación de construcción retroviral.
- MSCV-IRES-DsRed (MIDR) vector se construye sobre la base de MSCV-IRES-GFP vector sustituyendo el gen de la GFP con el gen DsRed.
- OT-I de células T del gen del receptor se subclonó en el vector MIDR para hacer OT-I/MiDR construir.
- Transducción retroviral y la clasificación de células.
- Plat-E células embalaje are utiliza para generar pseudovirus que se utilizará para la transducción siguiente.
- 3x10 6 E-Plat células se siembran en una cápsula de 100 mm cultura un día antes de la transfección.
- En el día 0, Plat-E células se transfectaron con OT-I MIDR plásmido mediante el uso de reactivo GeneJamma transfección.
- El día 1, 1x10 6 células iPS se sembraron en un pozo de un 0,1% de gelatina prerrevestida placa de 24 pocillos.
- El día 2, pseudovirus sobrenadante que contiene desde Plat-E la cultura se recogerán y se pasa a través de un 0,4 micras de filtro para excluir a posibles contaminantes.
- La transducción se llevará a cabo bajo la condición de 32 ° C centrífuga a 1400 rpm durante 1 hora en presencia de 5 g / ml de polibreno.
- Después de centrifugar basado en la transducción, las células se colocan en 32 ° C, 5% de CO 2 incubadora durante la noche.
- El día 3, repetir el día 2 transduction procedimiento como se describió anteriormente. Una placa de 6 pocillos se pre-revestido con células irSNL76 / 7 de conexión para su uso futuro.
- En el día 4, las células transducidas iPS se tripsinizaron apagado, se centrifuga a 400 g durante 5 min y se sembraron en precubiertos células alimentadoras irSNL76 / 7.
- En la confluencia, las células se tripsinizaron apagado, se centrifuga a 400 g durante 5 min y se procesaron para la clasificación de células. Las buenas prácticas agrarias y DsRed células doble positivas, serán ordenados por clasificador de células MoFlo. Células clasificadas se cultivaron en células alimentadoras irSNL76 / 7 para su uso futuro.
- Plat-E células embalaje are utiliza para generar pseudovirus que se utilizará para la transducción siguiente.
- La transferencia adoptiva y el desafío del tumor.
OT-I TCR transducidas iPS (OT-I/iPS) las células se mantiene generalmente en células alimentadoras irSNL76 / 7 como se describe anteriormente.- En el día de la transferencia adoptiva, las células se tripsinizan OT-I/iPS apagado, se centrifuga a 400 g durante 5 min y se resuspendieron en medio fresco.
- 30 minutos de incubación en una placa de cultivo fresco en la incubadora de 37 ° C se requiere para eliminar células diferenciadasy remanentes de células alimentadoras.
- Al final de la incubación, las células flotantes se recogen y se centrifuga a 400 g durante 5 min.
- Sedimento celular se lavó en PBS frío durante tres veces, y las células se hace pasar por un tamiz de nylon 70 micras entre dos lavados de excluir grupos de células (2X filtración).
- Después del lavado, las células se contaron y se resuspendieron en PBS frío en una concentración de 1.5x10 7 células / ml.
- Las células se mantienen en hielo antes de la inyección.
- Para la transferencia adoptiva, 4-6 semanas de edad ratones hembra C57BL/6J se utilizará. Antes de la inyección iv a través de la vena de la cola, los ratones se coloca bajo una luz infrarroja para dilatar las venas de la cola.
- Después de la dilatación venosa, 200 l suspensión de células o células 3x10 6 se adoptivamente transferido a través de la vena de la cola. Seis semanas será permitido para la maduración in vivo de OT-I TCR transducidas células iPS.
- Después de seis semanas de la inyección iv, 4x10 6 células E.G7 timoma se inocularon por vía intraperitoneal.
- E.G7 células de timoma se recogerán a partir de cultivo y se lavó tres veces en PBS.
- Al final del lavado, las células se suspendieron en PBS frío en una concentración de 8x10 7 células / ml.
- 50 l suspensión de células o 4x10 6 células se inyecta en la cavidad peritoneal.
- Evaluación.
- In vitro, la caracterización de OT-I TCR transducidas células iPS.
- Fluorescente examen microscópico de DsRed, las buenas prácticas agrarias de células positivas dobles se llevará a cabo bajo microscopio de fluorescencia convencional con células vivas no fijadas.
- La integración de la expresión génica y serán analizados por PCR y análisis de RT-PCR.
- Cellular DNA o RNA se aisló por separado a partir de muestras mediante el uso de ADN de Qiagen oKit de aislamiento de ARN.
- PCR y RT-PCR se realizó mediante el uso de cebadores que reconocen específicamente la región VDJ recombinada del TCR Vβ5 cadena.
- El desarrollo de células T y la maduración. Figura 3a.
- En la semana 2, 4 y 6 de la célula después de la transferencia, los animales se sacrificaron y los nodos de bazo, nódulos será eliminado de los animales.
- Única suspensión celular se realiza a través de avería mecánica. Los glóbulos rojos se lisaron mediante un tampón de lisis ACK y mononucleocitos se recogió y se lavó dos veces en PBS frío.
- Después del lavado, las células se bloquearon con bloqueador Fc 24G2 en 4 ° C durante 20 minutos y al final de bloqueo, las células se aliquotted y teñidas con diferentes anticuerpos conjugados fluorocromo en 4 ° C durante 20 minutos.
- Al final de la tinción, las células se lavaron tres veces en PBS frío antes de cargar el citómetro de flujo.
- Estimulación de péptidos. Figura 3b.
- El día 50 de reto tumoral, los animales serán sacrificados y los ganglios del bazo, nódulos se hayan extraído de animales.
- Única suspensión celular se realiza a través de avería mecánica. Los glóbulos rojos se lisaron mediante un tampón de lisis ACK y mononucleocitos se recogió y se lavó dos veces en PBS frío.
- Linfocitos T CD8 + se aisló mediante el uso de células CD8 + de Miltenyi Biotec de células T Kit de aislamiento. Aisladas células T CD8 + se mezclará con esplenocitos irradiados aisladas de los ratones no tratados C57BL/6J en la proporción de 1:10 y se pulsan con 0,5 mmol / ml OVA 257-264 péptido durante 40 horas. A partir de entonces, Brefeldina A se añadirá a la cultura de otras 4 horas.
- Al final de cocultivo, las células se recogen, se lavan y se bloquearon por bloqueador Fc como se describió anteriormente.
- Células bloqueados se tiñeron para la marca de la superficieres como CD8 y TCR Vβ5 la cadena mediante el uso de anticuerpos conjugados con fluorocromos.
- Después de la tinción de la superficie celular, las células se fijará mediante el uso de formaldehído al 4% y permeabilized mediante el uso de equipo de permeabilización celular.
- Después de permeabilización, las moléculas intracelulares como la IL-2 y IFN-γ se tiñeron mediante fluorocromo anticuerpos conjugados.
- Antes de examen de citometría de flujo final, las células se lavaron tres veces en PBS frío para excluir anticuerpos excesivas.
- In vivo matando ensayo. Figura 3C.
- Los esplenocitos de los ratones no tratados C57BL/6J serán aislados y marcados con carboxifluoresceína succinimidil éster (CFSE) como células diana.
- Las células marcadas con 5 mol / ml CFSE (células CFSE hi) se pulsaron con 10 mg / ml OVA 257-264 péptido y las células marcadas con 0,5 mol / ml CFSE (CFSE células LO) no se pulsaron.
- Una mezcla de 2.5x10 6 células CFSE hi más 2.5x10 6 células CFSE LO será adoptively transferido por vía iv en destinatario indicado.
- Después de 16 horas, esplenocitos de los ratones se aisló y células CFSE + se analizaron por citometría de flujo.
- Tumoral intraperitoneal recuento de células. Figura 4.
Al día 20 de desafío del tumor, los ratones se sacrificaron y lavado cavidad peritoneal se realiza mediante el uso de PBS frío. El lavado peritoneal se recuperó las células tumorales se contará. - Tumor de células T infiltrantes de identificación. Figura 5.
- En la última etapa de desafío del tumor, los ratones se sacrificaron y el tumor se retira de la cavidad peritoneal de los diferentes grupos.
- El tumor se corta en trozos, de una sola pieza se pondrá en un criovial y se coloca en hielo seco de inmediato, la otra mitad se fija en laformaldehído y una tercera pieza se conserva en RPMI acondicionado-1640 para uso futuro.
- Tinción H & E se llevará a cabo según el protocolo general de formaldehído y fija las muestras de parafina envueltos.
- Tinción por inmunofluorescencia se llevará a cabo en muestras criopreservadas.
- Tejido será seccionada y en conserva a -20 ° C antes de su uso.
- Las secciones de tejido será secó al aire 15 minutos antes de los 15 minutos fijación acetona fría.
- Después de la fijación, las secciones será seca al aire durante otros 15 minutos antes de 5 minutos de lavado PBS.
- Después de diapositivas de lavado lugar, en una cámara húmeda y cubrir la sección de tejido con 30 l 3% de BSA en PBS durante 30 minutos para bloquear la unión no específica.
- Al final del bloqueo, borra de tampón de bloqueo y cubrir las secciones de tejido con una mezcla de 50 l de PE-anti-TCR Vα2 anticuerpos y anticuerpos FITC anti-OVA diluidas en 3% de BSAen PBS.
- Incubar en una cámara húmeda durante 2 horas y al final de la incubación, los portaobjetos se lavaron tres veces en PBS frío y se monta con un medio a base de agua de montaje antes fluorescente examen microscópico.
- Citometría de flujo análisis de las células T tumor infiltrante.
- El tumor será aplastado en suspensión de células individuales y los glóbulos rojos se lisaron con el tampón de lisis ACK.
- Después de lavar y de bloqueo, las células se etiqueta con diferentes anticuerpos conjugados fluorocromo que reconocen específicamente CD8, TCR Vα2 y TCR V β5 moléculas que expresadas en la superficie celular.
- Supervivencia de los ratones. Figura 6.
Después de la exposición del tumor, la supervivencia del ratón se vigilará de cerca.
- In vitro, la caracterización de OT-I TCR transducidas células iPS.
4. Los resultados representativos
CD3 y TCRβ se utilizan como marcadores de Tcélulas. Para determinar si la estimulación de las células iPS con la muesca DL1 ligando podría contribuir a la diferenciación de células T, se evaluó la expresión de CD3 y + TCRβ en iPS células derivadas de células, y la expresión más analizado de CD4 y CD8, apertura de puerta en CD3 + y + TCRβ población. Como se muestra aquí, el día 22, CD3 + CD4 + TCRβ - CD8 + individuales positivos (SP) las células T se generaron a partir de células iPS in vitro. Además, los derivados de células iPS células SP-fueron capaces de producir IL-2 y IFN-γ cuando se estimulan in vitro mediante la placa recubierta con anti-CD3 y CD28 solubles anticuerpos anti-(fig. 2), lo que sugiere las iPS derivadas de células Las células T son funcionales.
Después de la transferencia adoptiva en ratones receptores, la mayoría de TCR-gen células transducidas iPS sometió a la diferenciación en células CD8 + CTL, que respondían a la estimulación in vitro de péptido por síhormigonado de IL-2 y IFN-γ (fig. 3). Lo más importante es la transferencia adoptiva de TCR-transduced células iPS provocado la infiltración de linfocitos T citotóxicos OVA-reactivas en los tejidos tumorales y animales protegidas del reto tumoral (Fig. 5-6). Por lo tanto, el gen TCR transducidas células iPS pueden diferenciarse en funcionales específicas de antígeno-CTL in vivo.

Figura 1. Morfología de diferenciación de las células iPS. En varios días, las células iPS de ratón fueron co-cultivadas con OF9-DL1 células en α-MEM suplementado con 20% de FCS y 2,2 g / l de bicarbonato de sodio en presencia de 5 ng / ml mFlt3L y 1 ng / ml de mIL-7 .
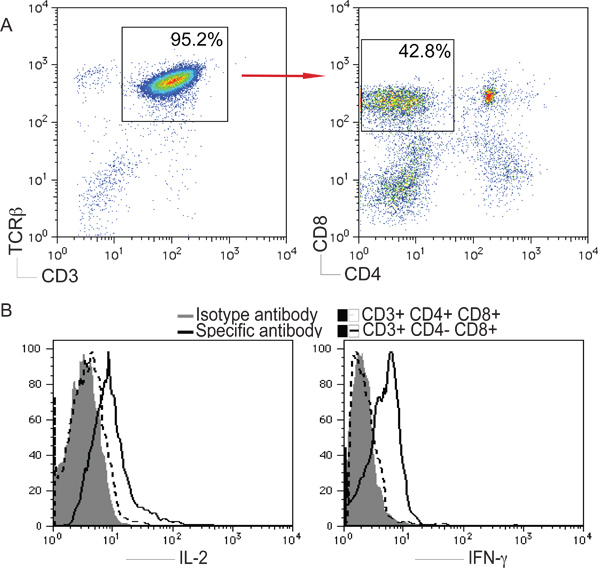
Figura 2. Diferenciación de las células T a partir de células iPS. Ratones células iPS fueron co-cultivadas con OF9-DL1 células como se describe en la Figura 1. En el díaay 22, derivadas de células iPS células se aislaron y analizaron. A) CD4 + CD8 - o CD4 - CD8 + después de la inyección en CD3 + y + TCRβ poblaciones. B) Las células se estimularon con la placa revestida con anti-CD3 y anti-CD28 soluble anticuerpos durante 5 horas a 37 ° C en 5% de CO 2. IL-2 e IFN-γ-fueron analizados por tinción intracelular, después de la inyección en células CD4 en vivo - linfocitos T CD8 +.
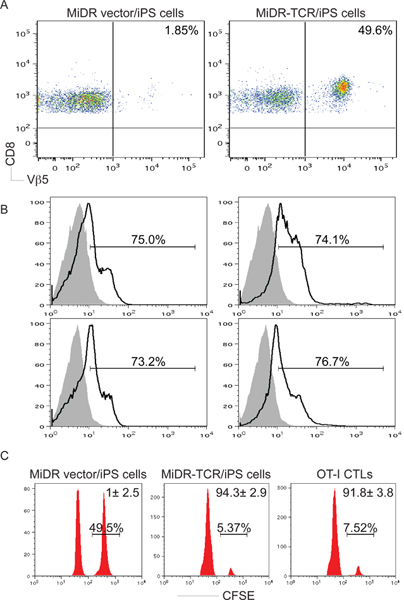
Figura 3. Antígeno CD8 + específicas de desarrollo de células T a partir de células iPS en vivo. OT-I-gen TCR transducidas células iPS fueron inyectados iv en ratones C57BL / 6. Después de seis a diez semanas, OVA-CD8 + específicas Vβ5 + desarrollo de células T se determinó. A) CD8 + Vβ5 + células T de LN agrupados y el bazo fueron analizadas por citometría de flujo, después de la inyección en CD8 poblaciones +. B) la IL-2 e IFN-γ producción (líneas oscuras, áreas sombreadas corresponden a controles de isotipo) se determinaron por tinción intracelular de citoquinas, después de la inyección en los CD8 + + Vβ5 poblaciones. C) En vivo proliferación / citotoxicidad del ensayo. CFSE alta (picos de la derecha) y he aquí CFSE (picos de izquierdas) las células diana fueron pulsadas con OVA 257-264 péptido y el control, respectivamente, y se inyectaron en ratones diez semanas después de la transferencia de células iPS o un día después de que la transferencia de OT-CTL.

La transferencia de la figura 4. Adoptivo de OT-I gen TCR-transduced células iPS suprime el crecimiento tumoral. OT-I-gen TCR transducidas células iPS fueron trasladados adoptiva en ratones C57BL / 6. Un grupo de ratones fue inyectado con OVA-reactiva células T CD8 + de OT-I TCR ratones transgénicos, y un grupo de ratones no tenía la transferencia de células. Después de seis semanas, ya sea o el día siguiente después de la transferencia de células, los ratones fueron sometidos a desafiar con las células tumorales E. G-7. El día 20, las células tumorales en la cavidad peritoneal se enumeran.
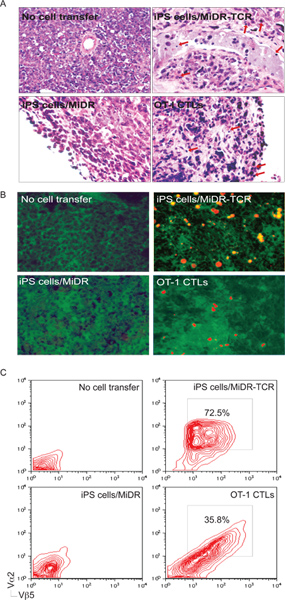
IPS Figura 5. Derivado de células antígeno-específica CTL infiltrarse en los tejidos tumorales. En el día 30 a 35 después del desafío del tumor, los tejidos tumorales fueron examinados para el tumor reactiva infiltración de células T. A) H & E tinción. Las células inflamatorias infiltrado en los tejidos tumorales (↓). B) Marcaje inmunohistoquímico. OVA específica Vα2 CTL + (rojo) se infiltraron en OVA-que expresan los tejidos tumorales (verde). C) Single-suspensiones de células de los tejidos tumorales se analizaron para la expresión de Vα2 + y + Vβ5 por citometría de flujo, después de la inyección en la población CD8 +.

Figura 6. La transferencia adoptiva de OT-I gen TCR-transduced células iPS sostiene supervivencia de los ratones. OVA gen TCR-transduced células iPS fueron trasladados adoptiva en ratones C57BL / 6 que fueron sometidos a desafío con E. células tumorales del G-7 como se describe en la figura. 4. Supervivencia de los ratones el día 50 fue mostrado por las curvas de supervivencia Kaplan-Meier (n = 6).
Access restricted. Please log in or start a trial to view this content.
Discusión
Para ACT terapias basadas en la generación in vitro de un gran número de Ag altamente reactivos específicos de las células T in vivo para la re-perfusión es una solución óptima. Aunque nuestro método in vitro da lugar funcional de las células T a partir de células iPS, un gran número de células iPS derivadas de las células mueren en cuatro semanas, sobre todo en la cuarta semana. Se concluye que las señales de supervivencia de señalización Notch mediada por el DL1 así co...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Agradecemos al Dr. Shinya Yamanaka (Universidad de Kyoto) para proporcionar iPS-MEF-Ng-20D-17 línea celular, el Dr. Darío Vignali (Hospital St. Jude Childrens Research) para apoyar la OT1-2A • pMig II construcción, el Dr. Juan Carlos Zúñiga Pflucker (Departamento de Inmunología de la Universidad de Toronto) para el apoyo a la línea celular OP9-DL1, y el Dr. Kent Vrana E (Departamento de Farmacología de la Universidad de Penn State College of Medicine) para ayudar al diseño de este estudio. Este proyecto está financiado, en virtud de concesiones con el número de concesión K18CA151798 del Instituto Nacional del Cáncer, la Fundación Barsumian y el Melanoma Research Foundation (canción J.).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| C57BL/6J ratones | Jackson Laboratory | 000664 | |
| B6.129S7-Rag1 tm1Mom / J | Jackson Laboratory | 002216 | |
| Anti-CD3 (2C11) anticuerpo | BD PharMingen | 553058 | |
| Anti-CD28 (37,51) de anticuerpos | BD PharMingen | 553295 | |
| Anti-CD3 (17A2) de anticuerpos | BioLegend | 100202 | |
| Los anti-CD4 (GK1.5) de anticuerpos | BioLegend | 100417 | |
| Anti-CD8 (53-6,7) de anticuerpos | BioLegend | 100714 | |
| Anti-CD25 (3C7) de anticuerpos | BioLegend | 101912 | |
| Unti-CD44 (1M7) de anticuerpos | BioLegend | 103012 | |
| Anti-CD117 (2B8) de anticuerpos | BioLegend | 105812 | |
| Anti-TCR-β (H57597) de anticuerpos | BioLegend | 109220 | |
| Anti-IL-2 (JES6-5H4) anticuerpo | BioLegend | 503810 | |
| Anti-IFN-γ (XMG1.2) de anticuerpos | BioLegend | 505822 | |
| DMEM | Invitrogen | ABCD1234 | |
| α-MEM | Invitrogen | A10490-01 | |
| FBS | HyClone | SH3007.01 | |
| Un Brefeldin | Sigma | B7651 | |
| Polybrene | Sigma | 107689 | |
| GeneJammer | Integrado de Ciencias | 204130 | |
| ARN kit | Qiagen | 74104 | |
| ADN kit | Qiagen | 69504 | |
| CD8 kit de aislamiento | Miltenyi Biotec | 130-095-236 | |
| Tampón de lisis ACK | Lonza | 10-548E | |
| mFlt-3L | PeproTech | 250-31L | |
| mIL-7 | PeproTech | 217-17 | |
| Gelatina | Sigma | G9391 | |
| FITC anti-OVA anticuerpo | Rockland Immunochemicals | 200-4233 | |
| Permeabilización de amortiguación | BioLegend | 421002 | |
| BSA | Sigma | A7906 | |
| Formaldehído | Sigma | F8775 | |
| 0,4 m de filtro | Millipore | ||
| MoFlo clasificador de células | Dake Cytomation | ||
| Calibur citómetro de flujo | BD | ||
| LSR II citómetro de flujo | BD | ||
| Ratón inmovilización | Braintree Científico |
Referencias
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. Med, N. .E. ngl.J. . 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados