Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El análisis de la maduración pulmonar de células dendríticas y migración durante la inflamación de las vías alérgica
En este artículo
Resumen
Se describe una estrategia para controlar la maduración y la migración de las células dendríticas pulmonares en respuesta a la ovoalbúmina en la configuración de las vías respiratorias inflamación inducida por ovalbúmina alérgica. Esta estrategia se puede modificar para evaluar la migración de las células dendríticas pulmonares en la configuración de la infección.
Resumen
Las células dendríticas (DC) son los principales actores implicados en la iniciación de la respuesta inmune adaptativa mediante la activación de antígenos específicos de células T. Los países en desarrollo están presentes en los tejidos periféricos en estado estacionario, sin embargo, en respuesta a la estimulación antigénica, los países en desarrollo ocupan el antígeno y rápidamente migran a los ganglios linfáticos que drenan en el que inician la respuesta de células T contra el antígeno de 1,2. Además, los países en desarrollo también desempeñan un papel clave en la iniciación de la respuesta inmunitaria autoinmune, así como alérgica 3.
Los países en desarrollo desempeñan un papel esencial tanto en la iniciación de la respuesta inmune y la inducción de la tolerancia en el ámbito del medio ambiente de pulmón 4. Entorno de pulmón es en gran parte tolerogénico, debido a la exposición a la amplia gama de antígenos ambientales 5. Sin embargo, en algunos individuos hay una ruptura en la tolerancia, lo que conduce a la inducción de la alergia y el asma. En este estudio, se describe una estrategia, que se puede utilizar para controlar las vías respiratorias maduración DC y MIGración en respuesta al antígeno utilizado para la sensibilización. La medición de las vías respiratorias maduración de las DC y la migración permite la evaluación de la cinética de la respuesta inmune durante la inflamación las vías respiratorias alérgicas y también ayuda a comprender la magnitud de la posterior respuesta inmune junto con los mecanismos subyacentes.
Nuestra estrategia se basa en la utilización de ovoalbúmina como agente sensibilizante. Ovoalbúmina inducida por el asma alérgica es un modelo ampliamente utilizado para reproducir la eosinofilia las vías respiratorias, inflamación pulmonar y niveles elevados de IgE se encuentran en el asma 6,7. Después de la sensibilización, los ratones son desafiados por la administración intranasal de ovoalbúmina marcado con FITC, lo que permite el etiquetado específico de los países en desarrollo las vías respiratorias, que la captación de ovoalbúmina. A continuación, utilizando varios marcadores específicos de CC, podemos evaluar la maduración de estos países en desarrollo y también se puede evaluar su migración a los ganglios linfáticos de drenaje mediante el empleo de la citometría de flujo.
Protocolo
1. Sensibilización de los ratones con ovoalbúmina
- Preparar una solución de OVA (grado V, Sigma, MO) en PBS estéril a una concentración de 1 mg / ml (solución puede ser almacenada a -80 ° C).
- A fin de preparar OVA-Alum mezcla, tomar alumbre en un tubo y añadir solución OVA en una gota a gota mientras vórtex el tubo en una proporción de 1:1. Revuelva la mezcla durante 30 minutos y utilizar de inmediato después de la mezcla.
- Utilizando una jeringa de 1 ml, inyectar 0,2 ml de la mezcla en la cavidad peritoneal de ratón y repetir la inyección de nuevo después de 2 semanas.
2. Desafío intranasal de ratones con ovoalbúmina marcado con FITC
- 7 días después de la segunda inyección de OVA-Alum, los ratones están listos para ser desafiados por vía intranasal con OVA-FITC.
- Preparar una solución de OVA-FITC (Sigma) utilizando PBS estéril a una concentración de 1 mg / ml y se conserva en alícuotas a -80 ° C.
- Colocar una gasa estéril en la parte inferior de un tubo de 50 ml Falcon y en un h químicaud, añadir 5 ml de Aerrane en la gasa. Con el fin de anestesiar ratones, dirigir el animal en el tubo de aproximadamente 5-10 segundos.
- Sostenga el animal anestesiado en posición vertical y el uso de puntas de pipeta estériles, los Pipetear 100 L de la solución de OVA-FITC en las fosas nasales de los ratones de una forma gota a gota.
- Repita el desafío intranasal con OVA-FITC para los próximos dos días.
3. Preparación de una sola célula de la suspensión de los pulmones y los ganglios linfáticos que drenan
- El sacrificio de los ratones con la inyección intraperitoneal de Euthanyl.
- Con el fin de reducir la contaminación de macrófagos, que pueden complicar el análisis de CC, lavado pulmonar se lleva a cabo. Para el lavado de los pulmones, tráquea del ratón se expone brevemente y se canuló con un catéter y una jeringa, con helado de PBS con 5 mM EDTA, el tracto respiratorio inferior se lava 3 veces para eliminar las células de los espacios alveolares.
- Perfundir los pulmones con 10 ml de PBS que contenía 10 U / ml Heparen a través del ventrículo derecho del corazón, para eliminar las células de sangre de la vasculatura pulmonar. Realizar las perfusiones hasta que los pulmones se vuelven blancas, lo que indica la eliminación de la mayoría de las células sanguíneas. Esto es especialmente importante para eliminar las células contaminantes de la sangre periférica.
- Diseccionar los pulmones y para quitar los ganglios linfáticos del mediastino (MLN) y poner los ganglios linfáticos en un plato aparte. (Trate de minimizar la exposición de los tejidos a la luz para evitar la extinción de la fluorescencia FITC).
- Coloque los pulmones en una placa de Petri y picar con unas tijeras. Siguiente digerir los pulmones durante 25 minutos a 37 ° C con 250 U / ml de colagenasa D (Roche) y añadir EDTA (10 mM concentración final) para los próximos 5 minutos para detener la actividad de la colagenasa.
- Pase los fragmentos de los pulmones digeridos a través de un colador 100 m celular y la lisis hipotónica para eliminar los eritrocitos. La suspensión de células individuales está listo para su posterior análisis de los países en desarrollo.
- A fin de preparar suspensión de células individuales de la MLN, taliviar el MLN utilizando agujas finas y digerir con colagenasa como se describió anteriormente seguido por el esfuerzo a través de un filtro de células.
4. La tinción de DC marcadores para evaluar la maduración / migración
- Con el fin de identificar los países en desarrollo en los pulmones, la tinción se lleva a cabo para CD11c y CD11b. Además de evaluar la maduración, la coloración se realiza para CD86 y CD80, que se reguló en los países en desarrollo someterse a la maduración. CD11c + CD11b + OVA-FITC + en las células del MLN se identifican como países en desarrollo pulmonar que migran desde los pulmones al MLN en respuesta al reto de las vías respiratorias OVA.
- Suspender las células a una concentración de 10 x 10 6 células / ml en tampón FACS (PBS con FBS al 1% y EDTA 1 mM) y alícuota 150 l de suspensión de células / tubo para la tinción FACS. Para la identificación de los países en desarrollo pulmonar, las manchas se necesitan los siguientes: el control no teñida (células de pulmón de los ratones no expuestos a la OVA-FITC), OVA-FITC, control de CD11c sola, CD11b solo mando, CD11b+ CD11c + doble control, CD11b + OVA-FITC + doble control, CD11c + OVA-FITC + doble control, MHC II de control único, el control de un solo CD86, CD80 única de control y las muestras teñidas con OVA-FITC + CD11c + CD11b + + MHCII , OVA-FITC + CD11c + CD86 + CD11b + y OVA-FITC + CD11c + CD80 + CD11b +.
- Para evaluar la migración de CC, realizar recuentos absolutos de células de la suspensión de células individuales del MLN y, posteriormente, preparar los tubos siguientes: control de células sin teñir (MLN de los ratones no expuestos a la OVA-FITC), el control de OVA-FITC, CD11c + control único, CD11b + doble control, el control de CD11b + OVA-FITC + doble, control de CD11c + OVA-FITC + doble y CD11c + CD11b + OVA-FITC + muestras.
5. Los resultados representativos
Los puntos de tiempo requeridos para la sensibilización intraperitoneal para inducir inflamación de las vías alérgica es importante y debe ser llevado a cabo como se representa en la Figura 1. Tras la sensibilización intraperitoneal y OVA desafío vías respiratorias, para confirmar la inducción de la inflamación de las vías alérgica, algunos ratones pueden ser sacrificados y los análisis histológicos puede llevarse a cabo en las secciones de pulmón, como se muestra en la Figura 2. La presencia de células inflamatorias puede ser confirmado por Hematoxilina y Eosina (Figura 2A) y la presencia de la producción de moco puede ser evaluada por ácido periódico de Schiff-tinción (Figura 2B). En total, esto confirma la inducción de la inflamación de las vías respiratorias alérgicas después de OVA desafío de OVA-ratones sensibilizados a 8. En contraste, las secciones de pulmón de solución salina ratones tratados se espera que sea libre de cualquier inflamación junto con ausencia de cualquier producción de moco. Por otra parte, OVA desafío siguiente, pulmonar unde los países en desarrollo RGO maduración y posterior migración a los ganglios linfáticos de drenaje. El análisis de células CD11c + en los ganglios linfáticos del mediastino (MLN) de los ratones sensibilizados y desafiados con OVA se espera que muestre una mayor proporción de células CD11c + en comparación con los ratones tratados con solución salina (Figura 3). Además, el análisis del recuento de linfocitos absoluto de CD11c + CD11b + OVA-FITC + en las células en el MLN de los ratones OVA-sensibilizado y desafiado, se espera que muestre un valor significativamente mayor (es decir, varias veces superior) cuenta que los homólogos de los ratones tratados con solución salina ( Figura 3B).
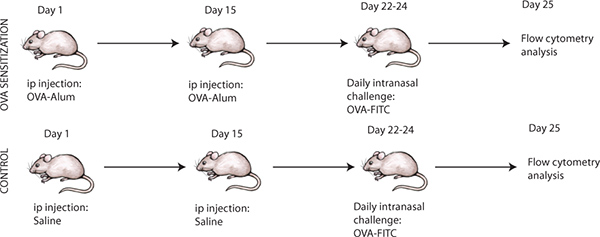
Figura 1. Protocolo experimental para la inducción de la ovoalbúmina (OVA) la inflamación inducida por las vías respiratorias alérgicas en ratones junto con el reto de las vías respiratorias con marcado con FITC ovoalbúmina (OVA-FITC).
fig2.jpg "/>
Sensibilización Figura 2. OVA seguido por las vías respiratorias reto OVA conduce a la inducción de la inflamación de las vías alérgica identificadas por tinción de hematoxilina y eosina de secciones de pulmón se muestran en (A) y también conduce a la producción de moco en las vías respiratorias como identificadas por tinción periódico de Schiff ácido de pulmón secciones como se muestra en (B).

Figura 3. OVA-FITC desafío induce la migración de CC de los pulmones a los ganglios linfáticos del mediastino (MLN). (A) parcelas de citometría de flujo que representa la proporción de células CD11c + en el MLN de control o los ratones sensibilizados con OVA. (B) Los recuentos absolutos de CD11c + células CD11b + + OVA-FITC en el MLN de los ratones solución salina u OVA sensibilizado. * P <0,05. Haga clic aquí para ver más grande la figura .
Access restricted. Please log in or start a trial to view this content.
Discusión
El método que aquí se presenta ofrece un enfoque basado en la citometría de flujo para el análisis de los países en desarrollo pulmonar, con base en la entrega de OVA-FITC para el desafío de las vías respiratorias. Esto permite el control selectivo de los países en desarrollo pulmonar, que ocupan un OVA-FITC y por lo tanto, las poblaciones de CC, que se controlan son efectivamente los que participan en la respuesta inmune vías respiratorias durante el curso de la inflamación inducida por OVA las vías respirat...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por CIHR y CF subvenciones a Canadá el Dr. Jim Hu y por una beca de doctorado otorgado a Rahul Kushwah por CF Canadá.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Ovoalbúmina | Sigma-Aldrich | A5503 | |
| Alumbre | Thermo Scientific | 77161 | |
| OVA-FITC | Sigma-Aldrich | A9771 | |
| Colagenasa D | Roche | 11088858001 | |
| Anticuerpos | e-Bioscience |
Referencias
- Kushwah, R., Hu, J. Role of dendritic cells in the induction of regulatory T cells. Cell Biosci. 20, (2011).
- Kushwah, R., Hu, J. Complexity of dendritic cell subsets and their function in the host immune system. Immunology. 133, 409-419 (2011).
- Lambrecht, B. N., Hammad, H. Taking our breath away: dendritic cells in the pathogenesis of asthma. Nat Rev Immunol. 3, 994-1003 (2003).
- Hammad, H., Lambrecht, B. N. Dendritic cells and epithelial cells: linking innate and adaptive immunity in asthma. Nat. Rev. Immunol. 8, 193-204 (2008).
- Lloyd, C. M., Murdoch, J. R. Tolerizing allergic responses in the lung. Mucosal. Immunol. 3, 334-344 (2010).
- Herz, U. The relevance of murine animal models to study the development of allergic bronchial asthma. Immunol. Cell Biol. 74, 209-217 (1038).
- Herz, U., Lumpp, U., Daser, A., Gelfand, E. W., Renz, H. Murine animal models to study the central role of T cells in immediate-type hypersensitivity responses. Adv. Exp. Med. Biol. 409, 25-32 (1996).
- Nakae, S. TNF can contribute to multiple features of ovalbumin-induced allergic inflammation of the airways in mice. J. Allergy Clin. Immunol. 119, 680-686 (2007).
- Guth, A. M. Lung environment determines unique phenotype of alveolar macrophages. Am. J. Physiol. Lung Cell Mol. Physiol. 296, L936-L946 (2009).
- Kushwah, R., Cao, H., Hu, J. Characterization of pulmonary T cell response to helper-dependent adenoviral vectors following intranasal delivery. J. Immunol. 180, 4098-4108 (2008).
- Kushwah, R., Oliver, J. R., Zhang, J., Siminovitch, K. A., Hu, J. Apoptotic dendritic cells induce tolerance in mice through suppression of dendritic cell maturation and induction of antigen-specific regulatory T cells. J. Immunol. 183, 7104-7118 (2009).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados