Method Article
Generación de una línea murina Inmortalizado microvascular cerebral célula endotelial como
En este artículo
Resumen
Este método se describe cómo aislar e inmortalizar las células endoteliales microvasculares de cerebro de ratón. Se describe un protocolo paso a paso a partir de la homogeneización del tejido cerebral, las fases de digestión, la siembra y la inmortalización de las células. Por lo general, toma alrededor de cinco semanas para obtener una homogénea línea inmortalizada de células endoteliales microvasculares.
Resumen
Las células epiteliales y endoteliales (CE) están creando barreras paracelulares que protegen el tejido del entorno externo e interno. La barrera sangre-cerebro (BBB) que consiste en CE, astrocitos pies finales pericitos, y la membrana basal es responsable de la protección y de la homeostasis del parénquima cerebral. En modelos in vitro BBB son herramientas comunes para estudiar la estructura y función de la BBB en el nivel celular. Un número considerable de diferentes modelos in vitro BBB se han establecido para la investigación en laboratorios diferentes hasta la fecha. Generalmente, las células se obtienen de bovino, porcino, de rata o de tejido de cerebro de ratón (discutido en detalle en la revisión por Wilhelm et al. 1). Muestras de tejidos humanos sólo están disponibles en un número limitado de laboratorios o empresas 2,3. Mientras que las preparaciones de células primarias son mucho tiempo y las culturas CE puede variar de lote a lote, el establecimiento de inmortalizada CE lines es el foco de interés científico.
A continuación, se presenta un método para establecer una línea microvascular cerebral inmortalizado CE de cerebro de ratón recién nacido. Se describe el procedimiento paso a paso lista de los reactivos y las soluciones utilizados. El método establecido por nuestro laboratorio permite el aislamiento de una homogénea línea inmortalizada de células endoteliales dentro de las cuatro a cinco semanas. Las líneas de células microvasculares endoteliales del cerebro denominada CEND 4 (a partir de la corteza cerebral) y cerebEND 5 (a partir de corteza cerebelosa), se aisló de acuerdo con este procedimiento en el laboratorio Förster y se han usado eficazmente para la explicación de diferentes procesos fisiológicos y patológicos en el BBB. Uso de CEND y cerebEND hemos demostrado que estas células responden a glucocorticoides y estrógenos 4,6-9 tratamiento 10, así como a pro-infammatory mediadores, tales como TNF-alfa 5,8. Por otra parte, se ha estudiado la patología de múltiples sclerosis 11 y 12,13 hipoxia en la CE-nivel. El CEND y líneas cerebEND se puede considerar como una buena herramienta para el estudio de la estructura y función de la BHE, las respuestas celulares de los AE a diferentes estímulos o en la interacción de la CE con linfocitos o células cancerosas.
Protocolo
1. Aislamiento del cerebro microvasos
- Para cada preparación utilizan cinco a diez ratones neonatales de cualquier sexo (3-5 días de edad).
- Eutanasia a un ratón de acuerdo a locales IACUC / veterinario recomendaciones, retire inmediatamente el cerebro, y se transfiere a una placa de Petri que contiene la solución siguiente: 15 mM Hepes (pH 7,4), 153 mM NaCl, 5,6 mM KCl, 2,3 mM CaCl 2 x 2H 2 O, 2,6 mM de MgCl 2 x 6H 2 O, 1% (w / v) de BSA (en lo sucesivo denominado tampón como A).
- A menos que se indique otra cosa, todos los procedimientos de aislamiento deben realizarse a temperatura ambiente (RT) (22-24 ° C) bajo la campana de flujo laminar. Cortar el cerebro (cerebro sin cerebelo y tallo cerebral), después de la eliminación de las meninges y los fragmentos capilares, en tampón A usando un escalpelo estéril. Pipetear fragmenta el tejido de arriba abajo usando una pipeta de 10 ml hasta que no queden grumos aparecen. Transferir la suspensión a un tubo Falcon de 50 ml y centrifugar a 250 xg durante 5 min a TA.
Nota: Meninges puede ser identificado como membranas delgadas y transparentes en la superficie del tejido cerebral. Pueden retirarse cuidadosamente con pinzas estériles.
- Eliminar el sobrenadante.
- Disolver el precipitado en 4,5 ml de Tampón A con 1,5 ml de 0,75% (w / v) de colagenasa / dispasa (Roche) y se incuba durante 45 min a 37 ° C en un baño de agua (ocasionalmente agitación).
- Mientras tanto, preparar las placas de 12-pocillos por recubrimiento de cuatro pocillos con colágeno IV (0,1 mg / ml disuelto en ácido acético 50 mM). Permitir que se adhieran durante 1 hr.
- Detener la digestión mediante la adición de 15 ml de tampón enfriado con hielo A. Resuspender el precipitado completamente.
- Centrifugar la suspensión a 250 xg durante 10 min a TA.
- Eliminar el sobrenadante.
- Para quitar la mielina, añadir 10 ml 25% (w / v) de BSA (Sigma, pureza> 98%) y se centrifuga a 1.000 xg durante 20 min a 4 ° C. 25% de BSA se debe disolver en 1x PBS (PAA Laboratories) y se filtró a través de f 0,2 milter).
- Con cuidado, descartar el sobrenadante, disolver el precipitado en 10 ml de tampón A y transferir a un nuevo tubo Falcon.
- Centrifugar la suspensión a 250 xg durante 5 min a TA. El sedimento resultante contiene las células endoteliales.
- Lavar dos veces el colágeno IV recubierto 12-así placa con PBS.
- Resuspender el sedimento en 4 ml de medio de crecimiento (DMEM que contenía 10% de FCS, penicilina 50U/ml / estreptomicina, 1% de L-glutamina) y la placa de la suspensión celular en dos pocillos de 2 ml a cada pocillo. Añadir la puromicina a una concentración final de 4 mg / ml y se incuba durante 45 min a 37 ° C en una incubadora de cultivo celular. Este paso permite la eliminación de células que se adhieren rápidamente Nota:. Puromicina se añade durante 24 horas. Sólo cerebro ECs puede metabolizar, para otros tipos de células puromicina es tóxico 14.
- Pasar el medio que contiene 2 ml de células no adheridas de paso 1,14 en dos pocillos frescos (estos pocillos contienen la fracción CE). Llenar los pocillos con células adheridas de step 1,14 con 2 ml de medio fresco (estos pocillos contienen otros tipos de células, por ejemplo, fibroblastos, astrocitos y se puede cultivar en paralelo y se utiliza para la comparación de la morfología).
- Cambiar el medio al día siguiente.
2. Inmortalizando el cerebro células endoteliales microvasculares
- Cultivar la GP + E-86 Neo (GPENeo) 15 secretoras de fibroblastos, un virus deficiente en la replicación con polioma medio oncogén T en medio DMEM que contiene 10% FCS inactivado por calor, 50U/ml penicilina / estreptomicina, y 2 mg / ml de G418 ( . PAA Laboratories) en matraces recubiertos de gelatina Nota: polioma medio de transfección oncogén T provoca ventaja de crecimiento de las EC sobre los no-ECS que conduce a una monocapa homogénea de células con morfología endotelial 4 a 6 semanas de cultivo. GPENeo no están disponibles comercialmente y se pueden obtener como material pública compartida (por favor refiérase a las publicaciones originales 4,16).
- Para usar el medio que contiene el virus de inmortalización, cultivar las células en G418 GPENeo libre de mediano durante 24 h.
- Eliminar 10 ml del sobrenadante y añadir GPEneo Polybrene (bromuro de hexadimetrina) (Sigma) a una concentración final de 8 mg / ml, esterilizar a través de filtros de 0,45 micras para eliminar los fragmentos celulares.
- Retire el medio de cultivo de las culturas comunitarias preparadas en la parte 1 y añadir 2 ml de sobrenadante GPEneo / Polybrene mezcla en los pocillos. Repita al día siguiente utilizando un sobrenadante fresco GPEneo / Polybrene mezcla Nota:. Polybrene se utiliza para hacer los poros en la pared celular para facilitar la infección con las partículas víricas).
- Eliminar el sobrenadante GPEneo / Polybrene mezcla el día siguiente, se lavan las células dos veces con PBS y mantener las células en el medio de crecimiento cambiantes que cada 3 días. Al confluencia, dividir las celdas 1:2 en colágeno IV placas recubiertas.
- Típicamente, estables cerebrales endoteliales (CEND) líneas de células se debe obtener 4-5 semanas más tarde.
- Descongelar las células de cryoaliquot en un baño de agua y la transferencia de 15 ml-Falcon de 10 ml pre-calentado medio.
- Centrifugar la suspensión a 250 xg durante 5 min a TA.
- Eliminar el medio, transferir el precipitado en el colágeno IV T revestido 25 cm 2 frasco de cultivo celular con medio de crecimiento pre-calentado (densidad celular para el revestimiento debe ser de al menos 1 x 10 4 células / ml).
- Cambio de medio al día siguiente y después de que las células alcanzaron la confluencia (generalmente después de 5 días) dividir las celdas.
4. La división de las células CEND (Nota: La división debe hacerse sólo una vez por semana, evitar la división superior de 1:4).
- Eliminar el medio, se lavan las células con PBS.
- Añadir 3 ml de tripsina-EDTA caliente solución (PAA Laboratories) (T 75 cm 2 matraz), se incuba a 37 ° C y espere hasta que la capa de células se dispersa (generalmente dentro de 5 a 15 min).
- Añadir 5 ml omedio f crecimiento, pipetear arriba y abajo, y la transferencia a un nuevo colágeno IV recubierto matraz.
5. La congelación de las células CEND
- Obtener la suspensión de células como se describe en el paso 4
- Centrifugar la suspensión a 250 xg durante 5 min a TA.
- Resuspender el sedimento celular (obtenido a partir de 1 T 75 cm 2 matraz) en 6 ml de medio de congelación (95% medio de crecimiento, 5% de DMSO).
- Divida la suspensión de células en 1,5 ml cuatro alícuotas crio-Nota:. Crio-Una alícuota se pueden sembrar en T 25 cm 2 frasco.
- Guarde los crio-alícuotas en nitrógeno líquido a temperatura de vapor.
CEND medio de crecimiento: 450 ml de DMEM, 10% FCS, 10 ml de L-glutamina, 2% MEM-Kit, 2% NEAA, 10 piruvato natrium ml, 50 U / ml de penicilina / estreptomicina
6. Los resultados representativos
Las células CEND y cerebEND se caracteriza por inmunotinción de una endotelialnd BBB marcadores, así como por mediciones de la resistencia eléctrica transendotelial (TEER) y la permeabilidad. El CEND y cerebEND tenían una morfología similar a cultivos primarios de cerebro ECS, con monocapas de células alargadas estrechamente empaquetados que mostraron inhibición del crecimiento a la confluencia. Las células expresaron niveles detectables de bien claudin-5, ocludina y cadherina VE proteínas que se localizan en las uniones célula-célula, como se muestra por inmunofluorescencia (Figura 3) 4,5. El cultivo de células CEND en el suero reducida medio resultó en un aumento de la TEER (de 150 Ωcm 2 en presencia de 10% de suero a 500 Ωcm 2 en presencia de 2% de suero), que fue potenciada por la adición de hidrocortisona (800 Ωcm 2) o insulina (1.000 Ωcm 2) 4. Monocapas de CEND cultivadas en suero reducida medio durante 21 días tenía TEER de 900 Ωcm 2 (Figura 4). TEER se midió utilizando un conjuntoque contienen electrodos de corriente y voltaje de paso de medición-(World Precision Instruments). Para la comparación, el principal microvascular cerebral ECs se ha informado que tienen valores de TEER de 200-600 Ωcm 2 y una línea celular de ratón comercialmente disponible bEnd.3 tenía TEER valores de 100-140 Ωcm 2 (para una revisión reciente ver Abbot 2005 y Toth et al., 2011 17,18). Además, el paso de macromoléculas, tales como no cargado FITC-dextranos de masas moleculares 4, 10, 70 y 500 kDa, o con fluoresceína (300 Da) a través de la monocapa de CEND en medio de diferenciación 2% de FCS durante 4 h se redujo en comparación con las células de control mantenidos en medio de crecimiento que contiene 10% de FCS: flujo paracelular se redujo a 30% de las células de control para la fluoresceína, a 26% de FITC-dextrano 10 y 70 kDa, y el flujo se redujo a 4,5% de las células de control para FITC -dextrtan 500 kDa. Similar a TEER valores, la permeabilidad era al nivel más bajo en las células cultivadas en presencia de glucocorticoids (GC) 4. En otros estudios, se identificaron los genes diana de glucocorticoides, ocludina, claudin-5 y VE-cadherina en el endotelio vascular cerebral 4,7,9. Tratamiento GC llevado a un aumento en la expresión de estas proteínas y a la reordenación de la VE-cadherina con el citoesqueleto. El GC directa mediada por la regulación de proteínas apretado cruce occludin y claudina 5 aparece a través de los elementos de respuesta GC en sus regiones promotoras 4,7,19. Además, claudin-5 fue identificado como un objetivo estrógeno novela en endotelio vascular 10.
Subyace en la disfunción endotelial muchas enfermedades diferentes. Hemos cultivado la CEND bajo oxígeno / privación de glucosa (OGD) condiciones. OGD condujo a la interrupción de la función BBB, que podría ser reconstituido después del tratamiento combinado con GC y el proteasoma bortezomib inhibidor 12. Condiciones OGD condujo a un fuerte aumento en la captación de glucosa y en la expresión de transpor glucosatros en cerebEND, que podría ser atenuada por la adición de MK801, un inhibidor no competitivo de NMDA-receptor 13.
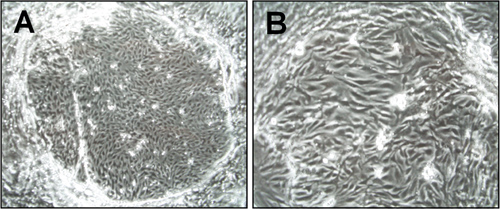
Figura 1. Morfología de las células endoteliales microvasculares del cerebro (CEND) una semana después del aislamiento. Fotografías de microscopía de luz se tomaron bajo el 6x (A) y 15x (B) aumentos. Las colonias formadas isla de células endoteliales son visibles.
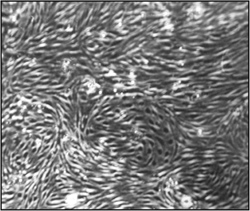
Figura 2. Morfología de las células endoteliales microvasculares del cerebro (CEND) un mes después del aislamiento y la inmortalización. Imágenes de microscopía de luz se tomaron bajo la ampliación de 15x. Una monocapa confluente, homogénea de células endoteliales puede ser observado.
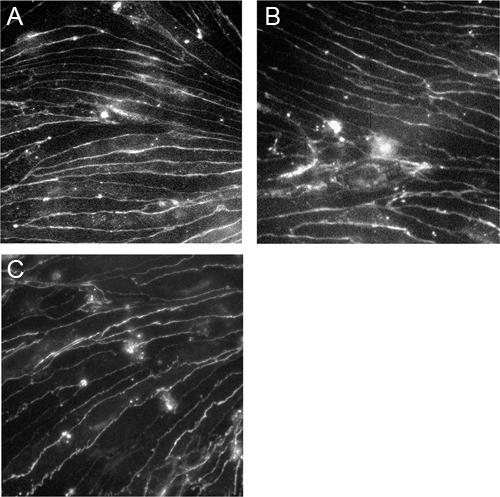
Figura 3. Inmortalizado cerebro microvascular células endoteliales expresan claudin-5, ocludina y cadherina VE. CEND células fueron cultivadas en colágeno IV cubreobjetos recubiertos y se tiñeron con anticuerpos contra claudin-5 (A), la ocludina (B) y VE-cadherina (C). Las imágenes fueron tomadas con un microscopio Zeiss Axioscop2 bajo el aumento de 40x.
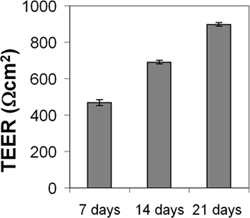
Figura 4. Medición de la resistencia eléctrica transendotelial (TEER) de CEND monocapa. CEND fueron cultivadas en colágeno IV recubiertos filtros transwell (tamaño de poro de 0,4 micras). Después de alcanzar la confluencia, las células se mantuvieron en medio que contenía 2% de FCS. TEER se midió después de 7 días, 14 y 21 utilizando un conjunto que contiene los electrodos de corriente y tensión de medición pasajeras.
Discusión
El procedimiento descrito puede ser utilizado para el aislamiento de microvascular ECs de diferentes cepas de ratón, así como a partir de diferentes cepas de ratón knock-out para estudiar los cambios específicos en la función del endotelio vascular. Como un método de inmortalización se utilizó la transformación con oncoproteína de poliomavirus murino, Polioma medio antígeno T. Se transforma rápidamente inmaduros células endoteliales in vivo e in vitro 20,21,22. Otros métodos de inmortalización de ECs descritos en la literatura incluyen, por ejemplo, la inmortalización con antígeno T grande SV40 de Simian Virus 40 23 vacuolizante, producto del gen E1A del adenovirus 24 o la sobreexpresión de la subunidad catalítica de la telomerasa humana 3. La inmortalización con PYMT es específico para el murino ECs inmaduro, que permite la obtención de un cultivo homogéneo CE de ratones neonatos en un corto tiempo. Inmortalización cambia las propiedades de las células y thE Resultados obtenidos con las líneas celulares inmortalizadas deben compararse con las células primarias o con experimentos in vivo con ratones. PYMT inmortalizada CE se ha descrito para expresar altos niveles de actividad fibrinolítica que resultan de una mayor producción de plasminógeno de tipo uroquinasa activador y disminución de la producción de activador del plasminógeno 25. La comparación directa de PYMT inmortalizada bEND5 línea celular primaria con ECs reveló que tanto en modelos in vitro BBB son muy adecuados para los estudios de adhesión de células T 26.
Las líneas celulares establecidas de acuerdo con el procedimiento descrito se puede utilizar en el paso número bajo para mantener las propiedades de barrera por la alta expresión de proteínas de BBB y CE de la unión, como las células pierden estas propiedades durante el envejecimiento. Así, después de la pérdida de propiedades de barrera, la preparación de una nueva línea celular debe ser considerado. Densidad de célula de recubrimiento debe ser alta para ECs, ya que es fundamental para la proliferación celular. Esto debe tenerse en cuenta durante el procedimiento de aislamiento así como el mantenimiento de la inmortalizada ECs. Cada línea celular nuevo deben ser evaluados por sus propiedades de barrera y de posibles contaminantes con otros tipos de células. Monocapas CE pueden ser teñidas con anti-antígeno de músculo galactocerebrósido, anti-proteína ácida fibrilar glial y anti-liso como anticuerpos primarios para excluir la contaminación con los oligodendrocitos, astrocitos y pericitos 4,27. Para descartar la contaminación por vasculatura meningal, la expresión de la trombomodulina puede ser probado, que se expresa en todos los lechos vasculares con la excepción del cerebro 28.
Curiosamente, las líneas de células endoteliales microvasculares inmortalizadas aisladas de diferentes regiones del cerebro difieren en sus propiedades de barrera y la susceptibilidad a los estímulos proinflamatorios. Como ejemplo, las líneas cerebEND CEND cerebrales y del cerebelo celulares se pueden mencionar 4,5. CerebEND mostró, en comparacióna CEND, la disminución de los niveles de expresión de los principales componentes del apretado nudo de claudina-1 y ocludina. Sin embargo, los niveles de claudin-3 y -12 fueron mayores en cerebEND. La función de barrera de las células cerebEND sufrido mucho más bajo un tratamiento con el mediador inflamatorio, TNFa que las propiedades de barrera de las células CEND hizo 5. Mayor vulnerabilidad cerebelosa a estímulos inflamatorios, se puede observar in vivo en pacientes con esclerosis múltiple y en su modelo animal experimental encefalomielitis autoinmune 29. Estos hallazgos interesantes muestran la necesidad de generación y caracterización individual en modelos in vitro para diferentes regiones del cerebro, con el fin de mejorar la focalización de medicamentos futuro en el cerebro.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Esta investigación fue apoyada por la DFG Deutsche Forschungsgemeinschaft bajo el número de concesión y DFG 315/4-1 FO SFB 688.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Albúmina de suero bovino (BSA) | Sigma-Aldrich | A7906 | Pureza> 98% |
| colágeno IV | Sigma-Aldrich | C5533 | 50 ug / ml en 50 mM de ácido acético |
| Colagenasa / dispasa | Roche | 10269638001 | |
| Dulbecco modificado a medio Eagle (DMEM) | Sigma-Aldrich | D5796 | |
| Sulfóxido de dimetilo (DMSO) | Sigma-Aldrich | D2650 | |
| Suero de ternera fetal (FCS) | PAA Laboratories | A15110-1333 | concentración final 10%, inactivado por calor (30 min a 56 ° C) |
| L-glutamina | Biochrom AG | K0282 | Almacenamiento: ≤ -15 ° C |
| MEM Vitamine | Biochrom AG | K0373 | Almacenamiento: ≤ -15 ° C |
| Na-piruvato | Biochrom AG | L0473 | |
| Neomicina (G418) | PAA Laboratories | P11-012 | |
| No aminoácidos esenciales (NEA) | Biochrom AG | K0293 | El almacenamiento a 4 ° C |
| Penicilina / Estreptomicina | Biochrom AG | A2212 | Almacenamiento: ≤ -15 ° C |
| Salina tamponada con fosfato (PBS) | Biochrom AG | L1825 | |
| Polibreno (bromuro de hexadimetrina) | Sigma-Aldrich | 107689 | 0,8 mg / ml en PBS, el almacenamiento a -20 ° C |
| Puromicina | Sigma-Aldrich | P8833 | |
| Tripsina / EDTA | Biochrom AG | L1825 | 0,05%, 0,02% de EDTA en PBS |
Referencias
- Wilhelm, I., Fazakas, C., Krizbai, I. A. In vitro models of the blood-brain barrier. Acta Neurobiol. Exp (Wars). 71, 113 (2011).
- Forster, C. Differential effects of hydrocortisone and TNFalpha on tight junction proteins in an in vitro model of the human blood-brain barrier. J. Physiol. 586, 1937 (2008).
- Weksler, B. B. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. FASEB. J. 19, 1872 (2005).
- Forster, C. Occludin as direct target for glucocorticoid-induced improvement of blood-brain barrier properties in a murine in vitro system. J. Physiol. 565 (Pt 2), 475 (2005).
- Silwedel, C., Forster, C. Differential susceptibility of cerebral and cerebellar murine brain microvascular endothelial cells to loss of barrier properties in response to inflammatory stimuli. J. Neuroimmunol. 179, 37 (2006).
- Forster, C. Glucocorticoid effects on mouse microvascular endothelial barrier permeability are brain specific. J. Physiol. 573 (Pt 2), 413 (2006).
- Burek, M., Forster, C. Y. Cloning and characterization of the murine claudin-5 promoter. Mol. Cell Endocrinol. 298, 19 (2009).
- Forster, C., Kahles, T., Kietz, S., Drenckhahn, D. Dexamethasone induces the expression of metalloproteinase inhibitor TIMP-1 in the murine cerebral vascular endothelial cell line cEND. J. Physiol. 580 (Pt.3), 937 (2007).
- Blecharz, K. G., Drenckhahn, D., Forster, C. Y. Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells. J. Cereb. Blood Flow Metab. 28, 1139 (2008).
- Burek, M., Arias-Loza, P. A., Roewer, N., Forster, C. Y. Claudin-5 as a novel estrogen target in vascular endothelium. Arterioscler. Thromb Vasc. Biol. 30, 298 (2010).
- Blecharz, K. G. Glucocorticoid effects on endothelial barrier function in the murine brain endothelial cell line cEND incubated with sera from patients with multiple sclerosis. Mult. Scler. 16, 293 (2010).
- Kleinschnitz, C. Glucocorticoid insensitivity at the hypoxic blood-brain barrier can be reversed by inhibition of the proteasome. Stroke. 42, 1081 (2011).
- Neuhaus, W. Addition of NMDA-receptor antagonist MK801 during oxygen/glucose deprivation moderately attenuates the upregulation of glucose uptake after subsequent reoxygenation in brain endothelial cells. Neurosci. Lett. 506, 44 (2012).
- Perriere, N. Puromycin-based purification of rat brain capillary endothelial cell cultures. Effect on the expression of blood-brain barrier-specific properties. J. Neurochem. 93, 279 (2005).
- Golenhofen, N., Ness, W., Wawrousek, E. F., Drenckhahn, D. Expression and induction of the stress protein alpha-B-crystallin in vascular endothelial cells. Histochem Cell Biol. 117, 203 (2002).
- Risau, W., Engelhardt, B., Wekerle, H. Immune function of the blood-brain barrier: incomplete presentation of protein (auto-)antigens by rat brain microvascular endothelium in vitro. J. Cell Biol. 110, 1757 (1990).
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cell Mol. Neurobiol. 25, 5 (2005).
- Toth, A. Patented in vitro blood-brain barrier models in CNS drug discovery. Recent Pat. CNS Drug Discov. 6, 107 (2011).
- Harke, N. Glucocorticoids regulate the human occludin gene through a single imperfect palindromic glucocorticoid response element. Mol. Cell Endocrinol. 295, 39 (2008).
- Kiefer, F., Courtneidge, S. A., Wagner, E. F. Oncogenic properties of the middle T antigens of polyomaviruses. Adv. Cancer Res. 64, 125 (1994).
- Kiefer, F. Endothelial cell transformation by polyomavirus middle T antigen in mice lacking Src-related kinases. Curr. Biol. 4, 100 (1994).
- Ong, S. H. ShcA and Grb2 mediate polyoma middle T antigen-induced endothelial transformation and Gab1 tyrosine phosphorylation. EMBO J. 20, 6327 (2001).
- O'Connell, K. A., Edidin, M. A mouse lymphoid endothelial cell line immortalized by simian virus 40 binds lymphocytes and retains functional characteristics of normal endothelial cells. J. Immunol. 144, 521 (1990).
- Roux, F. Regulation of gamma-glutamyl transpeptidase and alkaline phosphatase activities in immortalized rat brain microvessel endothelial cells. J. Cell Physiol. 159, 101 (1994).
- Montesano, R. Increased proteolytic activity is responsible for the aberrant morphogenetic behavior of endothelial cells expressing the middle T oncogene. Cell. 62, 435 (1990).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. J. Cereb. Blood Flow Metab. 31, 315 (2010).
- Skaper, S. D., Conn, M. . Methods in Neurosciences. 2, 1303 (1990).
- Ishii, H. Thrombomodulin, an endothelial anticoagulant protein, is absent from the human brain. Blood. 67, 362 (1986).
- Minagar, A., Alexander, J. S. Blood-brain barrier disruption in multiple sclerosis. Mult. Scler. 9, 540 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados