Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La producción de vectores lentivirales de células transductoras del Sistema Nervioso Central
En este artículo
Resumen
En este protocolo se describe la producción, purificación y valoración de lentiviral vectores. Se presenta un ejemplo de entrega gen vector lentiviral mediada por neuronas cultivadas en la enseñanza primaria y astrocitos. Nuestros métodos pueden aplicarse también a otros tipos de células In vitro Y En vivo.
Resumen
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
Protocolo
1. Embalaje de vectores lentiviral
Lentiviral vectores son producidos por cotransfección de un vector de transferencia lentiviral y otros plásmidos necesarios para el envasado en células 293T por el método de transfección con fosfato de calcio. Usamos 10 de 100 mm placas de cultivo de tejidos en este protocolo. Se puede escalar hacia arriba o hacia abajo dependiendo de las aplicaciones. La línea celular 293T se mantiene en modificado de Dulbecco medio Eagles (DMEM) con glucosa alta (4500 mg / l), suplementado con suero fetal bovino al 10% (FBS), 100 unidades / ml de penicilina, 100 ug / ml de estreptomicina a 37 ° C incubadora con 5% de CO 2.
- Semillas 293T células de la confluencia del 30-40% a 10 de 100 mm placas de cultivo de tejidos (3 x 10 6 células / placa) en medio de cultivo. Volver a las células a la incubadora.
- Después de 20-24 h de cultivo, comprobar la densidad de las células. Las células debe ser aproximadamente 80% de confluencia en el momento de la transfección.
- Preparar un tubo de 50 ml. Añadir 4,4 ml TE79/10 (1 mM Tris HCl, 0,1 mMEDTA, pH 7,9) menos el volumen total del ADN plásmido siguiente. Añadir 100 g de transferencia lentiviral plásmido (Figura 1), 58 g pMDLg / pRRE, 31 ug pCMV-T, 25 mg pRSV-Ap, 600 l 2M CaCl 2. Mezclar con cuidado.
- Preparar otro tubo de 50 ml. Añadir 5 ml de 2x HBS (0,05 M, HEPES 0,28 M NaCl, 1,5 mM Na 2 HPO 4, pH 7,12).
- Tomar la ADN-CaCl 2 por mezcla de 10 ml pipeta y añadir al tubo que contenía 2 x HBS, gota a gota mientras que el tubo vortex.
- Mantener la reacción de precipitación a temperatura ambiente (TA) durante 30 min.
- Retire las placas de cultivo de la incubadora. Mezclar la reacción de precipitación adecuadamente por agitación. Añadir 1 ml de suspensión a cada uno de las células del plato de 100 mm que contienen. La suspensión se debe añadir lentamente, gota a gota mientras agita suavemente el medio en el plato. Volver estas placas en la estufa y se deja durante 5 horas.
- Retire el medio de la cultura. Añadir 6 ml de medio de cultivo fresco que contiene 6 mM de sodio butyrate a cada plato. Volver a los cultivos a la incubadora. Después de cultivo durante la noche, si hay un reportero fluorescente en el constructo, comprobar la expresión del gen bajo microscopio de fluorescencia. Por lo general, más del 80% de las células expresan el gen reportero si es impulsado por un promotor ubicuo (por ejemplo, promotor CMV).
- Dos días (40-44 h) después de la transfección, recoger el líquido sobrenadante de 10 platos en 2 50-ml tubos (aproximadamente 30 ml cada tubo). Congelar el sobrenadante en el congelador de -80 º C o ir al siguiente paso.
2. La concentración y purificación de los Vectores
- Centrifugar el recién recogida o descongelado sobrenadante a 900 g (aproximadamente 2000 rpm) durante 10 minutos para eliminar cualquier residuo de células en el sobrenadante.
- Coloque una jeringa de 60 ml a un filtro de 0,2-m SFCA jeringa. Transferir el sobrenadante de 50-ml tubo de la jeringa. Se filtra el sobrenadante en un tubo de centrífuga de polialómero.
- Tomar 5 ml de sacarosa 20% (preparado en PBS) en una pipeta de 5 ml. Insertarla pipeta a la parte inferior del tubo de centrífuga que contiene sobrenadante. Añadir lentamente la solución de sacarosa en el sobrenadante del vector. Repita estos pasos con sobrenadante de otro tubo.
- Centrifugar el sobrenadante a 11000 rpm y 4 ° C durante 4 h con rotor Beckman SW28 oscilación.
- Eliminar el sobrenadante. Añadir 150 l de lactosa 4% (preparado en PBS) a cada tubo de centrífuga. Resuspender las pastillas.
- Transferir el vector de concentrado de todos los tubos de centrífuga a un tubo de 1,5 ml. Dejar el tubo en hielo durante 15 min.
- Mezclar la suspensión de vectores con la pipeta. Gira con la microcentrífuga a máxima velocidad (alrededor de 16.000 g) durante 1 min.
- Transferir el sobrenadante a un nuevo tubo de 1,5 ml. Divida la muestra final en 20 ml de alícuotas y se almacenan en -80 ° C congelador.
3. Valoración de los Vectores
- Semillas de 5 x 10 4 / pocillo de células HT1080 en 12-pocillos en 1 ml de medio DMEM suplementado con FBS al 10%.
- Después de Overnigla cultura ht, contar las células de un bien y anotar el número de células.
- Hacer 5-pliegue dilución en serie (1:5, 1: 25; 1:125, y 1:625) del vector de concentrado con medio de cultivo. Añadir I l de cada vector diluido a los pocillos separados. Las muestras pueden ser duplicados para aumentar la precisión.
- Añadir 1 l de 4 mg / ml de polibreno (Hexadimetrina Bromuro) en cada vector que contiene bien y en un pozo sin vectorial. Mezcle agitando suavemente la placa. Volver a la incubadora durante 48 h.
- Quitar medio de los pocillos de cultivo de células. Lavar cada pocillo con PBS. Añadir 250 l 1x tripsina-EDTA solución a las células. Cuando las células se separan (3-5 minutos), añadir 1 ml de medio de cultivo. Resuspender las células mediante pipeteo. Transferir la suspensión de células a tubos de 1,5 ml de centrífuga.
- Centrifugar a 900 g durante 6 minutos. Para los vectores con un gen indicador fluorescente (GFP, por ejemplo), vaya al paso 3.7 para el análisis de FACS. Para los vectores sin un periodista, vaya al paso 3.8 para qPCR en tiempo real.
- Para los vectores que contienen un fluogen reportero fluorescentes, separar el sobrenadante y resuspender el precipitado con 300 l de 3,7% de formaldehído en PBS. Determinar el porcentaje de las células informadoras positivos por análisis FACS. El título se representa como unidades de transducción por mililitro concentrado vector (TU / ml).
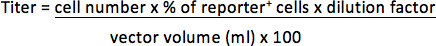
Por ejemplo, si 1 x 10 5 células transducidas con l fue 1/25 (0,04 l) vector y las células 30% son reportero positivo, el título será:
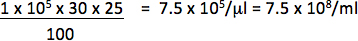
Sólo utilizar las diluciones caer en una relación lineal entre el porcentaje de células positivas y la cantidad de vector añadido para calcular título. El título final debe ser un promedio de los títulos obtenidos a partir de transducciones de al menos 2 diferentes cantidades del vector.
- Para los vectores sin ungen reportero fluorescente, extraer el ADN genómico de las células HT1080 con QIAamp DNA Mini Kit (Qiagen), según el protocolo del fabricante. Amplificar la secuencia del vector en el ADN genómico utilizando ABI Prism 7000 secuencia sistema de detección (Applied Biosystems) con los cebadores (VIH-1 en PBS / psi región 17) 5'-CCGTTGTCAGGCAACGTG-3 'y 5'-AGCTGACAGGTGGTGGCAAT-3', y sonda TaqMan 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Gen de la albúmina que es un gen de copia única en el genoma (2 copias / célula) también fue amplificado con los primers 5'-TGAAACATACGTTCCCAAAGAGTTT-3 'y 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3', y la sonda de 5'-FAM-TAMRA TGCTGAAACATTCACCTTCCATGCAGA-3- "como un control interno. Determinar el número de copias del vector y la albúmina por PCR en placa de 96 pocillos de acuerdo con la fabricación de instrucción con el siguiente programa: 50 ° C durante 2 min, 95 ° C durante 10 min, y 35 ciclos de 95 ° C durante 15 segundos y 60 ° C durante 2 min. Diez veces diluciones seriadas de los plásmidos de concentración conocida y representada como una copianúmero) que contiene las secuencias modelo también debe ser amplificada para crear una curva estándar para la cuantificación de muestras desconocidas. El título se representa como unidades de integración por mililitro concentrado vector (UI / ml).
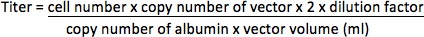
4. Transducción de las Culturas neocorticales
Culturas neocorticales que contienen tanto las neuronas y glía se preparó a partir de cortezas de ratón utilizando un procedimiento de chapado de dos pasos como se ha descrito previamente 18. Neocorteza obtenidos de ratones fetales en 14-16 días de gestación se sembraron en una monocapa previamente establecido gliales en MEM suplementado con FBS al 10%, 20 mM de glucosa y glutamina 2 mM en 24-así placa de cultivo de tejido.
- Después de 5 días in vitro, añadir 10 mM citosina arabinósido (Ara-C) en NEOCcultura ortical para inhibir no neuronal división celular. Continuar cultivar las células durante 2 días.
- Medio de cultivo en caliente 37 ° C baño de agua durante 5-10 minutos. Sustituir Ara-C que contiene el medio con medio de cultivo fresco (500 l / pocillo).
- Añadir vector con deseado MOI (multiplicidad de infección; la relación del número de partículas de vectores para el número de células diana) para el cultivo. Continuar la cultura durante 24 horas. Usamos MOI de 1-10 (generalmente 5) en cultivos primarios corticales.
- Sustituir el medio de cultivo con medio fresco. Continuar la cultura. Si hay un gen reportero en la construcción de vectores, visita células bajo microscopio fluorescente 2 días después de la transducción. La expresión del gen será visible en las neuronas 2-7 después de la transducción, dependiendo del diseño del vector y la dosis utilizada.
5. Los resultados representativos
Los títulos de los vectores lentivirales producidos con este rango de protocolo de 10 8 -10 10 UI / ml, which son adecuados para la transducción de una variedad de tipos de células a partir del SNC, tanto in vitro como in vivo. Tabla 1 y Figura 2 muestran un resultado representativo utilizando los vectores producidos por este protocolo. Nos transducidas murinos culturas neocorticales con vectores lentivirales que expresan la proteína verde fluorescente (GFP), controlada por sinapsina (SYN) promotor o promotor de la proteína glial fibrilar ácida (GFAP). Siete días después de la transducción, se realizó inmunotinción a las neuronas y astrocitos de la etiqueta con anticuerpos anti-NeuN y anti-GFAP, respectivamente. Como se muestra en la tabla 1 y fig. 2A, después de la transducción con el vector que lleva el promotor sinapsina, más del 90% de las neuronas (células NeuN +) expresa las buenas prácticas agrarias y los astrocitos no (GFAP + en las células) expresan este gen reportero. Cuando promotor GFAP se utiliza en la construcción de vectores (Fig. 2B), alrededor del 80% de los astrocitos (GFAP + células) expresións las buenas prácticas agrarias; todos GFP + células son los astrocitos según lo confirmado por colocalización con Bosnia y Herzegovina y la ausencia de expresión de GFP en las células NeuN marcadas. Estos resultados demuestran que los vectores lentiviral son muy eficientes para entregar los transgenes de las células de SNC y células específicas de la expresión génica puede lograrse cuando se utilizan promotores apropiados.
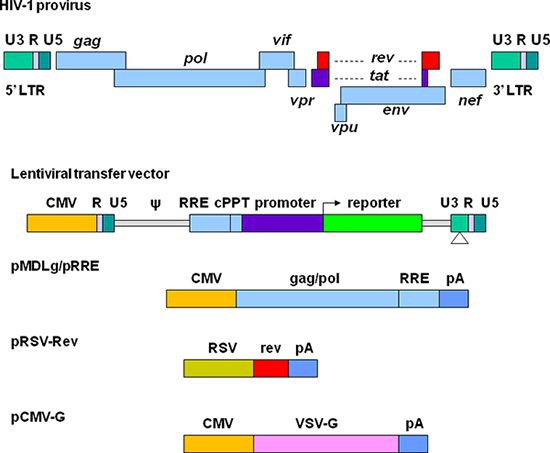
Figura 1. Representación esquemática de VIH-vectores basados en lentivirus y los plásmidos de embalaje. El VIH-1 provirus se muestra en la parte superior. Los elementos para la producción de vectores están separados en cuatro diferentes plásmidos. La transferencia del plásmido lentiviral contiene un híbrido LTR 5 'en la que se sustituye la región U3 con el citomegalovirus (CMV), la señal de empaquetamiento (ψ), la secuencia RRE, el tracto polipurina central (cPPT), un gen de interés (por ejemplo un reportero fluorescente), junto con un promotor de la elección, y LTR 3 'en la que elsecuencias reguladoras cis se elimina completamente de la región U3. pMDLg / pRRE contiene los genes gag y pol y secuencia RRE de VIH-1 bajo el control del promotor CMV. pRSV-Ap contiene la secuencia codificante de Rev impulsado por el promotor RSV. pCMV-G contiene el gen de la proteína VSV-G bajo el control del promotor CMV. PA indica la señal de poliadenilación de β-globina humana gen.
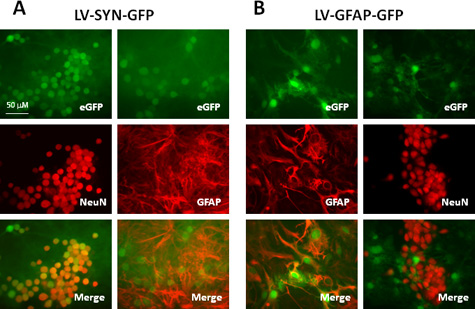
Figura 2. Expresión de genes reporteros en el ratón cultivo mixto neocortical transducidas con vectores lentivirales que llevan el tipo de células específicas de los promotores. Los cultivos fueron transducidas con el LV-SYN-GFP (A) o LV-GFAP-GFP vectores (B) a una MOI de 5. Siete días después de la transducción, las células se immunostained con anticuerpo anti-NeuN o anti-GFAP. Los paneles superiores muestran la fluorescencia de GFP, los paneles centrales muestran inmunotinción y los paneles inferiores se fusionan imágenes (GFP: verde; NeuN y GFAP: rojo).
| Vector | GFP + células en las neuronas | GFP + en los astrocitos |
| LV-SYN-GFP | 92,2 ± 7,3 | 0 |
| LV-GFAP-GFP | 0 | 78,3 ± 11,5 |
Tabla 1. Comparación de la expresión de GFP en murinos culturas neocorticales transducidas con vectores lentivirales que llevan a diferentes promotores.
unas culturas murinos neocorticales (5 x 10 5 / bien en placa de 24 pocillos) fueron transducidas con el LV-SYN-GFP o LV-GFAP-GFP en una MOI de 5. Siete días después de la transducción, las culturas se fijaron y se immunostained para NeuN y GFAP. El número de células GFP y NeuN / GFAP que expresan fueron contadas en imágenes de 10 campos por condición experimental. Los valores representan el porcentaje de las neuronas (células NeuN +) oastrocitos (GFAP + en las células), que también expresa el gen reportero GFP. Los valores mostrados son medias ± SD de tres experimentos independientes.
Discusión
En este protocolo, se ha demostrado la producción de vectores lentivirales y la aplicación de estos vectores en cultivos neocorticales. Hemos demostrado eficaz y tipo de células específicas de transducción con los vectores producidos por estos métodos. Cuando el promotor sinapsina se utiliza, la expresión de GFP es estrictamente neurona específica. Cuando el promotor de GFAP se utiliza, la expresión de GFP es exclusivamente en los astrocitos. Si ningún tipo de células específicas de expresión se requiere, u...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el NIH Blueprint Neurociencia básica de subvención (P30 NS057105, BJS) de la Universidad de Washington, el Programa de Proyecto de Donación NS032636 (BJS) y por el Centro de Esperanza para los Trastornos Neurológicos.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Suero bovino fetal | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-CM | |
| Tripsina-EDTA | Sigma-Aldrich | T3924 | |
| Butirato sódico | Sigma-Aldrich | B5887 | |
| Hexadimetrina bromuro (Polybrene) | Sigma-Aldrich | H9268 | |
| Células 293T | ATCC | CRL-11268 | |
| Células HT1080 | ATCC | CCL-121 | |
| Falcon 100 x 20 mm de tejido CULTURAe plato | BD Biosciences | 353003 | |
| 1 x 3 ½ en el tubo de centrífuga polyallomoer | Beckman-Coulter | 326823 | |
| 0.2 micras filtro de jeringa | Corning | 431219 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 |
Referencias
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados