Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La evaluación de la replicación y la función celular beta en Adenovirally transducidas aislados islotes de roedores
En este artículo
Resumen
Este protocolo permite a uno identificar los factores que modulan la masa funcional de las células beta para encontrar posibles dianas terapéuticas para el tratamiento de la diabetes. El protocolo consiste en un método simplificado para evaluar la replicación de islotes y la función de las células beta en los islotes de rata aislados siguientes manipulación de la expresión génica con adenovirus.
Resumen
Homeostasis de la glucosa se controla principalmente por la insulina y glucagon endocrino hormonas, secretada por la beta del páncreas y las células alfa, respectivamente. Masa funcional de las células beta está determinada por la masa de células beta anatómica, así como la capacidad de las células beta para responder a una carga de nutrientes. Una pérdida de masa funcional de las células beta es fundamental para ambas formas principales de diabetes 1-3. Considerando que los resultados la disminución de masa de células beta funcionales de un ataque autoinmune en la diabetes tipo 1, diabetes tipo 2, este decremento se desarrolla a partir tanto de la incapacidad de las células beta que segregan la insulina de manera adecuada y la destrucción de las células beta de un grupo de mecanismos. Por lo tanto, los esfuerzos para restaurar la masa funcional de las células beta son fundamentales para el tratamiento y la mejor de las curas potenciales para la diabetes.
Se están realizando esfuerzos para identificar las vías moleculares que pueden ser aprovechados para estimular la replicación y mejorar la función de las células beta.Idealmente, los objetivos terapéuticos que mejoraría tanto el crecimiento de las células beta y su función. Quizás lo más importante es sin embargo para identificar si una estrategia que estimula el crecimiento de las células beta es a costa de perjudicar la función de las células beta (por ejemplo, con algunos oncogenes) y viceversa.
En forma sistemática supresión o la sobreexpresión de la expresión de los genes diana en islotes aislados de rata, se puede identificar posibles dianas terapéuticas para el aumento de la masa funcional de las células beta 6.4. Los vectores adenovirales pueden ser empleados para las proteínas eficientemente sobreexpresan o desmontables en los islotes de rata aislados 4,7-15. A continuación, presentamos un método para manipular la expresión génica utilizando transducción adenoviral y evaluar la replicación del islote y la función de células beta en los islotes aislados de rata (Figura 1). Este método ha sido utilizado anteriormente para identificar nuevos objetivos que modulan la replicación de las células beta o de la función 5,6,8,9,16,17.
Protocolo
1. Transducción adenoviral y el cultivo de islotes de rata
- Preparar un 6-así no tejido recubierto con placa de cultivo mediante la adición de 2 ml de medio (RPMI 1640 que contienen 8 mM de glucosa, 10% de suero fetal bovino, 50 unidades / ml de penicilina, y 50 ug / ml de estreptomicina) para el número requerido de pozos. Por ejemplo, un experimento típico puede requerir tres pozos, uno cada uno para un control sin virus, un control de virus (por ejemplo, GFP-expresión de adenovirus), y el grupo experimental.
- Calentar la placa a 37 ° C colocándolo en una incubadora de cultivo de tejido por lo menos durante 30 min.
- Inmediatamente después de aislamiento rata islote 18,19, 100-200 islotes lugar en pocillos individuales de la placa de cultivo de 6-bien no tejido revestido. Sesenta islotes son necesarios para la secreción de insulina y ensayos de incorporación de timidina. Los islotes restantes pueden ser utilizados para el aislamiento del ARN para estudios de expresión génica o el aislamiento de proteínas para inmunotransferencia.
[Nota: A partir de este punto en adelante, por favor, siga los protocolos institucionales para el manejo, uso y desecho de materiales de riesgo biológico.]
- Girar suavemente la placa para llevar a los islotes al centro del pozo.
- Pipetear el adenovirus directamente sobre los islotes en el centro del plato. Utilizar 100-500 multiplicidades de infección (MOI, la proporción de las células diana a virales unidades formadoras de placas).
- Que el resto islotes durante 5 min.
- Colocar la placa en el tejido incubadora de cultivo (37 ° C, 5% de CO 2).
- Después de 24 h, agitar suavemente la placa para llevar a los islotes a los centros de los pozos y transferir los islotes utilizando una micropipeta P200 a un nuevo pozo que contiene medio fresco. Si los islotes se une a la placa, que puede ser desplazado suavemente con la punta de la pipeta.
[Nota: Para verificar la efi transducción adecuadaCY, el uso de un virus de control que expresa GFP es beneficioso, como islotes entonces se pueden obtener imágenes a través de microscopía confocal para verificar la penetración del adenovirus en el núcleo de islotes.]
- Cultura de los islotes de un adicional de 24 a 72 h, en función del tiempo deseado de la experiencia de los estudios piloto de optimización. Por ejemplo, la inducción de una respuesta proliferativa puede requerir tiempos que van desde 24 hasta 72 horas o desmontables del gen de interés puede requerir 48 o 72 horas. Traslado de los islotes a medio fresco cada día.
- Para el final de las 24 horas del experimento, la cultura de los islotes en los medios de comunicación que contienen 1 Ci [metil-3H] -thymidine/ml los medios de comunicación (generalmente de 1 l de timidina / ml de los medios de comunicación).
[Nota: A partir de este punto en adelante, por favor, siga los protocolos institucionales para el manejo, uso y disposición de materiales radiactivos.]
2. La insulina secreción de ensayo
- Preparar elsecreción tampón de ensayo (SAB) solución madre 10 veces (1,14 M NaCl, 47 mM KCl, 12 mM de KH 2 PO 4, 11,6 mM de MgSO 4) y CaCl 2 solución madre 100X (0,25 M CaCl 2). Estas soluciones madre se pueden preparar antes de tiempo y se almacenan a temperatura ambiente.
- Recién preparar 50 ml de la SAB de trabajo (5 ml de 10X SAB, 1 ml de HEPES 1 M, 0,5 ml de CaCl 100X 2, 0,28 ml de 35% de BSA, 0,11 g de NaHCO 3, y agua estéril para 50 ml) en un de 50 ml cónica del tubo y se calienta a 37 ° C, colocando en un baño de agua a 37 ° C.
- Pipeta 10 ml de la SAB de trabajo en un tubo cónico de 15 ml y añadir 66,8 l de 2,5 M de D-glucosa para preparar la glucosa alta (16,7 mM) SAB.
- Añadir 44,8 l de 2,5 M de D-glucosa a los restantes 40 ml de la SAB de trabajo para preparar la baja de glucosa (2,8 mM) SAB.
- Etiqueta de tres de 1,7 ml tubos de microcentrífuga para cada pocillo de la placa de 6 pocillos y añadir 1 ml de buffer fosfato salino (PBS).
[Nota: A medida que los islotes son radiactivos, por favor, siga los protocolos institucionales para el manejo, uso y disposición de materiales radiactivos.]
- Coloque 20 islotes en cada tubo de microcentrífuga. Haga todo lo posible para añadir islotes de tamaño comparable a cada tubo de microcentrífuga. Por ejemplo, cada tubo puede contener 5 de pequeño, mediano 10, y 5 de gran tamaño islotes (véase Figura 1).
[Nota: Los islotes se pueden visualizar utilizando un estereoscopio de disección o un microscopio estándar.]
- Después de que los islotes se han asentado en la parte inferior del tubo por gravedad (~ 2 min), aspirar el PBS con una micropipeta y desechar.
[Nota: Como alternativa a la sedimentación por gravedad, los tubos pueden ser centrifugadas a 300 xg durante 1 min.]
- Para la pre-incubación, añadir 400 l de la glucosa bajaSAB glucosa, colocar los tubos (con sus tapas abiertas) en el tejido incubadora de cultivo (37 ° C, 5% de CO 2), y pre-incubar durante 60 min. Aspirar el SAB pre-incubación de baja la glucosa y los descartes.
- Para la secreción de insulina basal, añadir 400 l de la glucosa baja SAB, colocar los tubos (con sus tapas abiertas) en el tejido incubadora de cultivo (37 ° C, 5% de CO 2), y se incuba durante 60 min. Recoger la baja de glucosa en SAB y ahorrar para el radioinmunoensayo de insulina.
- Para la secreción de insulina estimulada, añadir 400 l de la glucosa alta SAB, colocar los tubos (con sus tapas abiertas) en el tejido incubadora de cultivo (37 ° C, 5% de CO 2), y se incuba durante 60 min. Recoger la alta glucosa en la SAB y ahorrar para el radioinmunoensayo de insulina.
3. Ensayo de incorporación de timidina
- Añadir 1 ml de PBS, después de los islotes se han asentado en la parte inferior del tubo por gravedad, aspirar el PBS con una micropipeta, desechar, y repetir esteEntra una vez.
- Añadir 500 l de ácido hielo frío tricloroacético (TCA, 10% w / v) y se incuba en hielo durante 30 min.
- Centrifugar los tubos a 16 000 g durante 3 min a 4 ° C.
- Aspirar el TCA, añadir 80 l de 0,3 N NaOH, y se incuba durante 30 min a temperatura ambiente. Durante este tiempo, vigorosamente vórtice las muestras para s 5-10 cada 10 min.
- Agregar 4 ml de cóctel de conteo de Econo-seguro para 7 tubos de centelleo ml de líquido de recuento.
- Añadir 50 l de la muestra al tubo de centelleo contando, tapar el tubo, agitar brevemente, y cuentan en un contador de centelleo líquido.
- Medir la concentración de proteína utilizando el ácido bicinconínico (BCA) de ensayo y 10 ul de muestra de acuerdo con el protocolo del fabricante.
4. Análisis de Datos
- Lleve a cabo el radioinmunoensayo de insulina siguiendo el protocolo del fabricante.
- Normalizar la secreción de insulina y los datos de la incorporación de timidina con el concentrado de proteínaentration.
5. Los resultados representativos
Un ejemplo del experimento para evaluar la replicación de islotes y la función de las células beta en los islotes de rata se muestra en la Figura 2. Este ejemplo muestra que la sobreexpresión adenoviral de la hipotética "Gene # 6" con firmeza estimula la replicación del islote, sin alterar la función celular beta. En el panel superior, los resultados del ensayo demuestran que la incorporación de timidina aumentar la expresión de "Gene # 6" aumenta la síntesis de ADN, medida por la incorporación de timidina. Dado que la mayoría de las células en el islote de rata son células beta, es probable que este aumento de la incorporación de timidina indica un aumento en la replicación de las células beta. Sin embargo, los experimentos de confirmación se debe realizar para establecer firmemente este. En el panel inferior, los resultados de la prueba de la secreción de insulina demuestran que la sobreexpresión de "Gene # 6" no alteró una de las funciones celulares primarias beta, es decir, insulin la secreción de la glucosa en baja y alta. La calidad del aislamiento de islotes y la salud de los islotes después del tratamiento con adenovirus se indica por el aumento de veces en la secreción de insulina en concentraciones de glucosa de baja y alta. Si el aumento de la expresión de "Gene # 6" alteración de la función de las células beta, esto es probable que se refleja como una disminución en la insulina secretada en altas concentraciones, estimuladores de glucosa (16,7 mM). Una curva dosis-respuesta para variar las concentraciones de glucosa también podría llevarse a cabo.
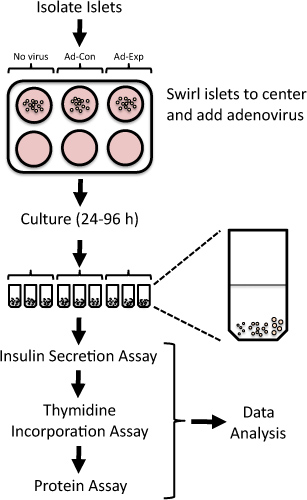
Figura 1. Visión general de protocolo para evaluar la replicación del islote y la función de células beta en los islotes aislados de ratas después de mediada por adenovirus alteraciones en la expresión génica. Recién aislados islotes de rata están expuestos a adenovirus durante 24 horas y después se cultivaron hasta 96 h. La incorporación de timidina se evalúa en la final de 24 h, seguido por la medición de la secreción de insulina ala glucosa baja y alta.
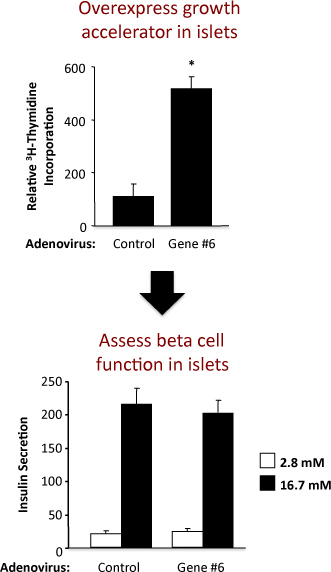
Figura 2. Los resultados de un experimento utilizando un adenovirus control y un adenovirus que sobreexpresan un gen hipotético etiquetado como "Gene # 6". El panel superior muestra la incorporación de timidina y el panel inferior de la secreción de insulina.
Discusión
El establecimiento de las vías que pueden ser moduladas para estimular la replicación y mejorar la función de las células beta son relevantes para las dos formas principales de diabetes. Debido a que la masa de células beta funcionales depende de la existencia y función de las células secretoras de insulina, la evaluación de estos factores determinantes al mismo tiempo tiene sus ventajas. Este protocolo se describe un protocolo simplificado para determinar si la sobreexpresión o la supresión de una proteína c...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por subvenciones del NIH DK078732 (para PTF).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| RPMI 1640 medios | Gibco | 11879 | |
| La penicilina / estreptomicina | Gibco | 15140 | |
| 6-así placa | BD-Falcón | 35-1146 | No tratada TC |
| [Metil-3 H]-timidina | Perkin Elmer | NET027Z001MC | 1 mCi / ml |
| Centrífuga micro-tubos | Denville | C2170 | 1,7 ml |
| NaCl | Sigma | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ Sub> PO 4 | Acros | 20592 | |
| MgSO 4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Sigma | H0887 | 1 M solución |
| 35% de BSA | Sigma | A7979 | |
| NaHCO $ 3 | Acros | 42427 | |
| d-glucosa | Sigma | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% w / v |
| NaOH | Acros | 12426 | |
| Centelleo contando tubo | Sarstedt | 58.536 | 7 ml, PP |
| Centelleo tubo de contar la tapa | Sarstedt | 65.816 | |
| Econo-Safe cóctel de contar | RPI | 111175 | |
| La insulina RIA | Siemens | TKIN2 | |
| Kit de ensayo de BCA | Thermo Scientific | 23250 | |
| Equipo | |||
| Centrifugar | Eppendorf | 5415R | |
| Recuento de centelleo gradilla | Sarstedt | 93.1431.001 | |
| Contador de centelleo líquido | Perkin Elmer | Tri-Carb 2910TR |
Referencias
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados