Method Article
La conversión de un ELISA de captura para un ensayo de Luminex xMAP utilizando un anticuerpo Multiplex Método de detección
En este artículo
Resumen
Un ELISA se puede convertir fácilmente a un ensayo de Luminex xMAP y, a través de los beneficios de anticuerpos de multiplexación, varios pueden ser examinados simultáneamente para identificar un par de anticuerpos óptima, dando lugar a una mayor sensibilidad y rango dinámico, mientras que reduce el coste del ensayo.
Resumen
La prueba de inmunoensayo ligado a enzimas (ELISA) ha sido durante mucho tiempo la principal herramienta para la detección de analitos de interés en las muestras biológicas tanto para la investigación en ciencias biológicas y diagnóstico clínico. Sin embargo, ELISA tiene sus limitaciones. Se realiza típicamente en una microplaca de 96 pocillos, y los pocillos se revisten con anticuerpo de captura, que requiere una cantidad relativamente grande de la muestra para capturar un antígeno de interés. La gran superficie de los pocillos y la unión hidrofóbica de anticuerpo de captura puede también conducir a no específica la unión de fondo y mayor. Además, la mayoría de ELISA depender enzima mediada por la amplificación de la señal con el fin de lograr una sensibilidad razonable. Tal amplificación no siempre es lineal y puede por lo tanto los resultados de inclinación.
En los últimos 15 años, una nueva tecnología ha surgido, que ofrece los beneficios de la prueba ELISA, sino que también permite un mayor rendimiento, mayor flexibilidad, reducción del volumen de la muestra, y un menor coste, con un ¡ay similaresrkflow 1, 2. Luminex xMAP Technology es una microesfera (bola) plataforma matriz que permite tanto monoplex y ensayos multiplex que se pueden aplicar tanto a la proteína y las aplicaciones de ácido nucleico 3-5. Las perlas tienen el anticuerpo de captura covalentemente inmovilizado sobre una superficie más pequeña, requiriendo menos anticuerpo de captura y pequeños volúmenes de muestra, en comparación con el ELISA, y la unión no específica se reduce significativamente. Pequeños volúmenes de muestra son importantes cuando se trabaja con muestras limitantes como el líquido cefalorraquídeo, líquido sinovial, etc 6. Multiplexación el ensayo reduce aún más los requisitos de volumen de la muestra, lo que permite múltiples resultados de una sola muestra.
Las recientes mejoras de Luminex incluyen: el nuevo sistema de MAGPIX, uno más pequeño, menos costoso, más fácil de usar analizador; baja concentración magnética MagPlex microesferas que eliminan la necesidad de costosas placas de filtro y vienen en una concentración de trabajo más adecuado para el desarrollo y ensayobajo rendimiento de aplicaciones, y el anticuerpo xMAP kit de acoplamiento (ABC), que incluye un protocolo, reactivos y consumibles necesarios para el acoplamiento de cuentas para el anticuerpo de captura de interés. (Vea la sección de Materiales para obtener una lista detallada del contenido del kit.)
En este experimento, convertir un ensayo de pre-optimizado ELISA para TNF-alfa citoquina a la plataforma xMAP y comparar el rendimiento de los dos métodos 7-11. TNF-alfa es un marcador biológico utilizado en la medición de las respuestas inflamatorias en pacientes con trastornos autoinmunes.
Comenzamos por el acoplamiento de cuatro anticuerpos de captura candidatos a cuatro conjuntos de microesferas y regiones diferentes. Cuando se mezclan, estos cuatro conjuntos de permitir el análisis simultáneo de todos los cuatro candidatos con cuatro anticuerpos de detección separadas para determinar el mejor par de anticuerpos, reactivos de ahorro, la muestra y el tiempo. Dos ensayos xMAP luego se construye con los dos pares de anticuerpos más óptimos y es su rendimientoen comparación con la del original ensayo ELISA en cuanto a intensidad de la señal, el rango dinámico, y la sensibilidad.
Protocolo
I. Preparación de los reactivos
- Selección y preparación de anticuerpos
- Identificar los anticuerpos para ser utilizados en el experimento.
- Cuatro anticuerpos de captura específicos para el consumo humano: TNF-alfa, monoclonales o policlonales, todas las especies de un mismo host.
- Cuatro anticuerpos específicos para detección: TNF-alfa humano, ya sea sin modificar, biotinilado, o PE-conjugado.
- Un anticuerpo confirmación: PE-conjugado y específica para la especie huésped de los anticuerpos de captura.
- Reconstituir todos los anticuerpos a las concentraciones recomendadas por el fabricante de trabajo.
- Seleccione cuatro viales de baja concentración de microesferas MagPlex (bola) conjuntos o regiones, por ejemplo, los números de parte de Luminex MC10012-ID, ID-MC10013, MC10014-ID, y MC10015-ID.
- Identificar los anticuerpos para ser utilizados en el experimento.
- Acoplamiento de anticuerpos contra el MagPlex microesferas, utilizando el anticuerpo xMAP (ABC) Kit de acoplamiento
Refer el Manual del Usuario ABC Kit (Parte # 89-00002-00-319) para el procedimiento de acoplamiento completo. (Nota: fotosensible microesferas deben ser protegidos de la luz siempre que sea posible.)- Llevar los reactivos en el kit de ABC a temperatura ambiente y se etiqueta cuatro tubos de reacción con los números de región de talón seleccionados para la reacción de acoplamiento. Transferir el contenido de los cuatro viales de perlas MagPlex (1 ml cada uno o 2,5 x 10 6 bolas) en los tubos de reacción cuatro etiquetados.
- Lavar cada uno de los juegos de microesferas dos veces en 500 l de tampón de activación, como se describe en el manual ABC Kit.
- Activar cada conjunto de perlas con 480 l de tampón de activación, 10 l de Sulfo-NHS, y 10 l del reactivo de EDC, de acuerdo con el procedimiento descrito en el manual ABC Kit, y se incuba durante 20 minutos. (Nota:. Reactivo EDC debe ser reconstituido en 250 l de tampón de activación inmediatamente antes de esta etapa)
- Repita el paso anterior con el lavado de ahora "activado" microesferas con un total de THRee veces con 500 l de tampón de activación, como se describe en el manual ABC Kit.
- Preparar cuatro soluciones separadas, cada una conteniendo 7,5 microgramos (es decir, 3 g / millones de microesferas) de anticuerpo de captura en tampón de activación.
- Añadir estas soluciones de captura de cuatro de anticuerpos frente a sus respectivos tubos de reacción y agitar cada tubo inmediatamente, y se incuba durante dos horas en un rotor.
- Repita el paso anterior con el lavado de ahora "acoplado" microesferas de un total de tres veces con 500 l de tampón de lavado incluido en el kit ABC.
- Después de la etapa de lavado final, se añaden 500 l de tampón de lavado a cada tubo de reacción para proporcionar una concentración de stock final de 5 millones de anticuerpos acoplados a perlas por mililitro. Vortex y sonicar los tubos de reacción para dispersar las microesferas.
NOTA: En parte sumergir el frasco cerrado de microesferas en un limpiador ultrasónico llenado con agua desionizada ofrece sonicación eficaz para todos los pasos de lavado. (Vea la tabla de materiales para eEQUIPO PARA detalles.) - Guarde las bolas junto a 2-8 ° C y protegido de la luz hasta que se necesite.
- La enumeración de acoplamiento microesferas
- Contar el número de microesferas se recuperó después de la reacción de acoplamiento mediante un contador de células o hemocitómetro. Consulte el manual de usuario del instrumento contando para ver las instrucciones adecuadas para ello. La recuperación de la reacción de acoplamiento es normalmente más del 90%.
- La confirmación de acoplamiento
- Confirmar la reacción de acoplamiento tuvo éxito mediante la preparación de soluciones de ensayo de las poblaciones de perlas acopladas para cada conjunto, con la concentración final de 100 perlas / l en tampón de ensayo (PBS con 1% de BSA). Preparar diluciones del ficoeritrina-(PE-) anticuerpo anti-especie de anticuerpo IgG de confirmación a 4 mg / ml en tampón de ensayo.
- Alícuota de 50 l de cada solución de ensayo en cuatro pocillos de un fondo redondo, 96-pocillos, para un total de 16 pozos. A continuación, añadir 50 μL de tampón de ensayo en ocho de los pozos, para medir el fondo, y 50 l de anticuerpo diluido confirmación en los ocho pozos restantes.
- Mezclar suavemente por las reacciones pipeteando arriba y abajo varias veces con una pipeta multicanal. Se cubre la placa, y se incuba durante 30 minutos a temperatura ambiente en un agitador de placas.
- Colocar la placa en un separador de placa magnética durante 1-2 minutos para extraer las perlas de la solución. A continuación, eliminar el líquido por la fuerza invirtiendo la placa, mientras que en el separador, sobre un receptáculo de desechos.
- Lavar cada pocillo dos veces mediante la adición de 100 l de tampón de ensayo y de separar el sobrenadante de la placa de una manera similar utilizando el separador de placa magnética.
- Resuspender las perlas en 100 l de tampón de ensayo pipeteando suavemente hacia arriba y hacia abajo cinco veces con una pipeta de canales múltiples.
- Analizar en un instrumento Luminex xMAP, tales como el Instrumento MAGPIX. La intensidad de la señal fluorescente de esta reacción es sobre el tery proporcional a la cantidad de proteína en la superficie de las perlas, proporcionando una evaluación rápida de la cantidad relativa de proteína unida a las perlas.
- Acoplamiento de biotina a los anticuerpos no modificados para la detección
- Si el uso de anticuerpos modificados de detección, biotinilar estos anticuerpos con la Thermo Fisher EZ-Link sulfo-NHS-LC-biotina reactivo (Cat. N º PI-21335) y el procedimiento descrito en el prospecto. Una vez biotinilado, los anticuerpos de detección más tarde se puede marcar con estreptavidina ficoeritrina (SA-PE) en el ensayo (Paso III.6.) De modo que puedan ser detectados con el analizador xMAP.
II. Ensayo de la instalación
- Preparar una mezcla inicial de los cuatro conjuntos de talón mediante la adición de 10 L de cada uno a 0,96 ml de PBS con BSA al 1% (Tampón de Ensayo. Ver tabla Materiales) para determinar que es más eficaz con el Ensayo xMAP.
- Preparar las soluciones de detección de anticuerpos por diluting cada uno a 1 mg / ml en tampón de ensayo.
- Preparar el R & D Systems TNF-α estándar de la proteína a 2000 pg / ml en tampón de ensayo.
- Diluir la estreptavidina-rPhycoerythrin (SA-PE) (proporcionada @ 1 mg / ml) a 8 mg / ml en tampón de ensayo.
III. Detección de anticuerpos
- Añadir 50 l de la mezcla de microesferas anticuerpo acoplado a cada uno de 16 pocillos de una Costar de fondo redondo de 96-pocillos para el ensayo de cribado.
- Añadir 50 l de tampón de ensayo a 8 de los 16 pocillos, para medir de fondo.
- Añadir 50 l de I + D Sistemas de TNF-α estándar (a 2.000 pg / ml) a los otros 8 pozos, para medir la respuesta.
- Incubar durante una hora a temperatura ambiente, protegido de la luz, mientras se agita en un ensayo de un agitador de placas.
- Añadir 50 l de cada uno de los cuatro anticuerpos de detección de cuatro pozos (dos de fondo y la respuesta de dos) y se incuba durante 30 minutos a temperatura ambiente, protegidos de la luz, mientras se agita en un ensayo de placa shaker.
- Añadir 50 l del reactivo de SA-PE a todos los pocillos y se incuba 15 minutos a temperatura ambiente, protegida de la luz, mientras se agitaba en un ensayo de un agitador de placas.
- Colocar la placa en un separador magnético de la placa durante un minuto y luego eliminar el líquido por la fuerza invirtiendo la placa.
- Añadir 100 l de tampón de ensayo para cada uno de los 16 pocillos, coloque la placa en el separador de placa magnética durante un minuto y luego eliminar el líquido por la fuerza invirtiendo la placa, mientras que en el separador.
- Añadir 100 l de tampón de ensayo para cada uno de los 16 pozos y leer la placa con el instrumento Luminex MAGPIX, consultando el manual del usuario para el correcto funcionamiento.
- Seleccione un par de anticuerpos que cumpla con su fuerza de señal deseada.
IV. xMAP Funcional de ensayo
- Después de seleccionar el anticuerpo de captura mejor, diluir 100 l de dicha población anticuerpo acoplado talón (del paso IB8) a 10 ml con tampón de ensayo.
- Añadir 50 l delas cuentas diluidas a 78 pozos de fondo redondo de dos Costar-96-y placas. (78 x 2 pozos de placas = 156 pozos) Cada placa se utilizará para evaluar el desempeño de un anticuerpo de detección diferente.
- Preparar una curva estándar de 12 puntos, a partir de 8000 pg / ml y termina a las 4 pg / ml, con el R & D Systems TNF-α estándar. Añadir 50 l seis repeticiones de cada dilución a cada una de las placas, además de los pozos de seis con 50 l de tampón de ensayo cada uno, como un fondo, para un total de 78 pocillos / placa.
- Las placas se incuban durante una hora a temperatura ambiente, protegido de la luz, mientras se agita en un ensayo de un agitador de placas.
- Añadir 50 l de la primera detección de anticuerpos a los 78 pocillos de la primera placa. Repetir para la detección de anticuerpos segundos sobre la segunda placa.
- Las placas se incuban durante 30 minutos, a temperatura ambiente, protegido de la luz mientras se agita en un ensayo de un agitador de placas.
- Añadir el 50 l del reactivo de SA-PE a todos los pocillos de cada placa.
- Incubarlas dos placas durante 15 minutos, a temperatura ambiente, protegido de la luz mientras se agita en un ensayo de un agitador de placas.
- Coloque las placas en los separadores de placas magnéticas durante un minuto, a continuación, eliminar el líquido por la fuerza invirtiendo la placa, mientras que en el separador.
- Añadir 100 l de tampón de ensayo a cada uno de los 78 pozos de las placas, colocar las placas en los separadores de placas magnéticas durante un minuto, a continuación, eliminar el líquido por la fuerza invirtiendo la placa.
- Añadir 100 l de tampón de ensayo a cada uno de los 78 pozos de las placas y analizar en el instrumento MAGPIX, siguiendo el manual del usuario para el correcto funcionamiento.
V. Ensayo ELISA
- Siguiendo las instrucciones incluidas con el R & D Systems Humanos TNF-α/TNFSF1A DuoSet kit ELISA (R & D Parte # DY210), medir la respuesta generada por la norma prevista en el kit de I + D. Repita la prueba de ELISA tres veces más, la sustitución de la captura de R & D Systems y la detección de la hormigaibodies con los anticuerpos de los otros vendedores. Por simplicidad, los anticuerpos par por proveedor (por ejemplo, el anticuerpo de captura Millipore con anticuerpo de detección de Millipore, el anticuerpo de captura Abcam con anticuerpo de detección Abcam, etc.)
- Evaluar cada par de forma independiente, como es requerido por el formato ELISA, con cada uno de los tres estándares de proteína de TNF-alfa.
VI. Los resultados representativos
Este protocolo se muestra cómo un típico ELISA se puede convertir en la plataforma xMAP mientras se utiliza la capacidad de múltiplex de la tecnología para optimizar rápidamente el ensayo. La prueba de ELISA utilizada en este ejemplo era el factor de necrosis tumoral humano-alfa (TNF-α) DuoSet kit ELISA de R & D Systems (I + D Parte # DY210).
Además de los dos anticuerpos proporcionado en el kit, tres pares de anticuerpos otros procedentes de distintas fuentes (véase la Tabla de Materiales) fueron evaluados de forma simultánea utilizando la plataforma xMAP. Four de los anticuerpos fueron designados como anticuerpos de captura y se acopla a MagPlex Concentración Mínima microesferas. Las otras cuatro anticuerpos fueron designados como anticuerpos de detección; tres de los cuales fueron adquiridos como biotina-acoplado y el cuarto fue biotinilado como se describe en el Protocolo.
Los anticuerpos para este estudio fueron elegidos en base a la disponibilidad y el proveedor. Sin embargo, en el establecimiento de prácticas, los anticuerpos se debe elegir según las preferencias del usuario individual y la experiencia de los resultados anteriores con los que el anticuerpo. A pesar de que este experimento no prueba la idoneidad de un anticuerpo como anticuerpo de captura contra la detección de anticuerpos, este protocolo puede ser fácilmente modificado para tal fin.
Los ensayos de Luminex xMAP se realizaron como un múltiplex para evaluar todos los anticuerpos de captura cuatro como una mezcla, mediante la combinación de cuatro conjuntos de TNF-α anticuerpo acoplado MagPlex microesferas. Los anticuerpos de captura se evaluaron con cada uno de los cuatroanticuerpos biotinilados detección individualmente, de tal manera que la interacción de un anticuerpo de detección con cada uno de los cuatro anticuerpos de captura se pudo determinar simultáneamente. Cuatro tales ensayos, realizados en paralelo, determina las interacciones de los cuatro anticuerpos de detección con los cuatro anticuerpos de captura. Figura 1 muestra los datos comparativos de estos ensayos de selección.
Los resultados indicaron que el par de anticuerpos de la R & D Systems DuoSet realiza mejor con una respuesta resultante en 6183 intensidad media de fluorescencia (MFI) unidades. También se observó que los anticuerpos de detección de Millipore (86% de la respuesta de anticuerpos de I + D par) y Abcam (67%) proporcionaron una respuesta razonable en el ensayo xMAP, cuando se combina con el anticuerpo de captura R & D Systems. Los anticuerpos de captura de Abcam, Millipore y Novus produce una respuesta menos deseable en el ensayo xMAP.
Es importante señalar, que el PURplantean de este estudio no es necesariamente para resaltar las diferencias entre los anticuerpos o proveedores concretos, sino simplemente para ilustrar que existen diferencias observables en su rendimiento cuando se utilizan en condiciones similares, y que la plataforma xMAP puede ofrecer un medio eficaz para la evaluación de estas diferencias.
La I + D DuoSet Sistemas de protocolo se utilizó para comparar los cuatro pares de anticuerpos en un formato ELISA. El R & D Systems protocolo se utiliza con todos los pares de anticuerpos, ya que es un reflejo de los típicos protocolos de ELISA utilizados hoy en día y es análogo a los protocolos utilizados con la tecnología xMAP. Las pruebas de ELISA mostró que el par de anticuerpos de R & D Systems volvió a dar los mejores resultados (Figura 2). La pareja de anticuerpos de Abcam no produjo respuesta de anticuerpos y los pares de Millipore y Novus producido respuestas modestas.
A fin de evaluar cualquier variación en la reactividad de anticuerpos con el estándar, todo anticuerpos cuatroY los pares se han probado con tres diferentes niveles de proteínas recombinantes de TNF-alfa, de tres proveedores diferentes (ver la Tabla de Materiales). Los datos de la Figura 2 muestran que los recombinantes de TNF-alfa estándares de proteína de los tres vendedores dieron resultados equivalentes.
La proteína TNF-α de R & D Systems se utilizó para generar las curvas de calibración con la prueba ELISA (Tabla 1) y los ensayos xMAP (Tablas 2 y 3). Mientras que el ensayo de ELISA se realizó con el par de anticuerpos R & D Systems, los ensayos xMAP utilizado el anticuerpo I + D de Sistemas de captura y, o bien la detección de anticuerpos de R & D Systems o Millipore. La proteína TNF-α de R & D Systems se diluyó para producir un rango de concentraciones de 8.000 a 4 pg / ml. Sólo el par de anticuerpos de R & D Systems produce el resultado esperado en el ensayo xMAP, con una respuesta de> 20.000 IMF, como se muestra en la Tabla 2 yFigura 3. Cuando el anticuerpo de detección de Millipore se utilizó con el Ensayo xMAP en lugar del anticuerpo de detección R & D Systems (Tabla 3), la respuesta (6.000 IFM) era de aproximadamente 30% de la respuesta obtenida con el anticuerpo de detección de R & D Systems, como se muestra en Figura 3.
Los datos de la Tabla 1 representa la curva estándar de la prueba ELISA, que tenía un fabricante recomienda el TNF-α rango de 16 a 1000 pg / ml. Esta gama era muy limitada debido a la DO a 1000 pg / ml fue ligeramente superior a 2 unidades de DO y el espectrofotómetro es incapaz de medir por encima de 3 OD. Debido al límite con el espectrofotómetro, no fue posible aumentar el rango del ensayo ELISA adicional. Además, los datos de la Tabla 1 indican que la I + D DuoSet Sistemas ELISA no es capaz de detectar el TNF-α en concentraciones mucho menores de 16 pg / ml. Por otro lado, el ensayo xMAP es capaz de medirción de TNF-α en una concentración de menos de 7,8 pg / ml con el anticuerpo de captura de R & D Systems junto con la detección de anticuerpos de cualquiera de R & D Systems o de Millipore.
El rango dinámico y la sensibilidad de ambos métodos se ilustra mejor cuando se trazan en una escala log-log (Figura 4). Una clara distinción entre la pendiente de las respuestas de ELISA y las respuestas de los ensayos xMAP puede verse que indica, además, una capacidad más limitante para la detección de TNF-α con el ELISA, en ambas concentraciones superiores e inferiores.
Los límites de detección (LOD) para los dos funcionales TNF-alfa ensayos xMAP se aproxima mediante la identificación de las más bajas de TNF-α concentración con un nivel de respuesta observada (IMF) más de fondo, más tres veces su desviación estándar (DE). Para alcanzar la significación estadística, seis repeticiones se utilizaron para determinar la desviación estándar para los métodos tanto la xMAP y ELISA. Tesestimaciones e de LOD son optimistas con la intención de proporcionar una "mejor de los casos", en el entendimiento de que, en condiciones normales de funcionamiento sólo dos o tres repeticiones se utilizará. En la Tabla 2, se puede observar que, cuando se utiliza el par R & D Systems, la más baja de TNF-α concentración a 3,91 pg / ml produjo una respuesta de 66 IFM, que es mayor que la respuesta del fondo + 3SD, satisfacer este criterio . Cuando el anticuerpo de detección de Millipore se utilizó con el anticuerpo de captura R & D Systems (Tabla 3), el límite de detección fue inferior a 7,81 pg / ml. En este caso, la segunda más baja de TNF-α concentración producido una respuesta aceptable de 17 IMF; mayor que la respuesta de los más bajos de TNF-α concentración más tres veces su desviación estándar. (10 IMF + 3 (2,4) = 16.29 IMF) Del mismo modo, el límite de detección para la I + D de Sistemas ELISA DuoSet se estimó en entre 63 pg / ml y 31 pg / ml (Tabla 1).
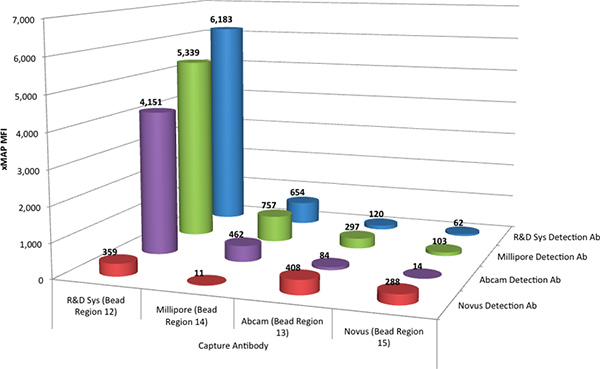
Figura 1. La intensidad media de fluorescencia (MFI) del R & D Systems estándar (a 2.000 pg / ml) para cada combinación posible de los anticuerpos de captura de cuatro (junto a cuatro regiones de microesferas diferentes) y los anticuerpos de detección de cuatro. Haga clic aquí para ver más grande la figura .
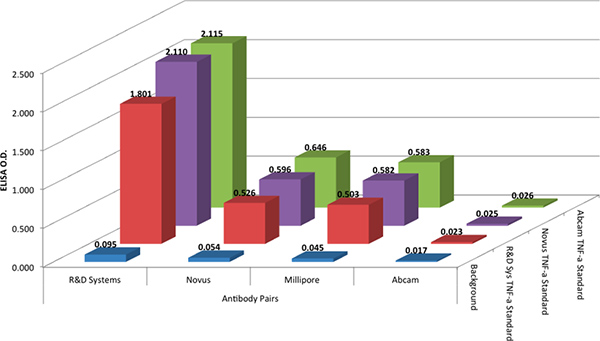
Figura 2. La densidad óptica (DO) de tres niveles diferentes recombinantes (@ 1.000 pg / ml) para la captura y cuatro combinaciones de detección de anticuerpos par. La captura y detección de anticuerpos fueron emparejados arbitrariamente por proveedor, por la simplicidad. Haga clic aquí para ver más grande la figura .
| pg / ml | OD | Desviación estándar | 3 SD |
| 1000 | 2,084 | 0,035 | 2,187 |
| 500 | 1,328 | 0,038 | 1,441 |
| 250 | 0,787 | 0,025 | 0,863 |
| 125 | 0,476 | 0,026 | 0,554 |
| 63 | 0,304 | 0,023 | 0,374 |
| 31,3 | 0,212 | 0,025 | 0,287 |
| 15,6 | 0,167 | 0,026 | 0,244 |
| 0 | 0,118 | 0,021 | 0,182 |
Tabla 1 La densidad óptica (OD) de la serie de dilución 2-pliegue especificado por el inserto de I + D Systems paquete DuoSet, para su uso como una curva estándar;. Incluyendo la desviación estándar (SD) y el límite estimado de detección (LD), entre 31,3 pg / ml y 63 pg / ml.
| R & D Systems captura y detección de anticuerpos | |||
| pg / ml | IMF | Desviación estándar | 3 SD |
| 8000 | 20.320 | 463 | 21.707 |
| 4000 | 15.594 | 223 | 16.263 |
| 2000 | 11.098 | 79 | 11.336 |
| 1000 | 6985 | 160 | 7465 |
| 500 | 4149 | 80 | 4390 |
| 250 | 2233 | 30,0 | 2323 |
| 125 | 1199 | 43,8 | 1330 |
| 63 | 636 | 14,0 | 678 |
| 31,3 | 340 | 12,9 | 379 |
| 15,6 | 183 | 5.9 | 201 |
| 7.8 | 103 | 2.2 | 109 |
| 3.9 | 66 | 2.4 | 73 |
| 0 | 11 | 0.8 | 13,8 |
Tabla 2 La intensidad media de fluorescencia (MFI) de una serie de diluciones estándar medida por la tecnología xMAP, utilizando el par de anticuerpos se incluye con el R & D Systems DuoSet;. Como desviación estándar (DE) y el límite estimado de detección (LOD), a menos de 3,91 pg / ml.
| R & D Systems captura de Ab con Millipore detección de Ab | |||
| pg / ml | IMF | Desviación estándar | 3 SD |
| 8000 | 5800 | 143 | 6229 |
| 4000 | 3881 | 120 | 4242 |
| 2000 | 2176 | 73 | 2396 |
| 1000 | 1138 | 32,1 | 1234 |
| 500 | 578 | 31,3 | 671 |
| 250 | 289 | 6.2 | 307 |
| 125 | 142 | 3.1 | 151 |
| 63 | 75 | 5.3 | 91 |
| 31,3 | 44 | 3.3 | 54 |
| 15,6 | 28 | 2.6 | 35,5 |
| 7.8 | 17 | 1.5 | 21,2 |
| 3.9 | 10 | 2.0 | 16,3 |
| 0 | 7 | 1.4 | 11,4 |
Tabla 3 La intensidad media de fluorescencia (MFI) de una serie de diluciones estándar medida por la tecnología xMAP, utilizando el anticuerpo R & D Systems captura y el anticuerpo EMD Millipore detección;. Como desviación estándar (DE) y el límite estimado de detección (LOD), menos de 7,81 pg / ml.
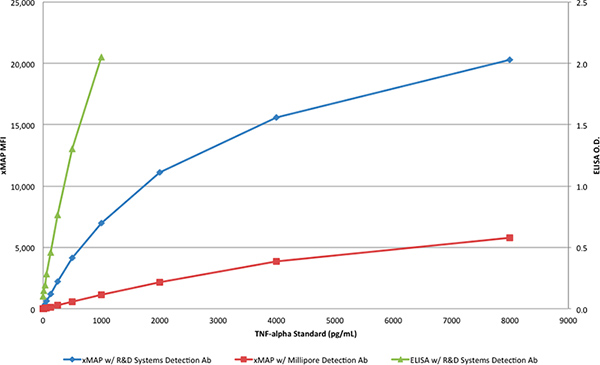
Figura 3. Las curvas de calibración de los dos ensayos xMAP y el R & D Systems DuoSet ELISA. Haga clic aquí para ver más grande la figura .
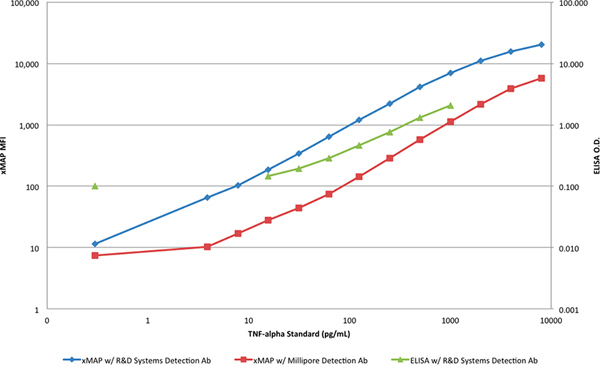
Figura 4. Una comparación de las curvas xMAP estándar y la curva ELISA estándar en una escala log-log. Haga clic aquí para ver más grande la figura .
Discusión
La conversión de un ensayo ELISA para la plataforma Luminex xMAP puede ser tan simple como la sustitución de estreptavidina peroxidasa de rábano (SA-HRP) en un típico kit de ELISA con estreptavidina ficoeritrina (SA-PE), y la optimización del rendimiento. Para aquellos que desean crear un inmunoensayo xMAP desde cero, esto se puede lograr con un protocolo sencillo que también permite la evaluación rápida, múltiplex de los pares de anticuerpos. Los reactivos para el ensayo xMAP se prepararon fácilmente con el kit de anticuerpos xMAP de acoplamiento para acoplar los anticuerpos de captura designados para MagPlex baja concentración de microesferas. El uso de microesferas de baja concentración se reduce el coste de desarrollo de ensayos mientras que proporciona el rendimiento del ensayo mismo de mayor concentración de microesferas. La cantidad de tiempo requerido para preparar acoplado MagPlex microesferas es aproximadamente 3 horas, que es mucho más rápido que el 22 - 24 horas requerido para recubrir el pocillo de una placa de ELISA, seguido por el tratamientode los pocillos recubiertos. El rendimiento del ensayo xMAP es también superior a la de ELISA en términos de límite de detección (<4 pg / ml vs> 31 pg / ml) y rango dinámico (<4 pg / ml a> 8000 pg / ml frente a 16 pg / ml a 1000 pg / ml). Lectores de la placa tienen una limitada gama de DO que es 3 o 4 OD, restringiendo el límite superior del rango dinámico para un ensayo.
Sin duda, no todos los anticuerpos funcionan en un formato ELISA y no todos los anticuerpos que funcionan bien en un método de ELISA son fácilmente transferibles a el formato de ensayo xMAP. Sin embargo, puesto que los ensayos de xMAP pueden ser multiplexados (es decir, ejecutar simultáneamente), es posible evaluar la captura de varias combinaciones de detección de anticuerpos y simultáneamente para identificar el mejor par de usar para un ensayo. Este proceso ahorra tiempo y reactivos en comparación con el procedimiento de desarrollo de ELISA, que está limitada a la evaluación de un par a la vez. Si dos o más pares de anticuerpos realizar equivalentemente; otros parámetros del ensayo puedeconsiderarse para determinar la idoneidad del par (por ejemplo, disponibilidad, coste, etc.)
Además de un rendimiento mejorado y ensayo de flexibilidad con el ensayo xMAP, también hay un ahorro significativo. La cantidad recomendada de anticuerpo necesaria para recubrir un solo pozo de una placa de ELISA es 400ng, mientras que la cantidad necesaria para las perlas utilizadas en un pocillo de un ensayo xMAP es de aproximadamente 7,5 ng. Así, la cantidad de anticuerpo necesaria para un ELISA bien proporcionará más de 50 resultados de la prueba, si se utiliza en un ensayo xMAP. Para aplicaciones que implican muestras preciosas, xMAP también tiene una ventaja significativa. El volumen de muestra recomendado para el ELISA es 100 l, mientras que el volumen requerido para el ensayo xMAP puede ser un medio de que, o menos.
En resumen, la conversión de un ensayo de ELISA para la plataforma Luminex xMAP es sencillo, eficiente y ahorro de costes, mientras que la producción de un ensayo con un rango dinámico superior y la sensibilidad.
Divulgaciones
Este trabajo fue realizado a Luminex Corporation con equipos fabricados en el Luminex Corporation.
R & D Systems y EMD Millipore son socios estratégicos de Luminex Corporation, con licencia para desarrollar y comercializar los ensayos multiplex xMAP base.
Agradecimientos
Este trabajo fue financiado por Luminex Corporation.
Materiales
| Name | Company | Catalog Number | Comments |
| Descripción | Vendedor | Número de catálogo | Comentarios |
| Humanos TNF-α/TNFSF1A DuoSet kit ELISA | R & D Systems | DY210 | Incluye monoclonales y biotina acoplados anticuerpos policlonales y proteína recombinante estándar de TNF-α |
| Anticuerpo monoclonal a TNF-α | Abcam | Ab18696 | Captura de anticuerpos, el clon CH8820 |
| Anticuerpo monoclonal a TNF-α | Abcam | Ab16166 | Biotina acoplado Detección de anticuerpos, el clon AS1 |
| La proteína TNF alfa | Abcam | Ab9642 | TNF-α recombinante de proteínas estándar |
| Anticuerpo monoclonal a TNF-α | Novus | NBP1-50115 | Captura de anticuerpos, el clon 4H31 |
| Anticuerpo monoclonal a TNF-α | Novus | NB100-78162 | Biotina acoplado Detección de anticuerpos, el clon MAb11 |
| La proteína TNF alfa | Novus | NBC1-18460 | TNF-α recombinante de proteínas estándar |
| Anticuerpo monoclonal a TNF-α | EMD Millipore | MAB1141 | Captura de anticuerpos, clonar 3C7.2 |
| Anticuerpos policlonales a TNF-α | EMD Millipore | 654250 | Detección de anticuerpo de conejo policlonal |
| Estreptavidina-ficoeritrina | Musgo | SAPE-001 | Reactivo fluorescente reportero de Luminex xMAP Ensayo |
| MAGPIX w / Software XPONENT | Luminex Corporation | MAGPIX-XPONENT | Aparato Luminex |
| xMAP anticuerpos de acoplamiento (ABC) Kit | Luminex Corporation | 40-50016 | Incluye reactivo de la EDC, el reactivo sulfo-NHS, el tampón de activación, el tampón de lavado, tubos de 1,5 mL de reacción y pipetas desechables |
| MagPlex microesferas, la baja concentración | Luminex Corporation | MC10012-ID, ID-MC10013, MC10014-ID, MC10015-ID | Cuentas de baja concentración (2,5 x @ 10 6 bolas / ml) |
| EZ-Link sulfo-NHS-LC-biotina | Thermo Fisher | PI-21335 | Biotinilación kit para la detección de anticuerpos sin modificar |
| Tecan Infinite F200 Reader | Tecan | Lector de placas ELISA | |
| Tampón fosfato salino | Sigma-Aldrich | P-3688 | 1% de PBS-BSA, Tampón de ensayo |
| Una pinta-limpiador ultrasónico compacto, 115 VCA | Cole-Parmer | WU-08.849-00 | Produce una frecuencia de operación efectiva de 55 kHz |
| Separador de tubo magnético | Luminex Corporation | CN-0288 a 01 | Para la separación solo tubo 1,5 ml magnético en los pasos de lavado de acoplamiento |
| Separador placa magnética | Luminex Corporation | CN-0269-01 | Para 96-así separación placa magnética en los pasos de lavado de ensayo |
Referencias
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados