Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelado Colitis asociada a cáncer con azoximetano (AOM) y Sodio sulfato de dextrano (DSS)
En este artículo
Resumen
Se demuestra un protocolo en el que la administración del agente genotóxico azoximetano (AOM), seguido por tres ciclos de la sódico pro-inflamatoria agente sulfato de dextrano (DSS) rápida y consistente genera tumores de colon en ratones con similitudes morfológicas y moleculares a las que se observan en la colitis humana asociada a cáncer.
Resumen
Los individuos con enfermedad inflamatoria intestinal (EII), tales como la enfermedad de Crohn (CD) o colitis ulcerativa (UC) están en mayor riesgo de desarrollar cáncer colorrectal (CRC) sobre los individuos sanos. Este riesgo es proporcional a la duración y extensión de la enfermedad, con una incidencia acumulada de hasta un 30% en los individuos con larga UC con afectación colónica generalizada. 1 displasia de colon en la EII y la colitis asociada a cáncer (CAC) se cree que se desarrollan como resultado de ciclos repetidos de lesión de la célula epitelial y la reparación, mientras que estas células se bañan en un medio de citoquinas inflamatoria crónica. 2 Mientras que los cánceres espontáneos y la colitis asociada a compartir la calidad de los adenocarcinomas siendo, la secuencia de eventos moleculares subyacentes se cree que es diferente. 3 Esta distinción argumenta la necesidad de modelos animales específicos del CAC.
Varios modelos de ratón existen en la actualidad para el estudio de CAC. Sulfato de dextrano sodium (DSS), un agente con efectos tóxicos directos sobre el epitelio del colon, puede ser administrado en el agua potable a los ratones en varios ciclos para crear un estado inflamatorio crónico. Con una duración suficiente, algunos de estos ratones desarrollan tumores. 4 desarrollo tumoral se aceleró en este modelo si se administra en un entorno pro-cancerígenos. Estos incluyen ratones con mutaciones genéticas en las vías de tumorigénesis (APC, p53, MSH2), así como ratones tratados previamente con agentes genotóxicos (azoximetano [OMA], 1,2-dimetilhidracina [DMH]). 5
La combinación de DSS con OMA como un modelo de colitis asociada a cáncer ha ganado popularidad por su reproducibilidad, potencia, bajo precio y facilidad de uso. Aunque tienen un mecanismo compartido, AOM se ha encontrado para ser más potentes y estables en solución que la DMH. Mientras que el desarrollo de tumores en otros modelos generalmente requiere varios meses, los ratones inyectados con AOM y posteriormente tratado con DSS desarrollar tumores adecuados en uns poco como 7-10 semanas. 6, 7 Finalmente, AOM y DSS se puede administrar a ratones de cualquier fondo genético (knock out, transgénicos, etc) sin cruzamiento para una cepa específica tumorigénico. Aquí, demostramos un protocolo para la inflamación impulsada por la tumorigénesis de colon en ratones utilizando una única inyección de AOM seguido de tres de siete días ciclos de DSS durante un período de semanas 10. Este modelo induce tumores con cambios histológicos y moleculares muy parecidas a las que ocurren en humanos CAC y proporciona un modelo muy valioso para el estudio de la oncogénesis y la quimioprevención en esta enfermedad. 8
Protocolo
1. Colitis asociada al cáncer de inducción
- Ponga a un lado las jaulas de sexo y edad, los ratones 6-8 semanas de edad que se utilizarán para los grupos experimental y control. Los ratones pueden ser etiquetados individualmente con marcas de cola o clips de oído.
- En el día 0, los pesos iniciales de registro y se inyecta por vía intraperitoneal a cada ratón (IP) con 10 mg / kg de solución AOM de trabajo (1 mg / ml en solución salina isotónica, diluido a partir de 10 mg / ml de solución madre en dH2O mantuvo a -20 ° C) . Basado en la experiencia, esta dosis puede ajustarse entre 7-14 mg / kg y / o repetido temprano en el experimento.
Precaución: OMA es un agente genotóxico volátil y debe ser manejado con cuidado de acuerdo con el acompañamiento MSDS. Las diluciones se prepararon en una campana química, mantenido en hielo, y se desecha siguiendo protocolos institución específica.
- Hacer un% 2,5 (2,5 g/100 ml) solución de DSS en agua destilada y se pasan a través de un f acetato de celulosa 0,22 micrasilter por vacío. Esta dosis se puede ajustar entre 1-3.5% dependiendo de la cepa del ratón y el medio ambiente. Una vez preparada, la solución de DSS puede mantenerse refrigerado hasta por 1 semana.
- En el día 7, de suministro de solución de DSS en ratones como su agua potable. Aproximadamente 250 ml / jaula será necesario cada vez que se proporcionan DSS nueva para un máximo de 5 ratones / jaula, sin embargo, estos son sólo estimaciones y pueden variar en función del tipo de botellas de agua utilizados en su instalación de animales.
- Para proporcionar un suministro continuo de DSS durante siete días, la solución de DSS debe ser sustituido en botellas limpias tres veces (cada 2-3 días) durante este período. Algunos investigadores medir la cantidad de DSS consumidos antes de reemplazar con nueva solución como una medida de la exposición.
- El día 14, cambia de nuevo a las jaulas de agua potable estándar durante dos semanas.
- Repetir los pasos (1,4) - (1,6) en los días 28 y 49 para proporcionar un segundo y tercer ciclo de DSS. Un DSS "ciclo" se compone de una semana de DSS en el agua de bebidaseguido de 2 semanas de regular (autoclave) de agua.
2. Colitis Evaluación clínica y la progresión tumoral
- Los ratones se pesaron / observado 2-3 veces por semana. Pérdida de porcentaje en peso respecto a la línea base se utiliza como una medida sustituta de la gravedad de la colitis. Las evaluaciones regulares de sangrado rectal, diarrea o prolapso puede hacerse en función de objetivos experimentales e indicará con arreglo a los sistemas de puntuación diferentes. 9, 10
- Una pérdida de peso de hasta el 10% a lo largo de 2-3 días de diarrea y sangrado rectal se puede esperar en la semana después de un ciclo completo de DSS (observación diaria puede ser útil durante este inmediato post-DSS período).
Es posible que algunos ratones no pueden recuperarse; ratones que pierden más de 20% de su peso son menos probabilidades de sobrevivir y puede requerir la eutanasia precoz. Una sola inyección IP de 0,5 a 1,0 ml de solución salina en estos ratones puede ser una medida útil de apoyo a corregir FLUI d volumen perdido debido a la diarrea.
3. Murino Endoscopy (Opcional)
- Endoscopia siguiendo el ciclo de segundo o tercero de DSS se puede realizar para confirmar el crecimiento del tumor in vivo antes de su sacrificio. Como la OMA / DSS modelo es bastante fiable en la producción de tumores, este paso no es necesario en general. Sólo unos pocos ratones se evaluó usando este método, ya que tiene el potencial de interrumpir los tumores de ratón. 11
- Se anestesia el ratón con sedación inhalada o inyectable.
- Después de ratón es anestesiado, asegure el ratón a un tablero plano con cinta en la cola y el pecho.
- Haga avanzar el endoscopio murino en el recto ratón suavemente con solución salina para inflar y riego para mejorar la vista intraluminal y eliminar contenido fecal. (Tenga en cuenta que la endoscopia también se puede realizar usando la insuflación de aire como una alternativa a la solución salina y la técnica esto puede ofrecer una mejor visualización del tumor. 12)
- El día 70, cada ratón OMA / DSS tratada debe albergar múltiples tumores de colon y estar listo para la evaluación. Esta fecha puede retrasarse semanas o meses si los tumores más grandes son deseados. (Es de destacar que los ratones con prolapso rectal severa pueden necesitar ser sacrificados temprano para evitar excesivas molestias a los animales como por los Comités Institucionales de cuidado de los animales.)
- Antes de la necropsia, individualmente eutanasia a los ratones con dislocación cervical y el isoflurano (u otro método aprobado institucionalmente). El peso final y otras mediciones se pueden hacer en este momento.
- Coloque el ratón con su lado ventral expuesta en una tabla de cortar. Cubrir el abdomen con 70% de etanol para evitar que los pelos de la contaminación de los contenidos del abdomen durante la extracción del colon.
- Use pinzas para agarrar la línea media del abdomen y hacer una pequeña incisión para exponer el peritoneo.
- Extienda la incisión en cada lado del abdomen a lo largo de la margi costaln.
- Utilice unas tijeras para cortar a través de la pelvis para que el colon se pueden cosechar hasta la unión anorrectal. Esto es importante porque la lesión colitis DSS es mayor en el recto distal y, correspondientemente, esta es la región de mayor desarrollo del tumor.
- Tejidos adicionales, tales como los ganglios linfáticos mesentéricos también pueden cosecharse en este momento.
5. Preparación del colon para el análisis macroscópico
- Usando una aguja de 18G sonda unida a una jeringa de 5 ml, lavar el colon con helado de buffer fosfato salino (PBS) de tal manera que las salidas de fluido en la dirección fisiológica. Si el tejido del colon se utilizan para ARN o proteína basada en el análisis, puede mantenerse en frío mediante el empleo de pre-refrigerado bandejas de trabajo.
- Abra el colon enrojecida longitudinalmente a lo largo de su mesenterio y la pintura en la bandeja de frío. Los tumores son más fácilmente visualizados cuando el colon se coloca sobre una superficie oscura. Alternativamente, 1% de tinte azul Alcian se puede aplicar para resaltar tumors. Evaluar el número y tamaño del tumor con una regla o calibrador digital.
- Pequeñas secciones de tejido normal y tumoral adyacente se puede escindir en este punto para el análisis futuro por el ARN, proteína, o métodos de inmunohistoquímica (IHC), dejando una parte del colon restante para su evaluación histológica.
Fotografía digital de las muestras de colon brutos inmediatamente después de la etapa 5,2 puede ser útil para el análisis preciso de la carga tumoral, especialmente si partes significativas de los dos puntos se escindió para otras formas de análisis, como se describe anteriormente. La carga tumoral (%) se calcula como el área del tumor / área total del colon usando software libre como ImageJ.
6. Preparación del colon para su evaluación histológica
- Aplicar 10% de formalina para el colon restante en la bandeja de frío mediante una jeringa o un dedo. Permitiendo que el tejido a fijar durante al menos 30 segundos de esta manera facilita la transferencia a la cuenca de fijación. Asegúrese residual formalina es wiped apagado antes de pintar dos puntos de nueva construcción inaugurado en la misma bandeja.
- Transferir dos puntos a un recipiente lleno de formol al 10% y precisar en los bordes.
- Después de 3 horas de la fijación, transferir dos puntos a 70% de etanol. Los dos puntos pueden ser conservados en etanol al 70% indefinidamente.
- Tres secciones longitudinales de dos puntos (proximal, medio y distal / recto) puede ser estabilizado en 2% de agar y presentado para su inclusión en parafina. Asegurarse de que el colon proximal y distal del colon / recto están orientados de manera uniforme para cada ratón.
- Displasia, daño cripta, y la inflamación puede ser descrito y evaluado por un individuo experimentado de acuerdo con protocolos publicados previamente. 10, 13-15 Los ratones pueden ser sacrificado antes de 70 días si el experimentador está interesado en la detección de los eventos tempranos de displásicas.
7. Los resultados representativos
El modelo de OMA / DSS se describe en este documento permite al investigador generar fiable tumores de colon en ratones.El crecimiento tumoral en este modelo está directamente influenciada por el proceso inflamatorio asociado. Gravedad de la colitis deben ser controlados clínicamente siguiendo la pérdida de peso y la presencia de diarrea / hematoquecia (Figura 2). Estos signos de actividad de la enfermedad tienden a comenzar por día 5 del ciclo de DSS y de cuatro o más días después de DSS se retira. En raras ocasiones, los ratones con una carga tumoral rectal significativa puede desarrollar prolapso rectal. Después de la diarrea DSS segundo o tercer ciclo puede llegar a ser persistente. Típicamente los tumores están presentes e identificables por colonoscopia murino antes del tercer ciclo de DSS (Figura 3). El tiempo adicional y un tercer curso de los resultados DSS en tumores más grandes en el momento de la cosecha (Figura 4). El uso de la aplicación tópica de Alcian mancha azul puede ser utilizado para poner de relieve los tumores (Figura 5). Las fotografías de los tumores de colon ayudará en la generación de las mediciones del tumor que pueden ser utilizados para comparar cuantitativamente la producción de tumores y el tamañoentre los grupos experimentales (Figura 6). Fijos y embebidos en parafina las muestras de colon se puede entonces evaluar para histología o con el uso de la tinción inmunohistoquímica (Figura 7 y 8).
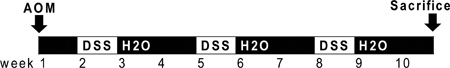
Figura 1. Esquema de la OMA y la administración de DSS. AOM (10 mg / kg) se inyecta en el día 0. Al comienzo de la segunda semana (día 7), 2,5% de solución de DSS se administra a ratones en su agua potable. Siete días de DSS es seguido por dos semanas de agua tratada en autoclave. Un adicional de dos ciclos de DSS se administran antes de su sacrificio.

Figura 2. Ratón respecto al valor basal durante AOM y administración DSS peso. Tenga en cuenta que en la semana siguiente a cada ciclo de DSS, los ratones e 5-10% de su peso corporal. La pérdida de peso en este experimento es un marcador sustituto de la gravedad de la colitis.
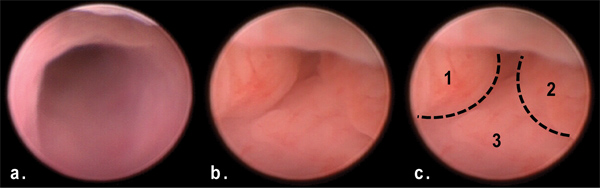
Figura 3. Vista de tumores en el colon distal mediante endoscopia murino en el día 50 de OMA / DSS tratamiento. Tenga en cuenta las múltiples masas polipoides que obstruyen el lumen del colon distal (b, c) en comparación con el colon normal (a).
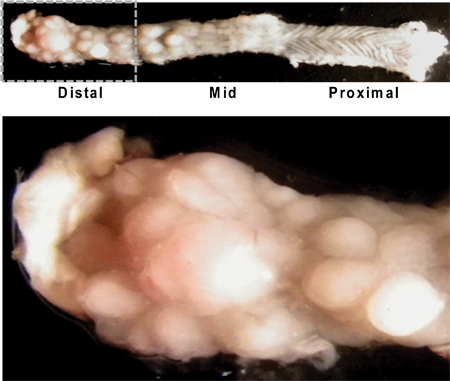
Figura 4. Longitudinalmente abierto colon de ratón que ilustra aspecto macroscópico de los tumores. Tenga en cuenta la mayor carga del tumor en el distal del colon / recto (imagen superior izquierda), y la textura característica rugated del colon proximal (imagen superior derecha) con el crecimiento tumoral poco. Una vista de cerca del colon distal muestra numerosos tumores de diferentes tamaños (abajo).
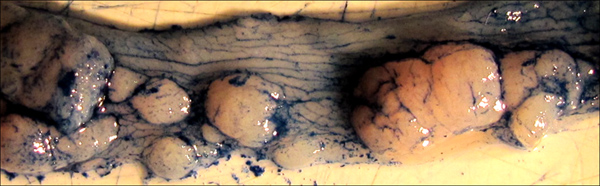
Los tumores Figura 5. Resaltados por la aplicación de Alcian azul mancha. Nótese cómo el colorante enfatiza la textura normal del colon, así como los bordes de cada tumor individual. Tinción de este tipo puede ser útil en la medición precisa de las zonas tumorales por regla o medida digital.
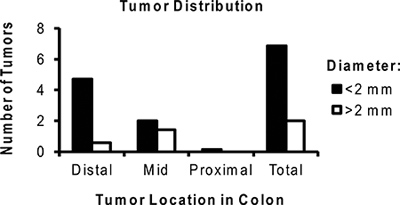
Figura 6. Distribución representativa del número medio de tumores por ratón tratados con OMA / DSS. Tenga en cuenta que la mayoría de los tumores se localizan en el colon distal y son <2 mm de tamaño.
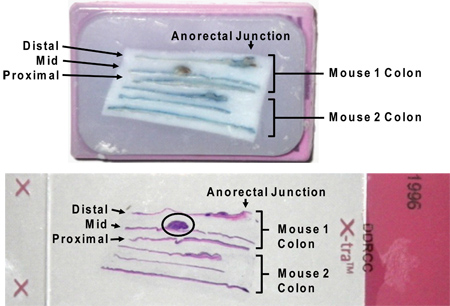
Figura 7. Parafina embebido en secciones longitudinales del colon en cassette (arriba) unad en la diapositiva después de tinción con HE (abajo). Tenga en cuenta que la mancha azul Alcian residual no interfiere con H & E tinción. Un tumor grande es un círculo en la imagen de la diapositiva (en el círculo). Las denominaciones "distal", "medio" y "proximal" resultan de seccionar el colon en tercios entre el ciego y el ano.

Figura 8. Histología Representante de un tumor resultante de la OMA / DSS administración en el colon distal. H & E, BrdU, y β-catenina portaobjetos teñidos a 50x (panel superior) y 400X (panel inferior), respectivamente, demuestran cambios displásicos similares a los adenocarcinomas de colon humano.
Discusión
El tratamiento de ratones con OMA y DSS rápida y efectivamente los modelos humanos cáncer de colitis asociada. Hipótesis con respecto a factores hereditarios contribuyen a la colitis cánceres asociados pueden ser fácilmente estudiado con ratones genéticamente modificados. 13, 16 Alternativamente, el efecto de objetivos farmacológicos en colitis asociada a cáncer puede ser estudiada mediante el empleo de ratones de tipo salvaje.
Si bien este modelo es muy valorado por los i...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado en parte por DK089016 y RR030244 L30 (MAC), CA153036 (AS), y P30 DK52574-(to the Core Washington University Digestive Diseases Research). AIT era un Howard Hughes Medical Institute Medical Research Fellow de Formación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Ratones C57BL/6J | Jackson Laboratory | 000664 | |
| Azoximetano (AOM) | Sigma Aldrich | A5486-100MG | Solución stock: diluido a 10 mg / ml en agua destilada que se mantuvo a -20 ° C como 0,5 a 1 ml de alícuotas. Solución de trabajo: diluir stock a 1 mg / ml en solución salina isotónica (0,9%) de solución salina |
| El dextrano sulfato de sodio (DSS) | TDB Consultoría | DB001 | MW 40 kDa (36-50 kDa preparaciones procedentes de otras fuentes son aceptables; El mismo lote se debe utilizar para un único experimento) 6 |
| Coloviewsistema miniendoscopic | Karl Storz | Múltiple | Ver Becker et al. Para la explicación detallada de los equipos y la configuración. 11 |
| TPP Rapid FilterMax 500 ml Botella-Filter, 0,22 m PES | Midwest Scientific | TP99500 | Cualquier filtro de cultivo de tejidos estándar es aceptable |
| Alcohol etílico 200 Proof ASC / USP | Fármaco-AAPER (u otro) | 11ACS200 | Diluir hasta 70% en agua destilada |
| USP isoflurano, | Mayordomo Animal Health Supply | 4029405 | Coloque el ratón en el tarro de cristal con una gasa o un paño empapado en anestésico pequeño |
| 18G Aguja Recta Gavage | Braintree Scientific | N-008 | |
| Tampón fosfato salino (PBS) | SigmaAldrich | P5493 | Diluir a 1X (0,01 M) en agua destilada |
| Bandeja fría (Tissue Tek II Placa Fría) | Fisher Scientific | NC9491941 | Almacenar a -20 ° C |
| ImageJ software | NIH (descarga gratuita) | http://rsbweb.nih.gov/ij/ | |
| Formaldehído (37%) | Fisher Scientific | F79-500 | Diluir a 10% en PBS |
| BD Bacto Agar | Fisher Scientific | DF0140-01-0 | Use placa calefactora para crear 2% de solución en agua destilada |
| Miltex Pinza Dressing Eye | MedPlus Inc. | 18-780 | |
| Miltex Tijeras oculares | MedPlus Inc. | 18-1430 | puntos curvos evitar daños en dos puntos durante la apertura. |
| Azul de Alcian 8GX (polvo) | Sigma Aldrich | A5268 | Añadir 1 g de polvo a 100 ml de 3% de ácido acético (3 ml de ácido acético glacial + 97 ml de agua destilada) |
| 1 ml jeringa de tuberculina con adjunto x 26 G 3/8 de aguja intradérmica bisel | BD | 305946 | Para la inyección de AOM |
Referencias
- Ekbom, A. Ulcerative colitis and colorectal cancer. A population-based study. N. Engl. J. Med. 323, 1228-1233 (1990).
- Terzic, J. Inflammation and colon cancer. Gastroenterology. 138, 2101-2114 (2010).
- Ullman, T. A., Itzkowitz, S. H. Intestinal inflammation and cancer. Gastroenterology. 140, 1807-1816 (2011).
- Okayasu, I. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J. Gastroenterol. Hepatol. 17, 1078-1083 (2002).
- Kanneganti, M., Mino-Kenudson, M., Mizoguchi, E. Animal models of colitis-associated carcinogenesis. J. Biomed. Biotechnol. 342637, (2011).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat. Protoc. 2, 1998-2004 (2007).
- Tanaka, T. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 94, 965-973 (2003).
- De Robertis, M. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J. Carcinog. 10, 9 (2011).
- Wirtz, S. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Cooper, H. S. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 69, 238-249 (1993).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat. Protoc. 1, 2900-2904 (2006).
- Becker, C., Fantini, M. C., Wirtz, S., Nikolaev, A., Kiesslich, R., Lehr, H. A., Galle, P. R., Neurath, M. F. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Shaker, A. Epimorphin deletion protects mice from inflammation-induced colon carcinogenesis and alters stem cell niche myofibroblast secretion. J. Clin. Invest. 120, 2081-2093 (2010).
- Boivin, G. P. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124, 762-777 (2003).
- Cooper, H. S. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 21, 757-768 (2000).
- Yoshida, Y. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 132, 1420-1431 (2007).
- Suzuki, R. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis. 27, 162-169 (2006).
- Mahler, M. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, 544-551 (1998).
- Nambiar, P. R. Preliminary analysis of azoxymethane induced colon tumors in inbred mice commonly used as transgenic/knockout progenitors. Int. J. Oncol. 22, 145-150 (2003).
- Tanaka, T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 8, (2009).
- Ciorba, M. A. Induction of IDO-1 by immunostimulatory DNA limits severity of experimental colitis. J. Immunol. 184, 3907-3916 (2010).
- Kerr, T. A. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: A poly-A purification solution. Inflamm. Bowel Dis. 18, 344-348 (2012).
- Tang, Y. is required for resection-induced changes in apoptosis, proliferation, and members of the extrinsic cell death pathways. Gastroenterology. 126, 220-230 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados