Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y cultivo de células de la cresta neural de embriones murinos del Tubo Neural
En este artículo
Resumen
Aislamiento de cresta neural embrionario del tubo neural facilita el uso de In vitro Métodos para el estudio de la migración, la auto-renovación, y multipotencia de la cresta neural.
Resumen
El embrión de la cresta neural (NC) es una población de progenitores multipotentes que se origina en la cara dorsal del tubo neural, se somete a un epiteliales de transición mesénquima (TEM) y migra a través del embrión, dando lugar a diversos tipos de células de 1-3. CN también tiene la capacidad única para influir en la diferenciación y maduración de los órganos diana 4-6. Cuando explantado in vitro, los progenitores NC someterse a la auto-renovación, migrar y diferenciarse en una variedad de tipos de tejidos incluyendo las neuronas y células gliales, células del músculo liso, cartílago y hueso.
Multipotencia Carolina del Norte fue descrita por primera vez a partir de explantes del tubo neural aviar 7-9. En el aislamiento in vitro de células NC facilita el estudio de la dinámica de Carolina del Norte, incluyendo la proliferación, migración y multipotencia. Seguir trabajando en los sistemas de aves y ratas demostraron que las células explantados NC conservar su potencial de Carolina del Norte cuando se trasplantan de nuevo en el embrión de 10-13. Debido a estas propiedades inherentes celulares se conservan en explantados progenitores NC, el tubo de ensayo explante neuronal proporciona una opción atractiva para el estudio de la NC in vitro.
Para lograr una mejor comprensión de los mamíferos NC, muchos métodos han sido empleados para aislar poblaciones NC. NC-derivados de los progenitores puede ser cultivado a partir de post-migratorias lugares, tanto en el embrión y el adulto para estudiar la dinámica de la post-migratorias progenitores NC 11,14-20, sin embargo el aislamiento de progenitores de Carolina del Norte, ya que emigran del tubo neural proporciona una conservación óptima de NC potencial de la pila y propiedades migratorias 13,21,22. Algunos protocolos emplear fluorescencia de células activadas clasificación (FACS) para aislar una población NC enriquecido para progenitores particulares 11,13,14,17. Sin embargo, cuando se inicia con embriones en fase inicial, el número de células adecuadas para el análisis son difíciles de obtener con FACS, lo que complica el aislamiento de principios populatio NCns a partir de embriones individuales. A continuación, describimos un método que no depende de la FACS y los resultados en una población de aproximadamente el 96% pura Carolina del Norte sobre la base de un reportero Wnt1-Cre activado linaje 23.
El método que aquí se presenta es una adaptación de los protocolos optimizados para el cultivo de ratas NC 11,13. Las ventajas de este protocolo en comparación con los métodos anteriores son que: 1) las células no se cultivan en una capa alimentadora, 2) FACS no se requiere para obtener una población NC relativamente puro, 3) premigratorias células aisladas se NC y 4) resultados son fácilmente cuantificados. Además, este protocolo se puede utilizar para el aislamiento de NC de cualquier modelo de ratón mutante, lo que facilita el estudio de las características de NC con diferentes manipulaciones genéticas. La limitación de este enfoque es que el CN se retira del contexto del embrión, que se sabe que influyen en la supervivencia, la migración y la diferenciación del CN 2,24-28.
Protocolo
1. Preparación de las placas
- Utilizar una técnica estéril en todo momento.
- Preparar fibronectina (FN) por dilución de 100 l de plasma humano de stock FN en un volumen final de 3,3 ml en PBS de Dulbecco (DPBS). La concentración final es de 30 mcg / ml y esto se puede almacenar a 4 ° C durante 1 semana.
- Cubrir el fondo de cada pocillo de una cultura estéril del tejido cuatro pocillos con solución de FN y deje reposar durante 15 minutos. Asegúrese de que toda la superficie está cubierta. Hacer medios durante este tiempo (pasos 2 y 3).
- Quitar FN solución y permita que las placas que se seque. Enjuague suavemente los pocillos con 500 L DMEM, DMEM quitar y añadir 500 l de auto-renovación (SR) medio (ver más abajo). Se incuba a 37 ° C en una incubadora humidificada que contiene 5 por ciento de CO 2. Complete esta hora aproximadamente un antes de la disección de modo que las placas se seca antes de su uso.
2. Preparación de Medio SR
- Para la cultura de vago y tronco Carolina del Nortede diez embriones (aproximadamente una camada, en función de los antecedentes genéticos de la línea de ratón), preparar 25 ml de medio de SR. Combinar 12,5 ml de DMEM bajo de glucosa, 7,5 ml de medio Neurobasal, 25 l de ácido retinoico (117 mM concentración final), y 25 l de 2-mercaptoetanol (50 mM concentración final). Mezclar bien.
- Añadir 3,75 ml de extracto de embrión del polluelo, 250 l de N 2 suplemento de sal, 500 l suplemento de B27 y 250 l de penicilina-estreptomicina (1% concentración final). Filtrar el medio a través de un filtro de 0,22 micras.
- Añadir 10 l estéril IGF1 (20 ug / ml de concentración final) y 20 l bFGF estéril (20 mg / ml de concentración final). Mezclar por inversión. Almacenar a 4 ° C.
3. Preparación de medio de lavado
- Durante aproximadamente 10 embriones preparar 50 ml de medio de lavado. Combinar 50 mg de BSA con 35 ml de glucosa bajo DMEM, 15 ml de medio Neurobasal, y 500 l de penicilina-estreptomicina (1% de concentración final). Filtro estéril con un 0,22filtro micras.
4. Preparación de colagenasa / dispasa
- Añadir 50 l de 100 mg / ml de colagenasa / dispasa a 5 DPBS mL. Mezclar bien.
- Jeringa filtro con un 0,2 micras filtrar y añadir 1,5 ml en cada uno de los tres pocillos de una placa de doce también. Pipeta aproximadamente 1 ml de medio de lavado en los pocillos restantes. Guarde toda la placa de hielo hasta que esté listo para digerir los tejidos disecados.
- Cortar la punta de una punta de pipeta P20 y P1000 filtro con una hoja de afeitar estéril. Cortar justo debajo del borde biselado de la punta. El corte p1000 se utiliza para transferir todo el embrión mientras que el p20 se utiliza para transferir piezas de tejido aislado.
5. Aislar vagal y el tubo neural del tronco de 9,5 embriones DPC
- Para los embarazos programados, las presas con un tapón vaginal se consideran 0,5 dpc al mediodía por la mañana el tapón que se observa. El sacrificio y extirpar el útero en el 9,5 dpc.
- Retire la decidua del útero y suavemente reMove el embrión de la decidua. Una vez experimentado con este protocolo, aislar 3-4 9,5 embriones DPC en un momento en DPBS estériles. Utilice una técnica estéril y esterilizados los instrumentos de disección. Los instrumentos pueden ser esterilizados mediante esterilización por calor autoclave, o por incubación en etanol.
- Para vagal anterior, Carolina del Norte: el uso de agujas de insulina, cortar el tubo neural en la placoda ótica medio. Corta de nuevo en el borde posterior de la somite 4 º. Recorte el tejido ventral a la del tubo neural para quitar los arcos faríngeos y el corazón.
- Para NC tronco: el uso de agujas de insulina, retire la parte del tubo neural entre 16-22 somitas (o la última somite si los embriones son de desarrollo anterior a la somite etapa 22).
- Mantenga el saco vitelino y cualquier resto de tejido embrionario para la genotipificación.
6. La eliminación de los nervios no ectodermo y mesodermo
- Coloque el tubo neural que contiene segmentos en colagenasa / dispasa a temperatura ambiente durante 10 minutoss. Lavar inmediatamente en el medio de lavado.
- Volver a tejido DPBS estériles. El uso de agujas estériles de insulina, retire suavemente el ectodermo no neural de los tejidos y separar los somitas lejos del tubo neural. Las últimas partes restantes del mesodermo a partir de tejido somito se puede quitar por trituración suavemente usando un corte hacia abajo p20 punta. Tenga cuidado de no dañar el tubo neural. Observe esto muy de cerca durante la trituración.
- Se coloca el tubo neural aislado a través de una segunda y tercera de lavado 30 segundos de medio de lavado.
- Lavar una vez en un medio de SR, y colocar el tubo neural aislado en el centro de un pozo FN-revestido que se preparó previamente (Paso 1,3). Humedezca el ambiente de la cámara de hipoxia con un plato de agua estéril. Poner la cápsula en la cámara de hipoxia y vaciar la cámara con gas mixto a 3% de O 2 (usar un tanque que contiene una mezcla de 1% de O 2, 6% de CO 2, 93% de N 2).
- Siempre maneje la cámara con sumo cuidado para asegurarse de Thaexplantes son t tranquila y permanecen en el centro de los pocillos.
- Se incuba a 37 ° C. Resumen de los pasos 5-6 se muestra en la Figura 1.
7. La eliminación del tubo neural
- Después de 24 horas de incubación, retirar el tubo neural suavemente burlas el borde del tubo neural lejos de las células que migran utilizando una aguja de insulina estéril. Retirar y desechar el tubo neural del medio utilizando un corte de p20 estéril como en el paso 6,2 y reemplazar el medio con medio fresco SR (Figura 2). Esto es más fácil hacerlo mediante un microscopio invertido.
8. Los resultados representativos
Tras 24 horas de incubación a 37 ° C en condiciones hipóxicas, las células NC han migrado lejos del tubo neural en una población casi puro (Figura 3a). A veces, menos que los cultivos ideales no va a ceder crecimientos robustos. Por ejemplo, es posible que después de 24 horas tque el tubo neural se han enroscado sobre sí mismo y el CN no se migran fuera del tubo neural (Figura 3b). De vez en cuando el tubo neural no se adhieren a las placas recubiertas de fibronectina.
En nuestra experiencia, sub-óptimo de migración Carolina del Norte o problemas con la conexión del tubo neural pueden ser afectados adversamente por las condiciones de normoxia o de concentración de la fibronectina, respectivamente. La actividad enzimática de la colagenasa / dispasa varía ligeramente por lote y el tiempo de digestión se debe ajustar apropiadamente, sin embargo, no digieren el tejido más de quince minutos. Overdigestion del tubo neural que contiene tejido en colagenasa / dispasa también dará lugar a crecimientos deficientes. Si el tejido somite no se elimina fácilmente del tubo neural después de la incubación en la colagenasa / dispasa, el tubo neural puede ser incubado durante más de diez minutos. A veces el tubo neural no se adherirá al sustrato. Si este es el caso, compruebe la fibronecestaño concentración y las condiciones de hipoxia.
Aunque las condiciones normoxic se puede utilizar para cultivo de tipo salvaje NC, las condiciones hipóxicas más estrechamente imitar el entorno in vivo 29,30. En nuestra experiencia, las condiciones de hipoxia se tornó crítica cuando se cultiva mutante Carolina del Norte. Por ejemplo, cuando Foxd3 mutante NC se cultivaron en condiciones normoxic, NC tronco tenía una excrecencia celular reduce considerablemente en comparación con los controles. Esta disparidad en tamaño consecuencia se eliminó cuando los explantes se cultivaron en condiciones hipóxicas (Figura 4). Además, cuando los explantes de tipo salvaje del tubo neural se cultivaron en normoxia, el número de células positivas caspasa fue mayor que a continuación de explantes similares cultivadas en hipoxia (datos no presentados). Al mantener toda la cultura Carolina del Norte en la hipoxia, las comparaciones pueden ser más fácilmente entre la dinámica de control y culturas mutantes.
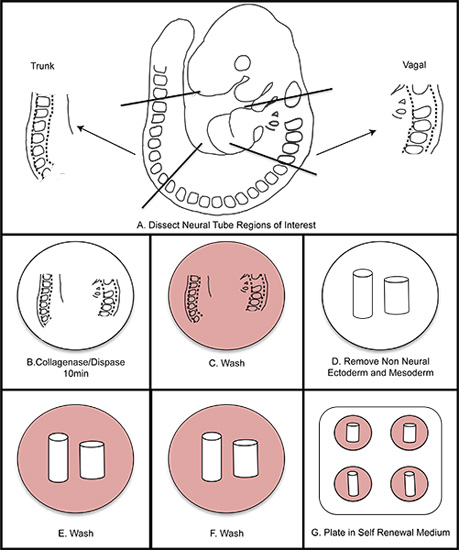
Figura 1. Esquemática general de aislamiento CN. A) Disección de las regiones de interés del embrión. B) Recopilación del tubo neural en la colagenasa / dispasa durante diez minutos (no sobrepasar los quince minutos). C) Lave en medio de lavado. D) diseccionar el ectodermo no neural y mesodermo. EF) Lavar dos veces en medio de lavado. G) Placa en el medio de auto-renovación. Se incuba a 37 ° C en el 3% de O 2 condiciones de hipoxia.
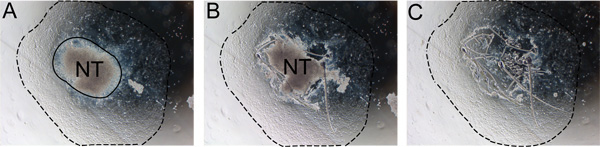
Figura 2. La eliminación gradual del tubo neural del explante. El tubo neural deben ser removidos después de 24-48 horas para evitar la contaminación con los no-NC células. A) una notificación de la frontera entre el tubo neural y la consecuencia Carolina del Norte (línea continua). B) Cortar a lo largo del borde del tubo neural con una aguja de insulina. C) Se desecha el tubo neural y reemplazar con un nuevo medio a medio auto-renovación. La línea de puntos indica el alcance de la consecuencia. Abreviatura: NT, del tubo neural.
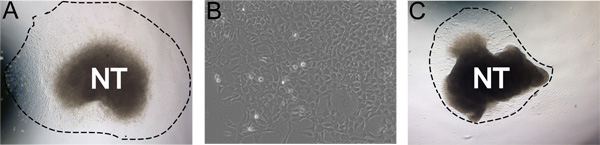
Figura 3. Ejemplos de resultados representativos. A) fruto típico explante después de 24 horas de incubación en un medio de auto-renovación en condiciones de hipoxia (línea punteada indica el alcance de la consecuencia). B) Vista ampliada de la consecuencia Carolina del Norte después de 48 horas en la cultura. C) Menos de la cultura ideal, con rendimiento de fruto baja. A y C se cultivaron en las mismas condiciones. Imágenes demuestran la solidez en el área de distribución natural la cultura. Esto puede verse afectada por la eficiencia de aislamiento del tubo neural, la concentración de FN, las condiciones hipóxicas, y el tiempo en digestiones colagenasa / dispasa.
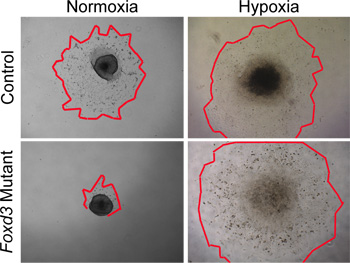
Figura 4. En los análisis in vitro de cultivos de explantes NC en normoxia frente a la hipoxia. De control (tipo salvaje) NC células migraron a partir de explantes de tubo neural después de 48 horas en condiciones de cultivo normoxic. En contraste, Foxd3 mutanteCarolina del Norte se había reducido en gran medida crecimientos celulares en normoxia (de color rojo marca los contornos de los bordes de las derivaciones NC). Cuando los explantes comparables fueron cultivadas bajo condiciones de hipoxia, Foxd3 mutantes explantes de Carolina del Norte creció de forma comparable a los controles, lo que permite su posterior análisis. Tenga en cuenta que este comportamiento una buena correlación con el comportamiento de Foxd3 mutante Carolina del Norte en vivo.
Discusión
Debe prestarse cuidadosa atención a la etapa de desarrollo del embrión para asegurar el éxito de este enfoque. Contando somitos de embriones tempranos de ratón es fundamental tanto para la etapa correspondiente embriones dentro de una camada y la determinación de las regiones correctas del tubo neural para el aislamiento. Una variación de uno o dos somitas entre embriones está dentro de una gama razonable de tiempo de desarrollo, dependiendo de la resolución del experimento llevado a cabo. Un embrión entre el 9...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Nos gustaría agradecer a Marc Wozniak para la asistencia de vídeo. También queremos agradecer a Sean Morrison de UT Southwestern para el protocolo original para el cultivo de células de rata NC. Este trabajo fue apoyado Vanderbilt University Medical Centro de Soporte del Programa Académico y fue por las subvenciones del NIH (HD36720 y HD036720 11S109-) y la AHA 11GRNT7690040 a PAL, las becas predoctorales de la AHA (0615209B) y el NIH (NS065604) a Nam, y el ERP con el apoyo de una formación T32HD007502 NIH subvención.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | Comentarios |
| DMEM (glucosa baja) | Gibco / Invitrogen | 11885 | |
| Medio Neurobasal | Gibco | 21103 | |
| BSA | Sigma | A3912-10G | |
| DPBS | Gibco | 14190-144 | |
| IGF1 | BD Biosciences | 354037 | Almacenar en 50 mg / ml alícuotas a -20 ° C. |
| bFGF | BD Biosciences | 354060 | Tienda en 25 g / ml alícuotas a -20 ° C. |
| La fibronectina | Gibco | 33016-015 | Almacenado en 1mg/mL aliquots a -20 ° C. |
| El ácido retinoico | Sigma | R2625 | Tienda en 35 microgramos / ml alícuotas después de la reconstitución de etanol a -20 º C. |
| 2-mercaptoetanol | Sigma | D-5637 | |
| N 2 suplemento | Gibco | 17502-048 | |
| Suplemento B27 | Gibco | 17504-044 | |
| Filtros de 0,22 micras Steriflip | Millipore | SCGP00525 | |
| La penicilina-estreptomicina | Invitrogen | 15140122 | |
| 0,20 micras filtros | Corning | 431219 | |
| Jeringas (por filtración) | BD Biosciences | 301604 | |
| Cuatro placas | Thermo Fisher Scientific | 176740 | |
| Colagenasa / dispasa | Roche | 269 638 | Actividad varía por lotes. Almacenar en 100 mg / ml alícuotas a -20 ° C. |
| Agujas de insulina (29 ½ medidor) | Becton Dickinson | 309306 | |
| Cámara de Hipoxia | Billups-Rothenberg | ||
| Analizador de oxígeno | Billups-Rothenberg | ||
| Pinzas # 5 | Herramientas de Bellas Ciencia | Para quitar el útero y la decidua. | |
| Tripsina-EDTA (0,25%) | Gibco | 25200 |
Referencias
- Le Douarin, N., Kalcheim, C. . The neural crest. , (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -. P. . Neural crest induction and differentiation. , (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e. Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados