Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Postproducción de procesamiento de las Fibras electrospun de Ingeniería de Tejidos
En este artículo
Resumen
Andamios electrospun puede ser procesado post-producción para aplicaciones de ingeniería de tejidos. Aquí se describen los métodos para hacer girar los andamios complejos (por hilado consecutivos), para la fabricación de andamios más gruesas (por el multi-capas usando calor o recocido de vapor), para lograr la esterilidad (la producción aséptica o esterilización de la post-producción) y para la consecución de adecuadas propiedades biomecánicas.
Resumen
Electrospinning es un método de uso común y versátil para producir andamios biodegradables (a menudo) para la ingeniería de tejidos en 3D. 1, 2, 3 Muchos tejidos in vivo someterse a la distensión biaxial de mayor o menor medida, como la piel, vejiga, pelvis y hasta el paladar duro, como los niños crecer. En la producción de andamios para estos fines hay una necesidad de desarrollar andamios de adecuadas propiedades biomecánicas (si lograrse sin o con las células) y que son estériles para uso clínico. El objetivo de este trabajo no es la forma de establecer los parámetros básicos electrospinning (ya que hay una amplia literatura sobre electrospinning), sino sobre cómo modificar la producción de hilado después de andamios para que sean aptas para usos de ingeniería de tejidos - aquí espesor, propiedades mecánicas y la esterilización (necesario para la uso clínico) se consideran y también se describe cómo las células pueden ser cultivadas en los andamios y se somete a tensión biaxial a condición ellos para aplicaciones específicas.
Electrospinning tiende a producir láminas finas, como el colector de electrospinning se cubre de fibras aislantes se convierte en un conductor tan pobre que las fibras no se depositan en él. Por lo tanto se describen métodos para producir estructuras más gruesas por el calor o vapor de recocido aumentar la resistencia de los andamios, pero no necesariamente la elasticidad. Hilado secuenciales de los andamios de diferentes polímeros para lograr andamios complejos también se describe. Metodologías de esterilización pueden afectar negativamente a la fuerza y la elasticidad de los andamios. Se comparan tres métodos para determinar sus efectos sobre las propiedades biomecánicas de los andamios electrospun de poli láctico-co-glicólico (PLGA).
Imagen de las células en los andamios y la evaluación de la producción de la matriz extracelular (ECM) de proteínas por las células en los andamios se describe. El cultivo de células in vitro en los andamios pueden mejorar la fuerza y la elasticidad de andamio, pero la ingeniería de tejidos literatuRe muestra que las células a menudo no producen ECM apropiado cuando se cultivan bajo condiciones estáticas. Hay muy pocos sistemas comerciales disponibles que permiten a las células un cultivo en los andamios bajo regímenes de acondicionamiento dinámicos -. Un ejemplo es el ElectroForce Bose 3100 que puede ser utilizada para ejercer un programa de acondicionamiento en las células en los andamios a cabo usando mordazas mecánicas dentro de unos medios de cámara de llenado 4 Una aproximación a un biorreactor presupuesto cultivo de células para la distorsión controlada en 2 dimensiones se describe. Se demuestra que las células pueden ser inducidas a producir elastina en estas condiciones. Por último la evaluación de las propiedades biomecánicas de los andamios procesados cultivadas con o sin células se describe.
Protocolo
1. Electrospinning de las Fibras azar y se alinea
Electrospinning crea finos fibrosos mediante el uso de las redes de potencial eléctrico para dibujar una solución de polímero hacia un colector conectado a tierra. Los coleccionistas pueden estar en formas muy numerosos y pueden ser estáticas o, más comúnmente giratorio,. El disolvente se evapora antes de la solución llega en el colector y el chorro se solidifica en una fibra.
Cada polímero requiere su propio conjunto de condiciones para producir un determinado tipo de fibra. La concentración del polímero, el disolvente, la distancia entre la solución bombeada y el colector conectado a tierra, la diferencia de potencial entre los dos, la velocidad del colector giratorio, la temperatura del caudal, y la humedad todo ello afectará electrospinning. Hay muchos estudios que describen la selección de electrospinning parámetros y cómo estos influyen en los andamios producidos (diámetro de la fibra, por ejemplo, la morfología y orientación). 5, 6, 7, 8En estos experimentos se hicieron girar andamios basado en condiciones seleccionadas en nuestros estudios anteriores. 2, 9
Los siguientes métodos son adecuados para la producción de andamios electrospun de PLGA, ácido poli láctico (PLA), poli ε-caprolactona (PCL) y poli hidroxibutirato-co-hidroxivalerato (PHBV), utilizando un colector giratorio como se muestra en la Figura 1. A lo largo del disolvente diclorometano (DCM) se utiliza. El método aquí produce microfibroso PLGA, EPL y PCL y nanofibras andamiaje PHBV con cuentas microscópicas ('collar de perlas' morfología).
- Escudo de la. Rotación colector de mandril con papel de aluminio, con el lado brillante / brillante hacia afuera Nuestra mandril era de 20 cm de ancho y 10 cm de diámetro.
- Preparar soluciones de polímeros, PLA, PCL y PHBV se componen como una solución al 10% en peso en DCM. PLGA se compone como una solución al 20% en peso en DCM.
- Coloque 4 jeringas de volumen de 5 ml en una bomba de jeringa. Jeringas se cargan a contain 5 ml del polímero cada uno, dando 20 ml en total.
- Para PLA, PCL y PHBV utilizar un caudal de 40 μLmin -1 por jeringa.
- Para PLGA utilizar un caudal de 30 μLmin -1 por jeringa.
- Para PLA, PCL y PLGA utilizar una distancia de trabajo de 17 cm de la punta de la aguja a mandril.
- Para PHBV utilizar una distancia de trabajo de 10 cm del extremo de la aguja al mandril.
- Cargue las agujas de jeringas de 17.000 V (P 73.030, Genvolt, Shropshire, Reino Unido) y electrospin de la distancia apropiada sobre el mandril de aluminio recubierto de aluminio.
- Para las fibras al azar girar el mandril a 200 rpm.
- Para las fibras alineadas girar el mandril a 1000 rpm.
- Los andamios se pueden almacenar en la lámina de aluminio bajo condiciones secas. Almacenamiento recomendado es en un recipiente sellado a 4 ° C en presencia de desecante. En nuestra experiencia, los andamios se mantienen estables durante al menos 4 meses (posiblemente mucho más tiempo) en estas condiciones (no somos conscientes de cualquier puestudios de comidas en condiciones de almacenamiento prolongado de andamios).
2. La producción de andamios complejos Spinning secuenciales
Hilatura secuenciales proporciona un método de combinar las propiedades de los materiales diferentes para crear un material que tiene el mejor de ambas propiedades. PHBV produce una superficie plana, hoja densa y quebradiza, mientras que el PLA o giro PCL produce láminas elásticas de baja densidad. Ambos materiales apoyar la unión de las células. Consecutivamente girar estos resultados materiales en una densa celda impermeable a la membrana que es elástica.
- Configurar el equipo electrospinning según la sección 1, con las condiciones de PHBV spinning.
- Electrospin PHBV como anteriormente.
- Sin cambiar la lámina de aluminio, electrospin un segundo polímero en la parte superior utilizando los parámetros y condiciones normales para ese polímero (por ejemplo, 17 cm de tambor a la aguja, 17000 V, 200 rpm durante PLA). Este proceso aditivo se acumula una capa doble de andamio producir una bicapa.
3. La producción de andamios multicapa de recocido Varias capas Juntos
- Los andamios pueden constar de varias capas a través del uso de calor de recocido. Para hacer esto 4 hojas de PLGA se colocan en la parte superior de la otra y luego calentar recocido a 60 ° C durante 3 horas.
- Los andamios también puede ser recocida por vapor de recocido. A continuación, 4 hojas de PLGA se colocan encima de la otra y se suspendieron 2 cm por encima de una piscina de DCM (10 ml) durante 1 hora. Esto se realiza en un recipiente sellado a temperatura ambiente.
4. La producción aséptica y esterilización Postproducción de Andamios electrospun
- Aséptica producción andamio se puede lograr por electrospinning en un ambiente aséptico de una campana de flujo laminar dentro de un ambiente de sala limpia. Para hacer esto polímeros o bien estériles de grado médico o polímeros esterilizados por incubación en DCM puede ser utilizado. Una vez disuelto, los polímeros se electrospun en papel de aluminio envuelto alrededor de estéril, comoterilised mandril. Los andamios se tratan de forma aséptica. La esterilidad se verificó mediante la incubación de muestras de que el andamio en medios de cultivo libres de antibióticos para el período correspondiente.
- Para la desinfección etanol (esto es de uso experimentalmente, pero no es un método reconocido de esterilización que podría ser llevado a la clínica) andamios se coloca brevemente (15 min) en un 70% v / v de etanol en agua destilada. Para propósitos prácticos experimentales esto suele ser suficiente para desinfectar los andamios a fin de que se puede combinar con éxito con células cultivadas.
- Para peracético andamios ácido esterilización se sumergen en ácido peracético (0,1% v / v en tampón fosfato salino (PBS)) y se incubaron durante 3 horas a temperatura ambiente como se describe en Selim et al. 9
- Para gamma andamios esterilización se irradian con una dosis de 3 kGy utilizando una fuente de cesio como se describe en Selim et al. 9
5. Pruebas de Biomecánica de andamios
- Los andamios están cortadas en rectángulos 5 mm x 20 mm, medida para el espesor utilizando un micrómetro, y se coloca en un instrumento de Bose ElectroForce 3100. Esta máquina se aplica una fuerza de 0-22 N hasta un desplazamiento de 6 mm y parcelas la carga vs desplazamiento como una curva de esfuerzo / deformación. Esto permite que el módulo de Young y elasticidad para ser calculado.
6. Visualizar las células en andamiajes y evaluación de la producción de MEC
Las células pueden ser teñidas con colorantes fluorescentes vitales que le permiten a uno ver las células en los andamios que al unirse, migrar y proliferar. Cultura post la presencia de células en los andamios se puede determinar mediante la tinción de núcleos de células con 4 ',6-diamino-2-fenilindol dihidrocloruro (DAPI). La producción de ECM por las células en el andamio puede ser evaluada por tinción de las células para una gama de proteínas ECM incluyendo elastina como se muestra en este ejemplo. Todos los andamios utilizados fueron medidos para tener unaespesor de al menos 0,2 mm y se cortó en cuadrados de 1,5 cm x 1,5 cm antes de la siembra.
En estos estudios, los fibroblastos dérmicos humanos se utilizan en todo por el papel que desempeñan en la reconstrucción de tejidos blandos, que es el interés de nuestro laboratorio de investigación primaria.
Las células se obtienen de muestras de piel de los pacientes sometidos a cirugía electiva de la reducción de senos o abdominoplastia (consentimiento fue dado por sus tejidos para ser utilizado con fines de investigación). Los tejidos se recogen y se utiliza de forma anónima en los tejidos de licencia de Investigación del Banco 12179. Los tejidos se lavaron con PBS que contenía estreptomicina (0,1 mg / ml) y penicilina (100 UI / ml) y anfotericina B (0,5 g / ml). Las muestras de tejido se incuban en 0,1% w / v tripsina y 0,1% de glucosa en PBS (12-18 horas, 4 ° C). La dermis se despega, picados finamente y se incubaron con 10 ml de colagenasa (0,5% w / v en DMEM y 10% de FCS, 37 ° C durante 18 horas). La centrifugación de las células resultantes Suspensiónico (400 g durante 10 minutos), produce un precipitado de células que pueden ser cultivadas y se subcultivaron en DMEM suplementado con suero fetal de ternera (FCS, 10% v / v), estreptomicina (0,1 mg / ml), penicilina (100 UI / ml) y anfotericina B (0,5 g / ml). Sólo los fibroblastos de paso 4-9 se utilizan en los experimentos.
- Fibroblastos dérmicos humanos, una vez confluentes en un T75 (EasyFlask, Nunc, Nueva York, EE.UU.) se siembran mediante la adición de tripsina / EDTA (5 ml, 5 mg / ml de tripsina, 2 mg / ml de EDTA en solución salina), incubando durante 5 minutos a 37 ° C. La suspensión se centrifuga durante 10 minutos (150 g). Las células se resuspendieron en 5 ml de DMEM (suplementado con FCS (10% v / v), estreptomicina (0,1 mg / ml), penicilina (100 UI / ml) y la anfotericina B (0,5 g / ml)) y se contaron utilizando un hemocitómetro, y la concentración se ajusta para la siembra. Las células se sembraron a normalmente 50.000 células por pocillo.
- Si es necesario, antes de la siembra de células en el andamio, las células pueden ser pre-marcado con CellTracker rojo o verde. La células se lavó con 3 x 5 ml de PBS. Una solución de 10 mM en CellTracker libre de suero, las células apropiadas, medio (10 ml) se añade y se incuban las células durante 45 minutos a 37 ° C. Después de la incubación, las células se lavaron en 3 x 5 ml de PBS siguiente que se sembraron en los andamios. Después de esto la superficie de los andamios se pueden obtener imágenes en un microscopio ImageExpress Axon (Molecular Devices, Sunnyvale, EE.UU.) en nm λex 570 a 620 nm λem (CellTracker rojo) y 480 nm λex - 533 nm λem (CellTracker verde). Para investigar la penetración de las células más profundamente en los andamios un microscopio confocal multifotónica puede ser utilizado. Esto se puede lograr una penetración de alrededor de 200 micras en la mayoría de los andamios, con o sin células.
- Poner las muestras de cultivo se fija en 1 ml de formaldehído 3,7% en PBS a 37 ° C durante 20 minutos y después se lavó con 3 x 1 ml de PBS.
- 200 l de anticuerpos primarios elastina se añadió a cada muestra (5% v / v en PBS, conejo anti-humanos ELAS alfaestaño, AbDserotec, Kidlington, Reino Unido) y se incubaron a 37 ° C durante 30 minutos.
- Las muestras se lavaron con 3 x 1 ml de PBS y luego incubadas en una solución de anticuerpo secundario (0,5% v / v de cabra anti-IgG de conejo (FC): FITC) en PBS que contenía DAPI (1 mg / ml) durante 30 minutos.
- Después de esto, las muestras se lavan con 3 x 1 ml de PBS.
- DAPI y muestras secundarias de anticuerpos teñidos luego son expuestas en un microscopio fluorescente ImageExpress Axon, 365 nm λex - 460 nm para λem DAPI y 480 nm λex - 533 nm para λem el anticuerpo secundario. DAPI manchas de los núcleos y permite ver la distribución de las células dentro de las fibras con mucha facilidad.
7. Someter a las células en los andamios para acondicionamiento dinámico de dos ejes
Para examinar el efecto del condicionamiento sobre la dinámica de la producción de fibroblastos ECM hemos desarrollado una simple prueba de concepto de biorreactor para explorar esta.
- Montar globo y el flujoaparato regulación y preparar el sistema para que pueda ser fácilmente colocado en un recipiente estéril adecuado para el cultivo de células una vez que está revestido.
- Autoclave el aparato que incluye el globo (122 ° C, 220 mbar durante 1 hora). Podemos confirmar que los globos sobrevivir autoclave sin afectar negativamente a su función por el inflado y desinflado de forma repetida.
- En una habitación limpia, desempaquetar el aparato en una campana de flujo laminar en condiciones de ser electrospun en.
- Inflar el globo a la superficie requerida (recordar el globo todavía tiene que encajar en el recipiente de cultivo) con tampón fosfato salino y conectar el PBS a una tierra eléctrica en un punto en el aparato que no necesita ser estéril (tubo de derivación sobre 3-way del grifo).
- Electrospin el polímero requerida sobre el globo usando las condiciones normales de hilatura, utilizando una distancia de trabajo de 10 cm. Permita que el andamio que se seque durante 1 hora. Las fibras húmedas que son 'pegajosas' suficiente para cumplir con las olasas del balón sin que posteriormente separar.
- Coloque el globo en un recipiente estéril y transportarlo a una campana de flujo laminar adecuada para el cultivo celular.
- Quitar el globo del recipiente y el lugar sobre una superficie estéril (cápsula de Petri) y repetidamente (cada 20 segundos) pipetear una suspensión de células (1 x 10 6 células en 5 ml de DMEM) en el globo recubierto durante 20 minutos para intentar distribuir las células de manera uniforme sobre la superficie.
- Colocar globo en el recipiente de cultivo, y añade precalentado medios apropiados para el tipo de célula.
- Conecte el aparato de la inflación a una bomba de jeringa (Kent Científico, Genie Plus, Connecticut, EE.UU.) e inflar / desinflar el globo tal como exigía la distensión de dos ejes. Una bomba de jeringa equipo controlado se puede utilizar para lograr un régimen de distensión más compleja.
8. Los resultados representativos
Las cifras siguientes son resultados representativos que se pueden esperarsi los métodos anteriores se siguen.
Electrospinning puede ser utilizada para crear los andamios con arquitecturas aleatorios y ordenada (Figura 1), esto es repetible y las fibras son uniformes. Muchos tipos de polímeros se pueden electrospun con características que pueden variar considerablemente, como se muestra en la Figura 2 para PHBV, EPL o PCL. Electrospinning pueden producir ligeros andamios mullidas o de las membranas celulares densos impenetrables (ver Figura 3). Todos los andamios que se muestran aquí facilitaron la adhesión celular y la proliferación. Trabajos previos han demostrado que las células pueden migrar a través de estos andamios hasta una profundidad de al menos 500-600 micras 9 para PLA el diámetro de fibra promedio es de 3 micras;. Para PHBV es 0.3μm con perlas que van desde 5-20 micras; para PCL es 3 micras; y para PLGA es 11 micras. Otros estudios que utilizan otros sistemas de solventes informan de que puede ser PHBV electrospun como fibras, sin cuentas o perlas de polímero 10,11.
Si se requieren más gruesas andamios de vapor y el calor de recocido puede ser empleado para recocer capas de andamios juntos (véase la Figura 4). Estas capas de andamios no delaminar y puede ser muy difícil encontrar la unión entre las capas.Se demuestra que las membranas bicapa se puede hacer que las células A y B pueden ser cultivadas en cada una membrana separada sin entremezclar como se muestra en la Figura 5. Aquí se demuestra esto usando los fibroblastos dérmicos humanos con dos colores diferentes tintes fluorescentes de células del perseguidor. Tal membrana bicapa sería útil cuando el cultivo de células para formar un tejido duro tal como el hueso o cartílago en un lado separado de las células destinadas a formar un suave (y generalmente más rápido crecimiento) del tejido en el otro lado, tales como la reparación del paladar hendido o reconstructiva periodontal la cirugía. 12, 13
Con respecto al impacto de la esterilización de electrospun andamios que tenemosya se ha informado que el método de los impactos de esterilización en el cultivo celular andamio y posterior. 9 Esto se ilustra en la Figura 6 que muestra los efectos del ácido peracético, irradiación gamma y etanol en el diámetro de la fibra y resistencia a la tracción y módulo de Young de un andamio PLGA .
La irradiación gamma no tiene ningún efecto significativo sobre diámetro de la fibra mientras que el ácido peracético y etanol reducir el diámetro de fibra en aproximadamente un 50%. Con respecto a la resistencia a la tracción de cada uno de los métodos de esterilización cambió la resistencia a la tracción y la elasticidad de los andamios. Cultivo de células en estos andamios reducido aún más la carga última, pero aumentó la elasticidad.
Finalmente, un método de probar el efecto de distensión biaxial dinámica en las células cultivadas en andamios electrospun se presenta. Este enfoque de prueba de concepto muestra que las células sigan siendo viables durante la dinámica dedistensión pero también producen cantidades aumentadas de elastina en estas condiciones. Esto contrasta marcadamente con la falta de elastina cuando las mismas células en el mismo andamio se mantienen bajo condiciones estáticas (ver Figura 7).
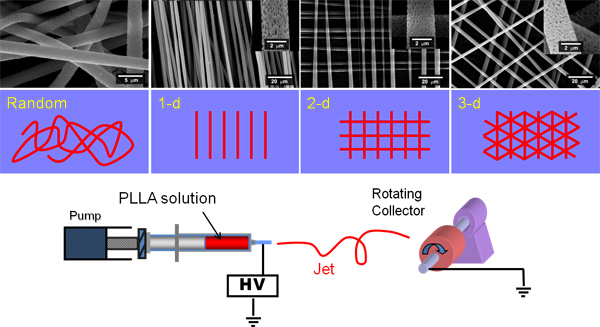
Figura 1. Muestra un dibujo de un equipo de perforación electrospinning y de la hilatura de fibras al azar y en paralelo y luego capas de fibras colocadas unas sobre otras. Fibras perpendiculares pueden ser creados por electrospinning un conjunto de fibras alineadas en una lámina de aluminio, al girar la lámina por 90 ° y luego inmediatamente electrospinning un segundo conjunto de fibras alineadas en la parte superior de estos.

Figura 2. Muestra la morfología de las esteras electrospun al azar de (A) PLA (barra de escala es de 100 m), (B) PHBV (barra de escala es de 100 m), (C) PCL (barra de escala es 100 micras) y (D) de PLGA (barra de escala es de 200 micras). Tenga en cuenta que el PLA, PCL y PLGA son todos los andamios uniformes microfibrosos. PHBV se hace girar como un "collar de perlas 'con nanofibras de conexión 5-20 gotas del tamaño de micras. Haga clic aquí para ver más grande la figura .

Figura 3. Producción de un andamio multicapa. Aquí los andamios son inicialmente giró con PHBV y jeringas llenas de PLA o PCL se utilizan. Estos se hacen girar en la parte superior del andamio PHBV. La figura muestra la aparición de estos andamios de varias capas, (A) Una sola capa de PHBV, (B) Un corte transversal de una bicapa de PHBV-PLA, que muestra la densidad de nanofibras, "collar de perlas" PHBV capa (izquierda) y microfibroso más abierto PLA capa (derecha) y (C) Una sola capa de PLA.nk "> Haga clic aquí para ver más grande figura.
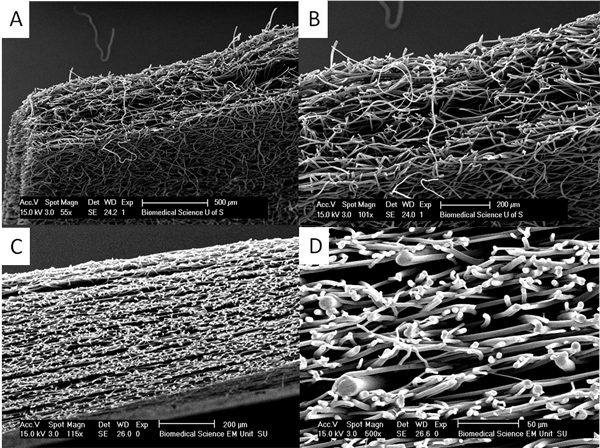
Andamios Figura 4. Más gruesas pueden ser producidos por el calor de recocido y recocido de vapor. (A) y (B) muestran una sección a través de un vapor de recocido PLA andamio donde iniciales andamios fibrosas de aproximadamente 150 micras se han colocado juntas y diclorometano de vapor se utiliza para hacer andamios mucho más gruesas de hasta 500 micras. En (C) y (D) se puede ver que el andamio consta de capas de fibras mucho más gruesas intercaladas con capas de fibras más finas creadas por el calor de recocido capas de fibras finas y gruesas juntos. Este enfoque puede ser utilizado para producir los andamios de las complejas propiedades mecánicas. Haga clic aquí para ver más grande la figura .
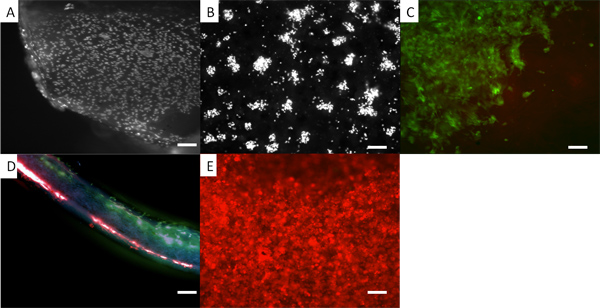
Fi gura 5. La aparición de las células en un andamio de dos capas. En todos los casos, las células presentes son los fibroblastos dérmicos humanos. (A) en fibroblastos electrospun PLA donde las células se fijan y se tiñeron con DAPI. (B) DAPI células teñidas en PHBV. En (C), los fibroblastos son pre-teñidas con un colorante vital, verde CellTracker, y se puede ver la aparición de ellos en la parte del EPL de la bicapa. (D) Una sección a través de la bicapa con rojos fibroblastos manchadas en la superficie inferior PHBV y verdes fibroblastos teñidos sobre la superficie superior del PLA. (E) Los fibroblastos de pre-teñido con rojo CellTracker crecido sobre la superficie PHBV. El uso de colorantes vitales fluorescentes proporciona una metodología conveniente para observar la distribución de las células en el cadalso, mientras que las células todavía están creciendo. Una forma rutinaria puede utilizar estos colorantes por lo menos 7 días. Sin embargo, la concentración de colorante se diluye como las células se dividen. Las barras de escala son iguales a 0,1 mm.
g6.jpg "alt =" Figura 6 "/>
Figura 6. Propiedades biomecánicas de electrospun andamio se obtienen usando un dispositivo de Bose ElectroForce tensiómetro (A). (B) de tensión / deformación curvas de PLGA andamios esteriliza por irradiación gamma, el alcohol, ácido peracético, o producidas asépticamente. Tres mediciones se pueden obtener de tal gráfica: la tensión de tracción última (UTS) para que la fibra puede ser sometido antes de romperse, la cepa a la tracción y el módulo de Young. El último da una indicación de la elasticidad del andamio. (C) El efecto de cada método de esterilización en el diámetro de la fibra de PLGA en micras. Cada metodología de esterilización disminución de UTS. Tanto el ácido peracético y la radiación gamma disminuir el módulo de Young dando un andamiaje más elástica, el alcohol hace que el andamio sobre todo frágil. Haga clic aquí para ver más grande la figura .

Figura 7. Esta figura muestra el uso de un balón sencillo para proporcionar un biorreactor biaxial en el que los andamios (y las células que crecen dentro de los andamios) puede ser sometido a la distensión biaxial durante períodos de tiempo. (A) Un globo desinflado sobre la cual electrospun fibras, PHBV, se han depositado. En esta etapa el globo está parcialmente cubierto con fibras. (B) Un globo completamente recubierto con PHBV y fibras PLA. (C) Una suspensión de células es repetidamente pipeta en el globo. (D) Un globo colocado dentro de una botella de medio estéril donde está conectado el globo a una bomba de jeringa y PBS (utilizado como un electrolito conductor) se utiliza para inflar suavemente y permitir el desinflado del globo contra un horario programado. (E) Las células en los andamios siendo retirados del globo al final del experimento y el análisis realizado para la viabilidad celular se muestra en (F) en donde las células viables desarrollar un color azul oscuro utilizando el metabólica indindicador rojo 3 - (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio. (G) muestra que las células (azul) se cultivaron en este globo y sujeto a la distensión biaxial desarrollar las fibras de elastina (verde, teñidas utilizando anticuerpos específicos de elastina), mientras que las mismas células en un andamio idénticas (H) cultivadas bajo condiciones estáticas tienen despreciable la producción de elastina . Las barras de escala es igual a 0,025 mm.
Access restricted. Please log in or start a trial to view this content.
Discusión
Electrospinning es una técnica muy popular para la producción de andamios para la ingeniería de tejidos. 14, 15, 16 Si bien es relativamente fácil de producir andamios básicos electrospun para uso experimental de la técnica también es complejo y multifacético, con muchas variables. 6 Hay muchos estudios que describen cómo el electrospinning parámetros determinan el andamiaje producido. En este estudio se centra en la post-producción desafíos considerables para que los andamios de las ar...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a BBSRC para la financiación de un doctorado para el Sr. Bye Frazer.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Poli láctico-co-ácido glicólico | Sigma Aldrich | ||
| Ácido láctico poli | Sigma Aldrich | 81273 | La viscosidad inherente ~ 2.0dl / g |
| Poli ε-caprolactona | Sigma Aldrich | ||
| Poly hidroxibutirato-co-hidroxivalerato 12:01 | Goodfellow | 578-446-59 | PHB88/PHV12 |
| Diclorometano | Sigma Aldrich o Fisher | 270997 o D/1850/17 | > 99,8% contiene 50-150ppm amileno estabilizador de |
| 50 globos de colores múltiples | Wilkinson Hardware Stores Ltd. | 0105790 | |
| De cabra anti-conejo IgG (FC): FITC | AbDserotec | STAR121F | |
| Conejo anti-humano alfa elastina | AbDserotec | 4060-1060 | |
| Tapón de rosca GL45 PP 2 puertos, pk / 2 | SLS | 1129750 | |
| 4 ',6-diamino-2-phenylindole dihidrocloruro | Sigma Aldrich | 32670 | |
| CellTracker verde CMFDA | Invitrogen | C7025 | |
| CellTracker roja CMTX | Invitrogen | C34552 |
Referencias
- Canton, I., McKean, R., Charnley, M., Blackwood, K., Fiorica, C., Ryan, A., MacNeil, S. Development of an Ibuprofen-releasing biodegradable PLA/PGA electrospun scaffold for tissue regeneration. Biotechnology and bioengineering. 105, 396-408 (2010).
- Blackwood, K., McKean, R., Canton, I., Freeman, C., Franklin, K., Cole, A., Brook, I., Farthing, P., Rimmer, S., Haycock, J., Ryan, A., MacNeil, S. Development of biodegradable electrospun scaffolds for dermal replacement. Biomaterials. 29, 3091-3104 (2008).
- Yang, F., Maurugan, R., Wang, S., Ramakrishna, S. Electrospinning of nano/micro scale poly(L-lactic acid) aligned fibers and their potential in neural tissue engineering. Biomaterials. 26, 2603-2610 (2005).
- Sittichokechaiwut, A., Edwards, J. H., Scutt, A. M., Reilly, G. C. Short bouts of mechanical loading are as effective as dexamethasone at inducing matrix production by human bone marrow mesenchymal stem cell. Eur. Cell Mater. 20, 45-57 (2010).
- Sill, T. J., von Recum, H. A. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29 (13), 1989-2006 (2008).
- Deitzel, J., Kleinmeyer, J., Harris, D., Beck Tan, N. C. The effect of processing variables on the morphology of electrospun nanofibers and textiles. Polymer. 42, 261-272 (2001).
- Fridrikh, S., Yu, J., Brenner, M., Rutledge, G. Controlling the fiber diameter during electrospinning. Physical review letters. 90, 1-4 (2003).
- Fong, H., Chun, I., Reneker, D. Beaded nanofibers formed during electrospinning. Polymer. 40 (16), 4585-4592 (1999).
- Selim, M., Bullock, A. J., Blackwood, K. A., Chapple, C. R., MacNeil, S. Developing biodegradable scaffolds for tissue engineering of the urethra. BJU Int. 107 (2), 296-302 (2010).
- Tong, H. -W., Wang, M. An investigation into the influence of electrospinning parameters on the diameter and alignment of poly(hydroxybutyrate-co-hydroxyvalerate) fibers. Journal of Applied Polymer Science. 120 (3), 1694-1706 (2011).
- Tong, H. -W., Wang, M. Electrospinning of poly(hydroxybutyrate-co-hydroxyvalerate) fibrous tissue engineering scaffolds in two different electric fields. Polymer Engineering & Science. 51 (7), 1325-1338 (2011).
- Retzepi, M., Donos, N. Guided Bone Regeneration: biological principle and therapeutic applications. Clinical oral implants research. 21, 567-576 (2010).
- Moreau, J., Caccamese, J., Coletti, D., Sauk, J., Fisher, J. Tissue engineering solutions for cleft palates. Journal of oral maxillofacial. 65, 2503-2511 (2007).
- Yang, F., Both, S., Yang, X., Walboomers, X., Jansen, J. Development of an electrospun nano-apatite/PCL composite membrane for GTR/GBR application. Acta biomaterialia. 5, 3295-3304 (2009).
- Yoshimoto, H., Shin, Y., Terai, H., Vacanti, J. A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering. Biomaterials. 24, 2077-2082 (2003).
- Telemeco, T., Ayres, C., Bowlin, G., Wnek, G., Boland, E., Cohen, N., Baumgarten, C., Mathews, J., Simpson, D. Regulation of cellular infiltration into tissue engineering scaffolds composed of submicron diameter fibrils produced by electrospinning. Acta biomaterialia. 1, 377-385 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados