Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El aislamiento de núcleos de cardiomiocitos a partir de tejidos post-mortem
En este artículo
Resumen
Núcleos están aislados cardíaca a través de la sedimentación y la densidad de immunolabeled con anticuerpos contra el material pericentriolar 1 (PCM-1) para identificar y clasificar los núcleos de cardiomiocitos mediante citometría de flujo.
Resumen
Identificación de los núcleos de cardiomiocitos ha sido un desafío en secciones de tejido, como la mayoría de las estrategias se basan sólo en proteínas marcadoras frente al citoplasma de 1. Los eventos raros en los miocitos cardíacos, como la proliferación y la apoptosis requiere una identificación precisa de los núcleos de los miocitos cardíacos para analizar la renovación celular en la homeostasis y en condiciones patológicas 2. En este caso, se proporciona un método para aislar núcleos de cardiomiocitos de post mortem del tejido por la sedimentación y la densidad de inmunomarcación con anticuerpos contra el material pericentriolar 1 (PCM-1) y la clasificación posterior de citometría de flujo. Esta estrategia permite un análisis de alto rendimiento y el aislamiento con la ventaja de trabajar igualmente bien en tejido fresco y material de archivo congelado. Esto hace posible el estudio de material ya reunido en biobancos. Esta técnica es aplicable y probado en una amplia gama de especies y adecuado para múltiples aplicaciones posteriores tales como el carbono-14 contactos 3, célula-CYculo 4 de análisis, la visualización de los análogos de timidina (por ejemplo, BrdU y UDI) 4, el análisis de transcriptoma y epigenéticos.
Protocolo
1. El aislamiento de los Núcleos cardiaca
- Tubos Coat ultracentrífuga Beckman (Tubos de centrífuga # 363664) con 10 ml de solución de revestimiento 1% de BSA / PBS. Tape los tubos y dejar que gire durante 30 minutos en un rotor de tubo. Eliminar la solución de revestimiento y dejar que la centrífuga tubos de aire seco (un tubo por el corazón del ratón se requiere para el análisis de los corazones de ratón individuales, alternativamente hasta 5 corazones de ratón o 1 g de tejido cardíaco de una especie diferente (por ejemplo, humano) puede ser procesado en un tubo).
- Todos los pasos siguientes se debe realizar en hielo. Diseccionar el ventrículo izquierdo del corazón del ratón fresco o congelado complemento con un bisturí. Nota, este protocolo se ha optimizado para el corazón del ratón, pero también se puede adaptar a la rata o el corazón humano. Alternativamente, el uso de hasta 1 g de tejido cardíaco de una especie diferente.
- Recorte la muestra en pequeños cubículos con un bisturí.
- Transferir los trozos de tejido en un tubo Falcon de 50 ml lleno con 15 ml de tampón de lisis.
- Homogeneizar elcorazón tejido con una T-25 homogeneizador Ultra-Turrax sonda (IKA) a 24.000 rpm durante 10 segundos.
- Diluir el homogeneizado con un volumen igual de tampón de lisis a 30 ml.
- Utilizar un vaso douncer (40 ml) para homogeneizar aún más el tejido y los núcleos libre el. Realizar ocho golpes con un mazo gran distancia.
- Pasar de los núcleos a través de un crudo de aislar a 100 micras y 70 micras de malla de nylon de células colador (BD Biosciences), de forma consecutiva.
- Girar hacia abajo los núcleos crudo aislado en una centrífuga refrigerada (4 ° C) a 700 xg durante 10 min.
- Eliminar el sobrenadante cuidadosamente invirtiendo los tubos y limpie el interior del tubo con una toalla de papel. Tenga cuidado de no molestar a los núcleos de pellets.
- Disolver los núcleos crudo aislado en 5 ml de tampón de sacarosa pipeteando la solución varias veces arriba y abajo. Añadir un nuevo 25 ml de tampón de sacarosa al disuelto precipitado.
- Añadir 10 ml de tampón de sacarosa recién preparada en el tubo de ultracentrífuga recubierto (véase el paso 1.1).
- Cuidadosamente superponer el añadido 10 ml de tampón de sacarosa con los núcleos precipitado resuspendido disolvió en tampón de sacarosa de 1,9 paso.
- Balance de los tubos de centrifugación antes de colocarlos en un rotor de giro libre JS13.1 y colocar el rotor en una centrífuga de alta velocidad (Beckman Avanti-S 25).
- Haga girar la muestra de los núcleos a 13.000 xg a 4 º C durante 60 min.
- Cuando el giro se ha completado, retirar los tubos cuidadosamente del rotor y descartar el sobrenadante invirtiendo los tubos y limpiando la suciedad restante de la parte interior de los tubos con una toalla de papel.
- Disolver el precipitado en los núcleos 1 ml de tampón de núcleos de almacenamiento (NSB más tampón). Nota: NSB además contiene 1,5 mM de espermina como un estabilizador de ADN.
- Proceda con el paso 2.1, inmunotinción de los núcleos de cardiomiocitos.
2. La inmunotinción para citometría de flujo
- Preparar el control negativo para inmunotinción. Tomar una alícuota de 20 l fuera de la muestra núcleos y undd 980 l de tampón NSB más.
- Añadir contra pericentriolar material de un anticuerpo (conejo anti-PCM-1, anticuerpos Atlas) a la muestra de los núcleos en una dilución de 1:500 a los núcleos immunolabel cardiomiocitos. Añadir el anticuerpo isotipo en la misma dilución como el anticuerpo anti-PCM-1 para el control negativo, preparada en la etapa 2.1.
- Incubar control negativo y el tubo de muestra a 4 ° C durante la noche.
- Lavar control negativo y la muestra al menos una vez con tampón NSB más (de girar los tubos en una centrífuga refrigerada (4 ° C) a 700 xg durante 10 min. Desechar el sobrenadante y se disuelve el precipitado en los núcleos 1 ml de tampón NSB más).
- Añadir anticuerpo anti-conejo fluorescente secundario (FITC o APC) para el control negativo y el tubo de muestra en una dilución de 1:1000.
- Incubar control negativo y el tubo de muestra a 4 ° C durante 1 h.
- Lavar control negativo y la muestra al menos una vez con tampón NSB más (de girar los tubos en una centrífuga refrigerada (4 ° C) a 700 xg durante 10 min. Desechar el sobrenadante y se disuelve el precipitado en los núcleos 1 ml de tampón NSB más).
- Continuar con el análisis de citometría de flujo y separación.
3. Citometría de Flujo
- Cubra los tubos de recogida de los núcleos (Falcon de 15 ml) con BSA / PBS solución al 1% antes de empezar a ordenar la citometría de flujo como se describe en el paso 1.1.
- Filtrar la muestra y el control negativo a través de un colador micras celda 30 y cargar primero el control negativo para el citómetro de flujo (afluencia BD). Definir la puerta primera y la segunda para definir los núcleos y los núcleos singletes (individual), sobre la base de dispersión frontal (FSC), la anchura del pulso de dispersión hacia adelante (FS ancho de pulso) y la dispersión lateral (SSC) (Fig. 2A y B). Adición de una mancha de ADN (DRAQ5 (1:500)) a la muestra puede ayudar a identificar la población de los núcleos inicialmente.
- Cargue la muestra immunolabeled y definir la tercera puerta para aislar núcleos de cardiomiocitos (PCM-1-positve) de los no cardiomiocitos núcleos (PCM-1-negativo). Inicie la clasificación(Fig. 2C y D).
Opcional: Con el fin de analizar el contenido de ADN nuclear (ploidía) y para realizar el análisis del ciclo celular añadir una mancha de ADN apropiada a los núcleos (por ejemplo, Hoechst 33342 o DRAQ5) (Fig. 2e).
- Después de la clasificación de citometría de flujo, coloque los núcleos de hielo y volver a analizar para determinar la pureza de clasificación (Figura 3a yb).
- Girar hacia abajo los núcleos ordenados en los tubos de recogida a 1500 xg en una centrífuga refrigerada durante 15 min.
- Disolver el precipitado núcleos en un tampón compatible con la aplicación de aguas abajo.
4. Los resultados representativos
Núcleos morfología y la integridad puede ser evaluada por las manchas de ADN y se visualizaron por microscopía (fig. 1). El éxito de PCM-1 etiquetado puede ser evaluada por microscopía de epifluorescencia y por citometría de flujo (fig. 1 y fig. 2c y d). PCM-1-positiVe y las poblaciones negativas deben estar bien separados unos de otros (Fig. 2C y D). En ventrículo izquierdo murino aproximadamente el 30% de todos los núcleos deben ser núcleos de cardiomiocitos (Fig. 2d). Clasificación pureza puede ser evaluada por re-analizar los núcleos ordenados (fig. 3a yb). En ambos grupos, los núcleos deben tener una pureza superior al 95% de clasificación.
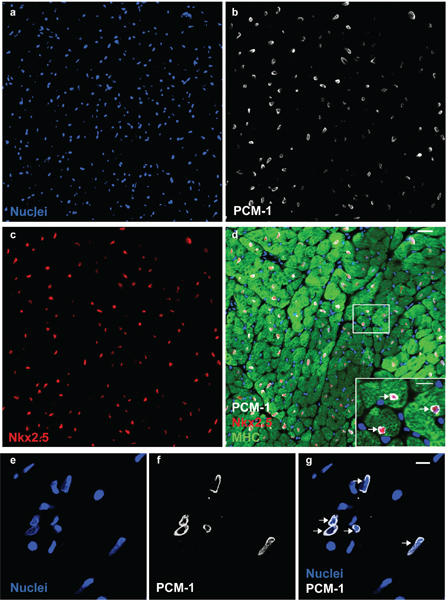
Figura 1. PCM-1 identifica núcleos de cardiomiocitos. Núcleos cardíaca (a) se tiñen con anticuerpos frente a PCM-1 (b) y Nkx2.5 (c) en un corazón de ratón adulto. (D) PCM-1-etiquetados núcleos están rodeados por citoplasma de los cardiomiocitos (cadena pesada de miosina (MHC)) y expresar el factor de transcripción Nkx2.5, la documentación de la identificación precisa de los núcleos de cardiomiocitos por el PCM-1 tinción (barras de escala de 20 micras y 10 m (d, recuadro)). (E) de los aislamientos cardíacos núcleos visualizados con el ADN de manchas DRAQ5. (F y G) Cardiomyocnúcleos YTE están etiquetados con anticuerpos contra el PCM-1 (barra de escala de 10 micras). Nota, el patrón de tinción epinuclear de PCM-1 en núcleos de los miocitos en sección de tejido y en núcleos aislados (flechas).
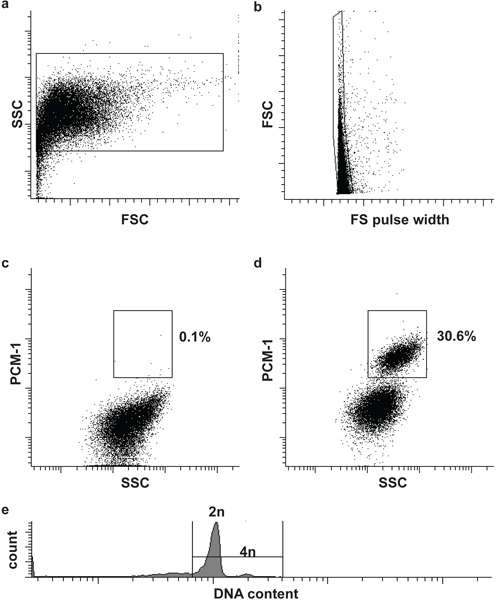
Figura 2. Citometría de flujo clasificación de los núcleos de cardiomiocitos. (A) los núcleos cardíaco se identifican por dispersión frontal (FSC) y dispersión lateral (SSC). (B) Una segunda puerta se identifica un solo núcleo por el FSC y FS ancho de pulso 5. (C, d) compuerta fluorescente permite la separación de núcleos de cardiomiocitos (PCM-1-positivo) y no cardiomiocitos-(PCM-1-negativa) núcleos de tejido del corazón. (E) de cardiomiocitos de ratón son en su mayoría (> 80%) diploides (2n), sólo un pequeño subconjunto es tetraploide (4n) 6. Tenga en cuenta que los cardiomiocitos humanos contienen una mayor frecuencia de los núcleos de poliploidía (> 2n) 7,8.

Figura 3. Pureza análisis de núcleos ordenados cardiomiocitos y no cardiomiocitos. Re-análisis de los núcleos ordenados no cardiomiocitos (a) y cardiomiocitos (b). Ambas poblaciones muestran una pureza superior al 99% de la clasificación.
Discusión
La identificación precisa de los núcleos de cardiomiocitos es crucial para el análisis de los procesos regenerativos en el miocardio 2,3. Las técnicas convencionales para aislar cardiomiocitos a partir de tejido fresco se basan principalmente en la digestión enzimática de proteínas de matriz extracelular y la posterior purificación de las células intersticiales por centrifugación a baja velocidad. La purificación adicional de cardiomiocitos vivos a partir de células madre embrionarias (CES) puede ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría agradecer Marcelo Toro para la asistencia con la citometría de flujo. Este estudio fue apoyado por el sueco de corazón y pulmón Fundación, la Comisión Europea el 7 º PM "CardioCell", Consejo Sueco de Investigación, seguros AFA y ALF. OB fue apoyado por la Deutsche Forschungsgemeinschaft.
Materiales
| Name | Company | Catalog Number | Comments |
| 1. Tampón de lisis | |||
| Nombre del reactivo | |||
| 0,32 M de sacarosa | |||
| 10 mM Tris-HCl (pH = 8) | |||
| 5 mM de CaCl 2 | |||
| 5 mM de acetato de magnesio | |||
| 2,0 mM de EDTA | |||
| 0,5 mM EGTA | |||
| 1 mM de DTT |
| 2. Sacarosa tampón |
| Nombre del reactivo |
| 2,1 M de sacarosa |
| 10 mM Tris-HCl (pH = 8) |
| 5 mM de acetato de magnesio |
| 1 mM de DTT |
| 3. Los núcleos buffer de almacenamiento (NSB más) |
| Nombre del reactivo |
| 0,44 M de sacarosa |
| 10 mM Tris-HCl (pH = 7,2) |
| 70 mM de KCl |
| 10 mM MgCl 2 |
| 1,5 mM de espermina |
| Reactivos y Equipos | Empresa |
| Isotipo IgG de conejo-chip de grado, # ab37415 | Abcam |
| De conejo anti-PCM-1 anticuerpo, # HPA023374 | Atlas anticuerpos |
| Donkey seg. anticuerpos, anti-conejo Alexa 488 Fluor, # A-21206 o equivalente seg. anticuerpos fluorescentes | Tecnologías de la Vida |
| DRAQ5 | Biostatus |
| coladores de células de 30 m, micras y 70 micras 100 | BD Biosciences |
| Vidrio douncer (40 ml) y sela mano del mortero "L" | VWR (Wheaton Industries Inc.) |
| T-25 Ultra-Turrax | IKA Alemania |
| La dispersión de herramientas S25 N-18 G | IKA Alemania |
| Beckman Avanti Centrífuga | Beckman Coulter |
| Tubos Falcon de 15 ml y 50 ml | VWR |
| Tubos de centrífuga Beckman # 363664 | Beckman Coulter |
| JS13.1 rotor de giro libre | Beckman Coulter |
| Afluencia citómetro | Beckman Coulter |
| Tubo de los rotadores | VWR |
Referencias
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28 (2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados