Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una herramienta de análisis que cuantifica los cambios celulares Morfología de imágenes tridimensionales de fluorescencia
En este artículo
Resumen
Hemos desarrollado una plataforma de software que utiliza Imaris Neuroscience, ImarisXT y MATLAB para medir los cambios en la morfología de una forma indefinida tomado de tres dimensiones de fluorescencia confocal de células individuales. Este nuevo enfoque se puede utilizar para cuantificar los cambios en la forma celular después de la activación del receptor y por lo tanto representa una posible herramienta adicional para el descubrimiento de fármacos.
Resumen
Las herramientas de software más comunes de análisis disponibles para la medición de imágenes de fluorescencia son para datos de dos dimensiones (2D) que dependen de los ajustes manuales para la inclusión y la exclusión de los puntos de datos, y asistido por ordenador de reconocimiento de patrones para facilitar la interpretación y el análisis de resultados. Se ha convertido cada vez más importante para ser capaz de medir las imágenes de fluorescencia construidas a partir de conjuntos de datos tridimensionales (3D) con el fin de ser capaz de capturar la complejidad de la dinámica celular y entender la base de la plasticidad celular dentro de los sistemas biológicos. Instrumentos sofisticados microscopía han permitido la visualización de 3D imágenes de fluorescencia a través de la adquisición de imágenes multiespectrales de fluorescencia y un software de análisis de gran alcance que reconstruye las imágenes de confocal pilas que luego proporcionan una representación 3D de las imágenes recogidas en 2D. Diseño avanzado de los métodos basados en estereología han pasado de la aproximación y los supuestos de la originaciónl modelo basado estereología 1 incluso en secciones de tejidos complejos 2. A pesar de estos avances científicos en microscopía, permanece una necesidad de un método analítico automatizado que explota completamente los datos 3D intrínsecas para permitir el análisis y la cuantificación de los complejos cambios en la morfología celular, la localización de proteínas y tráfico de receptores.
Las técnicas actuales disponibles para cuantificar las imágenes de fluorescencia incluyen Meta-Morph (Molecular Devices, Sunnyvale, CA) y la imagen J (NIH), que proporcionan un análisis manual. Imaris (Andor Technology, Belfast, Irlanda del Norte) software proporciona la función de MeasurementPro, que permite la creación manual de los puntos de medición que se pueden colocar en una imagen de volumen o dibujado en una serie de cortes 2D para crear un objeto 3D. Este método es útil para mediciones de punto de un solo clic para medir una distancia en línea entre dos objetos o para crear un polígono que encierra una región de interés, pero es difícil de aplicar a complex estructuras de redes celulares. Filamentos trazador (Andor) permite la detección automática de la 3D neuronal filamento-como sin embargo, este módulo ha sido desarrollado para medir estructuras definidas, tales como neuronas, que se componen de dendritas, axones y espinas (estructura de árbol). Este módulo ha sido ingeniosamente utilizado para realizar mediciones morfológicas a las células no neuronales 3, sin embargo, los datos de salida de proporcionar información de una red celular extendida mediante el uso de un software que depende de una forma de la célula definido en lugar de ser un modelo celular amorfo en forma. Para superar el problema de analizar amorfo en forma de células y hacer el software más adecuado para una aplicación biológica, Imaris desarrollado célula Imaris. Este fue un proyecto científico con la Eidgenössische Technische Hochschule, que ha sido desarrollado para calcular la relación entre las células y orgánulos. Mientras que el software permite la detección de las limitaciones biológicas, forzando un núcleo por célulay el uso de las membranas celulares de las células del segmento, no se puede utilizar para analizar los datos de fluorescencia que no son continuas, porque se construye idealmente superficie celular sin espacios vacíos. Para nuestro conocimiento, en la actualidad no modificable por el usuario enfoque automatizado que proporciona información morfométrica de las imágenes de fluorescencia 3D ha sido desarrollado que logra información celular espacial de una forma indefinida (Figura 1).
Hemos desarrollado una plataforma analítica usando el módulo principal de software Imaris y XT Imaris interfaz con MATLAB (Mat Works, Inc.). Estas herramientas permiten la medición 3D de las células sin una forma predefinida y con inconsistentes componentes de la red de fluorescencia. Además, este método permitirá a los investigadores que han extendido experiencia en sistemas biológicos, pero no familiaridad con las aplicaciones informáticas, para llevar a cabo la cuantificación de los cambios morfológicos en la dinámica celular.
Protocolo
1. Three-dimensional Análisis morfométrico de una sola célula cambios fenotípicos
- Embrionarias humanas de riñón (HEK293) células fueron transfectadas con hemaglutinina (HA)-etiquetados factor liberador de corticotropina receptor-2 (CRF-R2), una proteína G-receptor acoplado (GPCR) como se ha descrito previamente 4, 5.
- Las células se dejaron sin tratar (sin tratamiento, NT), estimuladas con el ligando endógeno CRF-R2, factor de liberación de corticotropina, CRF (1 mM, 30 min), o pretratadas con un selectivo antagonista de CRF-R2, anti-sauvagina 30 (como se -30, 1 mM, 30 min) antes del tratamiento con agonista.
- Las células se fijaron, permeabilizaron y tratados con anti-HA. CRF-R2 fue visualizado utilizando Alexa 594 nm conjugado anti-ratón (IgG 1) anticuerpo. DAPI se utiliza para visualizar la fase mitótica núcleos.
- Para limitar la subjetividad experimentador, las condiciones experimentales no se conocerá hasta después de que las imágenes fueron tomadas y analizadas.
- Adquirimos la imagens de fijos HEK293 células por medio de un Plan apocromático 63x/1.4 aceite objetivo DIC y Zeiss LSM 510 microscopio confocal META conectado a un sistema integrado coherente láser de dos fotones compuesto por un láser de Verdi-V5 y un F-900 Mira sistema láser.
- Durante el proceso de adquisición de datos, las células fueron compartimentadas tanto por seccionamiento multiespectral, 488 nm, y 790 nm (~ 350 nm Ex 2ph.) Y z-partición (0,5 incrementos mu m) para incluir los datos de la membrana nuclear hasta el receptor extracelular exterior extremidades.
- Los datos de fluorescencia se procesaron primero usando Imaris, que permite la visualización y la segmentación de conjunto de datos de microscopía 3D, y un modelo 3D compuesto de voxels cúbicos se ha creado para el análisis morfométrico.
Entonces, Imaris XT módulo se utilizó para Imaris de interfaz con el lenguaje MATLAB programa de ordenador para determinar el punto de coordenadas de las extensiones de GPCR.
Para tener en cuenta la variabilidad celular, se obtuvieron y analizaron imágenes de fluorescencia taken 22 de las células: sin tratamiento (NT) (n = 7), agonista (CRF) tratamiento (n = 8) y pre-tratamiento con antagonista (AS-30) antes del tratamiento con agonista (n = 7) (Figura 2) .- La región de interés (ROI) debe incluir una célula que no está en la etapa mitótica activo y no está cerca de otras células. De esta manera, el análisis se incluyen las células con un solo núcleo y las extensiones de los receptores no son perturbadas por la proximidad de otras células.
- La estructura 3D celular fue reconstruida primero multiespectrales de los datos de fluorescencia utilizando Imaris (v.7.1.1).
- Tras el algoritmo diseñado por Imaris, la primera representación de la superficie se utiliza para representar la membrana nuclear. Imaris determinará si hay más de un núcleo en la ROI.
- Entonces, el algoritmo de creación de puntos se utiliza para localizar la extensión CRF-R2. Detección de puntos se utilizó ya que compensa el ruido de fondo y la intensidad irregular de lacompleja red de células en forma amorfa.
- Para maximizar la inclusión de cada unidad de detección de fluorescencia de CRF-R2, diámetro de los puntos "se fijó a 0,2 micras, que es la unidad más pequeña dentro de la imagen para extrapolar la información distinta en la forma de una intensidad medida usando un filtro de Gauss. Lugar filtrado se incorporó en el proceso de creación de spots automatizado. El software, sin embargo, proporciona al usuario la flexibilidad de utilizar filtros para definir los parámetros.
- Para evitar el truncamiento de datos, el conjunto de datos se convierten de 8-bits (sin signo) de punto fijo, a decimal de 32-bit.
- Los datos de intensidad del voxel fueron intercambiados para detectar datos de coordenadas utilizando Imaris XT módulo interfaz con MATLAB y la ubicación espacial exacta de cada punto se determinó mediante la realización de una transformación a distancia utilizando la membrana nuclear como punto de referencia (Figura 3).
- Los datos resultantes se pueden cuantificar y presentan en formato gráfico para sanálisis tatistical. Las comparaciones entre grupos se realizaron mediante ANOVA de dos vías y post-test de Bonferroni. Los datos se presentan como media ± desviación estándar. Las diferencias se consideraron significativas a * p <0,05. Los cálculos se realizaron con el programa GraphPad Prism 5,02 (Figura 4).
2. Los resultados representativos
Para demostrar la potencia de nuestro enfoque, se cuantificó los cambios celulares que resultan de la interacción de proteína G-junto receptores (GPCR) y el factor de liberación de corticotropina receptor-2 (CRF-R2) con su ligando endógeno CRF en células HEK293 transfectadas.
Se demuestra que el CRF-R2 receptores están localizados en la membrana plasmática y se proyectan desde las regiones finitas de la membrana de las células (Figura 2A y Movie 1). Utilizando el análisis 2D convencional, es posible detectar este subconjunto de extracelulares CRF-R2 receptores sólo si se analiza la adhesión receptor points en el cristal cubre. Por lo tanto, perdemos cualquier otra información derivada de z apilados datos multiespectrales (Figura 5).
Cuando las células se tratan con CRF, los receptores extracelulares se reducen considerablemente, como se muestra por la disminución de la distancia de los puntos de la membrana plasmática. También se redistribuye desde ubicaciones principalmente finitos en un número de localizaciones diferenciadas (Figura 2B y Película 2).
El efecto del CRF en la distribución del receptor de membrana es impedido por el pretratamiento con el antagonista del CRF-R2 específico, antisavagine 30 (AS-30) y nos encontramos con que las extensiones CRF-R2 no cambia (Figura 2C y Movie 3).
La distribución distal de manchas, trazados en las 5 micras de color espectro-intervalos codificados, se utiliza para visualizar la distancia de los vóxeles de la membrana nuclear. No pretreatm tratamiento y antagonistaent (AS-30, 1 mM, 30 min) antes del tratamiento con el agonista (CRF, 1 mM, 30 min) no muestran ninguna significativa (ns) diferencia en la contracción de GPCR. El tratamiento de las células con el agonista (CRF, 1 mM, 30 min) reduce progresivamente la cantidad de CRF-R2 que contienen voxels en comparación con ningún tratamiento, 0-5 micras (ns), 6-15 micras (** p < 0,01) y> 15 micras (*** p <0,005), o en comparación con AS-30 tratamiento, 0-10 micras (ns), 11-15 micras (** p <0,01) y> 15 micras (*** p <0,005) (Figura 4).
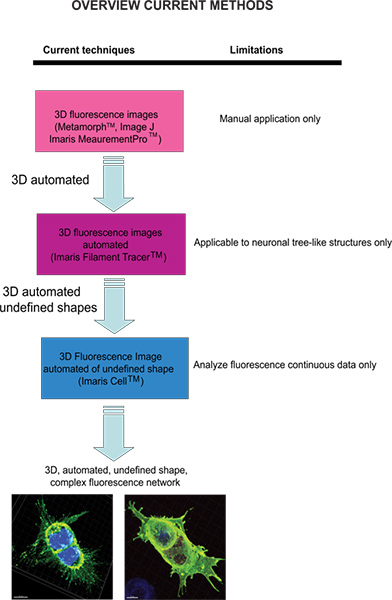
Figura 1. Esquema de las técnicas actuales disponibles y su limitación para analizar imágenes de fluorescencia. Haga clic aquí para ampliar la cifra .
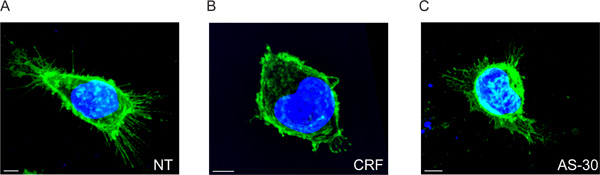
Figura 2. 3D imágenes multiespectrales de fluorescencia de las células HEK293 transfectadas con HA-CRF-R2 antes y después de agonista y antagonista de tratamiento. Imágenes fusionadas que muestran HA-CRF-R2-probaron utilizando anti-HA y se visualizaron utilizando Alexa 488 conjugada con anticuerpo anti-ratón (IgG 1) secundaria; DAPI se utiliza para visualizar los núcleos. Las imágenes fueron obtenidas con el láser confocal de barrido (CLS) microscopio. Barra de escala 5 micras.
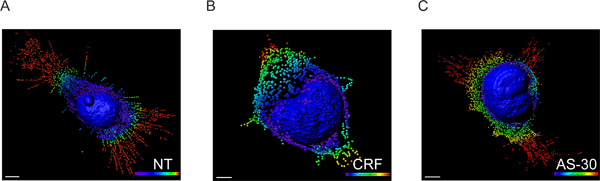
Figura 3. Modelo 3D de células HEK293 transfectadas con HA-CRF-R2 reconstruido a partir de las imágenes utilizando software CLS Imaris. Superficie de representación del núcleo y la creación de manchas describir extensiones GPCR convertidos en pequeñas vesículas. Los datos de fluorescencia se procesaron primero usando Imaris que permite la visualización y la segmentación de la microscopía 3D conjunto de datos. Luego, Imaris XT se utilizó para Imaris interfaz con MATLAB. La intensidad del voxel se intercambiaron enlugar coordina. Las manchas de color espectro-codificados (azul 0-5 micras, verdes, amarillas 6-10 m, 11-15 micras y rojo> mu m 15) representan la forma de la distancia de la membrana nuclear. Escala de 5 micras.
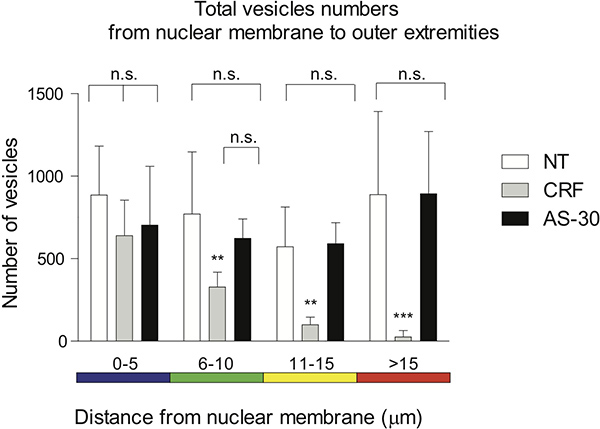
Figura 4. Representación gráfica de la distribución distal de puntos trazados en el espectro de color codificado en intervalos de 5 micras se utiliza para visualizar la distancia de los vóxeles de la membrana nuclear. Ningún tratamiento y pretratamiento con un antagonista (AS-30, 1 mM, 30 min) antes del tratamiento agonista (CRF, 1 mM, 30 min) no muestran ninguna significativa (ns) diferencia en la contracción GPCR. El tratamiento de las células con agonista (CRF, 1 mM, 30 min) reduce progresivamente la distancia del número de CRF-R2 que contienen voxels en comparación con ningún tratamiento 0-5 micras (ns), 6-15 micras (** p <0,01) y> 15 micras (*** p <0,005), o como tratamiento-30 0-10 micras (ns), 11-15 m (** p <0,01) y> 15 micras (*** p <0,005).
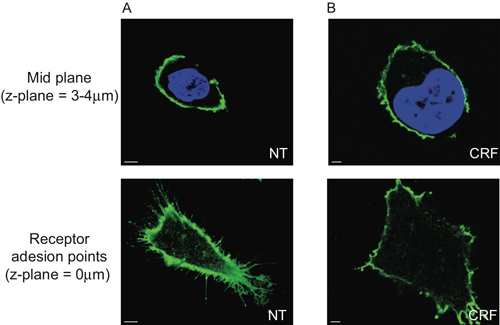
Figura 5. Limitación del análisis 2D morfométrico de las células HEK 293 transfectadas con HA-CRF-R2. La sección del plano medio de las células (3-4 micras por encima del cubreobjetos de vidrio) que muestra el centro de los núcleos se visualizaron con DAPI y HA-CRF R2-probaron utilizando anti-HA y se visualizaron utilizando Alexa 488 nm conjugado anti-ratón (IgG 1) secundaria anticuerpo y adquirida con CLS no muestra ninguna diferencia entre (A) sin tratamiento (NT) y (B) agonista (CRF, 1 mM, 30 min), mientras que los puntos de adherencia del receptor son dramáticamente diferentes.
Película 1. Giratorio modelo 3D en el "superar" el modo de células HEK 293 transfectadas con HA-CRF-R2, ningún tratamiento, para evaluar las diferencias fenotípicas celulares entre las proteínas receptoras. Bar escala de 5 a 20 micras./ Files/ftp_upload/4233/4233movie1.avi "target =" _blank "> Haga clic aquí para ver la película.
Movie 2. Giratorio modelo 3D en el "superar" el modo de células HEK 293 transfectadas con HA-CRF-R2, el tratamiento con agonistas, CRF (CRF, 1 mM, 30 min) para evaluar las diferencias fenotípicas celulares entre las proteínas receptoras. Bar escala de 5 a 20 micras. Haga clic aquí para ver la película.
Película 3. Giratorio 3D en el "superar" modo de células HEK 293 transfectadas con HA-CRF-R2, el pretratamiento con un antagonista (AS-30, 1 mM, 30 min) antes del tratamiento agonista (CRF, 1 mM, 30 min ) para evaluar las diferencias entre los fenotipos celulares proteínas receptoras. Bar escala de 5 a 20 micras. Haga clic aquí para ver la película.
Discusión
Hemos demostrado que el tratamiento CRF induce un cambio significativo en la morfología y ubicación de CRF-R2. El cambio en el CRF-R2 fue inhibido por el tratamiento antagonista selectivo. Hemos demostrado que las modificaciones no se detectaron receptores y no puede ser medido utilizando el estándar de las técnicas multiespectrales 2D. La capacidad para estudiar complejos imágenes en 3D es crítica para incorporar la complejidad de los parámetros biológicos para el análisis morfométrico. Hemos sido capaces de ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias al Centro de Desarrollo Biológico de imágenes (BIDC) Universidad de California, San Francisco para el uso de la Imaris, XT Imaris y Matlab. Damos las gracias a V. Kharazia por la asistencia técnica y AT Henry, LK Floren, L. Daitch por sus contribuciones a la edición del manuscrito. Este trabajo fue apoyado por fondos del Estado de California de Investigación Médica sobre el Abuso de Alcohol y Sustancias a través de la UCSF para SEB, los Institutos Nacionales de Salud: 1R21DA029966-01 y el premio NIH vía rápida para examinar la colección MLSMR a SEB Escuela de Farmacia de la UCSF ( Trabajo de Directores y Farmacia Clínica) y la Escuela de Medicina (Farmacología Clínica y Terapéutica Experimental) para CLHK.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| De riñón embrionario humano (HEK293) | American Type Culture Collection | CRL-1573 | |
| Dulbecco Eagle modificado (DMEM) | Invitrogen | 11965118 | |
| Suero bovino fetal (FBS) | Invitrogen | SH30070.03 | |
| AlexaFluor-488 (IgG2b) | Invitrogen | A-11001 | |
| monoclonal anti-HA.11 (IgG 1) | Covance | 16B12 | |
| DAPI | Vector Laboratories | H-1200 | ; |
| CRF | Sigma | C2917 | |
| Antisauvagine-30 (TAL-30) | Sigma | A4727 |
Referencias
- West, M. J. Design-based stereological methods for counting neurons. Prog, Brain Res. 135, 43-51 (2002).
- Burke, M., Zangenehpour, S., Mouton, P. R., Ptito, M. Knowing what counts: unbiased stereology in the non-human primate brain. J. Vis. Exp. (27), e1262 (2009).
- Sugawara, Y., Ando, R., Kamioka, H., Ishihara, Y., Honjo, T., Kawanabe, N., Kurosaka, H., Takano-Yamamoto, T., Yamashiro, T. The three-dimensional morphometry and cell-cell communication of the osteocyte network in chick and mouse embryonic calvaria. Calcif. Tissue Int. 88, 416-424 (2011).
- Vickery, R. G., von Zastrow, M. Distinct dynamin-dependent and -independent mechanisms target structurally homologous dopamine receptors to different endocytic membranes. J. Cell Biol. 144, 31-43 (1999).
- Bartlett, S. E., Enquist, J., Hopf, F. W., Lee, J. H., Gladher, F., Kharazia, V., Waldhoer, M., Mailliard, W. S., Armstrong, R., Bonci, A. Dopamine responsiveness is regulated by targeted sorting of D2 receptors. Pro.c Natl. Acad. Sci. U.S.A. 102, 11521-11526 (2005).
- Gordon, A., Colman-Lerner, A., Chin, T. E., Benjamin, K. R., Yu, R. C., Brent, R. Single-cell quantification of molecules and rates using open-source microscope-based cytometry. Nat. Methods. 4, 175-181 (2007).
- Schock, F., Perrimon, N. Molecular mechanisms of epithelial morphogenesis. Annu. Rev. Cell Dev. Biol. 18, 463-493 (2002).
- Pincus, Z., Theriot, J. A. Comparison of quantitative methods for cell-shape analysis. J. Microsc. 227, 140-156 (2007).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. Measurement of single-cell dynamics. Nature. 465, 736-745 (2010).
- Loo, L. H., Wu, L. F., Altschuler, S. J. Image-based multivariate profiling of drug responses from single cells. Nat Methods. 4, 445-453 (2007).
- Yarrow, J. C., Totsukawa, G., Charras, G. T., Mitchison, T. J. Screening for cell migration inhibitors via automated microscopy reveals a Rho-kinase inhibitor. Chem. Biol. 12, 385-395 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados