Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo para la permeabilidad del neuroepitelio embrionario de pez cebra
En este artículo
Resumen
Se describe una medición vivo animal entero cuantitativo para la permeabilidad del cerebro embrionario de pez cebra. La técnica analiza la capacidad de retener el líquido cefalorraquídeo y moléculas de diferentes pesos moleculares dentro del lumen del tubo neural y cuantifica su movimiento de salida de los ventrículos. Este método es útil para determinar las diferencias en la permeabilidad epitelial y maduración durante el desarrollo y la enfermedad.
Resumen
El sistema ventricular del cerebro se conserva entre los vertebrados, y se compone de una serie de cavidades interconectadas llamado ventrículos del cerebro, que se forman durante las primeras etapas del desarrollo del cerebro y se mantienen durante toda la vida del animal. El sistema ventricular del cerebro se encuentra en los vertebrados, y los ventrículos se desarrollan después de la formación del tubo neural, cuando el lumen central se llena con fluido cerebroespinal (CSF) 1,2. CSF es un fluido rico en proteínas que es esencial para el desarrollo normal del cerebro y la función 3-6.
En el pez cebra, la inflación cerebro ventrículo comienza a aproximadamente 18 horas después de la fertilización (hpf), después de que el tubo neural se cierra. Varios procesos están relacionados con la formación del cerebro ventrículo, incluida la formación de un neuroepitelio, la formación de uniones estrechas que regula la permeabilidad y la producción de LCR. Hemos demostrado que la Na, K-ATPasa se requiere para la inflación ventrículo cerebral, afectando todos estos procesoses 7,8, mientras que claudin 5a es necesario para la formación de la unión estrecha 9. Además, se demostró que "relajación" del neuroepitelio embrionario, a través de la inhibición de la miosina, se asocia con la inflación cerebro ventrículo.
Para investigar la regulación de la permeabilidad durante la inflación pez cebra ventrículo cerebral, hemos desarrollado un medio de contraste ventricular ensayo de retención. Este método utiliza la inyección ventrículo cerebral en un embrión de pez cebra de estar, una técnica desarrollada anteriormente en nuestro laboratorio 10, para etiquetar fluorescentemente el líquido cefalorraquídeo. Los embriones son entonces fotografiado con el tiempo a medida que el tinte fluorescente a través de los ventrículos cerebrales y el neuroepitelio. La distancia que el frente del colorante se aleja de la basal (no luminal) lado del neuroepitelio con el tiempo se cuantifica y es una medida de la permeabilidad neuroepitelial (Figura 1). Observamos que los colorantes de 70 kDa y más pequeñas se mueven a través del neuroepitelio y puede ser detected fuera del cerebro embrionario de pez cebra a las 24 HPF (Figura 2).
Este ensayo de retención de colorante puede ser utilizado para analizar la permeabilidad neuroepitelial en una variedad de diferentes antecedentes genéticos, en diferentes momentos durante el desarrollo, y después de las perturbaciones ambientales. También puede ser útil en el examen acumulación patológica de CSF. En general, esta técnica permite a los investigadores a analizar la función y la regulación de la permeabilidad durante el desarrollo y la enfermedad.
Protocolo
1. Preparación para la microinyección
- Preparar agujas de microinyección tirando tubos capilares utilizando Sutter extractor aguja instrumentos.
- Carga aguja de microinyección con tinte fluorescente (FITC-dextrano).
- Montar la aguja en un micromanipulador y un aparato de microinyección.
- Corte cuidadosamente la aguja de microinyección con unas pinzas a unos 2 m de ancho, sin embargo, esto puede variar dependiendo de la configuración microinyector. Para nuestros agujas de microinyección, esto corresponde a la primera región de la aguja desde la punta que no se doble.
- Medida de tamaño de gota en el aceite, el ajuste de tiempo de inyección y la presión, de modo que cada inyección ofrece 1 nl. Ejemplos de ajustes para Harvard Apparatus microinyector son: equilibrio P = 1,4 psi, P = 1,4 psi a cabo, P = 22,9 psi inyectar, P = 67,8 psi claras con un tiempo de inyección de .4 a 0.7 seg. El diámetro de la aguja con esta configuración es de aproximadamente 2 m. Sin embargo, los ajustes se microinyector específico, y variar unaegún el diámetro de la aguja.
2. Preparación de los embriones
- Capa 2 platos con agarosa al 1% en agua para cada condición, hacer agujeros en agarosa con una punta de pipeta 1-200 l, y quitar bloques de agarosa. Llenar los platos con los medios de embriones.
- Utilizando pinzas, embriones dechorionate que son 18 hpf o más bajo un microscopio estereoscópico. Los embriones se organizaron de acuerdo a Kimmel et al. 11.
- Transferencia de embriones dechorionated en el primer plato de agarosa recubierta.
- Para anestesiar embriones, añadir tricaína (0,1 mg / ml) a la placa de embriones hasta que dejan de moverse (hecho de acuerdo con Westerfield 12).
3. La inyección de los ventrículos del cerebro
- Embriones Orient lo que está buscando en su lado dorsal poniendo la cola del embrión en el agujero. Si su micromanipulador está a la derecha, a continuación, mover el embrión, de manera que el cerebro anterior está a la izquierda y a la derecha rombencéfalo.
- Posición de la aguja en widest punto de ventrículo rombencéfalo.
- Con cuidado, perfore placa del techo del ventrículo cerebro posterior asegurándose de no pasar por la profundidad del cerebro en la yema (Figura 1A).
- Inyectar 1-2 nl de colorante fluorescente en los ventrículos asegurándose de que el colorante se llena toda la longitud de los ventrículos del cerebro.
- Transferencia de embriones al segundo plato de agarosa revestido lleno de Medios para embriones y volver a anestesiar, como se describe en 2.4.
- Iniciar inmediatamente formación de imágenes, tal como se describe en la sección 4 con el fin de obtener una imagen de tiempo cero.
4. Proyección de imagen
- Embriones Oriente con su cola en el agujero como se describe en 3.1.
- El uso de un microscopio de disección con luz transmitida y fluorescencia tanto para tomar una imagen de campo claro dorsal. Mantener la ampliación constante entre imágenes de embriones diferentes. Esto permite una comparación directa de los análisis realizados usando Image J (5,2-6).
- Sin mover el embrión, un microscopio o un plato, tomar unaimagen fluorescente correspondiente.
- Repita el procedimiento para cada embrión en momentos deseados.
5. Cuantificación del Movimiento Dye
- Combinar claro y las imágenes fluorescentes en Photoshop como se ha descrito previamente por Gutzman y Sive 10.
- Mida la distancia que recorre la frente de colorante en el software Image J disponibles en http://rsbweb.nih.gov/ij/ .
- Abrir el archivo resultante de la fusión en J de imagen y utilizar la herramienta de línea para dibujar una línea desde el prosencéfalo bisagra puntos para teñir delante en un ángulo de 10-20 ° de neuroepitelio (fig. 1A). Esta región fue elegido porque es el primer sitio y más notable de fuga del líquido del neuroepitelio de tipo salvaje.
- Selecciona la herramienta de medición para calcular la longitud de la línea.
- Repita el proceso para cada punto del tiempo.
- Calcular la distancia neta el frente del colorante se movió a través del tiempo restando distancia en t = 0 a partir de otros puntos de tiempo.
- Parcela engráfico.
6. Los resultados representativos
Un ejemplo de los resultados obtenidos en un ensayo de permeabilidad neuroepitelial usando embriones de tipo salvaje se muestra en la figura 1B-D. Para distinguir con precisión la permeabilidad, es útil para poner a prueba los tintes con weightsto molecular diferente identificar un tamaño que es sólo ligeramente agujereado en embriones de tipo salvaje o de control (Figura 2). Esto permite la identificación de mutantes genéticos o condiciones ambientales que aumentan o disminuyen la permeabilidad (Figura 1D, verde y líneas rojas, respectivamente). Para el neuroepitelio pez cebra 24 HPF, 70 kDa dextrano FITC fugas lentamente durante 2 horas, mientras que 2.000 kDa no y 10 kDa casi inmediatamente se escapa. Por lo tanto 70 kDa es el peso ideal molecular para identificar las condiciones que aumentar y disminuir la permeabilidad neuroepitelial.
Si la aguja no ve la luz ventricular, fluorescencia wenfermo aparecer fuera del cerebro en t = 0 (para un ejemplo, véase Gutzman y Sive, 2009 10). Estos embriones deben ser desechados ya que el medio de contraste inyectado no figuraba inicialmente en el cerebro y no hay ninguna conclusión clara sobre el movimiento del colorante y la permeabilidad de la neuropeithelium se pueden hacer.
Por último, si los embriones tienen ventrículos pequeños o un-inflados ventrículos del cerebro, inyección usada de ventrículos con una solución salina se puede hacer antes de la inyección del colorante fluorescente. Esto infla los ventrículos de toma de visualización posterior de los ventrículos más fácil cuando se inyecta con el colorante fluorescente. Los controles apropiados debe ser realizado para determinar si la inyección de solución salina interrumpe el desarrollo normal del tubo neural.
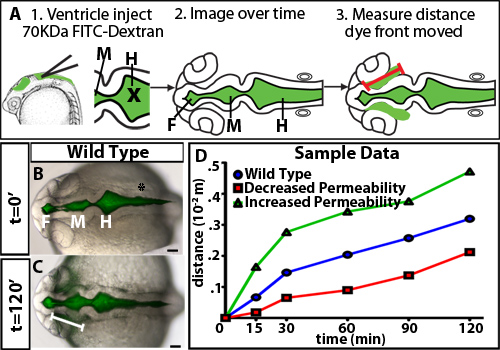
Figura 1. Evolución temporal de los diferentes tintes peso molecular. (A) Diagrama Experimental. Primero, Tinte fluorescente se inyecta en los ventrículos. X = posición de la aguja para la inyección. Siguiente imagen dorsales son capturados en el tiempo. Finalmente, la distancia recorrida por el frente del colorante desde el cerebro anterior se mide bisagra-punto (representado por una línea roja). (BC) Fusionada campo claro y fluorescencia imágenes dorsal a 22 HPF (t = 0 min, B) y 24 HPF (t = 120 min, C). Línea blanca indica la distancia de la parte frontal del cerebro anterior de tinte ventrículo. (D) hipotéticos datos de permeabilidad de la muestra. Azul = tipo salvaje o controles, rojo = muestra disminución de la permeabilidad con relación al control, y muestra verde = aumento de la permeabilidad con respecto al control.
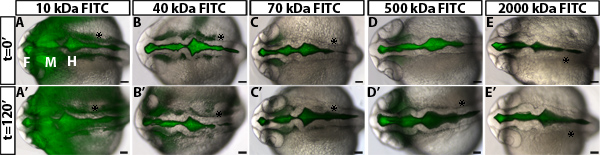
Figura 2. Medición de la permeabilidad neuroepitelial a diferentes colorantes peso molecular. (AE) y campo claro dorsal fusionada imágenes fluorescentes de 22 hpf embriones de tipo salvaje en t = 0 min después de la inyección con FITC-dExtran de los siguientes pesos moleculares: 10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D) y 2.000 kDa (E). (A'-e ') Igual que en el embrión (AE) en t = 120 min a 24 hpf. Anterior a la izquierda. F = cerebro anterior, cerebro medio = M, H = rombencéfalo. Asterisk = oreja.
Discusión
Se demuestra la capacidad de cuantificar la permeabilidad del cerebro embrionario de pez cebra vivo tal como se determina por un medio de contraste inyectado de un peso molecular dado. Nuestra observación de que el neuroepitelio embrionario de pez cebra es diferencialmente permeable a los tintes de diferentes pesos moleculares sugiere que el colorante se está moviendo a través de la permeabilidad paracelular. Sin embargo, no podemos descartar la posibilidad de una contribución a la permeabilidad transcelular observa...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Salud Mental, y la National Science Foundation. Un agradecimiento especial a los miembros del laboratorio Sive para muchas discusiones útiles y críticas constructivas, ya Olivier Paugois para la cría de peces experto.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de Reactivo | Empresa | Número de catálogo | |
| Dextrano, fluoresceína, aniónica, lisina corregible | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaína polvo | Sigma | A5040 | |
| Los tubos capilares | FHC Inc. | 30-30-1 |
Referencias
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados