Method Article
Alto rendimiento secuencial ELISA para la Validación de Biomarcadores de aguda injerto contra huésped
En este artículo
Resumen
Validación de alto rendimiento de candidatos a biomarcadores múltiples pueden ser realizadas por ELISA secuencial con el fin de minimizar ciclos descongelación / congelación y el uso de muestras de plasma preciosos. Aquí nos muestran cómo realizar secuencialmente ELISAs para seis diferentes biomarcadores plasmáticos validados 1-3 De la enfermedad de injerto contra huésped (GVHD) 4 En la misma muestra de plasma.
Resumen
Recomendaciones proteómica estrategias de descubrimiento tiene el potencial de identificar un gran número de nuevos biomarcadores que pueden mejorar las pruebas de diagnóstico y pronóstico en un entorno clínico y puede ayudar a dirigir intervenciones terapéuticas. Cuando grandes cantidades de las proteínas candidatas se identifican, puede ser difícil validar biomarcadores candidatos de una manera oportuna y eficiente a partir de muestras de plasma de pacientes que están controladas por evento, de volumen finito e irremplazable, como en el inicio de aguda de injerto contra huésped (EICH) es una complicación potencialmente mortal de alogénico de células madre hematopoyéticas (TCMH).
Aquí se describe el proceso de realización de pruebas ELISA disponibles comercialmente para seis proteínas validados GVHD: IL-2Rα 5, TNFR1 6, HGF 7, IL-8 8, elafin 2, y REG3α 3 (también conocido como PAP1) de una manera secuencial para minimizar ciclos de congelación-descongelación, Se descongeló plasma, tiempo y uso de plasma. Para este procedimiento se lleve a cabo los ensayos ELISA en orden secuencial según lo determinado por el factor de dilución de la muestra según lo establecido en nuestro laboratorio utilizando kits de ELISA fabricante y protocolos con ajustes menores para facilitar un rendimiento óptimo secuencial ELISA. Las concentraciones plasmáticas resultantes de biomarcadores puede ser recopilada y analizada por los hallazgos significativos dentro de una cohorte de pacientes. Si bien estos biomarcadores son actualmente para fines de investigación, su incorporación a la atención clínica está siendo investigado actualmente en ensayos clínicos.
Esta técnica se puede aplicar para llevar a cabo pruebas ELISA para múltiples proteínas / citoquinas de interés en la misma muestra (s) siempre que las muestras no necesitan ser mezclados con otros reactivos. Si kits de ELISA no vienen con pre-recubiertos con placas, placas de 96 pocillos medio pocillos o placas de 384-y se puede utilizar para minimizar aún más el uso de muestras / reactivos.
Introducción
Aguda de injerto contra huésped (EICH), una de las principales causas de mortalidad sin recaídas (NRM) después de trasplante alogénico de células madre hematopoyéticas (TCMH), se mide por la disfunción en tres sistemas orgánicos: la piel, el hígado y tracto gastrointestinal (GI) tracto 4. La EICH aguda se produce normalmente entre dos y ocho semanas después del trasplante, pero puede ocurrir más tarde, y con frecuencia es clínicamente indistinguible de otras complicaciones post-TPH como la toxicidad acondicionado régimen, infección o efectos secundarios de la medicación. Mediante el uso de las estrategias proteómicas y validación de alto rendimiento utilizando secuencial ELISA, se han identificado 6 proteínas cuyas concentraciones son elevadas en la aparición de las manifestaciones clínicas de la GVHD. IL-2Rα, TNFR1, HGF y IL 8-, cuando se combinan en un panel de 4-biomarcador puede diagnosticar la GVHD en el inicio de los síntomas clínicos y puede predecir la supervivencia después de un TCMH independientemente de la gravedad de GVHD 1. Elafin, un biomarcador de GVHD de la skin, puede discriminar entre erupción y erupción GVHD por otras causas, tales como erupciones medicamentosas y puede predecir la supervivencia del trasplante 2. Recientemente hemos identificado REG3α como un biomarcador de la EICH del tracto gastrointestinal inferior, el órgano diana que más se asocia con el MRN. La concentración plasmática de REG3α puede identificar con fiabilidad la EICH como la causa de la diarrea post-TPH y se correlacionan con la severidad histológica de la GVHD en diagnóstico biopsias intestinales. Concentraciones REG3α en GI inicio GVHD también puede predecir la respuesta al tratamiento y manejo de recursos naturales GVHD 3. La incorporación de estos biomarcadores validados GVHD en la atención clínica está siendo investigado actualmente en ensayos clínicos.
Estos experimentos se realizaron en alícuotas de plasma pequeñas tomadas de pacientes que recibieron TPH entre 2000 y 2010 en el momento de inicio de GVHD que son insustituibles y de cantidad limitada. Debido a la naturaleza valiosa de estas muestras, se ha desarrollado un metHod de medición de múltiples concentraciones de proteínas plasmáticas de una manera eficiente y reproducible para eliminar el exceso de congelación y descongelación, el tiempo de descongelación y el uso de plasma. Esta técnica se puede aplicar para llevar a cabo pruebas ELISA para múltiples proteínas / citoquinas de interés en la misma muestra (s) siempre que las muestras no necesitan ser mezclados con otros reactivos. Si kits de ELISA no vienen con pre-recubiertos con placas, placas de 96 pocillos medio pocillos o placas de 384-y se puede utilizar para minimizar aún más el uso de muestras / reactivos. Este manuscrito se centra en los aspectos tecnológicos de la medición de biomarcadores GVHD.
Protocolo
1. Experimento Día 0: Preparación de muestras y Recubrimiento ELISA Prueba de Placa con anticuerpos de captura para la IL-2Rα, REG3α y HGF
- Las muestras de plasma alícuotas a ser analizados se sacó, se descongeló y se centrifugó a 12.000 rpm durante 10 min para separar los coágulos en la parte inferior y en la parte superior de los lípidos del plasma. 150 l de plasma sin diluir se sembraron a partir de cada muestra en un 96-así placa con fondo en V (placa de fuente) por pipeteado manual de acuerdo con mapas predefinidos. Las alícuotas se envuelve en Parafilm y se mantuvo en una cámara húmeda a 4 ° C durante todo el proceso; hr no más de 72.
- IL-2Rα y anticuerpos de captura de HGF se reconstituye y se diluye según las especificaciones del fabricante y l 50 se sembraron en cada pocillo de 96 respectivos pocillos de alta unión media y placas que se sellan y se incuban durante la noche a 4 ° C. Alternativamente, muchas placas se pueden secar a 37 ° C y se almacenó a 4 ° C para su uso posterior, dependenING sobre la estabilidad de la proteína.
- Anticuerpo de captura REG3α se diluyó de acuerdo con el protocolo del fabricante usando tampón fabricante del revestimiento y 25 l se colocaron en placas en cada pocillo de un 384-así Nunc Maxi-sor placa que luego se sella y se incubaron durante la noche a 4 ° C.
2. Experimento Día 1: IL-2Rα ELISA (Figura 1)
- La placa de ensayo de IL-2Rα se lavaron, se bloquearon con BLOTTO en TBS, y el estándar reconstituido y una curva estándar de 8-punto se prepara según el protocolo del fabricante.
- Después de lavar la placa después de la etapa de bloqueo, 50 l de plasma sin diluir se sembraron por duplicado de la placa de fuente a la placa de ensayo ELISA, y 50 l de cada estándar se sembraron por duplicado. La placa se sella y se incubaron durante 2 horas a temperatura ambiente en un mezclador de placas ajustado a 300 rpm.
- El plasma se recupera de la placa de ensayo de IL-2Rα ELISA y se coloca de nuevo en la ONUdiluido placa plasma fuente. El ELISA se completa por el protocolo del fabricante (con volúmenes ajustados por medio-y placas) y la densidad óptica de cada pocillo se lee mediante un lector de placas de conjunto a 450-570 nm, y los datos guardados y analizados.
3. Experimento Día 1: REG3α ELISA (Figura 1)
- 10 l de plasma no diluido se transfirió a una placa de fuente separada con fondo en V. 90 l de fabricante proporcionado por el tampón de dilución se añadió a cada pocillo para crear una placa de dilución 1:10 fuente.
- El ELISA REG3α se realizó según el protocolo del fabricante (con volúmenes ajustado para 384-y placas) y la densidad óptica de cada pocillo se lee mediante un lector de placas ajustado a 450-620 nm, y los datos se guardan y analizan.
4. Experimento Día 1: Prueba de TNFR1 elafin y revestimiento de placas con anticuerpo de captura
- Elafin y los anticuerpos de captura TNFR1 será reconstituido y diluidobuido por las especificaciones del fabricante y l 50 se sembraron en cada pocillo de 96 respectivos pocillos de alta unión media y placas que se sellan y se incuban durante la noche a temperatura ambiente durante elafin, y a 4 º C para TNFR1.
5. Experimento Día 1-2: HGF ELISA (Figura 1)
- Después de completar el ELISA de IL-2Rα y asegurando el ensayo no es necesario que se repita, 60 l de plasma sin diluir se transfiere a una placa nueva fuente y, a continuación 60 l de BSA al 1% en 1 x PBS, se añade a cada pocillo para hacer una 01:02 plasma diluido placa fuente.
- La placa de ensayo HGF se lavaron, se bloquearon con BLOTTO en TBS, y el estándar reconstituido y una curva estándar de 8-punto se prepara según el protocolo del fabricante.
- Después de lavar la placa después de la etapa de bloqueo, 50 l de 1:2 de plasma diluido se sembraron por duplicado en la placa de ensayo ELISA, y 50 l de cada estándar se sembraron por duplicado. La placa se sella y seincubaron durante la noche a temperatura ambiente en un mezclador de placas ajustado a 300 rpm.
- El plasma diluido 1:02 se recupera de la placa de prueba HGF ELISA y se coloca de nuevo en la placa de 1:02 diluido fuente de plasma. El ELISA se completa por el protocolo del fabricante (con volúmenes ajustados por medio-y placas) y la densidad óptica de cada pocillo se lee mediante un lector de placas de conjunto a 450-570 nm, y los datos guardados y analizados.
6. Experimento Día 2: elafin ELISA
- 10 l de plasma sin diluir se transfiere a una placa nueva fuente y luego 190 l de BSA al 1% en 1 x PBS se añadieron a cada pocillo para hacer 200 l de plasma 1:20 dluted.
- El ELISA elafin como se realizó de acuerdo con el protocolo del fabricante (con volúmenes ajustado por medio pocillos), y la densidad óptica de cada pocillo se lee mediante un lector de placas ajustado a 450-570 nm, y los datos guardados y analizados.
7. Experimento Day 2: TNFR1 ELISA
- 25 l de 1% de BSA en PBS se añadió a la placa de fuente de 1:20 (que ahora contiene 100 l de plasma 1:20) para obtener 125 l de plasma diluido 1:25.
- El ELISA TNFR1 se completa por el protocolo del fabricante (con volúmenes ajustados por medio-y placas) y la densidad óptica de cada pocillo se lee mediante un lector de placas ajustado a 450-570 nm, y los datos guardados y analizados.
8. Experimento Día 2: IL-8 ELISA
- 60 l de 1:2 de plasma diluido se transfirió a una placa nueva fuente y luego 180 l de IL-8 diluyente se añade a cada pocillo para hacer una placa de 1:06 diluido fuente de plasma.
- La IL-8 ELISA se completa por el protocolo del fabricante (con volúmenes ajustados por medio-y placas) y la densidad óptica de cada pocillo se lee mediante un lector de placas ajustado a 450-570 nm, y los datos guardados y analizados.
Una vez que todos los ELISA se ha completado, unused stock de plasma se sustituye en las alícuotas descongeladas y congelado para uso futuro.
Resultados
El flujo de trabajo de biomarcadores y el calendario se detallan en la Tabla 1 y Tabla 2, respectivamente. Una vez completado, las concentraciones de 6 proteínas diferentes han sido cuantificados en la misma muestra de plasma utilizando un total de 150 l de plasma. Enchapado las muestras por duplicado por prueba permite garantizar la calidad interna, con menos de 10 CV% es óptima. Si se realiza la secuencial ELISA en placas múltiples, consistentes densidades ópticas de la alta calidad se prefieren y permitir una mejor inter-placa de fiabilidad de las mediciones; estándar ODs curva pueden ser comparados entre las placas de mirar para evaluar el rendimiento inconsistencia en ELISA (Figura 2). Los tiempos de desarrollo utilizando sustrato colorimétrico tetrametilbencidina y alta concentración de OD observados para cada biomarcador en nuestro laboratorio se enumeran en la Tabla 3.
tp_upload/4247/4247fig1.jpg "alt =" Figura 1 "/>
Figura 1. Flujo de trabajo para la IL-2Rα, REG3α y ELISA HGF. Después de las muestras de plasma se han sembraron en las placas de la prueba de ELISA IL-2Rα de ser reclamado para hacer placas de dilución de origen para otras pruebas ELISA. Para el ELISA HGF, el plasma sea reclamado para preparar la placa de dilución 1:6 para IL-8. Haga clic aquí para agrandar la figura .
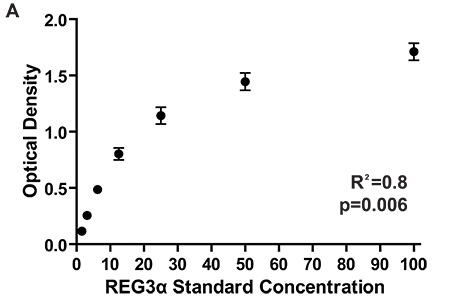
Figura 2. Densidades ópticas para la curva estándar de 7 diferentes placas de ELISA que miden concentraciones REG3α correspondientes a los 1084 pacientes ensayados para el informe inicial REG3α biomarcador GI GVHD 3. Consistente SAO entre placas asegurar consistentes mediciones de la concentración de proteína entre las placas. Las concentraciones de proteínasen muestras de plasma se calculan comparando las densidades ópticas de la muestra a las densidades ópticas de la curva estándar.
| Experimento Día 0 | 1. Preparar las muestras |
| 2. IL-2Rα, HGF y REG3α captura Ab | |
| Experimento Día 1 | 1. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ELISA (a través de placas de muestra) | |
| 4. Elafin y TNFR captura Ab | |
| Experimento Día 2 | 1. HGF ELISA terminación |
| 2. Elafin ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Volver a congelar sin usarplasma |
Tabla 1. Biomarcador GVHD flujo de trabajo general
| Día 0 | Preparación de la muestra y la incubación durante la noche de captura cuerpo | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Elafin | TNFR1 | IL-8 | |
| Tiempo (h) | 0,0 | Bloqueo | |||||
| 1,0 | Las muestras PLATEADO | ||||||
| 3,0 | Reclamar muestras de plasma, detección Ab | El bloqueo de las muestras; Preparar la dilución (1:10) | |||||
| 4.0 | Las muestras chapadas (1:10) | ||||||
| 5.0 | Estreptavidina-HRP | Detección Ab | |||||
| 5,5 | TMB | Estreptavidina-HRP | |||||
| 6.0 | De lectura de placas | TMB | El bloqueo de las muestras; Preparar la dilución (1:2) | ||||
| 6,5 | De lectura de placas | ||||||
| 7.0 | Las muestras chapadas (1:2) | Captura Ab (incubación durante la noche) | Captura Ab (incubación durante la noche) | ||||
| Día 2 | |||||||
| Tiempo (h) | 0,0 | Reclamar plasma, detección Ab | El bloqueo de las muestras; Preparar (1:20) | ||||
| 1,0 | Ejemplo de chapado (1:2) | Bloqueo; otra dilución 1:20 de las muestras de la dilución 1:25 | |||||
| 2,0 | HRP | Ejemplo de chapado (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | De lectura de placas | Detección Ab | |||||
| 3,5 | Preparar las muestras de dilución (1:6) | ||||||
| 4.0 | Detección Ab | Ejemplo de chapado (1:6) | |||||
| 5.0 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6.0 | De lectura de placas | HRP | Detección Ab | ||||
| TMB | |||||||
| 7.0 | De lectura de placas | TMB | |||||
| 7,5 | Placa de lectura | ||||||
| Después de la terminación | Vuelva a colocar la fuente de plasma en alícuotas y se congelan para su uso posterior | ||||||
Tabla 2. Cronograma para la realización de pruebas ELISA.
| Plasma Factor de dilución | Concentración Estándar Alto | Substrato Tiempo de Desarrollo (min.) | Alta OD | Curva | |
| IL-2Rα | 01:01 | 2.000 pg / ml | 5 | 1 | Lineal |
| HGF | 01:02 | 4.000 pg / ml | 22 | 2,1 | 4-parámetro |
| IL-8 | 01:06 | 200 pg / ml | 12 | 2,7 | 4-parámetro |
| REG3α | 1:10 | 100 ng / ml | 12 | 1,7 | 4-parámetro |
| Elafin | 1:20 | 2.000 pg / ml | 20 | 1,9 | 4-parámetro |
| TNFR1 | 1:25 | 800 pg / ml | 8 | 2,7 | Lineal |
Tabla 3. ELISA Detalles para 6 Biomarcadores EICH.
Discusión
El método secuencial ELISA que aquí se presenta permite la medición de las proteínas plasmáticas en múltiples pequeños volúmenes de plasma que pueden ser difíciles de obtener y / o irremplazables tales como muestras de sujetos humanos con enfermedades raras o muestras de plasma obtenidas de ratones 9,10. Los ELISAs secuenciales se realizan típicamente en el orden del factor de aumento de dilución de plasma, con ELISAs requieren plasma diluido 1:10 ≥ típicamente no pueda ser recuperado, aunque esto puede hacerse si se desea. La capacidad de realizar secuencial ELISA está limitada por kits de ELISA / protocolos en los que se mezcla el plasma con otros reactivos o para el que diferentes tampones de dilución se requieren para el plasma, lo que se opone a la ablility volver a utilizar una muestra debido a preocupaciones de que una incompatibles tampón / reactivo interfiere con la realización de una prueba particular. Con una planificación cuidadosa, 10 o más pruebas ELISA puede realizarse de la misma muestra de plasma.
Ent "> laboratorios individuales pueden necesitar ajustar diluciones de plasma con el fin de tener resultados interpretables en base a las concentraciones plasmáticas esperadas de la proteína de interés en las muestras de los sujetos de prueba. Las diferencias en equipos de laboratorio puede resultar en la necesidad de optimizar la incubación y el desarrollo colorimétrico veces, el número de lavados y / o lavar tiempos de inmersión con el fin de optimizar cualquier dado ELISA.Para aumentar la capacidad de alto rendimiento y precisión y para realizar análisis de una manera rentable, el uso de una plataforma de manipulación robótica líquido capaz de análisis en placas de 384 pocillos y un lavador de placas automatizado con unidad de apilamiento se recomiendan. Este equipo puede aumentar la exactitud y precisión del análisis realizado por múltiples usuarios, y ayudar a garantizar la coherencia de análisis para reducir inter-e intra-ensayo de variación.
Se utilizó ELISA secuencial sobre plataformas múltiplex disponibles, por dos razones: 1) La mayoría de laspares de anticuerpos para proteínas nuevas no puede fácilmente ser conjugados en perlas o de otros materiales, así como tiempo y es costoso, 2) individuales de los ensayos ELISA son más precisos que los microarrays multiplex o perlas, secundaria a una ausencia de reactividad cruzada 11. Si un método fiable se establece para realizar multiplexados, basado en perlas microarrays, puede ser capaz de reemplazar el proceso secuencial de ELISA, pero puede estar limitado por la capacidad para conjugar los anticuerpos a perlas y / o por el número de proteínas deseadas a ser analizado.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Apoyado por el NIH subvenciones RC1-HL-101102, P01-CA039542, T32-HL007622, la Fundación Hartwell, y la Fundación Caritativa Doris Duke. Dr. Paczesny es un investigador del fondo Eric Hartwell y el Programa de Investigación Amy Strelzer Manasevit.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| IL-2 humana alfa R Duoset | R & D Systems | DY223 | |
| HGF humano Duoset | R & D Systems | DY294 | |
| IL-8 humana OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match ASAMBLEA Humanos PAP1 (REG3α) Kit | MBL International | 5323 | |
| Ab-Match UNIVERSAL Kit | MBL International | 5310 | |
| Human Duoset sTNFRI/TNFRSF1A | R & D Systems | DY225 | |
| Human Duoset Trappin-2/Elafin | De I + D Syderiva | DY1747 | |
| 96-y placas de poliestireno de fondo cónico | Thermo Scientific | 249570 | Utilizado para las placas de la fuente de plasma |
| Costar media y alta unión a placas de 96 pocillos | Corning | 3690 | Para IL-2Rα, HGF, TNFR1 y ELISA elafin |
| Nunc 384-y placas MaxiSorp | Nunc | 464718 | Para REG3α Elisa |
| HyClone Phosphate Buffered Saline, 1x | Thermo Scientific | SH30256.02 | |
| Albúmina de suero bovino, Fracción V, Shock tratados térmicamente | Fisher Scientific | BP1600-100 | |
| Bloqueador BLOTTO en TBS | Thermo Scientific | 37530 | Agente de bloqueo de la IL-2Rα HGF y ELISAs TNFR1 |
| DulbeccoPhosphate-Buffered Saline | Gibco | 21600-069 | El tampón de lavado para IL-2Rα, HGF, elafin y ELISA TNFR1 |
| Susbtrate peróxido TMB | Kirkegaard y Perry Laboratories | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | El tampón de lavado para IL-2Rα, HGF, elafin y ELISA TNFR1 |
| Ácido sulfúrico | Sigma-Aldrich | 84720 | (Diluido a 2 N) para la solución de parada |
Referencias
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados