Method Article
Placa de Ensayo para Norovirus murino
En este artículo
Resumen
Aquí se describe un método para cuantificar las partículas infecciosas de norovirus murino (MNV), que es el norovirus que sólo se replica de manera eficiente en cultivo celular. El ensayo de placa se aprovecha de MNV tropismo para macrófagos murinos y puede ser adaptado para su uso con muestras biológicas o ambientales que contienen MNV.
Resumen
Norovirus murino (MNV) es el único miembro del género Norovirus que crece de manera eficiente en cultivo de tejido 1, 2. La lisis celular y efecto citopático (CPE) se observan durante MNV-1 infección de las células dendríticas o macrófagos murinos 1. Esta propiedad de MNV-1 puede ser usado para cuantificar el número de partículas infecciosas en una muestra determinada mediante la realización de un ensayo de placa 1. La placa de ensayo se basa en la capacidad de MNV-1 para lisar las células y para formar agujeros en una monocapa confluente de células, que se denominan placas 3.
Múltiples técnicas se pueden utilizar para detectar infecciones virales en el cultivo de tejidos, tejido recogido, clínica, y muestras ambientales, pero no todos medida el número de partículas infecciosas (por ejemplo, QRT-PCR). Una manera de cuantificar partículas virales infecciosas es llevar a cabo un ensayo de placa 3, que se describirá en detalle a continuación. Una variación en el ensayo de placas MNV es el flúorensayo de foco escent, donde se inmunotiñeron antígeno MNV en monocapas de células 4. Este ensayo puede ser más rápido, ya que la expresión del antígeno viral precede a la formación de placa. También es útil para valorar los virus incapaces de formar placas. Sin embargo, el ensayo de foco fluorescente necesita recursos adicionales a los de la placa de ensayo, tales como anticuerpos y un microscopio para contar las unidades formadoras de foco-. Infecciosa MNV también se puede cuantificar mediante la determinación de la Cultura 50% de tejido dosis infecciosa (TCID 50) 3. Este ensayo mide la cantidad de virus requerida para producir CPE en 50% de las células de cultivo de tejidos inoculados mediante valoración de punto final 5. Sin embargo, su límite de detección es mayor en comparación con un ensayo de placa 4.
En este artículo, se describe un protocolo de ensayo de placa que se puede utilizar para determinar efectivamente el número de partículas infecciosas de MNV presentes en muestras biológicas o ambientales 1, 4, 6. Este método es based en la preparación de 10-veces diluciones seriadas de MNV muestras que contienen, que se usan para inocular una monocapa de células permisivas (RAW 264,7 macrófagos murinos). Virus se le permite adjuntar a la monocapa de células durante un período determinado de tiempo y luego aspirado antes de cubrir las células con una mezcla de agarosa y medios de cultivo celular. El agar permite la propagación de la progenie viral a las células vecinas mientras que limita la propagación de las células situadas alejadas. Por consiguiente, las células infectadas se lisaron y se forman agujeros en la monocapa conocida como placas. Tras la propagación de virus suficiente, las placas convertido en manchas visibles siguiente de las células con tintes, tales como rojo neutro, azul de metileno, o violeta cristal. A diluciones bajas, cada placa se origina a partir de una partícula infecciosa viral y su progenie, que se extendió a las células vecinas. Así, contando el número de placas permite calcular unidades formadoras de placas (PFU) presentes en la muestra sin diluir 3.
Protocolo
1. El cultivo de la línea celular de macrófagos RAW 264,7
- Mantener células RAW 264,7 (ATCC, catálogo # TIB-71) en DMEM-10 medios de comunicación, que consiste en glucosa elevada DMEM con 10% (v / v) de baja endotoxina de suero bovino fetal (<10 EU / ml), 10 mM HEPES , 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 1 mM no aminoácidos esenciales, 2 mM L-glutamina. Las células se mantienen típicamente en 175 cm 2 frascos de cultivo de tejidos que contienen 35 ml de medio por frasco y se incubaron a 37 ° C y 5% de CO 2 en un incubador de cultivo de tejido. Sin embargo, cualquier matraz de tamaño puede utilizarse con un volumen de medio que resulte apropiado para el tamaño del matraz.
- Para dividir celdas: aspirar fuera de los viejos medios, añadir 10 ml de DMEM fresco-10 medios de comunicación a las células, y luego raspar las células de la parte inferior del matraz mediante el uso de un raspador de células. A continuación, se resuspenden las células en una solución homogénea mediante la elaboración de las células en una pipeta de 10 ml y con fuerza apretando las células a través de la punta de pipeta prEssed contra el fondo del matraz. Repita esta acción por lo menos 3 veces por lo que las células ya no se agrupan. Verificar por microscopía de luz que una única suspensión celular fue generado. Luego, transferir 1 ml (dilución 1:10 o células ~ 1x10 7) - 2 ml (dilución 1:5 o células ~ 2x10 7) de la suspensión celular a un nuevo matraz de 175 cm 2, y llevar el volumen final de los medios de comunicación hasta 35 ml.
- Dividir celdas cuando están casi confluente (~ 1x10 8 células total/175 cm 2 frascos): cada tres días, si a partir de una dilución 1:10, o cada dos días, si a partir de una dilución 1:5. El uso de microscopía de luz para comprobar la morfología celular antes de dividir celdas. La mayoría de las células se deben mirar a su alrededor y no activado. Las células activadas tienen gránulos y / o prolongado, larguiruchos morfología con apéndices. No permita que las células crecen en exceso como esas células no suelen formar placas. Mantenga un registro del número de pases y con frecuencia volver a empezar por el deshielo de una parte alícuota paso inferior de las células. (Usamos el paso 30 como un punto de corte).
2. Infect RAW 264,7 células con MNV Inóculo
- Semillas RAW 264,7 células en placas de 6 pocillos (3,5 cm de diámetro) con una densidad de 1x10 6 células viables / ml en DMEM-10 medios de comunicación, y añadir 2 ml de esta suspensión a cada pocillo. Es importante distribuir uniformemente las células en los pocillos, ya sea por las placas de balanceo con la mano por lo menos 10 veces o mediante el uso de un aparato de balanceo para ~ 10 min. No remolino las placas como esto hará que las células a agruparse en el centro del pozo. Colocar las placas en una incubadora de cultivo de tejidos (a 37 ° C y 5% de CO 2). Permitir que las células se unan durante la noche o durante al menos 4 horas a 37 ° C. Las células deben ser 60 - 80% confluente para el ensayo en placa y se distribuye uniformemente a lo largo del pozo.
- El día siguiente, preparar el inóculo del virus, que puede ser de MNV células infectadas en cultivo de tejidos o de tejidos homogeneizados o muestras fecales de MNV-ratones infectados. Al usar muestras de tejido, tamaño de un guisante piLos CEE de tejido se homogeneizaron en 2 ml con tapón de rosca tubos que contienen perlas de sílice estériles en 1 ml de DMEM-10 utilizando un homogeneizador de tejidos (por ejemplo MagnaLyser; Roche). Para las muestras de heces, no más de 3 partículas fecales se homogeneizaron en 1 ml de medio. Todas las muestras se congelan entonces (a -80 ° C) y se descongeló una vez antes de realizar el ensayo en placa.
- 10-Preparar diluciones del inóculo de virus en DMEM completo-5 medio, que consiste en DMEM / glucosa alta, 5% (v / v) de baja endotoxina suero bovino fetal (<10 EU / ml), 10 mM de HEPES, 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 1 mM no aminoácidos esenciales, 2 mM de L-glutamina.
- Diez veces la dilución se preparan en placas de 24 pocillos: Una pipeta de repetidor se utiliza para dispensar 1,35 ml de medio en pocillos múltiples, la dilución 10 -1 se prepara mezclando 1,35 ml de medio y 0,15 ml de virus que contiene la muestra, y luego 0,15 ml de la dilución 10 -1 se añade a 1,35 ml de medio para hacer que la 10 -2 dilution y así sucesivamente. Es importante cambiar las puntas cada vez que realice una nueva dilución. Una pipeta multicanal puede ser utilizado para hacer las diluciones de muestras múltiples a la vez con dos puntas de guarnición en un pocillo de una placa de 24-así la transferencia de un volumen total de 0,15 ml por pocillo (véase la Figura 3A).
- Un intervalo de dilución típico de homogeneizados de tejido y contenidos fecales es 10 -1 a 10 -3. Sin embargo, las placas de estas muestras tienden a ser más pequeños en comparación con los de las muestras de cultivo de tejidos. Además, en algunos casos una dilución 1:100 de las muestras de heces se necesita para diluir suficientemente a cabo cualquiera de los componentes tóxicos de las heces que podrían perturbar la monocapa de células, lo que dificulta la capacidad de contar las placas. El intervalo de dilución de los lisados de cultivo de tejido depende del punto de tiempo de interés durante el ciclo de vida viral. Las diluciones que van hasta 10 -9 puede ser necesaria en el pico de la infección.
- Después de las diluciones en serie se preparan, etiquetar el 6-así placas que contienen monocapas (RAW 264.7 de la sección 2.1) con el nombre de la muestra y las diluciones ser plateado. Una placa a la vez, eliminar todos los medios por moviéndola hacia fuera o aspiración de la misma. Inmediatamente después añadir 0,5 ml de una muestra diluida a un pocillo, y después repetir con un duplicado así, antes de proceder a la siguiente dilución. Una vez que los 3 diluciones se añaden a una placa de placa de inclinación, de ida y vuelta con la mano para asegurarse de que todas las células han sido cubiertos. Manejar un plato a la vez para asegurar que las células no se seque.
- Después de la adición de 0,5 ml de las diluciones a cada pocillo, la pila de placas en posición vertical y los incuban durante 1 hora a temperatura ambiente. Debido a que el volumen añadido a cada pocillo no es suficiente para cubrir completamente la monocapa, las placas deben ser suavemente inclinada hacia atrás y hacia adelante a mano cada 10-15 minutos o se coloca en un aparato de balanceo (~ 18 oscilaciones por minuto). Esto evita que las células se sequen.
3. Bajo punto de fusión de agarosa (SeaPlaque) Preparación Overlay
Nota: es recomendable tener varias botellas con autoclave SeaPlaque agarosa preparado con anticipación. La agarosa se puede volver a fundir en un horno de microondas antes de su uso.
- Calcular la cantidad de superposición necesaria para el volumen total de las placas antes de la incubación de 1 h se completa. El volumen necesario es 2 ml / pocillo o placa 12 ml/6-well. Preparar agarosa (ver sección 3.2) y los medios (ver sección 3.3) por separado.
- Para preparar la agarosa, suspender 3 g de agarosa SeaPlaque en un volumen total de 100 ml de agua destilada (3% w / v) en una botella de vidrio. Autoclave durante 20-30 min. (Si agarosa ya estaba preparada de antemano, re-fusión de agarosa en el microondas.) Es importante equilibrar SeaPlaque agarosa a 42 ° C en un baño de agua antes de su uso, porque si la agarosa es demasiado caliente, que matará a las células. Asegúrese de que el nivel de agua es igual o por encima del nivel de la agarosa para evitar la solidificación no deseada.
- Para preparar los medios de comunicación: hacer 100 ml de 2x MEM medios de comunicación, que consiste2x MEM, 10% (v / v) de baja endotoxina de suero bovino fetal (<10 EU / ml), HEPES 10 mM, 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 4 mM de L-glutamina. Equilibrar los medios de comunicación a 37 ° C en un baño de agua.
- Mezclar tanto la agarosa SeaPlaque y los medios 2X MEM juntos en una botella estéril en una relación 1:1 inmediatamente antes de la superposición de las monocapas de células infectadas. Si hay más de 200 ml de superposición que se necesita, volumen dividido en múltiples botellas y mantener en 37 ° C baño de agua hasta que esté listo para usar.
- Al final de la incubación de 1 hora (véase la sección 2,7), aspirar el inóculo fuera de cada pocillo. Se añade lentamente 2 ml de superposición al borde de cada pocillo mediante la colocación de la punta de la pipeta contra la pared de cada pocillo. Hasta 5 placas se pueden manejar simultáneamente sin células se sequen.
- Permitir la superposición de solidificar durante aproximadamente 10 min a temperatura ambiente antes de colocar las placas en posición vertical en el cultivo de tejidos incubadora. Incubar las placas durante 48 horas a 37 ° C en 5% de CO 2.
- Despuésel período de incubación, las placas son apenas visible a simple vista, a fin de comprobar las placas teñidas de presencia de placas. Si no están visibles las placas, se incuba durante 4 horas y puedes volver a intentarlo. Sin embargo, el tiempo máximo de incubación no debe superar los 72 hr.
4. La visualización de las placas por tinción con rojo neutro
- Para visualizar las placas, la solución de tinción con rojo neutro se prepara mediante la adición de 3 ml de rojo neutro (0,33% w / v en DPBS; Sigma, catálogo # N2889) a cada ml de 1x PBS 97 (grado de cultivo de tejidos, Mg 2 + -, Ca 2 + - libre, Gibco, catálogo # 10010). Calcular el volumen de la solución de tinción con rojo neutro necesario para el experimento: 12 ml de solución colorante rojo neutro se requieren para cada 6-así placa. A continuación, añadir 2 ml a cada pocillo. Aunque algunos protocolos de ensayo de placas requieren el tapón de agarosa para ser retirado de los pocillos, en este protocolo de la solución de tinción con rojo neutro se añade directamente a la superposición.
- Después de una hora uno encubation a 37 º C, comprobar si las placas son visibles con solución de tinción con rojo neutro todavía en pozos. Si las placas no son evidentes, deje que la tinción para continuar por otro hr. Continuar la incubación hasta que las placas son visibles. (Nota:. Tinción durante más de 3 horas no es óptimo y si no hay placas son visibles en la muestra de control positivo después de 3 horas de tinción, el ensayo de placa no funcionaba correctamente) Después de la tinción es completa, aspirar la solución de tinción con rojo neutro , asegurando el tapón de agarosa no se altera, y luego proceder a contar las placas.
- Cuente placas colocando la placa boca abajo sobre una caja de luz y marcar un punto en placas contados a evitar cargos duplicados. Elige la dilución para contar las placas en los pocillos en las placas están claramente separados (es decir, ninguna evidencia visual de la fusión de las placas juntas). Si es posible, contar las placas en dos diluciones. Es importante tener en cuenta que el tamaño de la placa puede variar entre cepas MNV, el inóculo de virus, y depende de lacondición de las células RAW 264,7 durante el ensayo de placas.
- Si no hay placas son visibles en un pozo, si no había un virus presente en la muestra o la cantidad de virus estaba bajo el límite de detección del ensayo en placa. En este caso, los pocillos se tiñen de rojo con un color parecido a otros que contienen pozos de placa. Alternativamente, la ausencia de placas también se observa cuando hay partículas virales demasiados presentes en una determinada dilución. Esto conduce a la lisis de la monocapa entera y pozos aparecen de color naranja / amarillo.
- Cálculo de los títulos virales. Añadir el número de placas en ambos pozos a una sola dilución y se multiplica por el factor de dilución (es decir, 1 ml si 2 pocillos se infectaron con 0,5 ml). Esto dará lugar a la cantidad de unidades formadoras de placas (PFU) en su volumen de inóculo de 1 ml. Por ejemplo, en la Figura 4 a la dilución 10 -2, un pocillo (marcada "II") tiene 14 placas y así el otro (marcado "V") tiene 17 placas. Por lo tanto, el título viral será 14x10 2 + 2 17x10 = 3100 (3.1x10 3) ufp / ml.
5. Los resultados representativos
Infecciosas MNV-1 partículas se puede cuantificar usando un ensayo en placa como se indica esquemáticamente en la Figura 1. Figura 2A muestra un pozo con una monocapa de células RAW 264,7 justo antes de la infección, mientras que la Figura 2B muestra tres placas visibles indicados por números romanos I, II y III en un pozo. Los pasos individuales del ensayo se representa en las Figuras 3A a F. La figura 3A muestra la preparación de la serie de dilución de 10 veces de una muestra que contiene virus. Figura 3B muestra la transferencia de las diluciones en pocillos duplicados de una placa de 6-así. Figura 3C muestra el aparato de oscilación usado para incubar células RAW 264,7 con el inóculo a temperatura ambiente durante 1 hr Figura 3D muestra las células que se superpone con el SeaPlaque:. MEMmezcla. Figura 3E muestra una placa a temperatura ambiente para permitir la superposición a solidificar, mientras que la Figura 3F muestra las células que se tiñen con un 0,01% neutral solución de color rojo 48 horas más tarde. Después de la tinción de células de 1-3 hr y aspirando la solución de tinción con rojo neutro, las placas son visibles y pueden ser contados (figura 4).
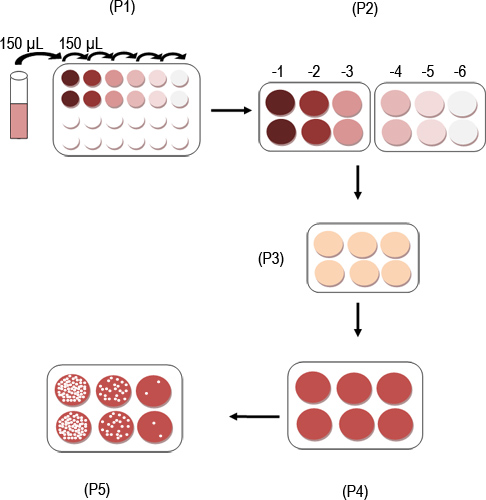
Figura 1. Esquema del protocolo de ensayo MNV placa.
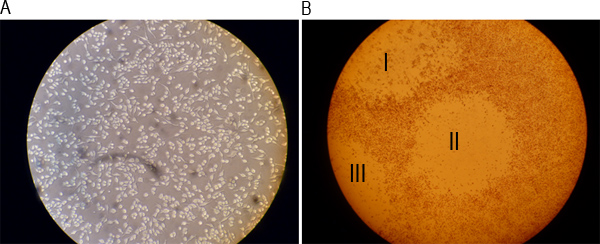
Figura 2. Imágenes representativas de un pocillo de una monocapa antes de la infección y después de la formación de placas. A) RAW 264,7 células se cultivaron durante la noche y formado la imagen bajo un microscopio óptico de 20 aumentos. B) Las células se tiñeron con un 0,01% de solución de rojo neutro después de 48 hr de la infección y se visualizaron bajo un microscopio de luz con un aumento de 4x. Números romanos I, II, y III indican tres placas visibles.
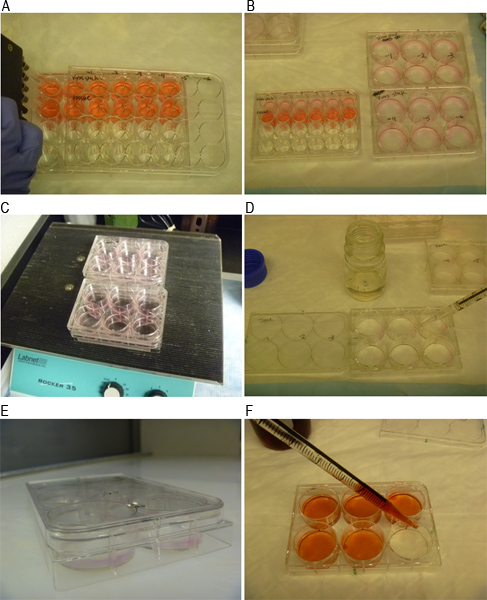
Figura 3. Imágenes representativas de los diferentes pasos del ensayo de placa. A) MNV-1 inóculo se prepara en diluciones de 10 veces. B) Inóculo se añadieron a monocapas de células en pocillos duplicados. C) Las células y el inóculo se incubó por balanceo durante 1 hora a temperatura ambiente. D) Las células se recubren con una mezcla 1:1 de agarosa SeaPlaque y 2x MEM medios de comunicación. E) Las placas se incubaron durante 10 min a temperatura ambiente para permitir la superposición de solidificar. F) Tinción de las células con la solución de tinción con rojo neutro 48 horas después de la infección.
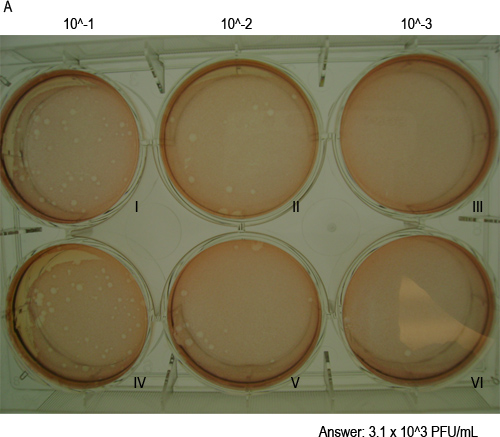
Figura 4. MNV-1 forma placas en células monolAyers. Aquí se muestra una placa de ensayo de placa representativa de 48 horas después de la infección, que muestra las placas teñidas con tinción con rojo neutro solución después de 1 hora de incubación. La placa de muestra de tres pocillos por duplicado 10-diluciones. Wells etiquetados con números romanos I y IV corresponden a la dilución 10-1; II y V corresponden a la dilución 10-2; III y VI corresponden a la dilución 10-3. El título viral de la muestra se indica a continuación (véase la sección 4,5 para los detalles del cálculo).
Discusión
El método de ensayo de placa para MNV-1 se presenta aquí es una forma de cuantificar partículas infecciosas de MNV. Siguiendo los pasos del ensayo se ilustra en la Figura 3, se puede obtener reproducibles títulos virales. El límite de detección del ensayo depende de la dilución de partida utilizado. Cuando comenzando con una dilución 1:10 de la muestra como se describe anteriormente, el límite de detección del ensayo de placa es de 10 ufp (es decir, 1 placa visible en la dilución 10 -1). Dado que cada placa representa un solo virus, el ensayo en placa también se puede utilizar para purificar poblaciones clonales de MNV recogiendo placas aisladas y propagar ellos como se ha descrito anteriormente 1. Además, purificaciones en placa también se puede utilizar para separar una población de virus individuales de poblaciones de virus mezclados. Una limitación del uso de un ensayo de placa para la detección de infección MNV es que no todas las cepas MNV formar placas 4. Sin embargo, puede ser posible superar la inability de algunas cepas MNV, aisladas de animales, para formar placas por pases en serie estos virus en cultivo de tejido 7. Una alternativa a la placa de ensayo es medir partículas infecciosas a través de la técnica de TCID 50 3, 4. Este ensayo cuantifica la cantidad de virus necesaria para producir CPE en 50% de las células de cultivo de tejidos inoculados tras diluciones de punto final y toma 1 semana para completar para MNV 4. Además de ser más lento que un ensayo en placa, el 50 TCID ensayo es también no es tan sensible (límite de detección = 200 TCID 50 / ml), debido a la toxicidad de las muestras de tejido para células RAW 264,7 4.
A pesar de los pasos críticos dentro del protocolo se han descrito en todo el protocolo, la siguiente sección se ofrece un resumen para facilitar la resolución de problemas. El paso más crítico en el protocolo es asegurar que RAW 264,7 células permanecen viables durante todo el ensayo para apoyar la replicación del virus. Esto puedeun control en cada etapa del ensayo a través de microscopía de luz. La viabilidad celular se garantiza de dos maneras. En primer lugar, se debe tener cuidado de no permitir que las células se secan durante la manipulación de placas. Por lo tanto, las placas se inoculan uno a la vez, sacudió durante el período de infección, y debe permanecer cerrado cuando no están siendo manejados. En segundo lugar, las soluciones de añadirse a las células deben equilibrarse a ~ 37 ° C. Además, es vital para la salud general de las células RAW 264,7 para su mantenimiento en medios que contienen suero de endotoxina bajo (<10 EU / ml), lo que limita la activación de las células. Además, hemos observado una mayor tasa de fracaso de la placa de ensayo utilizando las células de pasaje 30 o superior. Aunque esto probablemente variará de un laboratorio a otro, es importante incluir un control positivo (por ejemplo, una muestra con un título viral conocida) para asegurar títulos reproducibles, especialmente cuando se utilizan mayores pasaje células RAW 264,7. Para limitar el uso de células de paso superior, es aconsejable para congelar viales de principios passage células a la recepción de RAW 264,7 células y comenzar una nueva cultura de los viales congelados con frecuencia. Empezar de nuevo con bajas culturas pasaje celular también será útil cuando las células presentan características alteradas, tales como la falta de adhesión, los cambios en la morfología celular (por ejemplo, de redonda a larguirucha y hacia fuera), o cuando la contaminación por micoplasmas se ha detectado. Otro punto importante prestar atención a es asegurar que las puntas de pipeta se cambian entre las muestras y durante las diluciones. Esto asegurará precisos diluciones en serie y evitar la contaminación cruzada entre las muestras. El primer paso en el protocolo donde se encuentra la punta de la pipeta mismo es utilizado de nuevo cuando diluciones en serie de la misma muestra se añaden a los pocillos. En ese caso, hay que comenzar desde el inóculo más diluido a lo menos, y vigorosamente pipetear hacia arriba y abajo en la elaboración de una nueva dilución.
El protocolo de ensayo de placa es enmendable de varias modificaciones. Una modificación que puede hacerse cuando taquí no son suficientes células para la inoculación de los pocillos por duplicado es inocular sólo un único pocillo de cada dilución. Sin embargo, puesto que el volumen del inóculo es 0,5 ml, el número de placas luego tiene que ser multiplicado por un factor de 2 para normalizar a pfu / ml. El ensayo en placa también se puede adaptar para su uso con cualquier otra línea celular adherente que es capaz de soportar la replicación de MNV, y esto se ha descrito para la línea de murino microglial BV-2 de células 8. Otras modificaciones que se pueden aplicar son adaptaciones que se han descrito para los protocolos de la placa de ensayo desarrollados para otros virus. En caso de MNV, las siguientes modificaciones ya se han aplicado con éxito, el uso de celulosa de metilo en lugar de agarosa Sea Plaque 9, y la tinción de las células con cristal violeta o azul de metileno en lugar de rojo neutro 10, 11.
En general, este protocolo se puede adaptar fácilmente según sea necesario para cuantificar otras formadoras de placas o virus utilizado para OTHer los virus que causan las infecciones líticas en RAW 264,7 células, lo que hace que sea una herramienta útil para cuantificar partículas virales infecciosas en general.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a los miembros del laboratorio Wobus de comentarios críticos y sugerencias. El trabajo en el laboratorio de CEW fue financiado por fondos de puesta en marcha de la Universidad de Michigan, una subvención desarrollo de la carrera desde el Centro de NIH / NIAID Regional de Excelencia para la bio-defensa y de Investigación de Enfermedades Infecciosas Emergentes (ICE) Programa, Región V 'Gran Lakes 'ICE (premio NIH 1-U54-AI-057153) y NIH R01 AI080611. MBG-H. fue financiado por la Inmunología Experimental (NIH T32 A1007413-16) y los Mecanismos moleculares en la patogenia bacteriana (NIH T32 A1007528) becas de formación en la Universidad de Michigan. JBC fue financiado por Coordenação de Perfeccionamiento de Personal de Nível Superior (CAPES), Brasilia, Brasil.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| DMEM / glucosa alta | Hyclone | SH30243.02 | |
| 2x MEM | Gibco | 11935 | |
| 100x penicilina y estreptomicina | Hyclone | SV30010 | |
| 10 mm no aminoácidos esenciales | Hyclone | SH30238.01 | |
| HEPES 1 M | Hyclone | SH30237.01 | |
| 200 mM (100x) L-glutamina | Hyclone | SH30034.01 | |
| Suero Bovino Fetal | Gibco, Hyclone | 10437, SH30070.02 | |
| Sea placa de agarosa | Lonza | 50100 | |
| Rojo Neutro 0,33% | Sigma | N2889 | |
| 1x PBS | Gibco | 10010 | |
| 1,0 mm de zirconia / sílice cuentas | BioSpec Productos | 11079110z | |
| Modelo 35 Speed Rocker | Labnet | S2035 | |
| Instrumento lyser Magna | Roche | 03358968001 | |
| Raw 264,7 células línea | ATCC | TIB-71 | |
| Incubadora de cultivo de tejido | Sanyo | MCO-18AIC |
Referencias
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432 (2004).
- Wobus, C. E., Thackray, L. B., Virgin, H. W. Murine norovirus: a model system to study norovirus biology and pathogenesis. Journal of virology. 80, 5104-5112 (2006).
- Condit, R. C., Knipe, D. M., Howley, P. M. Ch. 2. Fields Virology. 1, 25-58 (2007).
- Thackray, L. B. Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence. Journal of virology. 81, 10460-10473 (2007).
- Reed, L. J., Muench, H. A simple method for estimating 50% endpoints. American Journal of Hygiene. 27, 493-497 (1932).
- Chachu, K. A. Antibody is critical for the clearance of murine norovirus infection. Journal of virology. 82, 6610-6617 (2008).
- Barron, E. L. Diversity of murine norovirus strains isolated from asymptomatic mice of different genetic backgrounds within a single U.S. research institute. PLoS ONE. 6, e21435 (2011).
- Cox, C., Cao, S., Lu, Y. Enhanced detection and study of murine norovirus-1 using a more efficient microglial cell line. Virology journal. 6, 196 (2009).
- Cooper, P. D. The plaque assay of animal viruses. Adv. Virus Res. 8, 319-378 (1961).
- Hyde, J. L. Mouse norovirus replication is associated with virus-induced vesicle clusters originating from membranes derived from the secretory pathway. Journal of virology. 83, 9709-9719 (2009).
- Simmonds, P. Bioinformatic and functional analysis of RNA secondary structure elements among different genera of human and animal caliciviruses. Nucleic acids research. 36, 2530-2546 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados