Method Article
Neo-Islet Formación en el hígado de ratones diabéticos por Ayudante dependiente de transferencia adenoviral Gene mediada por vector
En este artículo
Resumen
Se describe hepática neo-islote formación en STZ (estreptozotocina)-ratones diabéticos inducidos por la transferencia de genes de Neurogenin3 (Ngn3) y betacelulina (BTC) usando ayudante dependiente de vector adenoviral (HDAD) y la inversión de la hiperglucemia. Nuestro método tiene ventajas de dependientes helper-vectores adenovirales con su alta eficiencia en la transducción in vivo y la expresión génica a largo duradera.
Resumen
La diabetes tipo 1 es causada por células T mediada por la destrucción autoinmune de las células productoras de insulina en el páncreas. Hasta ahora el reemplazo de insulina sigue siendo la terapia principal, porque el trasplante de islotes ha sido limitada por la disponibilidad de donantes y por la necesidad de inmunosupresión a largo plazo. Inducida neogénesis de islotes mediante la transferencia génica de Neuogenin3 (Ngn3), el islote de linaje definir factor de transcripción específico y betacelulina (BTC), un factor de crecimiento de islote tiene el potencial para curar la diabetes tipo 1.
Los vectores adenovirales (Ads) son vectores de transferencia de genes altamente eficaz, sin embargo, los anuncios de los primeros generación tienen varias desventajas para uso in vivo. Dependientes de ayudante-Ads (HDAds) son los anuncios más avanzadas que se han desarrollado para mejorar el perfil de seguridad de la primera generación de anuncios y para prolongar la expresión del transgen 1. Carecen de toxicidad crónica por falta de codificación de secuencias virales 2-5 y conservar sólo el anuncio cisENTOS necesarias para la replicación del vector y envasado. Esto permite la clonación de genes hasta 36 kb.
En este protocolo, se describe el método para generar HDAD-Ngn3 y Hdad BTC-y para entregar estos vectores en ratones diabéticos STZ inducido. Nuestros resultados muestran que la inyección conjunta de HDAD-Ngn3 y 'islotes Neo' HDAD-BTC induce en el hígado y se invierte la hiperglucemia en ratones diabéticos.
Protocolo
1. Clonar los genes terapéuticos en el vector lanzadera Hdad
- Clone ratón Ngn3 y Btc ADNc en el vector plásmido que contiene pLPBL1 un alargamiento ubicuo factor-1 promotor (BOS) y una señal de poli A. Al finalizar, los vectores de verificar mediante análisis de secuencia y luego subclonar los casetes de expresión en pΔ28 lanzadera Hdad plásmido 6.
- Digest vectores lanzadera HDAD por PmeI para liberar el esqueleto del plásmido, purificar los ADN por extracción de alcohol de fenol / cloroformo / isoamilo seguido por precipitación con etanol y reconstituir con agua de grado de transfección.
2. Helper dependiente de la producción del vector adenoviral
Producción HDAD vector implica varios pasos que deben ser seguidos cuidadosamente para obtener resultados óptimos.
2.1 Transfección
- Dos días antes de la transfección 116, semillas células 7 en 6-cm plato para llegar a 70-80% de confluencia en el día de la transfección.
- Tres horas antes de la transfección, eliminar el medio y añadir 5 ml de medio de crecimiento fresco [MEM suplementado con FBS al 10% y 1% PSG (penicilina, estreptomicina y glutamina), Invitrogen].
- Transfectar células 116 con 10 g de ADN de la Etapa 1,2), utilizando el kit de transfección de mamíferos ProFectionR de Promega de acuerdo con las instrucciones del fabricante.
- El día siguiente, se lavan las células con 1 ml de medio de crecimiento 2 veces. Añadir virus auxiliar (HV) en 500 partículas de vector (VP) / célula a 0,1 ml de PBS que contiene calcio y magnesio (PBS + +) y de superposición en las células. Agite suavemente las placas para distribuir uniformemente el HV cada 10 min.
- Después de 60 min, añadir 1,5 ml de medio de mantenimiento (MEM, 5% FBS, 1% PSG).
- Añadir otra de 1 ml de medio de mantenimiento al día siguiente.
- Observar las células para CPE (efecto citopático - las células se redondean y separado). Mayor que 80% de las células deberían mostrar CPE 2 días después de la infección.
- Recoger lisado celular en bruto (CVL, células y medio), undd 10% en volumen de 40% de sacarosa y se almacena a -80 ° C. La CVL se etiqueta como paso 0 - (CVL-P0).
2,2 Vector amplificación
- Freeze (-80 ° C, 3-5 min) / descongelación (37 º C, 1-2 min) 3 veces.
- Superposición de 0,5 ml CVL suplementado con HV en 200 vp / célula a 116 células confluentes en 6-cm plato, y oscilar el plato suavemente cada 5 min. Después de 30 min, se añade 1 ml de medio de mantenimiento.
- Añadir 1 ml de medio de mantenimiento al día siguiente. 2 días después, la mayoría de las células debe mostrar CPE.
- Recoger el CVL y almacenar a -80 ° C (CVL-P1) tal como se describe para la etapa 2.1.8).
- Repita el procedimiento 3 veces para obtener el CVL P2-P4.
- Extraer el ADN (Blood DNeasy Tissue Kit y, Qiagen) a partir de 0,2 ml de CVL conseguidas en P1-P4, y analizar la amplificación vector por qPCR usando cebadores HV-y Hdad específico-(Tabla 1). Utilice el pasaje en el que HDAD amplificado exponencialmente con relación a HV (P3 en la figura 2) para la subsequenprocedimiento t.
- Co-infectar 90% confluentes 116 células en un plato de 15 cm con 0,5 ml CVL y HV en 200 vp / célula. Rock the plato suavemente cada 5 minutos. Después de 30 min, añadir 10 ml de medio de mantenimiento.
- Añadir 5 ml de medio de mantenimiento después de 24 hr.
- Recoger las células por centrifugación a 1.500 xg durante 5 min exactamente 48 horas después de la infección.
- Volver a suspender las células en 1 ml de PBS + + que contenía sacarosa al 4% (P5) y congelar a -80 ° C.
2,3 a gran escala la producción Hdad
- Para preparar 116 células para la infección de células en cultivo en suspensión, transferir 116 células confluentes en 8 x 15-cm plato en matraz de 3 l spinner y se añade medio de suspensión crecimiento (Joklik modificado MEM suplementado con FBS al 5%, 0,1 higromicina mg / ml y 1% PSG) al final 1 L y se incuban en una incubadora de CO 2 con la gira a 60 rpm 8.
- Añadir 0,5 L de medio fresco cada día durante 2 días (total 2 L).
- Contar las células en el día tercero. Las células están listas para usar si alcanzar to número total de células de 1x10 9.
- Congelación / descongelación P5 3 veces.
- Recoger células del matraz de 3 L spinner por centrifugación a 1.000 xg durante 5 min. Guardar 100 ml de sobrenadante para resuspender las células.
- Transferir las células a un matraz de agitación de 250 ml. Añadir P5 y HV en 200 vp / célula a las células y se incuba durante 1 hora a 37 ° C a 60 rpm.
- Transferencia de las células y el medio para matraz de 3 l spinner, añadir 2 suspensión L medio de cultivo. Transferir 1 ml de suspensión celular a un pocillo en una placa de 12-bien para observar las células de CPE.
- Se incuban las células en matraz de agitación durante 2 días en una incubadora de CO 2 a 60 rpm.
- Recoger las células por centrifugación y resuspender con 15 ml 100 mM Tris-HCl (pH 8,0) y se almacena a -80 ° C (P6) hasta la purificación.
2,4 Vector purificación
- Añadir 1,0 ml de desoxicolato de sodio al 5% a la P6. Mezclar suavemente y se incuba durante 30 min a temperatura ambiente.
- Añadir 400 l de 2 M MgCl 2, 300 μl de RNasa A (10 mg / ml), y 300 l de DNasa I (10 mg / ml) e incubar a 37 ° C durante 1 hr.
- Centrifugar a 6.000 xg durante 10 min a temperatura ambiente para recoger el líquido sobrenadante.
- Esterilizar NVT 65 tubos de ultracentrífuga (Beckman) bajo luz UV durante 1 hora en una campana de cultivo de tejido.
- Añadir 2,8 ml de solución de baja densidad de CsCl (1,25 g / ml), base de 2,8 ml de solución de alta densidad de densidad de CsCl (1.41g/ml) y, a continuación superposición 5-6 ml de sobrenadante para llenar el tubo en el cuello. Use 100 mM Tris-HCl (pH 8,0) para llenar el tubo si es necesario.
- Centrifugar a 10 ° C durante 30 min a 50.000 rpm a 10 ° C con Beckman LE-80K usando NVT-65 rotor.
- Limpiar la zona con 70% de etanol para punción de la aguja, y recoger la banda inferior opalescente con una jeringa de 3-ml equipada con 22-G aguja por punción lateral (Figura 3a). A veces, una banda muy débil ayudante puede ver por debajo de la banda vector más importante. Trate de obtener la mayor cantidad de the banda vector como sea posible, sin que la banda ayudante. Es aceptable en este paso incluso si parte de la banda de ayudante es aspirado, ya que se separan en la posterior centrifugación durante la noche que sigue.
- Coloque las bandas recogidas en tubos de ultracentrífuga nuevos esterilizados. Llenar los tubos para el cuello mediante la superposición de 1,35 g / ml solución de densidad de CsCl.
- Centrifugar a 10 ° C a 50.000 rpm durante una noche. Recoger la banda opalescente (Figura 3b).
- Transferencia de la banda en un casete de diálisis (Slide-a-Lyzer, 10.000 MWCO, Thermo-científica).
- Dializa contra 3 L de autoclave 10 mM Tis-HCl, pH 7,2 que contiene 2 mM de MgCl 2 y 4% de sacarosa a 4 º C durante la noche.
- Retire el vector Hdad de casete de diálisis. Alícuota de 20 l para el título físico y 50 l para la caracterización del ADN. (Nota: Para Ngn3 vector, repetir "P6" tres veces para obtener el vector suficiente, ya que el rendimiento de la Hdad-Ngn3 es pobre en comparación con Hdad-BTC o Hdad vacío.)
2,5 Caracterización de vectores HDAD
- Determinar el título físico (vp / ml) usando la densidad óptica (DO). Añadir 20 l vector o 20 l de tampón de diálisis a 380 l de tampón TE que contenía SDS al 0,1% y se incuba a 56 ° C durante 20 min. Medir la DO a 260 nm. El título física DO260 = x 1,1 x 10 12 x 20 (vp / ml).
- Analizar la contaminación HV por qPCR. Use alícuota 50μl para extraer el ADN usando tejido DNeasy / ADN kit de extracción de sangre (Qiagen). Diluir el ADN 1000-veces y tomar 5 l para el análisis de qPCR utilizando ayudante y específicos con vectores cebadores (Tabla 1). La contaminación ayudante debe ser inferior a 1%, como se muestra en la Figura 4A.
- Utilice Southern blot para analizar la estructura vectorial. Realizar análisis de transferencia Southern utilizando una sonda 10 para la repetición terminal invertida (ITR). El resultado representativo se muestra en la Figura 4B.
- Determinar la eficacia in vitro. Infect conocidonúmero de 116 células en una placa de 12 pocillos con vector HDAD en 1000 vp / célula por cuadruplicado. Recoger las células después de 48 horas y extraer el ARN para determinar la expresión de mRNAs y Ngn3 Btc de QRT-PCR (Tabla 1). Los resultados representativos se muestra en la Figura 5.
3. El tratamiento de ratones diabéticos por Hdad-Ngn3 y BTC-
3,1 Inducción de diabetes en ratones y la inyección de vectores HDAD
- Preparación de STZ: Preparar tampón citrato 0,1 M, y ajustar el pH a 4,3-4,5. Filtrar esta a través de un filtro de jeringa de 0,22 mm. El uso de agua estéril para diluir este 0,01 M Na citrato pH 4.2-4.5. Disolver cantidad apropiada de STZ (Sigma) en esta solución para conseguir una concentración final de 12,5 mg / ml. A esta concentración no hay precipitación. Mantener esta solución STZ a 4 ° C hasta utilizado. Llevar la temperatura de la solución de inyección a temperatura ambiente inmediatamente antes de la inyección. El hombro solución STZd ser preparadas cada día y se inyecta dentro de 5-10 minutos de disolverse.
- Inyectar la solución por vía intraperitoneal STZ (10 l / g para alcanzar una dosis de 125 mg de peso corporal / g), por la tarde entre 5-7 pm (antes de que las luces se apagan en las instalaciones del ratón y los ratones comienzan a alimentarse activamente), en dos días consecutivos 9.
3,2 ratones de control de glucosa y la inyección de vectores Hdad.
- Ratones ayunar durante 6 horas y se miden el peso corporal y la glucosa en sangre cada semana hasta que los ratones tienen hiperglucemia (≥ 250mg/dl). Utilice un glucómetro One Touch para que la sangre recogida por recorte de cola. Una vez que la glucosa en sangre es ≥ 250 mg / dl, vuelva a comprobar la glucosa en la sangre de nuevo en 48 horas después de una hr 6 rápido para asegurar la hiperglucemia persistente y de glucosa en sangre está dentro del intervalo objetivo para el tratamiento: 250-500 mg / dl.
- El tratamiento de ratones con hiperglucemia persistente por una única inyección intravenosa de vectores HDAD través vena de la cola. La dosis total es de 6x10 vector vp 11para todos los grupos de tratamiento (en 0,25 ml): 5x10 11 Ngn3 vp vp 1 x10 11 Btc para el grupo de combinación; 5x10 11 1x10 + vp Ngn3 vp 11 para Ngn3 grupo y 1x10 11 5x10 + vp Btc 11 vector vp vacío para el grupo y Btc 6x10 11 vp vacío vector para el grupo de control.
- Inyección en la vena de cola. Ponga en ratones Tailveiner contención (TV-150, Braintree Scientific Inc.), y el uso de agua caliente para dilatar las venas de la cola, limpiar la cola con un 70% de alcohol. Mantenga la cola por debajo de la zona de la inyección entre el pulgar y el dedo índice de la mano, utilice la otra mano para inyección. Antes de la inyección asegúrese de que no haya burbujas en la jeringa (con 30 1/2 G aguja y jeringa de 1 ml). Introduzca la aguja e inyectar el vector lentamente. Si la aguja está en la vena, un destello de la sangre puede ser visto en el cubo de la aguja y también que no hay resistencia durante la inyección. Después de retirar la aguja, mantenga el lugar de la inyección con una gasa para detener la hemorragia antes de regresar ratones to jaula.
Si la aguja no está en la vena existe una resistencia significativa a la inyección y un poco de pápula subcutánea surge. En este tiempo, extraer la aguja y vuelva a intentarlo en otro sitio.
3.3 Análisis de los efectos de la Hdad-Ngn3 + Hdad-BTC tratamiento.
- Monitor 6 hr glucosa en ayunas y el peso corporal por semana después del tratamiento vector.
- Recoger la sangre de la vena safena o vena de la cola en la pierna cada 2 semanas para ensayo, la insulina (insulina de ratón ELISA kit, Mercodia) y las enzimas hepáticas (AST y ALT Reactivos Infinity, Thermo Scientific) utilizando kits comerciales.
- Coloque el ratón en un tubo sin capuchón 50 ml Falcon con los agujeros hechos en el extremo cerrado.
- La cabeza del ratón está en el extremo cerrado del tubo y las patas y la cola en el lado abierto del tubo. Para recoger sangre de la pierna izquierda, extender la pierna izquierda fuera del tubo y suavemente pellizcar la piel del muslo entre el pulgar y el índice para inmovilizar la pierna.
- Utilizaruna cuchilla para retirar el pelo de la espinilla / área de la pierna inferior, para exponer la vena safena, que está presente en el lado lateral de la pierna inferior. Limpie la piel afeitada, con un 70% de alcohol y deje que se seque.
- La punción de la vena safena con una aguja de calibre 25, Recoger la sangre con Microvette tubo CB300 (Sarstedt) y poner los tubos en el hielo.
- Pulse el sitio de la punción con una gasa para detener el sangrado antes de volver a los ratones a las jaulas.
- Centrifugar los tubos a 3.000 xg durante 5 min, tomar el sobrenadante y se almacena a -20 ° C para su posterior análisis.
3.4 Realizar pruebas de tolerancia a la glucosa (GTT) a las 6 semanas después del tratamiento.
- Disolvió D-glucosa (Sigma) en agua destilada para obtener 15% de glucosa (15 g / 100 ml) y estéril de glucosa en el filtro.
- Fast ratones durante 6 horas. Utilice una almohadilla caliente para calentar los ratones y recoger la sangre (0 punto temporal min). Después inyectar 1,5 g / kg ip de D-glucosa (10 l / g de 15% de glucosa).
- Columnanar la sangre a los 15, 30, 60, 120 min.
- Medir la glucosa y la insulina en todas estas muestras.
3,5 Tissue análisis para evaluar la expresión de los vectores y evaluar la inducción de la neogénesis de islotes.
En todos estos pasos los controles que se requieren para interpretar con fiabilidad los resultados incluyen: (1) vector vacío trataron ratones diabéticos (2) ratones no diabéticos y (3) no diabética páncreas que actúa como un control positivo para la expresión de la isleta hormonas específicas y factores de transcripción.
- Cosecha hígado y el páncreas a los 3 y 6 semanas después del tratamiento. Dividir en 2 piezas, la primera para la congelación instantánea en nitrógeno líquido y el almacenamiento a -80 ° C para la extracción de proteínas y ARN, y el segundo para fijar con formalina al 10% durante la noche para el análisis de inmunohistoquímica.
- Extraer el ARN mediante un protocolo estándar y analizar la expresión de los islotes hormonas específicas y factores de transcripción, junto con Ngn3 y BTC para confirmaciónm vector de expresión, en el hígado de QRT-PCR utilizando cebadores específicos 9, 10.
- Extracto de insulina y péptido C en el hígado por el método de extracción con ácido-etanol y cuantificar por un kit comercial de ELISA (ensayo de ultra sensibles a la insulina, Mercodia, C-péptido ELISA kit, Wako).
- Lleve a cabo la inmunotinción para islotes hormonas específicas (insulina, glucagón, PP, acero inoxidable), junto con los islotes factores de transcripción específicos en parafina embebido en las secciones 9, 10. La expresión de Ngn3 y BTC también puede ser confirmada por inmunotinción.
4. Los resultados representativos
Hemos clonado y Ngn3 Btc cDNA en vectores pΔ28 impulsado por el promotor ubicuo eIF2a (BOS) y generó Hdad-Ngn3 y Btc Hdad. Como se muestra en la Figura 2, la contaminación HV relativa disminuyó significativamente (lo que implica una mayor amplificación del vector y menos amplificación helper) en el paso 3. Por lo tanto, hemos utilizado P3 para la producción de vectores posterior. Después de la primeraGradiente de CsCl discontinuo y ultracentrifugación, se recogieron la banda de menor vector y después se recogió la banda correspondiente al vector opalescente HDAD en la segunda ultracentrifugación (Figura 3). El vector purificado HDAD tenían menos de 1% de contaminación HV (Figura 4A) por qPCR y no tenía contaminación ayudante visible en el sur de secante (Figura 4B), que indica la calidad suficiente para la infusión vector en ratones. Un análisis más detallado incluye la expresión del transgen por la infección de 116 células. Los niveles de expresión de mRNA de Ngn3 y BTC fueron mayores en los vectores de células infectadas por más de 10.000 veces en comparación con los de las células no infectadas (Figura 5).
HDAD-Ngn3 y BTC-se administraron entonces a STZ-ratones diabéticos inducidos mediante inyección en vena de cola con el vector vacío inyectado y HDAD-BTC inyectaron a ratones diabéticos que actúa como control negativo. La hiperglucemia se invierte y la glucosa estimulada por la secreción de insulinafue restaurada en los ratones tratados con ambos HDAD-Ngn3 y Hdad BTC-pero no en los ratones tratados con el vector solo gen o vector vacío de control (Figura 6). La Hdad-Ngn3-BTC inducida por el tratamiento islote neogénesis y esto se cuantificó mediante el análisis de contenido total de insulina y péptido C (Figura 6E) con los no diabéticos, ratones diabéticos tratados vector vacío que sirven como controles. La presencia de péptido C y la insulina en relaciones equimolares, confirma que la insulina se detectó en el hígado está en efecto siendo sintetizada en el hígado. RT-qPCR confirmó que el hígado de HDAD-Ngn3-BTC ratones tratados expresaron todas las hormonas de los islotes específicas y factores de transcripción 9. La inmunohistoquímica mostró células positivas de insulina en el hígado de ratones tratados con HDAD-Ngn3 y Hdad BTC-, pero no las células de insulina positivos se observaron en los ratones tratados con el vector control (Figura 7). También confirmó que no había islotes residuales en el páncreas de la treate Ngn3-BTCd ratones en comparación con los numerosos islotes en los no diabéticos páncreas. Vector (Ngn3 y BTC) junto con islotes factor de transcripción específico de linaje (PDX-1 y Nkx6.1) expresión también se evaluó mediante la inmunotinción del hígado (Figura 7).
Figura 1. Diagrama de flujo de la terapia génica de ratones diabéticos utilizando helper-dependiente sistema de virus. En primer lugar, Ngn3 y BTC, en un cassette accionado por un promotor ubicuo BOS, se clonan en HDAD lanzadera (pΔ28) vectores. HDAD es producido por etapas tales como la transfección, pasos en serie de amplificación, y una infección a gran escala seguido de purificación vector. Tras la caracterización de la calidad, HDAds se inyectan por vía intravenosa en STZ-ratones diabéticos inducidos a través de vena de la cola. Los efectos del tratamiento se evaluó por medición de la glucosa, el peso corporal, GTT y por análisis de la expresión génicaen el hígado.
Figura 2. Determinación amplificación vector Hdad. ADN se extrae de paso P0 a P4 usando kits de extracción de ADN (Qiagen). ADN se diluye 1000 veces ADN 5μl y se utiliza para la PCR en tiempo real (qPCR). Helper y cebadores específicos de vectores se utilizan. Las curvas de calibración se generan por diluciones en serie (10 -5 a 1 ng / ml) de Hdad vector lanzadera de plásmido y HV plásmido (paneles superiores). Usando las curvas estándar y los valores de Ct para el número de copias del vector y virus auxiliar y se calcula la relación de HDAD / HV se representa como un porcentaje del total de virus (helper + HDAD). Por lo tanto, la amplificación vector relativa se calcula como: [número de copias de vector / (vector + número de copia virus auxiliar)]. En el ejemplo mostrado (panel inferior) de amplificación vector HDAD estancado en P4, mientras que el relativo HDAD / HV está aumentando a P3. Por lo tanto, P3 se ha seleccionado para la etapa posterior.
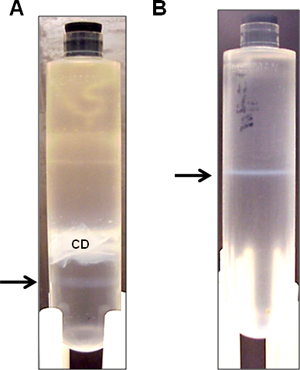
Figura 3. Representativos bandas vector HDAD discontinua después de la ultracentrifugación de densidad de CsCl. Hdad vector se purificó a partir de un cultivo spinner 3L sobre gradiente de densidad de CsCl secuencial. (A) Después de la ultracentrifugación en gradiente de densidad primero, una sola banda opalescente vector es visible (flecha) por debajo de los restos celulares opaco (CD). La banda opalescente (flecha) se recoge por centrifugación en gradiente de densidad de la segunda. (B) Después de la ultracentrifugación en gradiente de densidad segundos, la banda opalescente (flecha) se recoge para la diálisis.
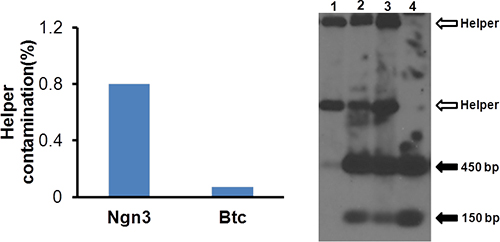
Figura 4. Análisis de contaminación helper virus. Se extrae el ADN de virus purificado y 50μl es un ayudante de contaminaciónssessed como en la Figura 2. La figura muestra contaminación ayudante de HDAD-Ngn3 y Hdad BTC-es menos de 1%.
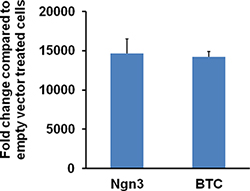
Figura 5. Blot análisis de la estructura de vector Hdad. Southern se realizó como se describió previamente (Oka K, et al.). Carril 1: ADN de virus auxiliar; Carril 2: ADN de P3; Línea 3: ADN a partir de P4; Carril 4: vectopr purificado. Las flechas abiertas indican las bandas de virus auxiliar derivados y las flechas llenas indican las bandas de ITR derivados del vector Hdad.
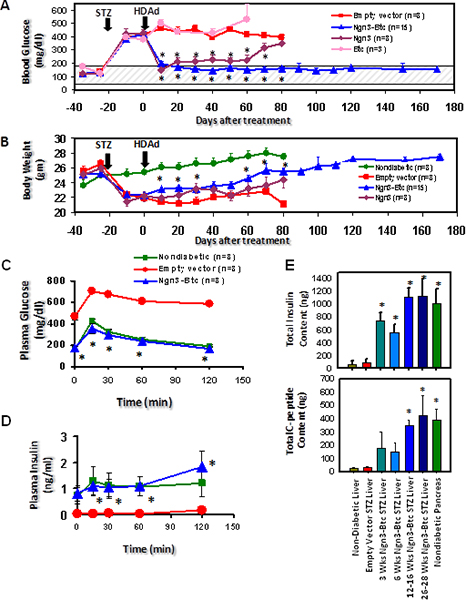
Figura 6. Nivel de expresión de Ngn3 o Btc en 116 células infectadas con el vector-Hdad Ngn3 o Btc Hdad. 116 células en un 12 placas de pocillos están infectadas con el vector HDAD-Ngn3 o HDAD BTC-o vacío en 1000 vp / célula durante 2 días. CeLLS se cosechan y el ARN total se extrajo usando el reactivo Trizol. QRT-PCR se realiza usando cebadores o Ngn3-BTC-específicos. El Ngn3 relativa o la expresión de ARNm Btc aumentó en más de 10.000 veces en las células infectadas con HDAD-Ngn3 o HDAD BTC-. La cifra es una reimpresión de Dev.Cell 2009 Mar; 16 (3): 358-73; Yechoor et. al., con permiso de Elsevier.
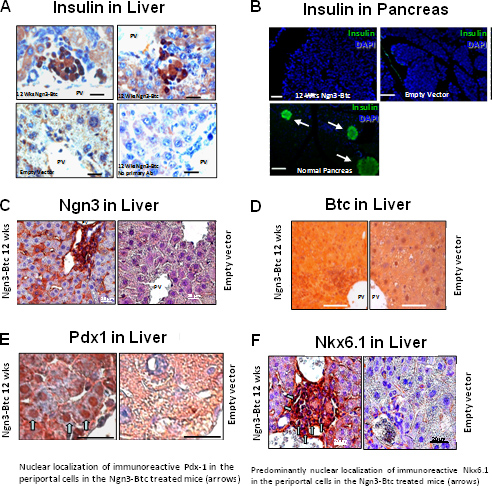
Figura 7. Transferencia génica de la Hdad-Ngn3 y Hdad BTC-en ratones diabéticos STZ inducido conduce a la reversión de la diabetes y la inducción de la neogénesis de islotes en el hígado. (A) de glucosa en plasma y (B) el peso corporal de ratones diabéticos inducidas por STZ tratadas con HDAD-Ngn3 y Hdad BTC-. (C) de glucosa en plasma e insulina durante un IP-GTT a las 6 semanas después del tratamiento. (D) Representante tinción de insulina en el hígado 12 semanas después del tratamiento. * P <0,05 (frente al grupo vector vacío). La cifra es una reimpresión de Dev. Cell 2009 Mar; 16 (3): 358-73; Yechoor et al, con permiso de Elsevier..
| nombre | cebador directo | cebador inverso | |
| ayudante | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| vector | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| Btc | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
Tabla 1. Las secuencias de cebador.
Discusión
HDAds se han desarrollado para superar la debilidad de Anuncios de primera generación y de aprovechar para la aplicación de la terapia génica. Sin embargo, los desafíos técnicos permanecen. Por ejemplo, HDAD requiere HV para el envasado HDAD y amplificación vector no es tan eficiente como anuncios de primera generación. HV es una oferta de primera generación y la contaminación de compromiso HV la eficacia de la Hdad. Por lo tanto, la transfección altamente eficiente y las condiciones óptimas para cada paso en serie son críticos. Otro parámetro crítico para la producción del vector es la que el paso (P1-P4) se debe utilizar para el posterior paso 5 que se utiliza directamente como inóculo para células en suspensión. En nuestra experiencia, los mejores resultados se obtienen usando el pasaje por el cual se dramáticamente proporción HDAD vector aumentado en el paso siguiente (P3 en la figura 2). El rendimiento de los vectores HDAD depende de casetes de transgén. Durante la producción de vectores, ambos transgenes se expresan debido a que ambos genes se encuentran bajopromotor ubicuo. Ngn3 es un factor de transcripción y BTC es un factor de crecimiento, lo que sugiere que el vector que expresa HDAD factor de transcripción que pueden influir en el linaje celular inhibe la amplificación de vector mientras que la hormona del crecimiento ayuda a expresar en la replicación del vector y envasado.
Con la diabetes adquiriendo proporciones epidémicas, nuevos enfoques para restaurar b masa de células se necesitan. En este informe, se describen los métodos para aprovechar las ventajas de los vectores HDAD para efectuar la transferencia de genes de islote linaje de definición de factor de transcripción, Ngn3 junto con el factor de crecimiento de los islotes, betacelulina para inducir la neogénesis de islotes en regiones periportal del hígado. Para evaluar la eficacia de esto, es importante elegir ratones con hiperglucemia estable y los controles adecuados se incluyen siempre. Para estos experimentos de transferencia de genes, el vector vacío ratones diabéticos tratados siempre debe ser utilizado. Además, el uso Hdad-Ngn3 y Hdad BTC-diabética tratada individualmente millasce sirve para probar la contribución individual de estos dos genes en la neogénesis de islotes. Como nuestros datos demuestran que Ngn3 por sí solo es suficiente para inducir la neogénesis de islotes, pero la adición del factor de crecimiento, BTC, sirve para aumentar la respuesta que conduce a la inducción robusto de neogénesis de islotes. También es importante comprobar que el vector de expresión se había alcanzado de hecho en el tejido diana, el hígado y también para demostrar que la insulina se ensaya en el plasma de los ratones tratados no viene de islotes residuales en el páncreas, por lo que demuestra la ausencia de páncreas islotes en los ratones diabéticos.
En resumen, la ventaja del sistema HDAD-vector para la transferencia de genes reside en su capacidad de clonaje elevada, transducción eficiente y la expresión a largo gen duradera en el hígado con la mínima toxicidad crónica, así como su naturaleza de no integración del genoma del vector en el huésped cromosoma. Las limitaciones principales son los pasos complejos que intervienen en su generación y suaplicación in vivo está limitada principalmente al hígado con el serotipo Ad más popular 5. Islet neogénesis puede ser inducido para restaurar completamente la insulina en plasma y la tolerancia a la glucosa en ratones diabéticos mediante la inducción de la neogénesis de islotes en el hígado por la transferencia de genes de factor de transcripción Islet linaje que define, junto con Ngn3 el factor de crecimiento de los islotes, betacelulina. En este informe, se muestra el protocolo óptimo para generar calidad-Hdad Ngn3 y Hdad BTC-, y demostrar las técnicas para inducir y evaluar la neogénesis islote en el hígado de ratones diabéticos a reducir la hiperglucemia.
Nota: Los vectores virales y las líneas celulares descritas aquí están disponibles en el Laboratorio de Producción Vector Core, Diabetes Research Center, Baylor College of Medicine ( http://www.bcm.edu/mcb/index.cfm?pmid=7731 ). Algunos kits comerciales están también disponibles para la generación de virus HDAD (por ejemplo, Microbix biosystems Inc.).
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por becas de los NIH R03: DK089061-01 (VKY); NIH: K08 DK068391 (VKY); Diabetes y Endocrinología del Centro de Investigación-(DERC - P30DK079638) en el Baylor College of Medicine, una subvención Pilot y viabilidad de el DERC (VKY), Juvenile Diabetes Research Foundation: Premio JDRF # 5-2006-134 (VKY).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| ProFectionR kit de transfección de mamíferos | Promega | E1200 | |
| Kit DNeasy Sangre y Tejidos (50) | Qiagen | 69504 | |
| Perfecta SYBR Green Supermix, ROX | Quanta Biosciences | 95055-500 | |
| Desoxicolato de sodio | Sigma | D6750-25G | |
| MEM polvo | Invitrogen | 61100087 | |
| La penicilina estreptomicina | Sigma | 15140122 | |
| FBS | Atlanta Biológicos | S11150 | |
| L-glutamina | Invitrogen | 25030-081 | |
| Higromicina B | Sigma | H0654-1G | |
| EAGLE MEM Joklik | Sigma | M0518-10L | |
| Rnase | Roche | 10109169001 | |
| DNasa I, grado II | Roche | 10104159001 | |
| Estreptozocina | Sigma | s0130 | |
| Vidrio frascos spinner | Corning | 4500-3L | |
| Vidrio frascos spinner | Corning | 4500-250 | |
| Deslice Lyzer A-casset | PIERCE CH | PI66380 | |
| Tube Optiseal poli allomer, 11,2 ml | Beckman Coulter | 362181 | |
| 1 kg de cloruro de cesio | JT4042-2 | VWR | |
| Beckman LE-80K | Beckman Coulter | Optimal LE-80K ultracentrífuga | |
| Filtrar | VWR | 28143-338 | |
| tubo de centrífuga de 500 ml | Corning | 431123 | |
| tailveiner restrainer | Braintree Scientific, Inc | tv-150 | |
| La insulina, Mouse ELISA | Mercodia | 10-1247-01 | |
| microvette CB300 | Sarstedt | 16.443.100 | |
| D-glucosa | Sigma | G8270 | |
| Ratón C-péptido ELISA Kit | Wako Pure Chemical Industries, Ltd | # 631-07231 | |
| guinea pig anticuerpo anti-insulina | Abcam | ab7842 | |
| de cabra anti-anticuerpo Pdx1 | regalo del doctor Christopher Wright | ||
| anticuerpo de ratón anti Ngn3 | Células Beta Consorcio de Biología, Univ. de Pennsylvania | AB2013 | |
| anticuerpo de ratón anti Nkx6.1 | Células Beta Consorcio de Biología, Univ. de Pennsylvania | F64A6B4 | |
| anticuerpo anti-betacelulina | Ciencias de la célula | PAAQ1 | |
| ALT (SGPT) Color de reactivos. | Teco Diagnóstico | A526 - 120 | |
| AST / (SGOT), punto final color de reactivos | Teco Diagnóstico | A561-120 |
Tabla 2. Reactivos y equipos específicos.
Referencias
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados