Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La implantación de fibra óptica para la estimulación optogenético crónica en el tejido cerebral
En este artículo
Resumen
El desarrollo de optogenética ahora proporciona el medio para estimular las neuronas precisamente definidos genéticamente y circuitos, ambos In vitro Y In vivo. Aquí se describe el montaje y la implantación de una fibra óptica para la fotoestimulación crónica del tejido cerebral.
Resumen
Elucidar los patrones de conectividad neuronal ha sido un reto tanto para la neurociencia básica y clínica. Electrofisiología ha sido el estándar de oro para el análisis de los patrones de conectividad sináptica, pero emparejados registros electrofisiológicos puede ser a la vez engorroso y limitar experimentalmente. El desarrollo de optogenética ha introducido un método elegante para estimular las neuronas y circuitos, tanto in vitro como in vivo 1 y 2,3. Mediante la explotación de células de tipo actividad promotora específica para conducir la expresión de opsina en poblaciones neuronales discretas, uno precisamente puede estimular genéticamente definidos subtipos neuronales en circuitos distintos 4-6. Métodos bien descritos para estimular las neuronas, incluyendo la estimulación eléctrica y / o manipulaciones farmacológicas, son a menudo de tipo celular indiscriminada, invasiva, y puede dañar los tejidos circundantes. Estas limitaciones podrían alterar la función normal sináptica y / o comportamiento del circuito. Además, debidoa la naturaleza de la manipulación, los métodos actuales son a menudo aguda y terminal. Optogenética proporciona la capacidad de estimular las neuronas de una manera relativamente inocuo, y en las neuronas genéticamente dirigidos. La mayoría de los estudios que implican en optogenética in vivo actualmente utiliza una fibra óptica de guía a través de una cánula implantada 6,7, sin embargo, las limitaciones de este método incluyen tejido dañado cerebro con la inserción repetida de una fibra óptica, y la rotura potencial de la fibra en el interior de la cánula. Dado el creciente campo de la optogenética, un método más fiable de la estimulación crónica es necesario para facilitar estudios a largo plazo con el mínimo daño tisular colateral. Aquí nos proporcionan nuestro protocolo modificado como un artículo de vídeo para complementar el método eficaz y elegantemente descrito en Sparta et al. 8 para la fabricación de un implante de fibra óptica y su fijación permanente en el cráneo de ratones anestesiados, así como el montaje de la fibraacoplador óptico de conectar el implante a una fuente de luz. El implante, conectado con fibras ópticas a un láser de estado sólido, permite un método eficiente para photostimulate crónicamente circuitería neuronal funcional con menos daño al tejido 9, usando pequeñas correas desmontables,. Fijación permanente de los implantes de fibra óptica proporciona coherente, a largo plazo in vivo en estudios optogenético de los circuitos neuronales en ratones despiertos, comportándose 10 con el daño tisular mínima.
Protocolo
* Todos los materiales, junto con los respectivos fabricantes y / o proveedores se enumeran a continuación el protocolo.
1. Asamblea de los implantes
- Preparar una mezcla de epoxi curable por calor de fibra óptica mediante la adición de 100 mg de catalizador a 1 g de resina.
- Mida y corte aproximadamente 35 mm de fibra óptica de 125 micras con núcleo de 100 micras al anotar con un escribano de cuña punta de carburo. Coloque el escribano perpendicular a la fibra óptica y la puntuación en un movimiento único, unidireccional. Cortar la fibra completamente dañará el núcleo de la fibra.
- Inserte un casquillo cerámico LC con un 127 micras llevaban en el vicio, con el lado convexo hacia abajo.
- Insertar la fibra óptica en el casquillo. La fibra óptica debe deslizarse suavemente y ligeramente sobresale más allá del extremo convexo de la férula (Figura 1a).
- Aplique una gota de epoxi fibra termocurable óptico hasta el extremo plano y el calor con una pistola de calor hasta que se vuelve negro epoxy. El epoxi debellenar la férula medida que se calienta y curado antes. El epoxi se cura dentro de ~ 1 min de la aplicación de calor constante.
- Limpiar cualquier epoxi a lo largo de los lados de la virola, como se obstruirá interfaz con el acoplador.
- Pulir el extremo convexo de la férula utilizando un disco de pulido LC fibra óptica (FOPD) en hojas de óxido de aluminio de pulido sobre la almohadilla de pulido (Figura 1b). Haga movimientos circulares de rotación y pulir en cuatro grados en el siguiente orden: 5, 3, 1 0,3 micras grano.
- Cortar la fibra óptica en el extremo plano a la longitud adecuada de manera que se dirige a la región de interés. La longitud puede ser determinada usando el atlas estereotáxico.
- Probar el implante mediante la conexión al láser a través del cable del acoplador se describe a continuación. El extremo pulida del implante se inserta en el manguito del acoplador y debe estar en contacto directo con el casquillo opuesto. El implante debe ser capaz de mantener 10 mW de salida de luz, medida en la punta de the implante de fibra. Un implante mal tendrá un punto focal débil cerca de la punta de la fibra óptica.
- La tienda de los implantes acabados (Figura 1c) en la espuma hasta su uso.
2. Asamblea de cable de fibra óptica acoplador
- Preparar una mezcla de epoxi curable por calor de fibra óptica como anteriormente.
- Medir y cortar una longitud apropiada de fibra óptica 220 micras con núcleo de 200 micras al anotar con una punta trazadora de cuña punta de carburo. La longitud de la fibra debe permitir el ratón para mover libremente alrededor de la vivienda, pero no permiten el ratón para masticar a través de la fibra.
- Insertar la fibra óptica en una longitud de tubería de bifurcación ligeramente más largo que la longitud de la fibra óptica. El tubo debe tener un diámetro interior ligeramente mayor que el de fibra óptica.
- Franja de ~ 25 mm en un extremo de la fibra óptica y la inserta en el extremo metálico de un multimodo MM FC Ferrule Asamblea con 230 micras llevaba hasta el tope. La fibra óptica debe sobresalir a través de la ferrufinal le (Figura 2a).
- Asegurar la conexión con cianoacrilato (pegamento) en el extremo de metal. Cubra la conexión con un conector de arranque y pulir el final con una férula FOPD FC. Haga movimientos circulares de rotación y pulido en cuatro grados en el siguiente orden: 5, 3, 1, 0,3 m de grano (Figura 2b).
- Pelar y el otro extremo de la fibra óptica en un LC de casquillo cerámico (230 micras Identificación del orificio de fijación) con el extremo distal convexa. Aplique una gota de epoxi para el extremo plano y el calor hasta que esté curado.
- Pulir el extremo convexo de la férula utilizando un FOPD FC en hojas de aluminio pulido de óxido como se ha descrito anteriormente.
- Deslizar un manguito LC collar sobre el extremo convexo de la férula hasta el punto medio del manguito.
- Lugar de calor tubo retráctil sobre el tubo de bifurcación y el manguito y el calor para asegurar y proteger la conexión (figura 2c).
- Pruebe el acoplador mediante la conexión a la fuente de láser y la medición de la luz Sal.ut a través del acoplador con un espectrofotómetro. La pérdida de luz entre la salida del láser y la salida del acoplador medido no debe exceder de 30%.
3. Implantación quirúrgica
* Este es un procedimiento puntas de sólo. Los instrumentos son estériles pero los guantes no necesitan ser debido a la manipulación constante entre los instrumentos y el equipo.
- Se anestesia el ratón con una inyección intraperitoneal de ketamina / xilazina mezcla de 100 y 10 mg / kg, respectivamente, utilizando una aguja de calibre 30.
- Afeitar el cuero cabelludo con las tijeras. Limpie el cuero cabelludo con un 70% de alcohol isopropílico seguido de Betasept limpiar (4% de solución de clorhexidina) durante dos minutos, repitiendo una vez.
- Coloque el ratón en la plataforma sterotaxic y asegurar la cabeza, asegurando que el cráneo es plano. Aplique ungüento oftálmico de los ojos para evitar la sequedad y el dolor postoperatorio. Mantenga la anestesia con isoflurano volatilizado (1-3% diluido con oxígeno en función del estado fisiológico del mouse, que deben ser controlados continuamente por la respuesta a un pinzamiento del rabo).
- Hacer una incisión a través de la línea media del cuero cabelludo, el cráneo de la exposición de las órbitas de los ojos de lambda. Empujar a un lado del tejido conectivo como sea necesario.
- Utilice abrazaderas Serafin para contener la piel y mantener un acceso al cráneo (Figura 3a).
- Etch un patrón de cuadros a lo largo de la superficie del cráneo con un palillo de dientes. Lave los residuos lejos con solución salina estéril. Secar bien.
- Aplicar el peróxido de hidrógeno (3%) en el cráneo expuesto con un bastoncillo de algodón para ~ 2-3 seg para crear microporos. Lavar varias veces y secar bien. Alternativamente, las anclas pueden ser atornillado en el cráneo, como se describe en Sparta et al. (2012).
- Una vez más, grabar un patrón de cuadros en todo el cráneo con un palillo de dientes y lavar los restos con solución salina. Secar bien.
- Uso de una herramienta rotativa, hacer un pequeño agujero de Burr craneotomía (<1 mm de diámetro) con una broca estéril(Autoclave) por encima de la región de interés, determinado por el atlas estereotáxico calibrado a bregma y lambda. Tenga cuidado de no romper la dura o dañar ningún tejido. Lavar y secar bien los residuos.
- Insertar la férula de fibra óptica (implante) en el soporte de la sonda y conectar con el brazo estereotáxica.
- Posicionar el implante en su sitio directamente encima de la región de interés utilizando el brazo estereotáxico (Figura 3b). Si la inserción de la fibra óptica en el tejido cerebral, la fibra debe avanzar lentamente a una velocidad de ~ 2 mm / min. La férula debe descansar en el cráneo restante.
- Preparar una mezcla de cemento dental. La mezcla debe tener una viscosidad lo suficientemente baja como para aplicar fácilmente a través del cráneo. Mezcla será utilizable durante 2-4 min.
- Usando un palillo de dientes estéril, aplicar una capa fina y uniforme de cemento dental a través del cráneo y sobre la parte inferior del implante. La capa de base de cemento dental debe cubrir la superficie tanto en el cráneo comoposible. No dejar que el cemento dental entrar en contacto con la piel del ratón. Esto conducirá a una mayor dificultad en la sutura, así como irritación para el ratón. Si el cemento dental entra en contacto con la piel, dejar que se seque parcialmente de tal manera que toda la capa de cemento se puede desprender antes de la configuración.
- Deje que se seque por completo.
- Aplicar incluso capas de cemento dental para formar un pequeño montículo sobre el cráneo y alrededor del implante, permitiendo que cada capa se seque por completo (Figura 3c). Deja ~ 3-5 mm del extremo convexo de la férula limpia de cemento para permitir una conexión sin problemas y sin obstrucciones.
- Suture el cuero cabelludo sobre el montículo de cemento dental y alrededor del implante mediante estériles de un solo uso suturas de seda trenzadas (6-0) con una aguja C22. Quitar después de 7 días. Opcional: Bond Uso Veterinario para la unión adicional después de la sutura. Asegúrese de usar Bond Vet mínimo. El exceso puede causar daño grave en la piel debido a las ralladuras.
- INMEDIATAMy después de la cirugía, el ratón debe ser inyectada por vía subcutánea con Ketprophen (5 mg / kg) para disminuir el dolor postoperatorio. Esto se debe repetir 24 horas más tarde. Aplicar analgésicos tópicos (bupivicaína) y antibióticos (Neosporin) a la piel se sutura y alrededor de la base del implante.
- Coloque el ratón en una jaula sobre una manta de calefacción para la recuperación de la anestesia. Coloque el ratón en una jaula estéril, la recuperación postoperatoria. La jaula de recuperación no debería contener la ropa de cama con el fin de mantener la temperatura y evitar la asfixia. El ratón puede ser devuelto a la jaula original, o una nueva jaula una vez despierto.
Ensamblaje correcto del implante de fibra óptica y los resultados del acoplador en una mínima pérdida de fotones entre la fuente de luz y el extremo de la fibra óptica en la región de interés. Bien pulido fibra óptica debe transmitir la luz de manera uniforme, concéntrico círculo (Figura 2d). Con la implantación cuidadosa y la sutura, el implante no causa irritación visible ael ratón y puede permanecer en su lugar para estudios a largo plazo (Figura 3D,> 1 mes, observaciones no publicadas) sin ninguna degradación significativa de la fibra óptica o de la cantidad de luz transmitida. Implantación inadecuada o la sutura puede causar irritación y puede resultar en el ratón rascado a través de su cuero cabelludo, dejando al descubierto el cemento dental, o rotura de la virola del cemento dental debido a la manipulación persistente. Un diagrama esquemático del sistema ensamblado se puede ver en la Figura 4.

Figura 1. Asamblea de la fibra óptica implantables. (A) La fibra óptica se inserta en el casquillo, que sobresale ligeramente más allá del extremo convexo indicado por la punta de flecha. (B) El extremo convexo de la férula se pule con un FOPD en grados progresivamente más finos de hojas de pulido. (C) El opt acabado de fibra implantableic. Haga clic aquí para ampliar la cifra .

Figura 2. Asamblea de acoplador de fibra óptica utilizada para atar la fibra óptica de la junta rotativa al implante. (A) La fibra óptica se pegue a través del conjunto casquillo. (B) La parte del conjunto de casquillo se inserta en los grados FOPD y pulido utilizando progresivamente más finos de papel de pulido. (C) El manguito de casquillo está montado sobre el casquillo y se fija con tubo termocontráctil. (D) El acoplador de fibra óptica terminado debe producir una luz concéntrica con pérdida mínima de fotones.

Figura 3. Implantación quirúrgica de las fibras ópticas. (A) La superficie entera de la cranium está expuesta y el tejido conectivo se borra. (B) El implante de fibra óptica se mantiene en posición con el brazo estereotáxica. (C) el cemento dental se aplica la fijación del implante de fibra óptica en el cráneo. (D)> 1 mes después de la implantación, la piel se ha curado alrededor del implante y no hay signos de irritación.
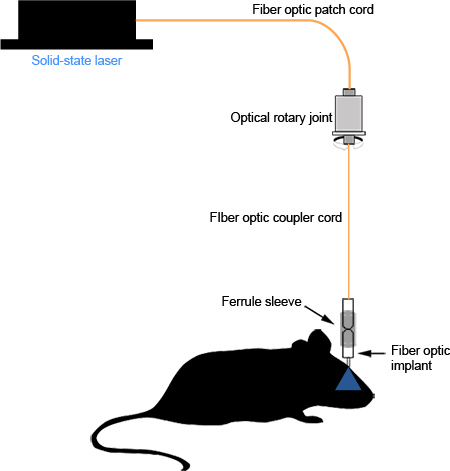
Figura 4. Diagrama esquemático del sistema funcional
Access restricted. Please log in or start a trial to view this content.
Discusión
Optogenética es una técnica nueva y potente que permite un control sin precedentes sobre determinados subtipos neuronales. Esto puede explotarse para modular los circuitos neuronales con precisión anatómica y temporal, evitando al mismo tiempo la indiscriminada de tipo celular y efectos invasivos de la estimulación eléctrica a través de un electrodo. La implantación de la fibra óptica permite la estimulación consistente, crónica de los circuitos neuronales en varias sesiones en despierto, comportándose raton...
Access restricted. Please log in or start a trial to view this content.
Agradecimientos
Nos gustaría reconocer que esta técnica fue descrita originalmente por Esparta et al., 2012, y ha sido fácilmente adaptado para su uso en nuestro laboratorio.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo o equipo | Empresa | Catálogo # | Comentarios |
| LC Ferrule manga | Precision Products fibra (PFP) | SM-CS125S | 1,25 mm ID |
| FC MM Pre-ensamblado Conector | PFP | MM-CON2004-2300 | 230 m Ferrule |
| Miller FOPD-LC Disc | PFP | M1-80754 | Para el LC casquillos |
| Bifurcación tubo | PFP | FF9-250 | 900 m OD, ID 250 micras |
| MM LC Memory Ferrule 1,25 mm | PFP | MM-FER2007C-1270 | ID 127 micras Diámetro |
| MM LC Memory Ferrule 1,25 mm | PFP | MM-FER2007C-2300 | 230 mID Bore |
| Heat epoxi curable, el endurecedor y la resina | PFP | ET-353ND-16OZ | |
| FC / PC y SC / PC Conector de disco de pulido | Thorlabs | D50-FC | Por FC casquillos |
| Potencia óptica digital y medidor de energía | Thorlabs | PM100D | Espectrofotómetro |
| Polishing Pad | Thorlabs | NRS913 | 9 "x 13" 50 Durómetro |
| Óxido de aluminio Pulido (pulido) Hojas: 0,3, 1, 3, 5 sémola micras | Thorlabs | LFG03P, LFG1P, LFG3P, LFG5P | |
| La fibra multimodo estándar Revestimiento Duro | Thorlabs | BFL37-200 | Bajo OH, 200 Core micras, 0,37 NA |
| Herramienta pelacables de fibra | Thorlabs | T10S13 | Clad / Coa: 200 micras / 300 micras |
| SILICA / sílice de fibra óptica | Polymicro Tecnologías | FVP100110125 | High-OH, UV mejorada, 0,22 NA |
| 1x1 junta rotativa con fibra óptica | lentes dóricas | FRJ_FC-FC | |
| Mono con fibra óptica Patchcord | lentes dóricas | MFP_200/230/900-0.37_2m_FC-FC | |
| Tubo termorretráctil, 1/8 pulgadas | Allied Electronics | 689-0267 | |
| Heat gun | Allied Electronics | 972-6966 | 250 W, 750-800 ° F |
| Aplicadores con punta de algodón | Puritan Medical Products Company | 806-WC | |
| Adhesivo de tejido Vetbond | Fischer Scientific | 19-027136 | |
| Flash dentadura acrílica de base | Yates Motloid | ColdPourPowder + Liq | |
| BONN miniatura Iris Scissors | Miltex Integra | 18-1392 | 3-1/2 "(8,9 cm), hojas rectas, 15 mm |
| Johns Hopkins Bulldog Clamp | Miltex Integra | 7-290 | 1-1/2 "(3,8 cm), curvada |
| MEGA-Torque eléctrico Motor Lab | Vector | EL-S | |
| Panther Burs-Ball # 1 | Clarkson Laboratorio | 77,1006 | |
| Violet Blue Laser System | CrystaLaser | CK473-050-S | Longitud de onda: 473 nm |
| Fuente de alimentación del laser | CrystaLaser | CL-2005 | |
| Dumont # 2 Pinzas laminectomía | Fine Ciencia Herramientas | 11223-20 | |
| Sonda | Herramientas Artes Ciencias | 10140-02 | |
| 5 "Straight Hemostat | EXCELTA | 35-PH | |
| Vise con base pesada | Altex Electronics | PAN381 |
Referencias
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neuronal activity. Nat Neurosci. 8, 1263-1268 (2005).
- Arenkiel, B. R. In Vivo Light-Induced Activation of Neural Circuitry in Trangenic Mice Expressing Channelrhodopsin-2. Neuron. 54, 205-218 (2007).
- Gradinaru, V. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 165-16 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Zhang, F. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat. Protoc. 5, 439-456 (2010).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450, 420-424 (2007).
- Sparta, D. R. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7, 12-23 (2012).
- Stuber, G. D. Excitatory transmission from the amygdala to nucleus accumbens facilitates reward seeking. Nature. 475, 377-380 (2011).
- Liu, X. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature. 484, 381-385 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados