Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo para la evaluación relativa hidrodinámico de Tri-lámina polimérica Válvulas
En este artículo
Resumen
Se ha renovado el interés en el desarrollo de válvulas de polímero. Aquí, los objetivos son para demostrar la viabilidad de la modificación de un duplicador de pulso comercial para dar cabida a geometrías tri-prospecto y para definir un protocolo para presentar los datos hidrodinámicos de la válvula de polímero en comparación con los datos de la válvula nativa y protésica recogidos en condiciones casi idénticas.
Resumen
Limitaciones de válvulas protésicas disponibles en la actualidad, xenoinjertos y homoinjertos han llevado a un resurgimiento reciente de los acontecimientos en el área de tri-valva polimérica prótesis. Sin embargo, la identificación de un protocolo para la evaluación inicial de la funcionalidad hidrodinámico válvula de polímero es de suma importancia durante las primeras etapas del proceso de diseño. Tradicional en los sistemas de duplicador de pulso in vitro no están configurados para acomodar materiales de tri-prospecto flexibles; además, evaluación de las necesidades de la funcionalidad de la válvula de polímero que se ha hecho en un contexto relativo a las válvulas cardiacas nativas y prótesis bajo condiciones de ensayo idénticos, por lo que la variabilidad en las mediciones de diferentes instrumentos pueden ser evitados. Por consiguiente, se realizó la evaluación hidrodinámica de i) nativo (n = 4, diámetro medio, D = 20 mm), ii) bi-valva mecánica (n = 2, D = 23 mm) y iii) las válvulas de polímero (n = 5, D = 22 mm) a través de la utilización de un sistema duplicador de pulso disponible en el mercado (ViVitro LabsInc, Victoria, BC) que se ha modificado para dar cabida a las geometrías de la válvula tri-folleto. Válvulas de silicona Tri-folleto desarrollado en la Universidad de Florida componen el grupo válvula de polímero. Una mezcla en la proporción de 35:65 glicerina al agua se utiliza para imitar las propiedades físicas de sangre. Velocidad de flujo instantáneo se midió en la interfaz del ventrículo izquierdo y la aorta unidades mientras que la presión se registró en las posiciones aórtica y ventricular. Bi-folleto y los datos de válvulas nativas de la literatura se utilizó para validar el flujo y lecturas de la presión. Se reportaron los siguientes parámetros hidrodinámicos: Caída de presión del flujo, la raíz aórtica tasa media plaza flujo delantero, cierre aórtico, la fuga y el volumen de regurgitación, cierre transaórtico, las fugas y las pérdidas totales de energía. Los resultados representativos indican que los parámetros hidrodinámicos de los tres grupos de válvulas se pueden obtener con éxito mediante la incorporación de un conjunto a la medida en un sistema duplicador de pulso disponibles comercialmente y subsequently, en comparación objetiva para proporcionar información sobre los aspectos funcionales del diseño de la válvula de polímero.
Introducción
Enfermedad de las válvulas del corazón a menudo resulta de la calcificación degenerativa de la válvula 1, 2 fiebre reumática, endocarditis 3,4 o defectos congénitos. Cuando se produce daño de la válvula, provocando la estenosis y / o regurgitación prolapso de la válvula y no se puede reparar quirúrgicamente, la válvula nativa se sustituye por lo general por una válvula protésica. Actualmente opciones disponibles incluyen válvulas mecánicos (válvulas de jaula de bola, válvulas de disco de inclinación, etc.), Homoinjertos y las bioprótesis (porcina y válvulas bovinas). Las válvulas mecánicas a menudo se recomiendan para los pacientes más jóvenes en función de su duración, sin embargo se requiere que el paciente permanezca en terapia con anticoagulantes para prevenir las complicaciones trombóticas 5. Válvulas protésicas homoinjertos y biológica han sido opciones eficaces para evitar la terapia anticoagulante, sin embargo, estas válvulas tienen un riesgo elevado para la fibrosis, calcificación, la degeneración, y las complicaciones inmunogénicas que conducen a la insuficiencia de la válvula 6. Las válvulas de tejido de ingeniería están siendo investigados como una tecnología emergente 7-9, pero aún queda mucho por descubrir. Se necesitan duraderos, válvulas protésicas alternativas, biocompatibles para mejorar la calidad de vida de los pacientes de la enfermedad de la válvula del corazón. Una vez más, este diseño de la válvula podría reemplazar la bioprótesis utilizado en la tecnología de la válvula transcatéter, con los enfoques de transcatéter que muestran el potencial para transformar el tratamiento de pacientes seleccionados con enfermedad de la válvula del corazón 10.
Como se ha indicado por las normas vigentes, un éxito sustituto de válvula cardiaca debe tener las siguientes características de funcionamiento: "1) permite el flujo hacia adelante con aceptablemente pequeña gota diferencia de presión media; 2) evita el flujo retrógrado con aceptablemente pequeña regurgitación; 3) resiste embolización; 4) resiste hemólisis; 5) resiste la formación de trombos; 6) es biocompatible; 7) es compatible con las técnicas de diagnóstico in vivo; 8) es entregable y implantable en el objetivopoblación; 9) permanece fija una vez colocada, 10) tiene un nivel de ruido aceptable, 11) tiene la función reproducible; 12) mantiene su funcionamiento durante un período de vida razonable, de acuerdo con su clase genérica; 13) mantiene su funcionalidad y la esterilidad de un estante razonable la vida antes de la implantación. "11. Algunas de las deficiencias de prótesis de válvulas existentes potencialmente se pueden superar mediante una válvula de polímero. polímeros biocompatibles han sido considerados los mejores candidatos sobre la base de bioestabilidad, anti-hidrólisis, anti-oxidación, y las propiedades mecánicas ventajosas, tales como alta resistencia y viscoelasticidad. En particular, los polímeros elastoméricos pueden proporcionar deformación del material se asemeja a la dinámica de la válvula nativa. Elastómeros se puede adaptar para imitar las propiedades del tejido blando, y pueden ser los únicos materiales artificiales disponibles que son bio-tolerante y que puede soportar el acoplado, in vivo, las tensiones inducida por el fluido, a la flexión ya la tracción, sin embargo, se mueven de una manera que se asemeja saludable,movimiento de la válvula nativa. Por otra parte, los elastómeros puede ser producido en masa en una variedad de tamaños, almacenados con facilidad, se espera que sean los dispositivos rentables y pueden ser estructuralmente aumentada con refuerzo de fibra.
El concepto de la utilización de materiales de polímero de montar una válvula tri-folleto no es nuevo y ha sido el objeto de varias investigaciones de investigación en los últimos 50 años 12, que fueron abandonados en gran medida debido a la durabilidad de la válvula limitada. Sin embargo, con el advenimiento de nuevas metodologías de fabricación 13,14, el refuerzo de los materiales de polímero 15,16 y la integración sin fisuras de polímero potencialmente sustitutos de válvulas con tecnología de válvulas transcatéter, recientemente ha habido un interés renovado y la actividad en el desarrollo de válvulas de polímero como un potencialmente alternativa viable a las válvulas comerciales disponibles en la actualidad. En este sentido, un protocolo para permitir pruebas de estas válvulas para evaluar la funcionalidad hidrodinámico es el primer pasoen el proceso de evaluación, sin embargo, los sistemas de simulador de pulso disponibles en el mercado en general, no están equipadas para acomodar diseños de válvula tri-folleto y contienen un espacio anular para insertar las válvulas del corazón disponibles en el mercado (por ejemplo, disco basculante, bi-valva válvulas cardíacas mecánicas). En segundo lugar, las válvulas de polímero son una tecnología emergente cuyo hidrodinámica sólo puede evaluarse en un contexto familiar. A pesar de que la presión de la válvula de corazón nativo y datos de flujo está disponible, es importante llevar a cabo las pruebas de válvulas aórticas porcinas nativas, que son biológicamente similar a las válvulas humanos, utilizando el mismo simulador pulsátil que se utiliza para evaluar las válvulas de polímero con el fin de dar cuenta de las diferencias de medición que pueden ser dependientes del sistema. Por lo tanto, el objetivo de este estudio fue demostrar cómo un simulador de pulso disponible en el mercado puede ser equipado con una asamblea para dar cabida a las construcciones de la válvula tri-folleto y una evaluación sistemática de polímero de válvulas métricas hidrodinámicas en un cont relativaext en comparación con porcinos homólogos de válvulas cardíacas mecánicas y nativas. En nuestro caso, nuevos tri-prospecto válvulas de polímero de silicona previamente desarrollados en la Universidad de Florida 13 incluido el grupo de válvula de polímero.
Protocolo
1. Preparación
- Diseñar y fabricar una asamblea para dar cabida a una geometría de la válvula tri-folleto. Esto por lo menos, un soporte de la válvula de sutura en las valvas de la válvula y un tubo para alojar el soporte de la válvula y accesorios circundantes para asegurar el conjunto en el sistema duplicador de pulso. En nuestro caso, hemos utilizado un sistema duplicador de pulso disponible comercialmente de ViVitro Labs Inc. (Victoria, BC). Diseño de soporte de la válvula, así como configuraciones de pre y post montaje se representan en la Figura 1.
- Tendrá que ser cebado antes de su uso todo el bucle. Esto implica dos pasos: i) la limpieza de todo el sistema de bucle usando solución de jabón y agua, incluyendo el reemplazo de cualquier tubos degradados antes de su uso y ii) de calibración de los instrumentos conectados al bucle, a saber, la bomba se utiliza, la sonda de flujo, y los transductores de presión (generalmente medido en lugares fibrilación, aórticas y ventriculares). La calibración puede initially llevarse a cabo utilizando solución salina al 1% y se debe repetir antes de utilizar la sangre-analógico solución de glicerina.
2. Nativo de la válvula aórtica Disección
- Obtenga 4 corazones de cerdo fresco con la aorta intacta de una casa masacre aprobado por USDA (Institucional Cuidado de Animales y puede ser necesario el empleo Comisión de aprobación (IACUC)). En nuestro caso, nuestro protocolo de disección fue aprobado por el IACUC la Universidad Internacional de Florida (Protocolo Número de aprobación: 11 a 020). Enjuague el corazón con agua desionizada y colóquela en un recipiente lleno con el 1% de fosfato antimicótica / antibiótica y solución salina estéril tamponada solución y el transporte (PBS) en hielo al laboratorio de análisis hidrodinámico.
- Coloque corazones en una sartén de disección y retirar con cuidado el pericardio. Coloque el corazón de tal manera que la parte ventral hacia usted. Inspeccione visualmente e identificar las cuatro cavidades del corazón y busque el arco aórtico en la aorta intacta.
- Separe el corazón en two mitades cortando a través horizontalmente a aproximadamente 0,75 en por debajo de la corona circular, es decir, la unión entre la aorta y el ventrículo izquierdo. Aislar cuidadosamente la aorta intacta todavía unido al segmento de tejido del ventrículo izquierdo.
- Examine la válvula aórtica se encuentra en la raíz de la aorta, la región entre la aorta ascendente y el anillo inferior, asegurándose de que no hay daños o signos de calcificación.
- Dividir la aorta en ~ 1 en por encima de la corona circular y separar el segmento de tejido del ventrículo izquierdo por debajo del anillo para aislar la válvula aórtica (Figura 2a).
3. Polímeros y Process sutura válvulas nativas
- Coloque la válvula de corazón en el interior del soporte de la válvula de tal manera que la base de cada válvula se alinea con la base del soporte de poste. Fije la válvula en su lugar en cada puesto de forma temporal con un clip, pero tenga cuidado de no dañar las comisuras o las cúspides.
- Inserte la sutura en elaguja. Comience sutura en la parte inferior del soporte de la válvula haciendo pasar la aguja a través del primer orificio, desde el exterior hacia el interior de tal que la aguja puede ser fácilmente retirado de la parte inferior. De un modo bucle, inicie suturar la válvula verticalmente hasta los postes del soporte de la válvula.
- Progreso con sutura (Figura 2b) a lo largo de la circunferencia del titular y seguro con sutura adicional alrededor de las puntas de los mensajes titular. Los clips de papel (Figura 2c) se pueden quitar cuando la válvula está completamente asegurada mediante suturas a los mensajes 3 y en la circunferencia del soporte de válvula (figuras 2d y 2e).
4. Evaluación hidrodinámica
Nota: protocolo real variará dependiendo del sistema duplicador de pulso específico que está siendo utilizado. Toda la información en este documento utiliza la caontained ViVitro pulso duplicadora Sysytem (ViVitro Labs, Inc., Vancouver, BC).
- VA Bi-folletolve
- Establezca la frecuencia cardíaca del sistema duplicador pulso 70 latidos / min.
- Seleccione una forma de onda de flujo para accionar la bomba (en el caso del sistema de ViVitro se eligió la forma de onda S35 para todas las pruebas hidrodinámicas). La forma de onda específica utilizada en nuestros experimentos se ilustra por Lim et al. (2001) 17.
- Encienda el amplificador y la bomba de pistón. Calentar durante 15 min.
- Coloque la válvula bi-valva (Figura 2f) en posición aórtica.
- Frotis de grasa de vacío en todos los cruces del dispositivo en el que podrían producirse fugas.
- Vierta glicerina / líquido salino en el compartimiento atrial. Tenga en cuenta que el sistema duplicador pulsátil se ejecuta en 2 L de líquido con: 35% / 0,7 L de glicerina y 65% / 1,3 L de solución salina. La solución salina se prepara utilizando sal común bien disuelto en agua desionizada a una concentración de 9 mg / ml (peso / volumen).
- Encienda el transductor de flujo que se ha colocado en la posición aórtica.
- Calibrar ªbomba de correo.
- Proceder a la calibración del transductor de flujo seguido por los transductores de presión. Al igual que en la bomba, simplemente siga las instrucciones dadas por el software ViVitest (ViVitro Labs Inc.) para cada flujo y la presión en la pestaña calibrar.
- Una vez terminada la calibración, encienda la bomba en una RPM baja hasta que el líquido llena el compartimiento de la aorta. Compruebe que no haya fugas. Utilice grasa de vacío adicional si es necesario.
- Gire los dos grifos de cierre (aórtica y transductores ventriculares) en la posición abierta.
- Aumentar el número de revoluciones de la bomba hasta que el volumen sistólico alcanza 80 ml / latido.
- Permitir que el sistema funcione durante 10 min hasta que el flujo se ha estabilizado. La estabilización de flujo se puede verificar mediante la observación del flujo y la presión formas de onda mostradas en la pantalla. Menor a ninguna variación entre ciclos es un buen indicador de la estabilización del sistema.
- En el software ViVitest seleccionar el modo de adquirir.
- Haga clic en recoger 10 ciclos.
- Desde el modo de analizar, Chaga clic sobre la tabla y guarde el archivo. Además, guarda una imagen de las formas de onda usando la opción de foto-snap en ViVitest.
- Válvulas nativas y polímero
- Para válvulas de polímero y de los animales, siga los mismos pasos 3.1.1 - 3.1.3 de las instrucciones de la válvula bi-valva.
- Coloque el soporte de la válvula con la válvula se sutura en el interior del tubo de vidrio desde el conjunto hecho a medida. Sandwich del tubo con las piezas superior e inferior y seguras en el lugar con los tornillos y las tuercas laterales.
- Coloque el ensamble entre la cámara de la aorta y el soporte de la válvula aórtica originales.
- Continúe con los pasos 3.1.5 - 3.1.16 de las instrucciones de la válvula bi-valva.
5. Publique Procesamiento
- Flujo y formas de onda de presión
- Promedio de los datos recogidos para cada una de las formas de onda conseguidas, es decir, la presión aórtica (AP), la presión ventricular (VP), y el caudal (Q).
- Para cada grupo de válvula (polímero, porcino nválvula aórtica ativa y bi-valva), trazar las correspondientes AP, VP y Q frente a relaciones de tiempo en la misma parcela.
- Para el AP, superponer, normal de la válvula aórtica nativa 18, y bi-valva de la válvula protésica 19 parcelas a partir de la literatura para los propósitos de validación.
- Mediciones hidrodinámicas
- Para cada válvula de prueba, los siguientes parámetros hidrodinámicos deben calcularse: a) Caída de presión y flujo de la presión máxima transvalvular (TVP), b) la raíz aórtica media cuadrática caudal hacia adelante (RMS), c) flujo delantero aórtica, cierre, fugas y el volumen total de regurgitación, d) área de la válvula final orificio (EOA), e) transaórtico flujo delantero, cierre, las fugas y las pérdidas totales de energía.
- Caída de presión del flujo se calcula a partir de las lecturas de TVP y se pueden clasificar en 3 intervalos de tiempo, P: intervalo que comienza y termina con 0 TVP, F: intervalo con el flujo hacia delante y H: intervalo a partir de 0 TVP y terminando con 0 flujo. Máximo TVP es la magradiente de presión ximo registró a través de la válvula de la aorta y las lecturas de la presión ventricular.
- La velocidad de flujo hacia adelante RMS (Q rms) proporciona una métrica útil para cuantificar la magnitud de la tasa de flujo de avance de la siguiente manera:

Donde "n" es el número total de puntos de tiempo recogido, 'Q i' es la medición del caudal instantáneo recogido para 'i'. - El volumen de la aorta hacia adelante, de cierre y las fugas se calculan sobre la base de los siguientes intervalos de tiempo, Delantero: comienzo de flujo de avance a través de la válvula (t o), hasta el final del flujo de avance (T 1); de cierre: a partir de t 1 hasta la instancia de la válvula de cierre (2 t); fuga: a partir de t 2 hasta el final del ciclo cardíaco (t 3). Volumen total de regurgitación es simplemente la suma de closING y volúmenes de fuga.
- La EOA basado en las propiedades de sangre puede ser calculado para los 3 intervalos, P, F y H de la TVP media durante cada uno de estos períodos como 20:
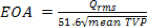
- Las pérdidas de energía se definen de la siguiente manera 21:
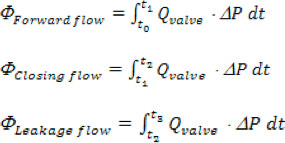
- Para cada válvula de prueba, los siguientes parámetros hidrodinámicos deben calcularse: a) Caída de presión y flujo de la presión máxima transvalvular (TVP), b) la raíz aórtica media cuadrática caudal hacia adelante (RMS), c) flujo delantero aórtica, cierre, fugas y el volumen total de regurgitación, d) área de la válvula final orificio (EOA), e) transaórtico flujo delantero, cierre, las fugas y las pérdidas totales de energía.
Resultados
Representante de flujo y formas de onda de presión se muestran en las Figuras 3, 4 y 5. Las parcelas se promediaron sobre el tamaño de la muestra de válvulas probadas para cada grupo, que era, n = 5, 4, y 2 válvulas de polímero, porcina nativa y grupos bi-valva, respectivamente. Las mediciones hidrodinámicas medias y el error estándar de la media para estos tamaños de muestra se presentan en la Tabla 1.
Discusión
En este estudio, hemos demostrado la utilidad de la modificación de una unidad duplicadora pulsátil disponible en el mercado para dar cabida a las geometrías de la válvula tri-folleto por lo que las pruebas hidrodinámico de polímero y válvulas porcinas nativas se puede realizar. Concretamente, en nuestro caso, el sistema modificado era un corazón izquierdo ViVitro y sistema simulador sistémica (Figura 1a), controlada a través del sistema de adquisición de datos ViViTest (ViVitro Systems, Inc,...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Una subvención de semillas de la Universidad de Florida - Facultad de Medicina se agradece. Estudios de Postgrado (Manuel Salinas) fueron apoyados a través de una oportunidad de minorías en los programas de investigación biomédica - Iniciativa de Investigación para la mejora científica (SAM-RISE) beca: NIH / NIGMS R25 GM061347. El apoyo financiero de la Fundación Wallace H. Coulter por la Florida International University de, Departamento de Ingeniería Biomédica también se agradece. Por último, los autores agradecen a los siguientes estudiantes por su asistencia durante las diversas etapas del proceso experimental: Kamau Pier, Malaquías Suttle, Kendall Armstrong y Abraham Alfonso.
Materiales
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
Referencias
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados