Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Derivado de la evolución temporal de la Liquidación glutamato con un análisis de deconvolución de Corrientes Transporter astrocíticos
En este artículo
Resumen
Se describe un método analítico para estimar la vida útil de glutamato en las membranas de los astrocitos a partir de grabaciones electrofisiológicas de las corrientes de transportador de glutamato en astrocitos.
Resumen
La mayor densidad de transportadores de glutamato en el cerebro se encuentra en astrocitos. Transportadores de glutamato par el movimiento de glutamato a través de la membrana con el co-transporte de Na + y 3 1 H + y el contador-transporte de K + 1. La corriente estequiométrica generada por el proceso de transporte se puede controlar con su conjunto de células patch-clamp grabaciones de astrocitos. El curso temporal de la corriente registrada está conformado por el transcurso de tiempo del perfil de glutamato concentración a la que están expuestos los astrocitos, la cinética de los transportadores de glutamato, y las propiedades electrotonic pasivos de membranas astrocíticos. Aquí se describen los métodos experimentales y analíticos que se pueden utilizar para registrar las corrientes transportador de glutamato en los astrocitos y aislar el curso del tiempo de aclaramiento de glutamato de todos los otros factores que dan forma a la forma de onda de las corrientes transportador astrocíticos. Los métodos descritos aquí pueden ser utilizados para estimar la vida útil of flash uncaged y glutamato liberado sinápticamente en membranas astrocíticos en cualquier región del sistema nervioso central durante la salud y la enfermedad.
Introducción
Los astrocitos son uno de los tipos de células más abundantes en el cerebro con morfología en forma de estrella y salientes de membrana fina que se extienden a lo largo de la neuropilo y llegan a la vecina contactos sináptica 1,2. Membrana celular Los astrocitos está densamente llena de moléculas transportadoras de glutamato 3. En condiciones fisiológicas, los transportadores de glutamato se unen rápidamente glutamato en el lado extracelular de la membrana y lo transfieren al citoplasma de la célula. Al hacerlo, los transportadores mantienen baja la concentración basal de glutamato en el espacio extracelular 4. Transportadores de glutamato en los procesos astrocíticos finas adyacentes a las sinapsis excitatoria están en una posición ideal para unirse glutamato liberado durante los eventos sinápticas como se difunde lejos de la hendidura sináptica. Al hacer esto, los transportadores de glutamato también limitan desbordamiento hacia peri-y extra-regiones sinápticas y en las sinapsis vecinas, la reducción de la propagación espacial de la señal excitadoras en el cerebro 5-7.
Transporte de glutamato es un proceso de electrogénico estequiométricamente acoplado al movimiento de 3 Na + y 1 + H a lo largo de su gradiente electroquímico y para la lucha contra el transporte de K + 8 1. Transporte de glutamato se asocia con (pero no junto estequiométricamente a) la conductancia aniónico permeable a SCN - (tiocianato)> NO 3 - (nitrato) ≈ ClO 4 - (perclorato)> I -> Br -> Cl -> F -, no a CH 3 SO 3 - (metano sulfonato) y C 6 H 11 O 7 - (gluconato) 9-11. Ambas corrientes (estequiométricas y no estequiométricas) se pueden grabar mediante la obtención de patch-clamp grabaciones de células enteras a partir de astrocitos, que se identifican visualmente bajo Dodt iluminación o diferencial de infrarrojos contraste de interferencia (IR-DIC) en acute rodajas de cerebro 12. El componente estequiométrica de la corriente asociada con el transporte de glutamato a través de la membrana se puede aislar mediante el uso de CH 3 SO 3 -, o C 6 H 11 O 7 - intracelulares basados en soluciones y puede ser evocada por el glutamato flash uncaging en astrocitos 13,14, o mediante la activación de la liberación de glutamato de las sinapsis vecinas, ya sea eléctricamente 12 o con un control optogenético específica.
El curso temporal de la componente de la corriente estequiométrica de transportador está formada por el curso de la vida del perfil de la concentración de glutamato en las membranas astrocíticos (por ejemplo, aclaramiento glutamato), la cinética de los transportadores de glutamato, las propiedades de la membrana pasivos de los astrocitos, y durante estimulaciones sinápticas, por la sincronía de la liberación de glutamato en las sinapsis activadas 13. A continuación se describe con todo detalle: (1) una ca experimentaloach para aislar el componente estequiométrica de corrientes de transportador de glutamato de su conjunto de células patch-clamp grabaciones de astrocitos utilizando rodajas de hipocampo de ratón agudos como una preparación experimental ejemplo; (2) un enfoque analítico para derivar el curso del tiempo de aclaramiento de glutamato de estas grabaciones 13, 14. Estos métodos se pueden utilizar para registrar y analizar las corrientes de transportador de glutamato a partir de astrocitos en cualquier región del sistema nervioso central.
Protocolo
1. Preparación Slice
- Preparar 500 ml de solución de corte / de almacenamiento que contiene (en mM): 119 NaCl, 2,5 KCl, 0,5 de CaCl 2, 1,3 MgSO4 · 7 H2O, 4 de MgCl 2, 26,2 NaHCO3, 1 NaH 2 PO 4, y 22 de glucosa, 320 mOsm, pH 7,4
- Use un vaso de 250 ml para preparar una cámara de inmersión de los cortes, llénelo con 200 ml de solución de rebanar / almacenamiento, caliente en un baño de agua a 34 ° C y la burbuja con 95% O 2, 5% de CO 2.
- Mantenga la solución restante rebanar / almacenamiento en una botella de vidrio a 4 ° C.
- Utilice un adhesivo de cianoacrilato para fijar un pequeño bloque de agar (6%, preparado en ACSF) en el soporte de la muestra vibratome y almacenar a 4 ° C.
- 30 min antes de comenzar corte, coloque la botella de cristal que contiene la solución de almacenamiento / corte en un cubo lleno de hielo y de la burbuja con 95% O 2, 5% de CO 2.
Nota: La velocidad y la precisión son de suma importancia para las etapas de disección se describen a continuación.
- Se anestesia el ratón (P14-21, C57BL / 6) con halotano / isoflurano (isoflurano se ha informado a mejorar la captación de glutamato astrocítico 15), decapitar a ella, y sumergir la cabeza en un vaso de precipitados de 50 ml que contiene la solución oxigenada, frío rebanar / almacenamiento.
- Lleve a cabo la disección del cerebro en una bolsa de hielo envuelta en toallas de papel y se almacenan a -20 ° C.
- Utilice un bisturí para realizar una incisión en la piel sagital media en el lado dorsal de la cabeza, desde el frontal al extremo caudal, y exponer el cráneo.
- Coloque la cuchilla de corte inferior de un pequeño par de tijeras quirúrgicas en el agujero occipital y hacer dos cortes, hacia la izquierda y en el lado derecho (45 °).
- Cortar el cráneo a lo largo de la línea media sagital, desde el extremo caudal a la frontal.
- Retire el cerebro con una espátula y lo mojará en oxigenado, frío soluti rebanar / almacenamientoen.
- Con un bisturí, hacer cinco cortes a: (1) eliminar los bulbos olfatorios y la corteza frontal, (2) eliminar el cerebelo, y (3) eliminar la izquierda (4) lóbulos temporales adecuados; (5) separar los dos hemisferios cerebrales con un corte sagital medio.
- Frote las dos partes del cerebro con toallas de papel para eliminar cualquier exceso de solución.
- Pegamento la superficie lateral de cada sección del cerebro a la placa de base vibratome frío: el lado dorsal del cerebro debe estar orientada hacia la hoja vibratome; el lado ventral del cerebro debe estar en contacto con el bloque de agar, lejos de la hoja vibratomo.
Nota: para obtener las rodajas de la más alta calidad, es importante que las dos partes del cerebro están firmemente pegados a la placa de base vibratomo. Para ello, utilice un adhesivo de cianoacrilato que no es demasiado líquido y que no se seque demasiado rápido. - Fije la placa base vibratome a la cámara de disección, coloque el trozo ªickness a 250 micras y ajustar el ancho de la carrera de la cuchilla. Proceder a cortar.
Nota: si todo está orientado correctamente, el vibratome debería estar cortando rebanadas parasagital de la dorsal hacia la parte ventral y medial de la hacia el lado lateral del cerebro. - Una vez que la hoja ha pasado a través de la corteza y el hipocampo, el uso de un bisturí para cortar la corteza / hipocampo del cerebro medio y colocar cada rebanada en la cámara de inmersión a 34 ° C.
- Deseche el primer par de rebanadas. Típicamente, 12 rebanadas (250 m de espesor) pueden obtenerse a partir de un cerebro de ratón P14-21.
- Mantenga los cortes a 34 ° C durante 30 minutos y dejar enfriar a temperatura ambiente durante 30 minutos antes de su uso para las grabaciones de electrofisiología.
2. Identificación y grabaciones Astrocyte
- Preparar una solución interna que contiene (en mM): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0.2 NaGTP,5 QX-314Br, y 5 NaCl, 290 mOsm, pH 7,2.
- Preparar una solución extracelular de grabación que contiene (en mM): 119 NaCl, 2,5 KCl, 2,5 de CaCl 2, 1,3 MgSO4 · 7H 2 O, 1 MgCl 2, 26,2 NaHCO3, 1 NaHPO 4, y 22 de glucosa, 300 mOsm, pH 7,4 , saturado con 95% O 2, 5% de CO 2.
- Añadir los siguientes medicamentos para la solución de registro extracelular, para bloquear la activación de GluA, GLUN, mGluRII, mGluRIII, GABA A, GABA B, y los receptores de adenosina A1 (en mM): 10 2,3-dioxo-6-nitro-1, 2,3,4-tetrahidrobenzo [ƒ] sal disódica de quinoxalina-7-sulfonamida (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-il)-propil-1-fosfónico (CPP), (2S )-2-amino-2-[(1S, 2S)-2-carboxycycloprop-1-il] -3 - (Xanth-9-il) propanoico sal disódica del ácido (LY341495), 100 (R, S)-α- metilserina-O-fosfato (SOIC), 100 picrotoxina, 5 3 - [[(3,4-diclorofenil) metil] amino] propil] dietoximetil) fosfínico (CGP52432), 18-ciclopentil-1 ,3-dipropilxantina (DPCPX).
- Establecer la temperatura de la solución extracelular en la cámara de grabación; temperaturas típicas son entre 34 a 36 ° C.
- Prepare electrodos de patch-clamp de borosilicato capilares de vidrio (R ≈ 2,5 mW) con una doble etapa, vidrio micropipeta extractor.
- Tome una de las rodajas y colocarla en la cámara de grabación. Manténgalo presionado con un arpa metálica hecha con alambre de platino y cuerdas de nylon.
- Inspeccione visualmente los cortes menores Dodt iluminación o IR-DIC. Los astrocitos pueden ser identificados por su cuerpo de células pequeñas (Ø = 10 micras) y núcleo prominente (Figura 1).
- Para estimulaciones sinápticas, coloque un electrodo bipolar de acero inoxidable, ~ 100 m de distancia del astrocito que va a arreglar.
- Parche del astrocito y romper en la configuración de célula completa mediante la aplicación de una aspiración muy suave.
Nota: Los astrocitos típicamente tienen una baja resistanc entradae (~ 10 mW), el potencial de membrana en reposo hiperpolarizado (~ -90 mV), y ninguna actividad de tiro. Los astrocitos son mantenidos en su potencial de membrana en reposo durante los experimentos en el modo de fijación de voltaje (es decir, la corriente de mantenimiento debe leer 0 pA). Antes de cada estimulación, una hiperpolarización de 10 ms escalón de tensión (-3 mV) se utiliza para monitorizar la serie y la resistencia de entrada del astrocito. - Deseche las grabaciones si los cambios en la resistencia serie> 20% o si el potencial de membrana del astrocito se despolariza. El potencial de membrana de la astrocitos se puede medir directamente por el cambio de voltaje-clamp a modo de corriente-abrazadera. Alternativamente, mientras que en el modo de fijación de voltaje, el potencial de membrana se puede controlar mediante la lectura del valor del potencial de mantenimiento que resulta en 0 pA de corriente de mantenimiento.
- Si se emplean estímulos sinápticas, estímulos alternos individuales y parejas (por ejemplo, 100 milisegundos de diferencia), cada 10 a 20 seg.
- Para experim fotólisis UVpadres, conectan una lámpara de Xe uncaging al puerto de epifluorescencia del microscopio y añadir el compuesto enjaulado a la solución extracelular. Transporter corrientes de ~ 100 pA amplitud se puede conseguir cuando el flash-uncaging 100 mM MNI-L-glutamato en todo el campo de visión (Ø = 662,5 micras cuando se utiliza un objetivo de 40X 14). Estímulos alternos con la trayectoria de la luz abierta y bloqueada, cada 10-20 seg.
- Evoke transitorios de glutamato y corrientes transportador de registro en las condiciones de control y en presencia de una concentración sub-saturación del transportador de glutamato antagonista de D, L-treo-β-Benzyloxyaspartic ácido de amplio espectro (TBOA; 10 mM) para reducir la amplitud de la corriente transportador a por lo menos 30% de su valor de control (véanse las secciones 4, 5) o en la presencia de una alta concentración de TBOA (50 - 100 micras) para bloquear corrientes transportador completamente y aislar el K +-sostenida actual (véase la sección 3) .
3. PharmacAislamiento gico del K + sostenida corriente
- Registrar las corrientes astrocíticos en condiciones de control y en presencia de una concentración alta, saturando de TBOA (50 - 100 micras).
- Promedio de al menos 20 barridos en TBOA (50 - 100 micras).
- Coloque las huellas promedio obtenidos en 3.2 con la función:
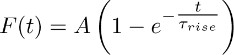
Nota: el componente TBOA insensible (es decir, la que se registra en la presencia de TBOA (50 - 100 micras)) representa el K +-sostenida actual. Su evolución en el tiempo es aproximado por la función mono-exponencial descrito anteriormente. - Repita este ajuste a través de diferentes astrocitos y obtener un valor promedio de Τ lugar (es decir, el tiempo medio de subida de la constante K +-actual (véase la sección 5)).
4. Yosolation de la parte Facilitado de Corrientes Transporter sinápticamente Activadas (fSTCs)
- Promedio de al menos 20 barridos obtenidos con estímulos vinculados, en condiciones de control y en TBOA (10 M) (Figura 2a izquierda).
- Promedio de un número idéntico de barridos obtenidos con estímulos individuales, en las condiciones de control y en TBOA (10 M) (Figura 2a medio).
- Comparar la amplitud de la respuesta de la corriente media a la tensión de paso -3 mV en las cuatro trazas promediados (control de impulso único, el control emparejado-pulsos, TBOA solo pulso, TBOA emparejado-pulsos).
- Si la amplitud de la respuesta de la corriente es la misma en los cuatro rastros, vaya al paso 4.7.
- Si la amplitud de la respuesta de la corriente media es diferente en cualquiera de las cuatro trazas, comprobar que todas las trazas individuales eran apropiados para ser incluidos en la media.
- Si la amplitud de la corriente media es diferente en cualquiera de las cuatro trazas, pero en todotrazas individuales son apropiadas para ser incluidas en el promedio, verificar que en cada traza el tamaño de las escalas FSTC linealmente con el tamaño de la respuesta de la corriente a la etapa de tensión de prueba. Si este es el caso, escalar todas las trazas con respecto a la otra de manera que las respuestas de corriente a la etapa de tensión de prueba son todos iguales en amplitud.
Nota: En las condiciones de grabación se describe aquí (es decir intracelular CH 3 SO 3 - o C 6 H 11 O 7 -), estimulaciones sinápticas de los axones excitatorios generan corrientes de los astrocitos con formas de onda complejas que consisten en un aumento rápido de corriente estequiométrica interna transitoria y una lenta -aumento, sostenido K + hacia el interior de corriente que refleja K + re-equilibrio en el espacio extracelular después de la acción potencial de propagación a lo largo de los axones vecinos. Es crítico para eliminar este K +-sostenida actual, como cualquier corriente residual conduciría a unasobreestimación de vida glutamato. - Reste la traza media obtenida con estímulos individuales de la traza media obtenida con estímulos emparejados (Figura 2a derecha). Este paso permite el aislamiento de la estequiométrica y el K +-sostenida de corriente provocada por el segundo estímulo.
- Desplazar la traza media obtenida con estímulos individuales por un intervalo de tiempo que coincide con el intervalo entre pulsos utilizado para entregar dos a dos pulsos (es decir, 100 mseg) (Figura 2b).
- Reste el tiempo pasado-respuesta media obtenida con estímulos individuales de la respuesta promedio para el segundo estímulo obtenido en 4.7 (Figura 2c). Este paso aísla la parte facilitado de la corriente evocada por el transportador segundo estímulo (el FSTC).
- En la mayoría de los casos, el paso anterior elimina por completo el K +-sostenida actual. Si este es el caso, el aislamiento de la FSTC es completa y se puede Procéed con el análisis de deconvolución y derivar la evolución en el tiempo del despacho de glutamato a partir de astrocitos. En algunos casos, sin embargo, un pequeño sostenido K +-actual está todavía presente (Figura 2d) y se requiere un análisis más detallado (véase la sección 5).
Nota: recuerde que el análisis descrito en 04.07 a 04.10 se debe realizar en las huellas medios obtenidos en las condiciones de control y en TBOA (10 M).
5. La resta de la K zdustained Residual + corriente de fSTCs
- Medir la amplitud de la constante K + corrientes que queda después de la realización del análisis se describe en la sección 4.
- Escala de la amplitud de la función mono-exponencial se describe en 3.3 a la amplitud de la K +-residual sostenida corriente medida en 5.1 (Figura 2d izquierda y centro). Para ello, en la ecuación 3.3, defina el término A es igual a la amplitud de la constante K +-corriente measured en 5,1 y el término Τ aumento es igual al valor promedio de Τ aumento estimado en 3,4.
- Restar la función mono-exponencial resultante de la K FSTC y sostenido +-corriente obtenida en 4,10 (Figura 2d derecha). Este paso completa el aislamiento de la FSTC.
6. Aislamiento de Corrientes Transporter Flash activados (FTC)
- Promedio de al menos 20 barridos obtenidos con el paso de luz libre, en condiciones de control y en TBOA (10 M).
- Promedio de un número idéntico de barridos obtenida con la trayectoria de la luz cerrada, en condiciones de control y en TBOA (10 mM).
- Comparar la amplitud de la respuesta de la corriente a la tensión de paso -3 mV en las cuatro trazas promediados (control de impulso único, el control emparejado-pulsos, TBOA solo pulso, TBOA emparejado-pulsos).
- Si la amplitud de la respuesta de la corriente es la misma en los cuatro rastros, vaya al paso 6.7.
- Si la amplitud de la respuesta de la corriente media es diferente en cualquiera de las cuatro trazas, comprobar que todas las trazas individuales eran apropiados para ser incluidos en la media.
- Si la amplitud de la corriente media es diferente en cualquiera de las cuatro trazas, pero todos los restos individuales son apropiadas para ser incluidas en el promedio, verificar que en cada traza con la trayectoria de la luz abrir el tamaño de la FTC escalas linealmente con el tamaño de los la respuesta de la corriente a la etapa de tensión de prueba. Si este es el caso, escalar todas las trazas con respecto a la otra de manera que las respuestas de corriente a la etapa de tensión de prueba son todos iguales en amplitud.
Nota: en las condiciones de grabación se describe aquí (es decir intracelular CH 3 SO 3 - o C 6 H 11 O 7 -), los estímulos de flash generan corrientes astrocytic consistentes únicamente en el rápido aumento transitorio estequiométrica corriente de entrada. - Reste la traza media obtenida con el pat luzh bloqueado de la traza media obtenida con el haz de luz libre. Este paso permite la eliminación del estímulo artefacto y el aislamiento de las FTC.
Nota: el análisis descrito en 6.7 se debe realizar en las huellas medios obtenidos en las condiciones de control y en TBOA (10 mM).
7. Análisis de deconvolución
- Ajustar la corriente transportador (FSTC o FTC), registrados en las condiciones de control (Figura 3a a la izquierda) y en TBOA (10 M) (Figura 3a a la derecha) y aislado como se describe en las secciones 4 - 6, con la función multi-exponencial:

- Crear una función instantáneamente ascendente que decae exponencialmente mono-según la función:
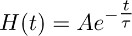
yque describe mejor la fase de descomposición de la corriente registrada en TBOA transportador (10 M) (Figura 3b).
Nota: la función descrita en 7.2 (es decir, H (t)) representa la evolución en el tiempo del despacho de glutamato a partir de astrocitos en la presencia de TBOA (10 mM). - Deconvoluir la función mono-exponencial obtenido en 7.2 (Figura 3b y 3c medio) a partir del ajuste de la corriente registrada en TBOA transportador (10 mM) obtenida en 7.1 (Figura 3a derecha, izquierda c).
Nota: deconvolución es una operación matemática incluido en muchos paquetes de software de análisis como (por ejemplo, Matlab, Python). En IgorPro, el código de programación que usamos normalmente para llevar a cabo este tipo de análisis, la operación de deconvolución se puede calcular eficientemente como se describe a continuación, mediante el uso de rápida de Fourier discreto transforma. En primer lugar, utilice la operación FFT para calcular el discrete transformada rápida de Fourier de la función de mono-exponencial obtenido en 7.2 y del ajuste de la corriente transportador registrada en TBOA obtenido en 7.1. A continuación, utilizar la operación de IFFT para calcular la inversa discreta transformada rápida de Fourier de la relación de las dos funciones de FFT. La función I resultante (t) puede ser descrito de la siguiente manera: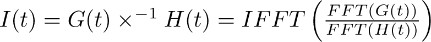
El paso se describe en 7.3 permite derivar el filtro de la corriente en el transportador de TBOA (10 M) (Figura 3c derecha). El filtro representa los factores de distorsión que convierten la vida útil de glutamato en las membranas astrocíticos en la corriente transportador aislado en secciones de 4 - 6 (es decir, el FSTC o FTC). - Deconvoluir el filtro (Figura 3c derecho, Figura 3d medio) a partir del ajuste de la corriente de transportador en condiciones de control (Figura 3a a la izquierda, la figura 3d izquierda).
Nota: este paso permite derivar la evolución en el tiempo del despacho de glutamato a partir de astrocitos en condiciones de control (Figura 3d derecha). La suposición subyacente en este paso deconvolución es que el perfil temporal del filtro se mantiene inalterada en condiciones de control y en TBOA (10 mM). - Para obtener una estimación cuantitativa del curso general momento del despacho de glutamato, calcular el centroide () de la forma de onda obtenida en el paso 7.4. Esto se hace mediante el cálculo de como:
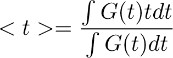
donde G (t) es la forma de onda obtenida en la etapa 7.1. En la ecuación se ha descrito anteriormente, el término t corresponde a la ventana de tiempo durante el cual se calcula la integral.
Nota: cuando se estableció por primera vez el método, se calculó sobre ventanas de tiempo que se quedaron sin restricciones 13. Este enfoque puede ser utilizado siempre y cuando la ventana de integración se establece para ser mayor que la duración de despacho de glutamato y el aclaramiento se desintegra de forma de onda completamente a la línea base. Si este no es el caso, sin embargo, este método de estimación de se encuentra con algunas limitaciones. Por ejemplo, si la forma de onda aclaramiento no decae exactamente a la línea base, a continuación, aumenta con la anchura de la ventana de integración. Para evitar cualquier posible fuente de inexactitud para la estimación de , que ahora calculamos sobre una ventana de tiempo correspondiente al 10% del pico de la corriente transportador, antes y después de su inicio 14. El último enfoque mejora la consistencia con la que se mide a través de las células. Esto es muy útil sobre todo en el análisis de pequeños efectos de los tratamientos farmacológicos en el curso del tiempo de despacho.
Resultados
El éxito del enfoque analítico descrito aquí depende de manera crítica en la obtención de los registros electrofisiológicos de alta calidad de las corrientes de transportador a partir de astrocitos en cualquier región del sistema nervioso central. En cortes de hipocampo agudos ratón, los astrocitos pueden ser fácilmente identificados bajo Dodt iluminación o IR-DIC debido a su cuerpo de células pequeñas (Ø = 10 micras) y núcleo prominente (Figura 1). Su morfología distintiva en forma de es...
Discusión
Aquí se describe un enfoque experimental para obtener los registros electrofisiológicos a partir de astrocitos, un protocolo de análisis para aislar corrientes transportador de glutamato en los astrocitos y un método matemático para derivar el curso del tiempo de aclaramiento de glutamato de las corrientes transportador astrocíticos.
El éxito del análisis se basa en la capacidad de obtener alta calidad patch clamp grabaciones a partir de astrocitos y en la exactitud de los algoritmos...
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Trastornos Neurológicos y Programa de Investigación Intramural Stroke (NS002986). Como escribió el manuscrito y aplicado el análisis de deconvolución. JSD desarrolló la primera versión del análisis de deconvolución y comentarios sobre el texto.
Materiales
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Referencias
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados