Method Article
Un modelo murino de cáncer de próstata humano Metástasis ortotópico
En este artículo
Resumen
Este modelo ortotópico de cáncer de próstata humano permite la cuantificación del tamaño del tumor, las células tumorales circulantes, y formación de distinta metástasis al pulmón. Como las células deben escapar del órgano principal, entrar en el torrente sanguíneo, y se implanta en un sitio secundario, este modelo recapitula efectivamente el escenario en los seres humanos.
Resumen
Nuestro laboratorio ha desarrollado un nuevo modelo de implantación ortotópico de cáncer de próstata humana (PCA). Como la muerte CaP no es debido al tumor primario, sino más bien la formación de distinta metástasis, la capacidad de modelar eficazmente esta progresión pre-clínicamente es de alto valor. En este modelo, las células se implantan directamente en el lóbulo ventral de la próstata en ratones BALB / c atímicos ratones, y dejó progresar durante 4-6 semanas. A la terminación experimento, varios puntos finales distintos pueden ser medidos, tales como el tamaño y la caracterización molecular del tumor primario, la presencia y cuantificación de células tumorales circulantes en la sangre y la médula ósea, y la formación de metástasis en el pulmón. Además de una variedad de puntos finales, este modelo proporciona una imagen de una capacidad de las células para invadir y escapar del órgano primario, entrar y sobrevivir en el sistema circulatorio, y el implante y crecer en un sitio secundario. Este modelo se ha utilizado eficazmente para medir metastásicorespuesta tanto a cambios en la expresión de proteínas, así como a la respuesta a terapias de moléculas pequeñas, en un tiempo de respuesta corto.
Introducción
El cáncer de próstata (CaP) es el cáncer más comúnmente diagnosticado en hombres y la segunda causa principal de muerte por cáncer en los Estados Unidos 1. La muerte por CaP no es debido a la formación del tumor primario, sino más bien la formación de metástasis. Por lo tanto, la prevención de la metástasis en pacientes es de gran importancia. Los modelos de ratón de CaP ofrecen una diversidad de opciones para descubrir información biológica crítica acerca de esta enfermedad.
Una gran variedad de modelos de ratón de CaP existe, cada uno con ventajas y limitaciones inherentes. Si bien la frecuencia de CaP en humanos es alta, de origen natural CaP es extremadamente raro en los ratones 2, a pesar de la igualdad de la susceptibilidad de los ratones con el cáncer en general 3. Una excepción de roedores es el desarrollo del CaP en ratas Wistar Lobund, que puede alcanzar velocidades de CaP de 90% a los 12 meses de edad a través de la inducción de metilnitrosourea y testosterona 4. Por esta razón, inducida por los sistemas modelo, como el vagabundo(Adenocarcinoma transgénico del ratón próstata) modelo se utilizan comúnmente. El modelo TRAMP puede inducir la expresión del transgén específicamente en la próstata, y se somete a la progresión normal de CaP, de la hiperplasia a la neoplasia intraepitelial prostática (PIN) para linfático y la metástasis pulmonar 5-6. Estos modelos proporcionan los beneficios de ser capaz de medir la gama completa de la progresión del tumor, así como contener un sistema inmune intacto. Sin embargo, los eventos moleculares subyacentes desarrollo CaP pueden diferir entre ratones y seres humanos, y las correlaciones entre los ratones y los estudios clínicos en humanos han demostrado la variabilidad. Además, tanto de estos modelos son mucho tiempo, como un ejemplo, el modelo TRAMP requiere aproximadamente 28 semanas con el fin de desarrollar metástasis.
En el estudio de la metástasis, se utiliza con frecuencia un modelo de inyección del ventrículo cola-vena o izquierda. Este modelo se beneficia de tiempo de respuesta rápido, y se puede medir, además, la presencia de metastas óseases el uso de líneas y condiciones específicos de células. Yang et al. Han informado de que la inyección subcutánea de células PC3 GFP-positivas pueden causar ampliamente diseminada metástasis ósea 7, y vena de la cola y las inyecciones intercardiac también han generado el desarrollo de metástasis ósea 8-9. Las principales limitaciones de estos modelos se refieren a la falta de un tumor primario que reside dentro de la propia glándula prostática. Además, para los modelos Reliant después de la inyección de las células cancerosas en la circulación, este pasa por toda la primera mitad de la cascada metastásica. Es por lo tanto impide el examen de pasos iniciales, incluyendo la invasión a través del órgano principal, que son biológicamente medidas cruciales de transformación metastásica. Muchos reguladores de transformación metastásico afectan directamente a la invasión celular temprana. Los primeros pasos en la cascada metastásica constituyen sitios de alta prioridad para el enfoque terapéutico, ya que una vez las células cancerosas difundir, la variación clonal amplía en gran medida, lo que aumenta biológicaal disminuir la diversidad y la orientación terapéutica eficaz.
En un intento de responder a muchas de las limitaciones de estos modelos, nuestro laboratorio ha desarrollado un modelo ortotópico de CaP humana en la que la línea celular de CaP PC3-M humana se implanta directamente en la próstata de ratones BALB / c atímicos ratones. Después de 4-6 semanas, el tamaño del tumor, la presencia de células tumorales circulantes (CTC), y metástasis a los pulmones y ganglios linfáticos pueden ser cuantificados. Hemos utilizado de manera efectiva este modelo para evaluar la eficacia de 4 ',5,7-trihidroxiisoflavona (genisteína) para inhibir la metástasis CaP humana 10. El consumo dietético de la genisteína se ha relacionado con la disminución de la metástasis del cáncer de próstata y la muerte 11-12, pero previamente ningún estudio había determinado si la administración de genisteína podría alterar CaP metástasis en animales u hombres. En este estudio hemos demostrado que el tratamiento con genisteína reduce en gran medida el número de metástasis de pulmón. Además, se determinó la genisteína altered la activación y expresión de varias proteínas pro-metastásicos importantes en el tumor primario, incluyendo quinasa de adhesión focal (FAK), p38 mitogen-activated proteína quinasa (MAPK p38), y proteína de choque térmico 27 (HSP27).
Estos resultados se corresponden con lo observado en la clínica. El uso de la sangre obtenida de los ratones, hemos sido capaces de medir con precisión las concentraciones en sangre de genisteína y observamos que estos son similares a los niveles en los seres humanos con la dieta el consumo regular de la genisteína. Además, un estudio de fase II realizado por nuestro grupo determinó que tras el tratamiento con genisteína, los hombres experimentan disminuciones en ARNm de próstata tejido expresión de genes asociados con la invasión celular y la metástasis, la matriz específicamente metaloproteinasa de tipo 2 (MMP-2) 13.
También hemos utilizado este modelo para evaluar el efecto de la expresión de genes alterados-producto en el tumor primario en la metástasis CaP humana 14. El suppr tumorendoglina essor es un miembro de la superfamilia de TGF y suprime la invasión celular humana CaP in vitro a través de la alteración de la señalización de Smad 15. Hemos ampliado estos estudios para determinar el efecto de la endoglina sobre la metástasis CaP humana. Knockdown endoglina estable, el control de vectores o endoglina sobre líneas celulares de expresión fueron implantados en ratones. Desmontables células endoglina mostraron el mayor número de metástasis de pulmón, así como las CTC en 38% de los ratones. Los ratones implantados con el control de vectores mostraron una respuesta media, con menos metástasis pulmonar por ratón, y CTC en sólo el 18% de los ratones. Los ratones de alta endoglina implantados mostraron supresión casi completa de la metástasis de pulmón, y la supresión completa de los CTC.
Estos son sólo dos ejemplos de la gran variedad de aplicaciones de esta técnica tiene. Desde el descubrimiento de fármacos, a los cambios de modelado en la biología molecular, este modelo ofrece un método de alto rendimiento de la evaluación de los efectos de las diversas funciones en el crecimiento del tumor y el topocambios cular, la presencia de CTC, y la formación de metástasis en los distintos nodos de pulmón y los ganglios.
Protocolo
Para todos los procedimientos con animales, los protocolos fueron aprobados por el Cuidado de Animales y el empleo Comisión Institucional (IACUC) de la Universidad Northwestern. Las técnicas quirúrgicas y las condiciones de cuidado de los animales fueron observados por el personal veterinario y modificar para minimizar el estrés de los animales o la mortalidad. Las instituciones individuales pueden tener requisitos diferentes y es importante trabajar con IACUC y animal del personal en el desarrollo y ejecución de esta técnica quirúrgica.
1. Preparación de las células para inyección
- Este paso se debe realizar lo más cerca posible a partir cirugías. Trypsinize células que se utilizan para el experimento, retirar del plato, y neutralizan con los medios de comunicación. La línea celular PC3-M humana CaP establemente transfectadas con GFP ha sido utilizado con éxito para estos experimentos, debido a las condiciones de crecimiento rápido de las células PC3-M. GFP se añadió para la facilidad adicional de detección de la metástasis de pulmón en muestras de tejido pulmonar, y la determinación rápida decélulas de cáncer frente a las células inmunes en cultivos obtenidos a partir de sangre y la médula ósea para identificar células tumorales circulantes. Si la modificación de un gen específico de interés, a continuación, la creación de líneas celulares estables con esta alteración del gen se lleva a cabo primero, seguida de la transfección con GFP. Si GFP va a alterar la función de este gen de interés, GFP puede ser omitido. Esto hará que la detección de metástasis de pulmón más difícil, pero todavía alcanzable. Además, si se utiliza tecnología de imagen específica el uso de marcadores fluorescentes, tales como basado en la luciferasa de IVIS, otras proteínas fluorescentes se pueden utilizar en su lugar.
- Centrifugar durante 5 min a 225 x g.
- Aislar 2.5 x 10 5 células, y centrifugar durante 5 minutos a 225 x g.
- Aspirar el sobrenadante y volver a suspender las células en 20 l de solución salina estéril.
- Aspirar suspensión de células en una jeringa de 0,5 ml con un permanente 28 ½ aguja de calibre (recomendado: Kendall monojet, ya que otras marcas han causado problemas), lo que garantiza no entre aire en la aguja alOng con la suspensión.
- Envolver la jeringa en papel de aluminio estéril y almacenar en hielo hasta su uso.
2. Implantación ortotópico de células de cáncer de próstata humano
- Se utilizan 6-8 semanas de edad Balb / c atímicos ratones machos. El peso corporal de ratón ideal para la cirugía es 19-21 g, y los ratones se debe permitir que crezca a por lo menos 18 g antes de la cirugía. Los animales más pequeños son técnicamente más difíciles de operar. Los animales más grandes tienden a experimentar más lenta cinética del crecimiento tumoral y la metástasis. Los animales deben ser alojados en las instalaciones de animales al menos una semana antes de la cirugía para minimizar el estrés de los animales. Dependiendo del diseño experimental, el tratamiento farmacológico puede comenzar una semana antes de la cirugía.
- Inyectar medicamentos para el dolor antes de la cirugía de acuerdo a las instrucciones del animalario. 0,1 mg / kg de peso corporal subcutánea Buprenex usando una aguja de 30 ½ T unido a una jeringa de 1 ml se sugiere.
- Coloque los animales en la cámara de isoflurano y esperar hasta los animales son totalmente unnesthetized. No toe reflejo del tono muscular debería estar presente en este punto. Este método se recomienda, pero si no está disponible, otros métodos de anestesia se puede utilizar de acuerdo a las instrucciones del animalario.
- Mueva los animales fuera de la cámara de isoflurano en una campana de procedimiento estéril. Coloca los animales dentro del aparato cono de la nariz, y volver a asegurar que los animales se encuentra bajo anestesia completa antes de proceder.
- Desinfectar región inferior del abdomen con un exfoliante Betadine con bolitas de algodón estériles, limpie con una toallita de alcohol, y final de pulverización con una solución de Betadine. Deje que se seque.
- Utilizando un bisturí estéril o tijeras quirúrgicas estériles afiladas, una incisión abdominal en la línea media baja de aproximadamente 3-4 mm está hecho. Levante suavemente la vejiga usando fórceps e identificar el lóbulo ventral de la próstata. Estos dos lóbulos se encuentran directamente debajo de la vejiga. Algunos ratones tendrán una pequeña capa de grasa que cubre la próstata que se puede mover suavemente a un lado usando un bastoncillo de algodón estéril. Minimizandoe todos los movimientos de los órganos y la musculatura si es posible.
- Inyectar 20 ul volumen de solución de células en la glándula de la próstata, lo que minimiza las fugas y asegurar que se observa una pequeña burbuja.
- Vuelva a colocar la vejiga y cerrar la capa muscular utilizando 4,0 absorbibles suturas monofilamento vicryl en un patrón interrumpido simple.
- Cierre la capa de la piel con grapas estériles 9 mm.
- Retire los animales de la anestesia isoflurano y monitorear hasta despiertos y moviéndose con normalidad. Coloque el cojín de la calefacción durante el período de recuperación.
- Si se realizan múltiples cirugías, entre cirugías, limpiar todas las herramientas con etanol al 70%, y esterilizan utilizando un esterilizador de cuentas de vidrio. Permita que las herramientas que se enfríen completamente antes del próximo animal. No vuelva a usar suturas, bolas de algodón o hisopos estériles.
3. Animales Monitoreo
- Administrar medicamentos para el dolor en base a las instrucciones de instalación para animales. 4 horas después de la cirugía de administración de una dosis de meloxicam subcutánea de 1 mg / kg de peso corporal ucantar una aguja 30 ½ T unido a una jeringa de 1 ml se sugiere, seguido por una dosis adicional cada 12-24 horas para el próximo 48 hr.
- Las grapas se pueden quitar de los animales de 7-10 días después de la cirugía una vez que la herida ha sanado.
- Vigilar el peso del animal, el consumo de alimentos, y palpar los ratones para los tumores dos veces por semana hasta la terminación del experimento. Aumentar la frecuencia de hasta cada dos días, cuando los tumores se vuelven visibles para verificar si hay animales bajo carga tumoral significativa o coacción. La muerte prematura de este modelo es debido a la gran carga tumoral primaria, como los tumores primarios pueden bloquear el flujo de orina, por lo que cualquier animales con una pérdida de más del 15% del peso corporal o un tumor primario alcanzando un diámetro de 1,5 cm debe ser necropsia inmediatamente a evitar la obstrucción urinaria y la muerte de los animales.
- Vigilar la necesidad de enriquecimiento adicional del entorno de los animales. El estrés de la cirugía aumenta las luchas internas de los animales. La adición de dos chozas de plástico por jaula en vez de uno y comportamiento adicionalal enriquecimiento puede disminuir estos incidentes. Discutir con el personal veterinario opciones disponibles en la instalación estén alojados en. Dada la falta de pestañas en esta cepa de ratones, no se recomiendan las chozas y el enriquecimiento de papel, ya que pueden irritar los ojos.
4. Procedimientos de necropsia
- Después de 4-6 semanas, los tumores son totalmente evidentes y los animales comienzan a perder peso debido al aumento de la carga tumoral. Los tumores normalmente se pueden palpar y / o son claramente visibles. La necropsia se debe realizar en este punto. Lleve a cabo una inyección intraperitoneal de Nembutal a 260 mg / kg de peso corporal utilizando una aguja de calibre 30 ½ unida a una jeringa de 1 ml, y permiten a los animales se vuelven totalmente inconsciente, sin reflejo dedo del pie o el tono muscular presente.
- Una vez que el animal es anestesiado, usando tijeras quirúrgicas estériles o un escalpelo, cortar horizontalmente a través del torso del animal directamente debajo de la caja torácica, entonces verticalmente a la axila a lo largo del lado del animal, Exponer el corazón. Realice una punción cardiaca terminal usando una aguja 30 ½ T unido a una jeringa de 1 ml purgado con 4% de citrato de sodio en DPBS para evitar la coagulación, la obtención de tanta sangre como sea posible a partir del animal.
- Eliminar los pulmones de los animales mediante la reducción de la tráquea con tijeras quirúrgicas o un escalpelo y colocar inmediatamente en un casete de cultivo de tejidos y en 10% de formalina.
- Retire el tumor primario de próstata del animal cortando individualmente cualquier vaso sanguíneo unidos al tumor y la garantía de ningún órgano adicionales, tales como los conductos deferentes o vesículas seminales se unen.
- Anotar el peso y el tamaño del tumor. Medir el peso del tumor en gramos a escala de laboratorio. Usando pinzas, medir la longitud del diámetro más largo del tumor en centímetros, y el eje perpendicular correspondiente. Multiplique estos valores para obtener el tamaño del tumor. Dependiendo del uso previsto, inmediatamente complemento congelación en nitrógeno, y / o lugar de líquido ena un casete de tejido en formalina al 10%.
- Exponga las articulaciones de la cadera y de la rodilla con tijeras quirúrgicas o un bisturí, y las articulaciones de desconexión de la pierna, teniendo cuidado de mantener intacto el fémur. Retire los fémures de los animales y el lugar en solución salina estéril.
- Obtener cualquier otro órgano o materiales de interés, y disponer de animales de acuerdo con las instrucciones de su instituto. En particular, los ganglios linfáticos regionales tienden a tener metástasis, tienden a ser ampliado si albergar ellos, y pueden ser cosechadas. Sin embargo, se debe tener cuidado ya que esto puede verse afectado por cambios en la presión hidrostática causada por el procedimiento quirúrgico.
5. Tramitación y inmunotinción de Tejido Pulmonar Muestras
- Dentro de 24 a 48 horas de la colocación de tejido en formalina al 10% en PBS, integrar los pulmones en parafina.
- Sección de los pulmones a 45 micras secciones escalonadas, teniendo 2-3 adyacentes 4 micras secciones de tejido pulmonar.
- Si se utilizaron células positivas para GFP (recomendado), lleve a cabo la inmunotinciónpara las buenas prácticas agrarias. Si no es así, realice hematoxilina estándar y eosina (H & E) tinción.
NOTA: El kit Dako Envision + combinado con el anticuerpo de GFP de Invitrogen ha sido utilizada con éxito de acuerdo con las instrucciones del fabricante, pero esto puede ser modificado para cualquier procedimiento de inmunohistoquímica.
- Puntuación metástasis en un modo ciego. Si GFP-positivas, las células tumorales se tiñen de marrón además de tener núcleos grandes y distintivas. La primera vez que la metástasis de puntuación, consulte a un patólogo para asegurar una puntuación correcta y use el H & E manchadas tejido pulmonar para confirmar la presencia de las células tumorales, y no la infiltración de células inmunes.
6. La identificación de células tumorales circulantes de Sangre y Médula Ósea
- Añadir toda la sangre obtenida de la autopsia a un tubo de centrífuga de 1,5 ml. Se centrifuga 5 min a 800 x g.
- Retire el plasma y se añade 1 ml de tampón de lisis ACK (154,95 mM cloruro de amonio, bicarbonato de potasio 9,99 mMnate, EDTA 0,0995 mM,). Permita que la sangre llegue a temperatura ambiente 3-5 min.
- Se centrifuga 5 min a 800 x g.
- Eliminar el sobrenadante y añadir 1 ml de medio de cultivo celular que contiene antibióticos. Añadir células a un matraz T75 que contiene 9 ml de medio de cultivo celular.
- Células de cultivo a 37 ° C en un ambiente humidificado contiene 5% de CO 2 durante 10 días, la comprobación de la presencia de CTCs cada 2-3 días.
- Para médula ósea, eliminar todo el tejido muscular de fémures utilizando un par de tijeras, una cuchilla de afeitar, o un escalpelo. Retire los extremos del hueso, tan cerca de los extremos posibles.
- Usando una aguja 23 ¾ G, expulsar suavemente la médula ósea del fémur en un tubo de centrífuga de 1,5 ml.
- Añadir a 1 ml de medios de cultivo celular y la pipeta suavemente para mezclar bien.
- Añadir células a un matraz T75 que contiene 9 ml de medio de cultivo celular.
7. Caracterización molecular de los tumores
- Para la reacción en cadena de la polimerasa (PCR)s, muestras de tumor que se congelaron en nitrógeno líquido se pulverizan primero en hielo seco y luego se homogeneizaron usando un homogeneizador de tejidos durante 3-5 min con 1 ml de TRIzol. TRIzol extracción se lleva a cabo según las instrucciones del fabricante. Se purifica ARN utilizando el kit de aislamiento de ARN RNeasy de acuerdo con las instrucciones del fabricante. Realización de la síntesis de ADNc y la PCR cuantitativa en tiempo real (QRT / PCR) usando reactivos TaqMan de acuerdo con las instrucciones del fabricante se recomienda pero puede ser modificado por cualquier método de PCR empleada actualmente.
- Para los ensayos de Western blot, homogeneizar los tejidos usando un homogeneizador de tejidos durante 3-5 min con 1 ml de tampón de lisis: PBS (NaCl 137 mM, 10 mM de fosfato de Na, 2,7 mM de KCl), 0,5% de Triton X-100, EDTA 1 mM, pirofosfato de sodio 2,5 mM, 1 mM de β-glicerofosfato, con la adición de cóctel inhibidor de la proteasa, inhibidores de fosfato cócteles 2 y 3, fluoruro de sodio 10 mM, y ortovanadato de sodio 1 mM. La mezcla de lisado celular se coloca en un tubo de centrífuga de 1,5 ml.
- Centavorifuge mezcla de lisado de células durante 10 min a 13.000 x g.
- Aspirar el sobrenadante y colocar en un nuevo tubo de centrífuga de 1,5 ml y se centrifuga de nuevo durante 10 minutos a 13.000 x g. Si los restos celulares aún está presente, se puede realizar una etapa de centrifugación adicional.
- Aspirar el sobrenadante y efectuar una transferencia Western según las condiciones normales de laboratorio.
Resultados
Para este experimento, se muestra un grupo representativo de ratones obtenidos durante estos procedimientos quirúrgicos. Cinco ratones fueron implantados con células PC3-M GFP-positivas que contienen un vector de control. Los tumores se dejaron crecer durante seis semanas, y luego se evaluaron múltiples parámetros. En las figuras 1A y 1B, se muestra el cambio en el peso corporal y el consumo de alimentos de ratones, respectivamente. Hay una pequeña caída en el peso corporal y el consumo de alimentos alrededor de la fecha de la cirugía debido a la anestesia. Durante el curso del experimento, el peso corporal aumenta lentamente después de la cirugía, y luego empieza a disminuir hacia el final del experimento como la carga tumoral alcanza un nivel crítico. Esto se corresponde con el consumo de alimentos en estos ratones.
En las figuras 2A y 2B, se muestran los tamaños tumorales representativos obtenidos. Tamaños tumorales individuales varían, pero en promedio que alcanzan los tumores de aproximadamente 1 gramo, convarianza normal entre 0,5-1,5 g, y un tamaño del tumor de 1 cm 2, con una variación normal de 0,5-1,5 cm 2. Aunque el tamaño de los tumores varía, éstos no se correlacionan con el número de metástasis resultante, se muestra tanto en este documento y nuestros trabajos publicados previamente 10. Sin embargo, a partir de este modelo, se puede determinar el efecto del tratamiento de drogas o cambios moleculares en el peso y tamaño del tumor. Una consideración importante en este modelo es cuando el punto final apropiado para el experimento es. En las Figuras 2C y 2D, se muestra los cambios en el peso del tumor y el tamaño del tumor en una línea celular PC3-M en particular transfectadas establemente con GFP y un vector de control a las 4 semanas ya las 6 semanas. En las últimas dos semanas, el peso medio de los tumores aumentó 2,7 veces, y el tamaño del tumor de 1,9 veces. Esto muestra la adición de 1-2 semanas adicionales en el experimento puede influir drásticamente en los resultados. Como una multitud de factores que pueden alterar el crecimiento de los tumores, incluyendola edad y el tamaño de los ratones, el número de pasajes de las células, etc no recomiendan terminación de los experimentos hasta que se observaron tumores visibles en la mayoría de los ratones.
En las Figuras 3A-3C, el número de metástasis se cuantifica tres maneras diferentes. En la figura 3A, se representa el número total de células de CaP humanos GFP-positivas. En la Figura 3B, el número de loci de células, o en lugares donde los depósitos metastásicos están presentes, se muestra. Finalmente, en la Figura 3C,, tal como se define por un grupo claramente unido de células que muestran 5 o más células de CaP humanos GFP-positivas, se muestra el número de metástasis distinta. Imágenes representativos de estos diferentes condiciones se muestran en las Figuras 4A-4D. En la Figura 4A, una célula individual a 40x magnitud se destaca con una flecha. Nótese la tinción de color marrón y grandes núcleos distintos. Una sección pulmonar adyacente teñidas utilizando tinción H & Ese muestra en la Figura 4B, confirmando que sin GFP, la detección de células cancerosas es todavía fácilmente alcanzable. Esta foto se toma en 40x magnitud y la celda se resalta con una flecha. En la Figura 4C, se muestran varios loci de diferente número de células a 10x magnitud y cada locus resaltados con una flecha. . Por último, en la figura 4D, un depósito metastásico de las células 10 se muestra. ¿Cómo influyen estos métodos los datos se muestran las diferencias de ratón 1 y el ratón 3. Ratón 1 tiene un menor número de células totales en el pulmón, con un promedio de 21,5 células por sección de pulmón, en comparación con el ratón 3 que tiene un promedio de 700 células por sección del pulmón. Sin embargo, el ratón 3 tiene menos loci, o lugares en los que están presentes de ratón 1 células. Ratón 3 tiene relativamente pocos sitios de metástasis, pero el número de células por área es muy alta en 82 células por loci debido a varias metástasis número de células muy grandes. En contraste, el ratón 1 tiene más loci único, pero significativamente fcélulas aguamanil por lugar a sólo un promedio de dos células por ubicación. Estos parámetros diferentes pueden arrojar luz sobre la cinética de las células de la trata en el pulmón y su capacidad para comenzar a crecer y proliferar.
Además, en la figura 3D, se muestra los cambios en las células metastásicas totales por pulmón en ratones necropsias a las cuatro frente a seis semanas. Tal como se describe en las figuras 2C y 2D, no se observan cambios significativos en el peso y el tamaño del tumor en las últimas dos semanas de un experimento. Esto se recapitula en la figura 3D. Ratones practicó la necropsia a las cuatro semanas no mostraron desarrollo metastásico, mientras que los ratones a las 6 semanas mostraron células metastásicas en todos los ratones evaluados. Esto demuestra una vez más la importancia de asegurar necropsias ratones se llevan a cabo en un punto final de la última etapa para asegurar la ha producido la formación de metástasis.
Una medición añadido en este modelo son los cambios moleculares que ocurren en el interior del tumor primario. En las figuras 5A-5C se muestran tres ejemplos de experimentos QRT / PCR medición de tres genes de interés en la progresión metastásica, la metaloproteinasa de matriz tipo 2 (MMP-2), tipo metaloproteinasa de la matriz 9 (MMP-9), y proteína de choque térmico 27 (HSP27) respectivamente. Cualquier gen de interés se mide a través de QRT / PCR puede detectarse utilizando esta técnica. Además, los niveles de proteína se pueden cuantificar usando procedimientos de transferencia de Western.
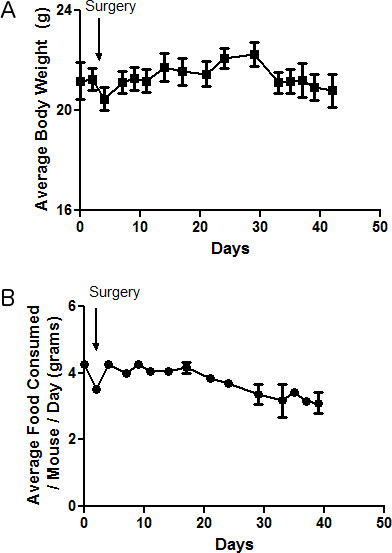
Figura 1. Peso corporal observada y el consumo de alimentos en los animales. AB) El peso corporal en gramos, o el consumo medio de alimentos por ratón por día en gramos, se registra en todo el experimento y se muestra en A) y B), respectivamente.
fig2highres.jpg "src =" / files/ftp_upload/50873/50873fig2.jpg "/>
Figura 2. El tamaño del tumor y el peso del tumor individual y en grupos de ratones. AB) El peso del tumor en gramos y el tamaño del tumor en centímetros cuadrados de cinco ratones de control representativos y la media de los cinco ratones en el extremo de seis semanas, se muestran en A) y B), respectivamente. CD) Una comparación de peso del tumor en gramos y el tamaño del tumor en centímetros cuadrados entre grupos de ratones necropsia a los cuatro y seis semanas. Haga clic aquí para ver más grande la figura .
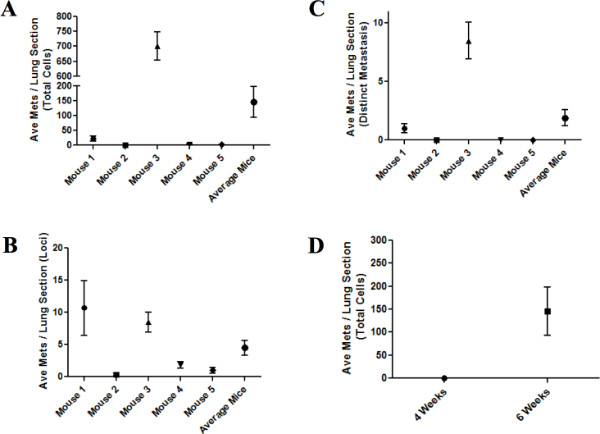
Figura 3. La diseminación metastásica en individual y grupos de ratones. AC) El sprea metastásico promedioD por la sección de pulmón durante cinco ratones individuales y la media de los cinco ratones en el extremo de seis semanas, representados ya sea como número total de células (A), las ubicaciones de las células metastásicas (B), o distinto metástasis como se define por 5 + en las células un grupo claramente definido (C). D) La comparación entre el número medio de células metastásicas por sección pulmonar por ratón entre los ratones necropsia a los cuatro y seis semanas. Haga clic aquí para ver más grande la figura .
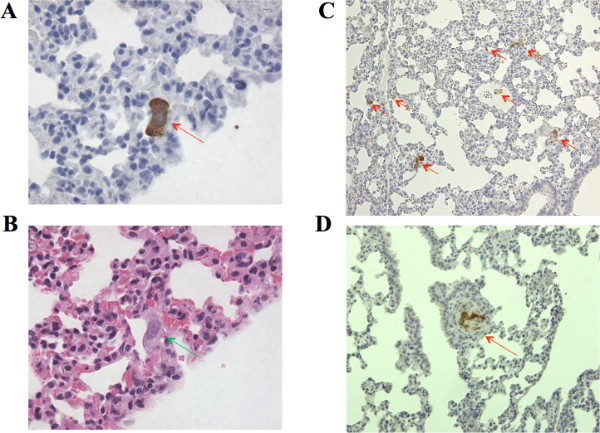
Figura 4. Imágenes representativas de las metástasis pulmonares. A) Una célula de pulmón individuo GFP positiva a 40X objetivo se destaca con una flecha. B) Una pulmonar adyacentesección de la A), que muestra la misma célula bajo tinción H & E. C) Una sección de pulmón en 10 veces objetivo con siete loci individuales que contiene un número variable de células. d) uno metástasis distinta a 10X objetivo que contiene 10 células de cáncer claramente definidos como un grupo.

Figura 5. Análisis de PCR de tres genes metastásicos de interés. QRT / PCR se realizó en muestras de tumores individuales recogidas de los ratones a las seis semanas. Niveles de mRNA de transcripción relativas de MMP-2 (A), MMP-9 (B) y HSP27 (C) se miden, normalizado a GAPDH. Haga clic aquí para ver más grande la figura .
Discusión
En este artículo ofrecemos un novedoso modelo murino de metástasis PCa humana. En este modelo, la humana CaP líneas celulares PC3-M se ortotópicamente implanta directamente en la próstata de ratones BALB / c atímicos ratones y tumores dejó desarrollar durante 4-6 semanas. En la sección de resultados representativos, que muestran ejemplos de los datos que pueden ser recogidos, incluyendo el peso del ratón y el consumo de alimentos, el tamaño del tumor y el peso, las características moleculares del tumor, y la formación de distinta metástasis al pulmón. Además, una amplia variedad de salidas adicionales puede ser estudiada en función de los intereses particulares de investigación. Un ejemplo es la presencia de CTC a la sangre y la médula ósea. Como CTCs son un evento relativamente infrecuente (se observa en aproximadamente el CTC 5-20% de los animales de control), no nos sorprendió que ninguno de los cinco ratones en estos experimentos desarrolló CTCs. Nuestro laboratorio también ha utilizado este modelo para determinar cambios en la adhesión celular mediante la medición de la morfología nuclear de células en elde próstata de tejido 10. También hemos utilizado este modelo para evaluar el estado de la proliferación tumoral y la apoptosis primaria utilizando Ki67 y tinción TUNEL del tumor de próstata 14.
Además de la amplia variedad de salidas de datos que se pueden obtener, este modelo se puede utilizar para determinar los efectos de los dos cambios en la expresión de proteínas, así como terapias de moléculas pequeñas. En comparación con muchos modelos espontáneos e inducidos de la metástasis CaP humano, hay un tiempo de respuesta más alta de sólo 4-6 semanas. Otros modelos con un tiempo de respuesta alta, como vena de la cola o los modelos de inyección intercardiac, tienen limitaciones de ningún tumor primario, por lo tanto no recapitular completamente la clínica cascada metastásica. En nuestro modelo, las células tumorales deben escapar el sitio primario de origen, entrar y sobrevivir el sistema circulatorio, e implantar en un sitio secundario. Esto proporciona los pasos adicionales a la que una intervención terapéutica o cambio en la expresión de la proteína podrían ofrecer un efecto. Addinalmente, la presencia del tumor primario debe permitir la fácil aplicación de este modelo a las nuevas tecnologías de imagen como la basada en luciferasa IVIS 16-17.
A pesar de la amplia variedad de beneficios de este modelo, también hay varias limitaciones a considerar. Un número creciente de estudios muestran la importancia del sistema inmune en el microambiente tumoral y el desarrollo de metástasis 18. En este modelo, debido al uso de un roedor atímicos, la capacidad de evaluar los efectos del sistema inmune no es posible. Una segunda limitación es la falta de capacidad de respuesta de andrógenos en las células PC3-M. Tras el diagnóstico inicial de CaP, los pacientes con frecuencia se someterán a la terapia con andrógenos como tratamiento de primera línea. Sin embargo, los pacientes con el tiempo se convertirán en andrógeno-resistente y los tumores comienzan a crecer de nuevo. Como las células PC3-M carecen del receptor de andrógenos, este modelo sólo mide los efectos del tratamiento de drogas o la modulación de proteínas en c resistente post-andrógenol cáncer. Aunque esta es una limitación, sensible a los andrógenos PCA es actualmente muy manejable y tiene una variedad de opciones de tratamiento eficaces, y por lo tanto el cáncer andrógeno-resistente se ha convertido en un lugar más destacado en estudio. Este modelo también utiliza específicamente una cepa endogámica de ratones, lo que minimiza el ratón a la variabilidad del ratón. Sin embargo, esta variedad puede ser particularmente sensible a determinadas proteínas o moléculas pequeñas, por lo tanto se debe tener cuidado al extrapolar estos datos a la clínica.
Aunque este modelo proporciona una medición efectiva de la eficacia del fármaco en un tiempo de respuesta rápido de 4-6 semanas, esto puede no tener en cuenta los efectos de la droga de dosificación a largo plazo. Después de la exposición prolongada a los muchos tratamientos disponibles en la actualidad, los pacientes pueden regresar con cánceres resistentes a los fármacos muchos años después del tratamiento. El rápido cambio de esta técnica no permite la modelización eficaz de la capacidad de un tumor para llegar a ser resistentes a un tratamiento. Sin embargo, con la modulación de este exexperimento, las células de cáncer de próstata humanos resistentes al tratamiento pueden ser implantados, y la eficacia de un agente terapéutico de segunda generación en la prevención de crecimiento tumoral y la metástasis CaP pueden ser modelados. Además, si un grupo estaba tratando de estudiar los cambios moleculares en el tumor primario con el tiempo, un modelo a largo plazo, tales como el modelo TRAMP es probable que sea más eficaz para esos estudios.
Otra limitación de este modelo es la difusión de las distintas metástasis sólo a los ganglios linfáticos y los pulmones de los animales. Ambos de estos sitios son sitios frecuentes y clínicamente relevantes de la metástasis, como lo demuestran los estudios de autopsia cálidos humanos 19. Sin embargo, la metástasis ósea clínicamente constituye una característica prominente de CaP humana, y por lo tanto los modelos que recapitulan este son de interés. Desafortunadamente, estos son difíciles de resumir en un modelo de ratón, con muy pocos modelos que muestran metástasis ósea y sin vena de la cola, la inyección intercardial, o la implantación directa enal hueso 20. Así, si la orientación al hueso es de importancia clave experimental, otro modelo puede ser más eficaz. Sin embargo, este modelo proporciona una cierta medida de tráfico para el hueso en forma de médula ósea las células tumorales circulantes.
A pesar de estas limitaciones, esta técnica es un poderoso modelo de PCa humana. La capacidad de medir los efectos tanto en el tumor primario, así como la formación de metástasis en un tiempo de respuesta corto ofrece una amplia variedad de aplicaciones. En este modelo, las células deben escapar el órgano primario, entrar y sobrevivir en el torrente sanguíneo, y el implante en un sitio secundario, recapitulando el proceso en los seres humanos. El método de medición de las características moleculares del tumor primario, los cambios en la morfología celular y la presencia de células tumorales circulantes te ofrece una gran bocanada de información de un modelo. Este procedimiento se puede utilizar tanto en el contexto del descubrimiento de fármacos, así como para estudiar los cambios en la biología del tumor.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por becas de los Institutos Nacionales de Salud (NIH) a RCB, CA122985 y próstata SPORE CA90386, ya JMP, NIH T32 AG000260 "Drug Discovery Formación en trastornos relacionados con la edad", y por el Walter S. Y Lucienne Programa de Postgrado en Ciencias de la Vida Driskill en la Universidad Northwestern. También nos gustaría dar las gracias al Fenotipificación Mouse y Laboratorio de Histología y Patología Core Facilidad en la Universidad Northwestern.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 1 ml Syringe, Tuberculin, Slip-Tip | Becton Dickinson | 309659 | |
| 23 G 3/4 Precison Glide Needle | Becton Dickinson | 305143 | |
| 30 G 1/2 Precision Glide Needle | Becton Dickinson | 305106 | |
| Alcohol Wipes | Triad | 10-3001 | |
| Autoclip Applier, 9mm, Stainless Steel | Becton Dickinson | 427630 | |
| Clips, 9mm | VWR | 15431-673 | |
| Convertors Polyline Towel (Sterile) | Cardinal Health | 3520 | |
| Cotton-Tipped Applicators, 6 inch, Sterile, Wooden Shaft | Fisher | 23-400-125 | |
| Curad Sterile Cotton Balls | VWR | 500043-544 | |
| Derf Needle Holder, Integra Miltex, 121 mm (4 3/4") | VWR | 95039-192 | |
| Duraprene SMT Sterile Neoprene Powder-Free Surgical Gloves | Cardinal Health | 2D72PN70 | |
| Germinator 500 | Cell Point Scientific | SN 7030 | |
| Kendall Monojet Needles, 1/2 cc syringe with permanent 28 G 1/2 needle | Tyco | 1180528012 | |
| Medium Heating Pad | VWR | 100229-094 | |
| Merit Iris Scissors, Sklar, 11.4 cm (4 1/2") | VWR | 94000-000 | |
| Metric/English Vernier Caliper | VWR | 19155-057 | |
| PDS*11 Violet Monofilament Sutcher 4-0, 27" | Ethicon | Z304H | |
| VetEquip Inhalation Anesthesia System | Contact Your Animal Facility for Availability | ||
| VWR Premium Tissue Cassettes | VWR | 18000-010 | |
| VWR Specimen Forceps, Serrated, Straight, 114 mm (4 1/2") | VWR | 82027-440 | |
| Reagents | |||
| Betadine Surgical Scrub | Fisher Healthcare | 19-027132 | |
| Buprenex | Controlled Substance - Obtain from Animal Facility | ||
| Dako DAB + Chromagen | Dako | K3468 | |
| Dako Envision + System HRP-Labeled Polymer, Anti-Rabbit | Dako | K4003 | |
| Dako Envision Kit Protein Block | Dako | X0909 | |
| Formalin | VWR | 95042-908 | |
| GFP Antibody | Invitrogen | A11122 | |
| Hematoxylin | Mayer | MH580-2.5L | |
| Meloxican | Obtain from Animal Facility | ||
| Nembutal | Controlled Substance - Obtain from Animal Facility | ||
| Rneasy RNA Isolation Kit | Qiagen | 74104 | |
| Sterile Saline | Obtain from Animal Facility | ||
| Taqman Reverse Transcription Reagents | Life Technologies | N8080234 | |
| TaqMan Universal PCR Master Mix | Life Technologies | 4304437 | |
| Trizol | Invitrogen | 10296 | |
Referencias
- Jemal, A., et al. Global cancer statistics. CA Cancer J Clin. 61, 69-90 (2011).
- Shappell, S. B., et al. Prostate pathology of genetically engineered mice: definitions and classification. The consensus report from the Bar Harbor meeting of the Mouse Models of Human Cancer Consortium Prostate Pathology Committee. Cancer Res. 64, 2270-2305 (2004).
- Rangarajan, A., Weinberg, R. A. Opinion: Comparative biology of mouse versus human cells: modelling human cancer in mice. Nat. Rev. Cancer. 3, 952-959 (2003).
- Pollard, M. Lobund-Wistar rat model of prostate cancer in man. Prostate. 37, 1-4 (1998).
- Gingrich, J. R., et al. Androgen-independent prostate cancer progression in the TRAMP model. Cancer Res. 57, 4687-4691 (1997).
- Gingrich, J. R., et al. Metastatic prostate cancer in a transgenic mouse. Cancer Res. 56, 4096-4102 (1996).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59, 781-786 (1999).
- Wu, T. T., et al. Establishing human prostate cancer cell xenografts in bone: induction of osteoblastic reaction by prostate-specific antigen-producing tumors in athymic and SCID/bg mice using LNCaP and lineage-derived metastatic sublines. Int. J. Cancer. 77, 887-894 (1998).
- Dolman, C. S., et al. Suppression of human prostate carcinoma metastases in severe combined immunodeficient mice by interleukin 2 immunocytokine therapy. Clin. Cancer Res. 4, 2551-2557 (1998).
- Lakshman, M., et al. Dietary genistein inhibits metastasis of human prostate cancer in mice. Cancer Res. 68, 2024-2032 (2008).
- Messina, M. J., Persky, V., Setchell, K. D., Barnes, S. Soy intake and cancer risk: a review of the in vitro and in vivo data. Nutr. Cancer. 21, 113-131 (1080).
- Adlercreutz, H., Markkanen, H., Watanabe, S. Plasma concentrations of phyto-oestrogens in Japanese men. Lancet. 342, 1209-1210 (1993).
- Xu, L., et al. MEK4 function, genistein treatment, and invasion of human prostate cancer cells. J. Natl. Cancer Inst. 101, 1141-1155 (2009).
- Lakshman, M., et al. Endoglin suppresses human prostate cancer metastasis. Clin. Exp. Metastasis. 28, 39-53 (2011).
- Craft, C. S., Romero, D., Vary, C. P., Bergan, R. C. Endoglin inhibits prostate cancer motility via activation of the ALK2-Smad1 pathway. Oncogene. 26, 7240-7250 (2007).
- Lim, E., Modi, K. D., Kim, J. In vivo bioluminescent imaging of mammary tumors using IVIS spectrum. J. Vis. Exp. , e1210 (2009).
- Cordero, A. B., Kwon, Y., Hua, X., Godwin, A. K. In vivo imaging and therapeutic treatments in an orthotopic mouse model of ovarian cancer. J. Vis. Exp. , e2125 (2010).
- Buijs, J. T., vander Pluijm, G. Osteotropic cancers: from primary tumor to bone. Cancer Lett. 273, 177-193 (2009).
- Rubin, M. A., et al. Rapid ("warm") autopsy study for procurement of metastatic prostate cancer. Clin. Cancer Res. 6, 1038-1045 (2000).
- Singh, A. S., Figg, W. D. In vivo models of prostate cancer metastasis to bone. J. Urol. 174, 820-826 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados