Method Article
Inyección de ganglios intra-linfáticos de partículas de polímero biodegradables
* Estos autores han contribuido por igual
En este artículo
Resumen
Los ganglios linfáticos son los tejidos inmunológicos que orquestan la respuesta inmunitaria y son un objetivo crítico para las vacunas. Los biomateriales se han empleado para dirigirse mejor a los ganglios linfáticos y para controlar la administración de antígenos o adyuvantes. Este papel describe una técnica que combina estas ideas para inyectar partículas biocompatibles del polímero en nodos de linfa.
Resumen
La generación de respuesta inmune adaptativa se basa en el drenaje eficiente o el tráfico de antígenos a los ganglios linfáticos para el procesamiento y la presentación de estas moléculas extrañas a los linfocitos T y B. Los ganglios linfáticos se han convertido así en objetivos críticos para las nuevas vacunas e inmunoterapias. Una estrategia reciente para apuntar a estos tejidos es la inyección directa de ganglios linfáticos de componentes solubles de la vacuna, y los ensayos clínicos que involucran esta técnica han sido prometedores. También se han investigado varias estrategias de biomateriales para mejorar la focalización de los ganglios linfáticos, por ejemplo, ajustar el tamaño de partícula para un drenaje óptimo de las partículas de la vacuna de biomateriales. En este papel presentamos un nuevo método que combine la inyección directa del nodo de linfa con las partículas biodegradables del polímero que se pueden carcar con el antígeno, el coadyuvante, u otros componentes de la vacuna. En este método las micropartículas poliméricas o nanopartículas se sintetizan mediante un protocolo de doble emulsión modificado que incorpora estabilizadores lipídicos. Las propiedades de las partículas(por ejemplo, tamaño, carga de carga) se confirman mediante difracción láser y microscopía fluorescente, respectivamente. Los ganglios linfáticos de ratón se identifican mediante la inyección periférica de un tinte trazador no tóxico que permite la visualización del sitio de inyección objetivo y la posterior deposición de partículas de polímero en los ganglios linfáticos. Esta técnica permite el control directo sobre las dosis y combinaciones de biomateriales y componentes de la vacuna entregados a los ganglios linfáticos y podría aprovecharse en el desarrollo de nuevas vacunas basadas en biomateriales.
Introducción
Los ganglios linfáticos (LNs) son los centros de mando del sistema inmunitario. En este sitio inmunológico, las células presentadoras del antígeno priman linfocitos ingenuos contra los antígenos extranjeros específicos para activar inmunorespuestas celulares y humorales. De este modo, las N se han convertido en un objetivo atractivo para la administración de vacunas e inmunoterapias. Desafortunadamente, la mayoría de las estrategias de vacunación resultan en la entrega ineficiente y transitoria de antígenos y adyuvantes al tejido linfoide1. Por lo tanto, los enfoques que mejoran la focalización y la retención de los componentes de la vacuna en las N podrían tener un impacto significativo en la potencia y la eficiencia de las nuevas vacunas.
Una estrategia para sortear el desafío de la focalización de LN que ha demostrado un gran interés en nuevos ensayos clínicos es la inyección directa, intra-LN(i.LN.)2-4. Estos ensayos emplearon la guía por ultrasonido para administrar vacunas a los LN como un procedimiento ambulatorio simple. En comparación con las rutas de inyección periféricas tradicionales, este enfoque resultó en una reducción significativa de la dosis y una mejora de la eficacia en contextos terapéuticos que incluyen alergias y cáncer2-4. Estos estudios emplearon la inyección i.LN. de vacunas solubles(es decir, libres de biomateriales) que fueron rápidamente despejadas por drenaje linfático. Por lo tanto, se administraron múltiples inyecciones, o ciclos de inyecciones múltiples, para lograr estos impresionantes efectos terapéuticos. La retención mejorada en el LN podría aumentar la interacción entre el antígeno y/o las células ayudantes e inmunes, mejorando más lejos la potencia del cebado de la célula inmune. Este potencial está avalar por estudios recientes que muestran que la cinética del antígeno y la administración adyuvante juegan un papel crítico en la determinación de la respuesta inmune específica generada5-7. Además, localizar y minimizar las dosis de medicamentos y vacunas podría reducir o eliminar los efectos sistémicos, como la inflamación crónica.
Los biomateriales han sido ampliamente estudiados para mejorar la potencia y eficiencia de las vacunas1,8,9. La encapsulación o adsorción en los portadores de biomateriales puede proteger físicamente la carga de la degradación y superar las limitaciones de solubilidad. Otra característica notable de los portadores de biomateriales, como las micro o nanopartículas poliméricas, es la capacidad de cocargar varias clases de carga y, posteriormente, liberar estas cargas en intervalos controlados. Sin embargo, una limitación significativa que sigue obstaculizando las vacunas e inmunoterapias de biomateriales in vivo es la focalización ineficiente de las células inmunitarias y el tráfico limitado a los ganglios linfáticos. Por ejemplo, la inyección periférica de vacunas de biomateriales a través de vías convencionales(por ejemplo, intradérmicas, intramusculares) típicamente exhiben una mala focalización de LN, con hasta el 99% del material inyectado permaneciendo en el sitio de inyección4,10. Más recientemente, el tamaño de los portadores de vacunas de biomateriales se ha ajustado para mejorar el tráfico preferencial o el drenaje de estas vacunas a LNs a través del flujo intersticial8,10. Estos avances han llevado a respuestas inmunes celulares y humorales mejoradas, subrayando la importancia de apuntar y de la ingeniería del ambiente del LN para las nuevas vacunas.
Este trabajo presenta un protocolo de vacunación que combina partículas poliméricas estabilizadas por lípidos y la entrega de i.LN. para generar depósitos de vacunas de liberación controlada5,11. Basándose en estudios recientes que emplean técnicas quirúrgicas para i.LN. en ratones6,7,12,13,desarrollamos una estrategia rápida y no quirúrgica para inyectar vacunas biomateriales en animales pequeños5. La combinación de la administración de i.LN. con portadores de vacunas de biomateriales mejoró poderosamente la respuesta de las células T CD8 dentro de los 7 días posteriores a una sola inyección de depósitos de vacunas de liberación controlada5. Una respuesta humoral fuerte(es decir títulos del anticuerpo) también fue generada; ambas mejoras se vincularon a una mayor retención de los componentes de la vacuna en los ganglios linfáticos que fue mediada por la liberación controlada de los portadores de biomateriales. Curiosamente, el tamaño de las partículas de la vacuna alteró el destino de estos materiales una vez en los LN: las partículas a nanoescala mostraron una mayor absorción directa por parte de las células, mientras que las micropartículas más grandes permanecieron en el entorno extracelular de LN y liberaron carga (porejemplo, adyuvante) que fue tomada por las células presentadoras de antígenos residentes en LN5. Estos datos sugieren dos vías que podrían ser explotadas para nuevas vacunas mediante el control del tamaño de los biomateriales inyectados i.LN.
En este artículo se sintetizan partículas de polímeros biodegradables estabilizados en lípidos (micro y nanoescala) utilizando una estrategia de doble emulsión modificada5,11. Las propiedades de las partículas se caracterizan por la difracción láser y la microscopía. Estas partículas se inyectan directamente en los LNs inguinales identificados no quirúrgicamente utilizando un colorante trazador común, no tóxico14. El análisis postinyección de LNs por histología o citometría de flujo se puede utilizar para verificar la distribución de partículas dentro del entorno LN, así como para monitorear la absorción celular y la retención de partículas a lo largo del tiempo. Para los protocolos que detallan el procesamiento histológico y la citometría de flujo, los lectores son referidos a artículos recientes de JoVE e informesde revistas 15-22. Los resultados típicos demuestran la focalización local de LN de estos depósitos que podrían explotarse para lograr respuestas inmunitarias potentes y eficientes o para adaptar la inmunidad a los patógenos diana.
Protocolo
Todos los estudios en animales en este protocolo se completaron de conformidad con las directrices federales, estatales y locales, y utilizando protocolos revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Maryland.
1. Síntesis de micro- y nanopartículas estabilizadas por lípidos
- En un vial de vidrio de 7 ml, combine los lípidos DOPC, DSPE-PEG y DOTAP en una relación molar de 60:20:20 para preparar una mezcla maestra de lípidos.
- Para sintetizar una sola muestra: Transferir 242,9 μl, 287,4 μl y 71,9 μl, de DOPC, DSPE-PEG y DOTAP respectivamente, en el vial utilizando pipetas serológicas de vidrio de 2 ml.
- Para sintetizar múltiples muestras: Multiplique cada volumen lipídico anterior por el número de muestras y combínese en un solo vial, luego transfiera las alícuotas iguales de esta mezcla lipídica en viales correspondientes a cada muestra a preparar.
- Seque los lípidos bajo una corriente suave de gas nitrógeno durante 10 minutos, o colóquese en el horno de vacío durante la noche.
- En un solo vial de vidrio de 20 ml vacío, disuelva 80 mg de PLGA en 5 ml de diclorometano para cada muestra de partículas para generar una solución de polímero de 16 mg/ml.
- Añadir 5 ml de solución polimérica al(los) vial(es) que contiene los lípidos secos, la tapa y el vórtice durante 30 seg.
- Para sintetizar micropartículas:
- Comience a sonicar la fase orgánica que contiene el polímero, lípidos y otra carga insoluble en agua en hielo a 12 W utilizando un sonicador.
- Cree la emulsión de agua en aceite (w/o) usando una pipeta para agregar 500 μl de H2O destilado, oH2O que contenga 1 mg de péptido, proteína u otra carga soluble en agua.
- Continúe sonicando durante 30 segundos a 12 W en el hielo, balanceando suavemente el vial hacia arriba y hacia abajo y de lado a lado alrededor de la punta del sonicador para garantizar una emulsificación completa.
- Cree la emulsión de agua en aceite en agua (p/o/p) vertiendo la emulsión sin agua en 40 ml de H2O en un casto de 150 ml.
- Homogeneizar durante 3 min a 16.000 rpm utilizando un homogeneizador digital.
- Agregue una barra de agitación magnética, transfiera el casto a una placa de agitación y permita que la emulsión w/o/w se revuelva durante la noche para eliminar el exceso de solvente.
- Para sintetizar nanopartículas:
- Comience a sonicar la fase orgánica que contiene el polímero, lípidos y otra carga insoluble en agua en el hielo a 14 W.
- Cree la emulsión sin usar una pipeta para agregar 500 μl de H2O destilado, oH2O que contenga 1 mg de péptido, proteína u otra carga soluble en agua.
- Continuar sonicando durante 30 segundos a 14 W en hielo.
- Cree la emulsión w/o/w vertiendo la emulsión w/o a 40 ml de H2O en un beaker de 150 ml y sonicando durante 5 min a 16 W sobre hielo. Mezcle suavemente el vial hacia arriba y hacia abajo y de lado a lado alrededor de la punta del sonicador para garantizar una emulsificación completa.
- Agregue una barra de agitación magnética, transfiera el matraz a una placa de agitación y deje que la emulsión sin alcohol se revuelva durante la noche para eliminar el exceso de disolvente.
- A la mañana siguiente, lave y recoja las partículas:
- Vierta emulsión a través de un colador de células de malla de nylon de 40 μm en un tubo cónico de 50 ml.
- Centrífuga partículas durante 5 min a 5.000 x g para micropartículas o 5 min a 24.000 x g para nanopartículas.
- Decantar las partículas sobrenadantes y lavar mediante el reenviado en 1 ml de H2O.
- Transferir partículas en suspensión a un tubo de microcentrífuga de 1,5 ml.
- Centrífuga durante 5 min a 5.000 x g para micropartículas o 5 min a 24.500 x g para nanopartículas.
- Lavar las partículas dos veces más eliminando el sobrenadante, reutilizando en 1 ml H2O y centrifugado como en el paso 1.6.5. Después del lavado, suspenda las partículas en 1 ml H2O para uso inmediato, o liofilice para un almacenamiento prolongado.
2. Medición del rendimiento de la síntesis
- Preweigh un vial de vidrio vacío de 20 ml. Añadir 100 μl de suspensión de partículas al vial preweighed después de pipetear hacia arriba y hacia abajo con una micropipeta para mezclar.
- Liofilizar las partículas o secar bajo una suave corriente de nitrógeno.
- Pesar el vial que contiene el polímero seco. Determine el rendimiento de partículas en el vial restando el peso original del vial de la masa del vial que contiene las partículas secas.
- Determine el rendimiento total de partículas multiplicando la masa de partículas en el vial por el factor de dilución. Para determinar el porcentaje de rendimiento, divida la masa de la partícula por la masa de entrada teórica máxima y multiplique por el 100%.
3. Determinación del tamaño de partícula
- Limpie la celda de fracción de vidrio estilo cubeta suministrada llenándola con agua desionizada y limpiándola con hisopos con punta de algodón. Transfiera 10 ml de H2O destilado a la celda de facción limpiada, agregue la barra de micro agitación magnética y cargue la celda de fracción en el soporte celular del analizador de tamaño de partícula.
- Ajuste la velocidad de agitación magnética en el analizador de partículas para lograr una mezcla completa en la celda de fracción y cierre la puerta del compartimiento.
- Alinee los láseres con la celda de fracción utilizando la interfaz del software del instrumento.
- Utilice la interfaz del software del instrumento para registrar una lectura de línea de base con la celda de fracción que contiene sólo destilado H2O.
- Pipetear la suspensión de partículas original hacia arriba y hacia abajo con una micropipeta para mezclar.
- Pipetear 10 μl de suspensión de partículas (típicamente aproximadamente 0,5 mg) en la celda de la fracción. Asegúrese de que el volumen de la muestra de partículas añadida a la celda sea suficiente para generar la intensidad de la señal en el rango apropiado como se indica en la interfaz del software del instrumento. La masa real de partículas requerida depende del porcentaje de rendimiento y de las propiedades ópticas de la muestra de partículas.
- Cierre la puerta del compartimiento del analizador de tamaño de partícula y mida el tamaño de partícula utilizando un índice de refracción de 1,60 para PLGA.
- Utilice la interfaz del software para calcular el diámetro de las partículas utilizando una base numérica.
4. Visualización de partículas
- Suspensión de partículas de pipeta hacia arriba y hacia abajo con micropipeta para mezclar. Diluir la suspensión de partículas a 1 mg/ml en agua desionizada.
- Prepare un portaobjetos de microscopio agregando 3 μl de suspensión de partículas diluidas y montando un cubrebocas en un ángulo de 45° para evitar la formación de burbujas. Coloque el portaobjetos en el escenario del microscopio y la imagen utilizando los conjuntos de filtros apropiados para cada carga fluorescente.
5. Preparación de ratones para i.LN. inyección
- Prepare la solución del tinte del trazador:
- Preparar una solución al 0,1% (p/v) de colorante trazador disolviendo 10 mg de colorante en polvo con 10 ml de H2O destilado.
- Esterilice la solución de tinte en un vial de vidrio usando un filtro de jeringa de 0,2 μm.
- Un día antes de la inyección, anestesiar el ratón usando isoflurano de acuerdo con un protocolo animal aprobado por el IACUC. Para evaluar la profundidad de la anestesia, realice una prueba de reflejo de pellizco del dedo deldo deldo del día y controle la frecuencia respiratoria para asegurar una frecuencia respiratoria de aproximadamente 100-140 respiraciones por minuto.
- Afeite el pelo en la base de la cola y el cuarto trasero usando clippers mientras el ratón está anestesiado. Retire el pelo del lado ventral del animal y lateralmente alrededor del lado dorsal justo por encima de la articulación de la pata trasera (cadera).
- Inyecte tinte trazador.
- Para cada inyección de tinte, use una micropipeta para transferir 10 μl de solución de tinte a un tubo de microcentrífuga y aspire la totalidad de 10 μl en una aguja de 31G conectada a una jeringa de 1 ml.
- Inyecte 10 μl de solución de tinte por vía subcutánea a cada lado de la base de la cola donde se recortó el cabello, recargándose entre las inyecciones.
- Retire el vello restante aplicando una crema depilatoria suave a través de hisopos de algodón. Asegúrese de recubrir el área entre la parte posterior del muslo y el abdomen.
- Deje que la crema depilatoria se incube en la piel durante 3 min. Después de la incubación, moje la mano enguantado con H2O caliente y frote suavemente la crema depilatoria en la piel.
- Retire inmediatamente la crema depilatoria mojando la mano enguantado conH2O caliente y frotando la base de la cola y el cuarto trasero. Repetir hasta que se elimine el exceso de depilatorio, asegurándose de mantener la mano mojada para evitar la irritación.
- Retire los residuos depilatorios del ratón mojando un paño suave o toalla de papel con H2O caliente y en un solo movimiento, limpiando la parte inferior del ratón. Evite un movimiento de frotamiento para evitar la abrasión o el daño de la piel al ratón.
- Permita que el ratón se recupere bajo una lámpara de calor y vuelva a sostenerse.
6. i.LN. Inyección de partículas
- Al día siguiente, anestesiar el ratón usando isoflurano de acuerdo con un protocolo animal aprobado por el IACUC.
- Examine el ratón para confirmar el drenaje del tinte trazador en cada ganglio linfático inguinal. El ganglio linfático debe ser visible como una mancha oscura cerca de la parte posterior del muslo y el abdomen.
- Prepare la solución de inyección de partículas:
- Partículas resuspender enH2O destilado a la concentración de inyección deseada. Para cada inyección, use una micropipeta para transferir 10 μl de solución de partículas a un tubo de microcentrífuga.
- Aspirar los 10 μl enteros en una aguja de insulina 31G unida a una jeringa de 1 ml.
- Inyectar dosis de partículas:
- Después de visualizar el LN, apriete la piel alrededor del LN usando el pulgar, el dedo índice y el dedo medio para tirar de la burla de la piel y permitir la colocación controlada del volumen de inyección.
- Acerque el LN con la aguja en un ángulo de 90° a la piel y penetre la piel sobre el LN teñido a una profundidad de 1 mm.
- Inyecte lentamente todo el volumen. Durante la inyección, observe el volumen de LN a través de la piel para confirmar la inyección por agrandamiento visible de LN.
- Permita que el ratón se recupere bajo una lámpara de calor y vuelva a sostenerse o realizar pruebas adicionales.
Para las técnicas de análisis relevantes(por ejemplo, histología, citometría de flujo) ver JoVE Artículos 265, 1743, y 3054 y Protocolos actuales en Inmunología,capítulos 5 y 2115-22.
Resultados
Los resultados esperados para los protocolos presentados en este manuscrito se pueden dividir en tres categorías: síntesis de partículas, preparación animal e inyección de partículas.
La Figura 1 representa la síntesis y caracterización de partículas poliméricas biodegradables, estabilizadas por lípidos anfifílicos. Los resultados del protocolo de síntesis de evaporación de emulsión/disolvente (Figura 1A) pueden evaluarse cualitativamente mediante inspección visual de las emulsiones finales generadas; los lotes de partículas deben ser emulsiones homogéneas y estables con apariencia opaca. Las complicaciones incluyen emulsiones que creman o floculan, a menudo debido al almacenamiento inadecuado de estabilizadores lipídicos. Para evitar esta inestabilidad, los lípidos deben almacenarse a -80 °C en estado deshidratado o en un vial sellado purgado con nitrógeno. La evaluación cuantitativa de la síntesis de partículas se puede realizar utilizando difracción láser o dispersión dinámica de luz para analizar la distribución del tamaño (Figura 1B). Los resultados esperados incluyen tamaños de partícula monomodales estrechamente distribuidos, lo que indica una población uniforme de partículas. Los parámetros de síntesis descritos en este manuscrito generan distribuciones promediadas centradas en aproximadamente 100 nm o 3 μm para nanopartículas y micropartículas, respectivamente. Se puede lograr una evaluación cualitativa adicional de la síntesis de partículas mediante la modificación del protocolo anterior para incorporar múltiples clases de carga fluorescente. En la Figura 1C,las imágenes de microscopía de micropartículas cargadas con un péptido fluorescente (FITC, verde), un tinte lipofílico (DiD, rojo) y una imagen de superposición (amarillo) confirman la creación de partículas dentro del rango de tamaño deseado y la encapsulación del péptido dentro del volumen de la partícula.
Los dos primeros paneles de la Figura 2 resumen los resultados esperados de la preparación animal para la estrategia de inyección de i.LN. descrita en este documento. La metodología consiste en marcar LNs inguinales mediante inyección periférica de un trazador no tóxico para identificar la localización para la posterior inyección i.LN. de partículas(Figura 2A)5. Como se ha señalado, el drenaje del tinte trazador tras la inyección subcutánea en la base de la cola permitirá la visualización de los LNs inguinales(Figura 2B)5. La ingestión de cremas depilatorias aprobadas puede plantear peligros para los ratones. Por lo tanto, se debe tener cuidado de eliminar a fondo toda la crema aplicada, prestando especial atención a las patas y al lado ventral de los ratones. Depilatorio debe eliminarse con un paño húmedo y suave o toalla de papel húmeda en un solo movimiento suave. Evite el frotamiento para eliminar la crema, ya que esto puede conducir a abrasiones en la piel expuesta de los ratones.
La confirmación del local de la entrega al LN inguinal se puede evaluar con la observación o la histología. El volumen de LN se puede monitorear visualmente durante la inyección como un indicador de la inyección exitosa. Los resultados esperados incluyen una distribución eficiente de la carga en toda la estructura de LN, sin fugas significativas a los tejidos o células adyacentes. Además, a medida que el líquido inyectado desplaza / diluye el trazador en el LN, la concentración / coloración del tinte debe ser menos intensa después de la inyección. La observación del tejido debe revelar un LN intacto, pero agrandado debido a la inyección de líquido. Los desafíos potenciales incluyen inyectar demasiado rápidamente o faltar el LN, que puede causar la elución del volumen en el tejido subcutáneo circundante. Estos resultados indeseables pueden ser confirmados por necropsia o histología, donde se observará la suspensión de partículas que se extiende a las células y tejidos alejados de los nodos destinados a la inyección. En contraste, un resultado esperado sería la identificación de un LN inguinal agrandado debido a la contención de partículas dentro de la estructura LN. El procesamiento histológico de LNs suprimidos puede confirmar definitivamente la entrega de carga al tejido linfoide, como se muestra en las Figuras 2C y 2D. Tenga en cuenta que las partículas de la Figura 2 incorporan carga fluorescente para permitir la visualización de la carga durante la inyección, así como durante el procesamiento histológico y la microscopía fluorescente.
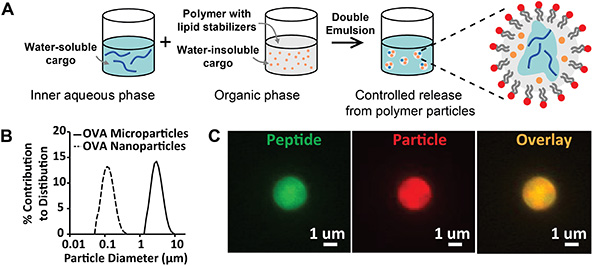
Figura 1. Synthesis and Characterization of Lipid Stabilized Particles. A)Diagrama esquemático que describe la síntesis de partículas estabilizadas por lípidos preparadas por evaporación de emulsión/disolvente. B)Distribuciones de tamaño de micropartículas (línea sólida, diámetro = 2,8 μm) y nanopartículas (línea discontinua, diámetro = 113 nm). C)Imágenes de microscopía fluorescente de partículas cargadas con péptido marcado fluorescentemente y un tinte de partículas fluorescentes. Etiquetas: péptido (verde) y partícula (rojo). Haga clic aquí para ver la imagen más grande.

Figura 2. i.LN. Inyección y Distribución de Partículas Biodegradables dentro de LN. A)Metodología para la inyección de i.LN. B) Visualización de LNs en un ratón a través de la piel (imagen superior) y después de la necropsia (imagen inferior)5. C)Tinción histológica de una deposición confirmante de LN y distribución de micropartículas poliméricas marcados fluorescentemente (partículas, verde; Células T rojas; B-células, azul). D)Nanopartículas etiquetadas fluorescentemente (50 nm, imagen izquierda) y micropartículas (6 μm, imagen derecha) en LNs 24 horas después de la inyección. Haga clic aquí para ver la imagen más grande.
Discusión
La técnica descrita en este protocolo permite la entrega controlada de vacunas a los LNs y a las células presentadoras del antígeno LN-residentes. La carga encapsulada de biomateriales se puede localizar dentro de la LN, lo que permite la manipulación de las dosis de uno o más tipos de carga entregadas al microambiente de la LN. Se ha demostrado que la localización y liberación controlada de partículas poliméricas genera una potente respuesta inmune celular y humoral a dosis significativamente más bajas que los enfoques convencionales. Además, a través de la manipulación del tamaño del portador de biomateriales, el modo primario de procesamiento celular puede modularse entre la absorción directa de nanopartículas o la liberación de carga extracelular de micropartículas más grandes5. Estos resultados establecen la viabilidad de la entrega de biomateriales i.LN. como plataforma para la administración de vacunas terapéuticas.
La síntesis de partículas de PLGA por evaporación emulsión/disolvente ha sido ampliamente empleada en aplicaciones de administración de fármacos23,24. Por lo tanto, los desafíos potenciales asociados con esta técnica se relacionan principalmente con la identificación y deposición exitosas de vacunas en el sitio objetivo de LN. Aunque el uso del tinte trazador facilita la visualización de los LNs inguinales apuntados, el tamaño y la profundidad de la blanco debajo de la piel son pequeños. Por lo tanto, los autores recomiendan asignar tiempo y ratones para practicar la preparación e inyecciones de ratones. Durante la preparación animal(es decir, el afeitado y la aplicación de depilatorio), se debe tener cuidado de no cortar los ratones en el lado ventral del animal donde el ángulo de la pierna con el abdomen hace que la piel sea más propensa a las lesiones de los cortadores. Además, todos los depilatorios deben eliminarse con agua tibia para evitar que los animales ingieran la crema durante el comportamiento normal de aseo. Para practicar las inyecciones de LN, se puede administrar una mayor concentración de colorante trazador y los animales de práctica pueden ser eutanasiados y luego inyectados varias veces. Después de la inyección, los ratones pueden ser necropsiados y el tamaño de los LN de los animales inyectados se puede comparar con un LN de control no inyectado. Una limitación de esta técnica es el límite físico del volumen de inyección que se puede cargar en la estructura LN. Nuestro protocolo sugiere un volumen de inyección de 10 μl en ratones, aunque otros estudios han reportado volúmenes de inyección más grandes al menos tan altos como 20 μl.13 Sin embargo, la administración directa de vacunas a través de la inyección de i.LN. permite un ahorro dramático de dosis, por lo que la función de estas vacunas generalmente no debe estar limitada por restricciones de volumen.
Como se ha señalado, el cambio de la propiedad física de las partículas (esdecir, el tamaño) es un mecanismo eficaz para alterar la vía o los resultados inducidos por los biomateriales y las cargas encapsuladas en el tejido LN. El protocolo de evaporación de emulsión/disolvente puede modificarse fácilmente para alterar las propiedades físicas o químicas, como la carga o funcionalidad de la superficie, y la tasa de biodegradación/liberación de carga23,24. Por ejemplo, la cinética de liberación se puede ajustar a través de composiciones de polímeros alternativos, y la función de la superficie se puede alterar utilizando composiciones lipídicas modificadas o poli (alcohol vinílico). La carga cargada en partículas puede ser fácilmente manipulada para contener diferentes antígenos o adyuvantes para patógenos diana. La ventaja de este enfoque se logra mediante la combinación de la entrega i.LN. con la liberación local y controlada de carga de biomateriales. Esta sinergia establece una plataforma que puede ser explotada para generar de manera eficiente respuestas inmunes adaptativas utilizando dosis diminutas y con efectos secundarios inespecíficos/sistémicos reducidos.
Divulgaciones
Los costos de producción y las tarifas de acceso para estos artículos fueron parcialmente patrocinados por HORIBA, Ltd.
Agradecimientos
Este trabajo fue financiado en parte por la fundación PhRMA y un Premio a la Investigación y Académico de la Universidad de Maryland, College Park. Agradecemos al Prof. Darrell Irvine por el apoyo al trabajo inicial realizado en la finalización de la "Ingenieríain situ del microambiente de los ganglios linfáticos a través de la inyección intranodal de partículas poliméricas liberadoras de adyuvantes". 5.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
Referencias
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados