Method Article
Metodología Para La Generación Eficiente De Proteínas Del Virus Vaccinia Marcadas Fluorescentemente
* Estos autores han contribuido por igual
En este artículo
Resumen
Un protocolo rápido y modular para la generación de virus recombinantes de la vacuna que expresan las proteínas fluorescente marcadas simultáneamente usando el método de selección dominante transitoria se describe aquí.
Resumen
El etiquetado de proteínas virales con proteínas fluorescentes ha demostrado ser un enfoque indispensable para promover nuestra comprensión de las interacciones virus-huésped. El virus de vaccinia (VACV), la vacuna viva utilizada en la erradicación de la viruela, es particularmente susceptible a la microscopía fluorescente de células vivas debido a su gran tamaño de virión y la facilidad con la que se puede diseñar a nivel del genoma. Divulgamos aquí un protocolo optimizado para generar virus recombinantes. Se determinaron los requisitos mínimos para la recombinación homóloga dirigida durante la replicación de vaccinia, lo que permite la simplificación de la generación de constructos. Esto permitió la alianza de la selección dominante transitoria (TDS) con un reportero fluorescente y la selección metabólica para proporcionar un acercamiento rápido y modular a las proteínas virales fluorescente de la etiqueta. Al racionalizar la generación de virus recombinantes fluorescentes, podemos facilitar aplicaciones posteriores, como el análisis avanzado de imágenes de muchos aspectos de la interacción virus-huésped que se produce durante la replicación del virus.
Introducción
El virus de Vaccinia (VACV) es el poxvirus prototípico y altamente relacionado con el virus de la variola, el agente causativo de la viruela. Ambos virus son miembros del género Orthopox que incluye otros patógenos notables como la viruela del mono y el virus de la ectromelia (viruela del ratón)1. Los orthopoxvirus tienen grandes genomas de ADN de doble cadena (180-220 kb) que codifican más de 200 marcos de lectura abiertos predichos2,3. La replicación de estos virus implica la formación de una fábrica de virus perinucleares, donde se fabrican virus maduros (VM), y la red trans-Golgi donde un subconjunto de MV adquiere dos membranas adicionales para generar virus envueltos (WV) (revisado por Roberts y Smith4). Los genomas de la ortopóx son altamente susceptibles de manipulación genética debido al alto grado de recombinación genética que es una característica de la replicación del genoma vacv y está mediada por la ADN polimerasa viral5. La generación de virus recombinantes se basa en la recombinación homóloga y moléculas de ADN lineales con homologías tan pequeñas como 12 pb que son suficientes para mediar la recombinación en células infectadas por virus de vaccinia6. El etiquetado fluorescente del virus de la vaccinia puede producir partículas de virus extremadamente brillantes debido al gran tamaño de las partículas de ortopóso, lo que permite la incorporación de muchas proteínas fluorescentes por virión7. Vaccinia tiene la capacidad de transportar grandes fragmentos de ADN extraño8 y, además, la falta de simetría rígida de la cápside puede permitir un grado de flexibilidad a la hora de expresar fusiones de genes de proteínas virales a partir de sus loci endógenos9. El etiquetado fluorescente de las proteínas VACV ha demostrado ser invaluable para el estudio de las interacciones huésped-patógeno a nivel subcelular, particularmente en el campo de la entrada de virus10,transporte11-13,y morfogénesis, particularmente de viriones envueltos7.
Los virus recombinantes pueden ser seleccionados por rescate de un fenotipo de crecimiento atenuado14,15,selección metabólica16-18,o por expresión de un gen marcador (porejemplo, X-gal19 o proteína fluorescente13,20). Aquí describimos la selección de virus fluorescentes utilizando una poderosa combinación de selección fluorescente y metabólica. Los vectores de selección dominante transitoria (TDS), desarrollados por Faulkner y Moss (1990)21,permiten integrar marcadores junto con el gen de interés marcado fluorescentemente deseado. Cuando se elimina la selección metabólica, puede ocurrir un evento de recombinación secundaria que suprime los genes de selección, pero deja intacta la proteína del virus marcada con fluorescente. La Figura 2 a continuación proporciona una visión general del procedimiento experimental. Los genes de selección utilizados en este estudio son mCherry y el gen de la Guanina fosforibosiltransferasa de Escherichia coli (gpt),ambos expresados a partir de un promotor viral sintético temprano/tardío y utilizados previamente por Cordeiro et al. 22 Además, hay fluorescencia de la proteína de fusión etiquetada de interés. Cuando se elimina la selección metabólica, los marcadores seleccionables(mCherry y gpt)se eliminan, dejando solo la fluorescencia del gen marcado, lo que permite la identificación de los virus recombinantes correctos. La escisión de los marcadores de selección proporciona la posibilidad de combinar múltiples etiquetas fluorescentes, lo que nos permite crear virus con la capacidad de etiquetar fluorescentemente varias proteínas virales simultáneamente. Estudios previos han determinado los requisitos mínimos de homología para la recombinación de vaccinia de moléculas de ADN lineales y circulares transfectadas en células infectadas por virus vaccinia6. Se quiso determinar las eficiencias de recombinación de las diferentes longitudes de homología de los brazos flanqueantes en el vector TDS gpt-mCherry a través de su incorporación en el genoma viral de la vaccinia. Se determinó que las regiones homólogas de 100 pb en el vector TDS son suficientes para apuntar y mediar en la inserción de ADN recombinante en el genoma del VACV por recombinación homóloga(Figura 4). Mientras que las longitudes más pequeñas de la homología también permitirían la recombinación, las longitudes de la homología de 100 puntos de ebullición proporcionaron bastantes virus recombinantes que se podrían identificar fácilmente con la selección metabólica y fluorescente. Los fragmentos de ADN de este tamaño se pueden sintetizar comercialmente a un costo relativamente bajo y facilita en gran medida la producción de múltiples vectores para la creación de virus recombinantes. Se optó por aumentar la longitud de la homología a 150 pb para proporcionar una mayor frecuencia de recombinación mientras se mantienen bajos los costos de síntesis de la secuencia de oligonucleótidos de las regiones de flanqueo.
Protocolo
1. Creación del vector de recombinación
- Identificar las regiones de homología que flanquean de 150 pb de largo (denominadas brazos izquierdo y derecho) necesarias para etiquetar N o C terminalmente el gen viral de interés (Ver Figura 1b).
- Diseñe una secuencia de oligonucleótidos que comprenda los brazos izquierdo y derecho de 150 pb separados por un par de sitios de restricción de elección. Toda esta secuencia también debe estar flanqueada por un segundo par de sitios de restricción (diferente al primer par) para permitir la incorporación en el vector TDS una vez sintetizado. Tenga cuidado al diseñar el oligonucleótido con sitios de restricción que las secuencias están en el marco con el sitio de inserción deseado.
- Incorporar sitios de restricción entre los brazos izquierdo y derecho al diseñar el oligonucleótido para la síntesis, que deben coincidir con los que flanquean el marco de lectura abierto de la etiqueta fluorescente de elección (ver Figura 1b). Es posible utilizar un sitio de restricción NotI como un vinculador de tres aminoácidos entre el brazo izquierdo y el inicio de la etiqueta fluorescente.
- Incorporar estos mismos sitios de restricción a cada lado de la etiqueta fluorescente por PCR (ver Figura 1c).
- Clone el fragmento sintetizado en el vector TDS.
- Clone la etiqueta fluorescente en el vector de recombinación resultante utilizando los sitios de restricción entre las regiones de homología del brazo izquierdo y derecho (consulte la Figura 1d).
2. Generación de virus recombinantes
- Según la Figura 2,infectar una monocapa de células BS-C-1 con virus vaccinia en medios libres de suero a una multiplicidad de infección (MOI) > 1.
- 1 hora después de la infección, células de rescate con el medio de águila modificado de Dulbecco (DMEM) y transfecto con una mezcla de plásmido vectorial de recombinación y reactivo de transfección en una proporción de 3:1 en medios sin suero.
- Después de 24 horas, raspe y recupere las células en DMEM que no contiene ningún suero bovino fetal (FBS) y realice tres ciclos de congelación-descongelación para romper las células abiertas y para lanzar partículas del virus.
- Realice un ensayo de placa con una superposición líquida de 10% FBS DMEM y reactivos de selección GPT ácido micofenólico (25 μg/ml) y xantina (250 μg/ml) de la siguiente manera:
- Siembra una placa de 6 pozos con una monocapa de células BS-C-1.
- Infecte monocapas de células 100% confluentes con diluciones en serie de las células congeladas y descongeladas que contienen partículas de virus para garantizar una separación adecuada de las placas individuales.
- Superposición con FBS líquido al 10% que contiene DMEM que contiene los reactivos de selección de GPT - ácido micofenólico y xantina a concentraciones finales de 25 μg/ml y 250 μg/ml respectivamente.
- Después de una incubación de 24 horas, retire la superposición líquida y utilice un microscopio fluorescente para buscar placas que exhiban fluorescencia roja difusa correspondiente a la incorporación de mCherry del vector TDS en el virus. Dependiendo del gen objetivo y de la etiqueta fluorescente elegida, también se puede observar fluorescencia localizada del gen marcado en la misma placa roja.
- Elija múltiples placas para cada virus recombinante mediante raspado localizado con una punta de pipeta y 100 μl de FBS al 5% que contienen DMEM para transferir células a un tubo de Eppendorf, seguido de tres rondas de congelación-descongelación de células raspadas para liberar virus recombinantes.
- Agregue el DMEM que contiene el virus congelado-descongelado a una monocapa de células en una placa de 12 pozos para amplificar los virus recombinantes con los reactivos de la selección de GPT en los medios de crecimiento. Raspe las amplificaciones acertadas 24 infección del poste de la hora.
- Realice un ensayo de placa de placas amplificadas con éxito que exhiben fluorescencia roja, esta vez con una superposición de agarosa y selección de GPT, de la siguiente manera:
- Siembra una placa de 6 pozos con una monocapa de células BS-C-1.
- Realizar una dilución en serie de los virus recombinantes e infectar pozos con una dilución creciente de virus en DMEM libre de FBS.
- 1 hora después de la infección, retire los medios líquidos y superponga cada pozo con agarosa al 0,5% en un medio esencial mínimo (MEM) que contenga 2,5% de FBS, 292 μg/ml de L-glutamina, 100 U/ml de penicilina y 100 μg/ml de estreptomicina, junto con los reactivos de selección de GPT.
- 2-3 días después de la infección, recoger placas que muestran fluorescencia que es a la vez rojo y el color de la etiqueta fluorescente elegida para amplificar de nuevo, esta vez sin selección de GPT.
- Realice el siguiente ensayo de placa con una superposición de agarosa sin selección.
- Elija las placas que han perdido su fluorescencia roja difusa pero conservan la fluorescencia localizada correspondiente a la etiqueta de elección.
- Continuar la purificación de la placa sin selección para obtener un stock puro de virus recombinantes que han perdido los genes de selección mCherry y gpt pero conservan la fluorescencia localizada correspondiente a la etiqueta elegida. Compruebe que las existencias son puras por ensayo de placa, todas las placas deben tener un fenotipo de placa similar.
- Utilice la detección por PCR del ADN genómico para asegurarse de que las existencias virales sean puras.
- Diseñe cebadores que flanqueen el sitio de inserción del gen fluorescente y cebadores que amplifiquen el gen fluorescente insertado en sí. Diferentes combinaciones de estos cebadores producirán amplicones de PCR que detectarán la inserción génica e indicarán pureza.
- Amplificar las existencias virales para ser cribado por PCR en un pozo de una monocapa de placa de 12 pozos de células BS-C-1.
- 24 horas después de la infección, raspar las células infectadas en 250 μl de DMEM.
- Centrífuga las células infectadas (18.000 x g durante 10 min, 4 °C), eliminar el sobrenadante y el pellet de células resuspénd en 500 μl de TE (10 mM Tris-HCl y 1 mM de EDTA, pH 8) con SDS al 0,1% (v/v). Vórtice para lisear células.
- Añadir 500 μl de fenol-cloroformo-isoamilo acohol, invertir para mezclar. Centrífuga (18.000 x g durante 4 min, 4 °C). Tome el sobrenadante y repita.
- Realizar una precipitación de etanol sobre el sobrenadante añadiendo 1 ml 100% etanol (refrigerado) y 50 μl de acetato de sodio, invertido para mezclar.
- Dejar a -20 °C durante la noche o -80 °C durante 1 hora. Centrífuga (18.000 x g durante 30 min, 4 °C), eliminar todo el líquido y dejar que el ADN precipitado se seque al aire. Resuspend en 50 μl TE.
- Utilícese esto como una plantilla para la detección de PCR de ADN genómico.
3. Generación de virus recombinantes que llevan más de una etiqueta
- Coinfectar la misma monocapa celular con virus recombinantes fluorescentes para crear virus doble o triple etiquetados o repetir el procedimiento del Protocolo 1) con una etiqueta diferente.
- Purificar los virus en función del fenotipo de la placa o de la investigación de la polimerización en cadena de la DNA genomic aislada del virus.
Resultados
La Figura 1 enumera las diversas construcciones que se requieren para este procedimiento, que se sintetizan(Figuras 1b y 1c)o se crean mediante pasos de clonación(Figura 1d). La Figura 2 proporciona un esquema del procedimiento experimental con imágenes representativas de placa fluorescente de un VACV recombinante A3-GFP representado para cada paso del proceso de selección. En la Figura 3,se muestran los virus de la vacuna recombinante que expresan proteínas etiquetadas con marcadores fluorescentes dirigidos a las proteínas estructurales virales A3 y F13, que forman parte del núcleo interno del virus23 y de la envoltura externa24,respectivamente. Se representan observaciones de placas virales y células infectadas para cada uno de los virus recombinantes creados. Se probó la eficiencia de la recombinación homóloga de vectores con el genoma vacv, que contiene tan sólo 70 pb de regiones de homología a la misma, y los resultados se representan en la Figura 4. El éxito relativo de la identificación de placas virales hechas de la recombinación con los vectores que contenían la homología de 100 puntos de ebullición era el razonamiento detrás de elegir sintetizar los brazos izquierdos y derechos de la longitud de 150 puntos de ebullición de la homología al gene de la blanco.
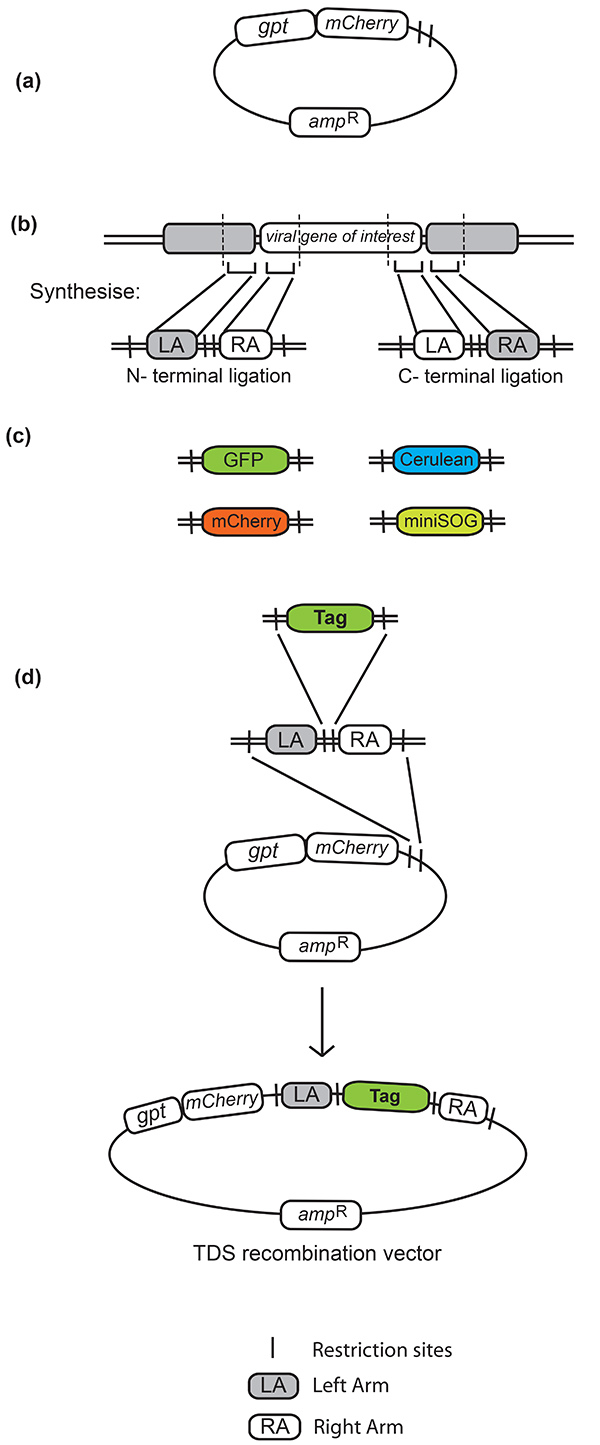
Figura 1. Vector de recombinación de selección dominante transitoria (TDS). (a) Vector TDS con marcadores de selección gpt y mCherry. (b)Los brazos izquierdo y derecho de la homología están diseñados con sitios de restricción específicos en el medio y flanqueando los brazos de la homología. Los sitios de restricción entre los brazos izquierdo y derecho utilizados en este método fueron NotI y BamHI, el sitio NotI también se utiliza como un enlazador entre el gen y la etiqueta fluorescente. (c)Las etiquetas fluorescentes compatibles con este método están flanqueadas por los sitios de restricción correspondientes. Algunas etiquetas empleadas son GFP (proteína fluorescente verde), RFP (proteína fluorescente roja), Cerúleo (una mejora de ECFP, una proteína fluorescente cian, por mutagénesis dirigida por el sitio25)y mini-SOG, una proteína fluorescente diseñada a partir de GFP que crea un producto resoluble por EM en iluminación26. d)Pasos de clonación implicados en la generación del vector de recombinación TDS final. El oligonucleótido sintetizado que contiene los brazos flanqueantes izquierdo y derecho se clona primero en el vector TDS. Esto proporciona un vector de recombinación en el que cualquier etiqueta de elección puede ser transportada dentro y fuera por clonación en los sitios de restricción incorporados entre los brazos izquierdo y derecho. Haga clic aquí para ver la imagen más grande.
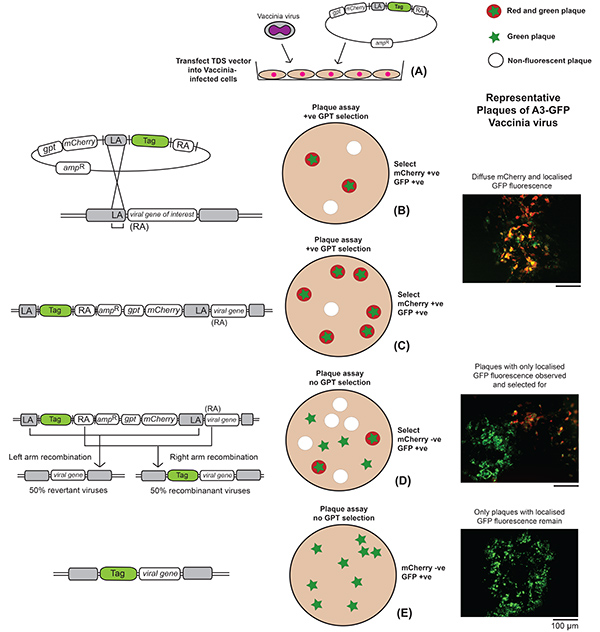
Figura 2. Esquema del procedimiento experimental para crear un virus de vaccinia recombinante. Los acontecimientos que ocurren en los niveles genéticos y celulares se representan, junto con las imágenes representativas de la placa que delinean los pasos que siguen la creación de un virus fluorescente A3-GFP-labeled de la vacuna. (A) Las células infectadas con el virus de la vaccinia se transfectan con el vector de recombinación TDS. (B) En esta figura, sólo se representa el resultado de la recombinación de la mano izquierda y el ejemplo utiliza GFP como la etiqueta fluorescente de elección. La recombinación de la derecha daría lugar a que todo el plásmido TDS se incorporara al genoma de una manera similar, excepto que la etiqueta se fusionaría con todo el gen diana en el paso intermedio, es decir, el paso C. Un ensayo de placa se realiza en una monocapa celular con la mezcla de recombinación y se somete a la selección de GPT. (C)Las placas que exhiben fluorescencia roja y verde, correspondientes a la expresión de mCherry y GFP respectivamente, se recogen y amplifican. Una vez que se elimina la selección, habrá pérdida de fluorescencia roja correspondiente a la pérdida de los genes gpt y mCherry (D)y las placas que exhiben exclusivamente fluorescencia verde se recogen y amplifican(E). Haga clic aquí para ver la imagen más grande.
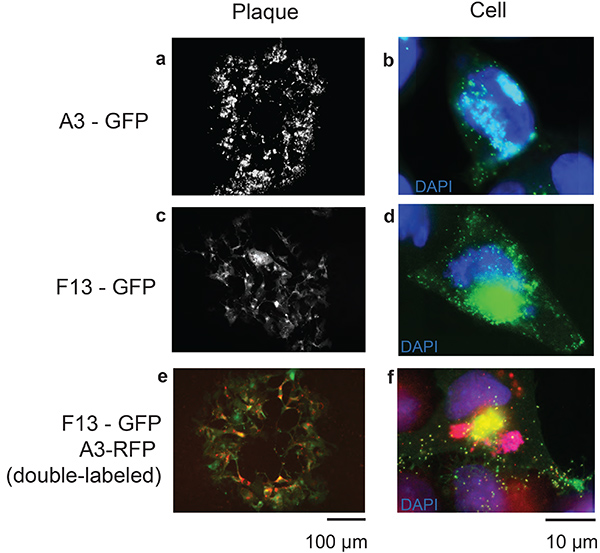
Figura 3. Resultados representativos del sistema de recombinación TDS. Las imágenes representan placas enteras de VACV recombinante infectando células después de 48 horas(a, c, e; barra de escala 100 μm), acompañadas de una imagen de una sola célula infectada por el virus recombinante correspondiente después de 8 horas(b, d, f; escala bar 10 μm). Se seleccionaron genes correspondientes a proteínas localizadas en viriones para visualizar partículas de virus. A3 es una proteína central del virión vaccinia(a, b) y F13 (c, d) es una proteína de envoltura viral. También se muestra un virus doble etiquetado con A3 y F13(e, f)marcados fluorescentemente. Haga clic aquí para ver la imagen más grande.
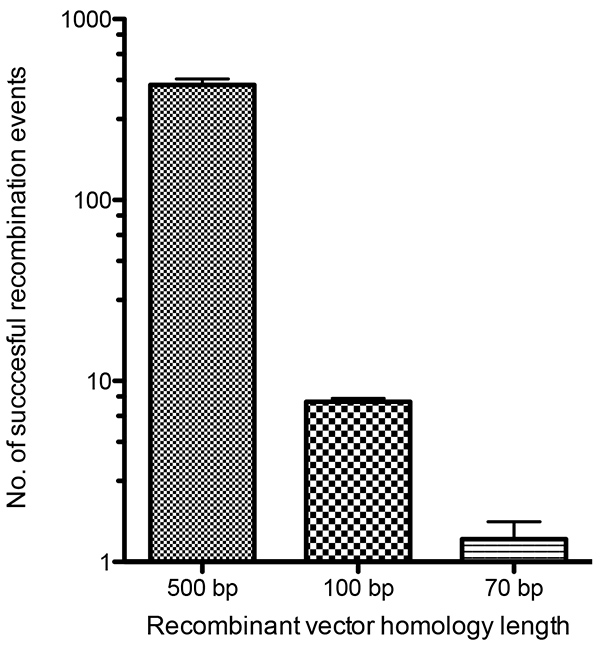
Figura 4. Análisis cuantitativo de las eficiencias de recombinación entre los vectores recombinantes y el genoma vacv. Las monocapas BS-C-1 fueron infectadas con VACV y transfected 1 poste-infección de la hora con tres vectores de la recombinación que contenían regiones de la homología de 500 puntos de ebullición, de 100 puntos de ebullición, o de 70 puntos de ebullición al genoma de VACV. Cada vector también contenía el casete TDS que comprendía los genes de selección gpt y mCherry. Las células fueron recuperadas 24 horas después de la infección y lised para liberar los virus recombinantes formados. Los análisis de la placa fueron realizados en los lysates de la célula con los medios de selección de GPT y las placas que demostraban fluorescencia del mCherry fueron contadas como recombinantes acertadas. Haga clic aquí para ver la imagen más grande.
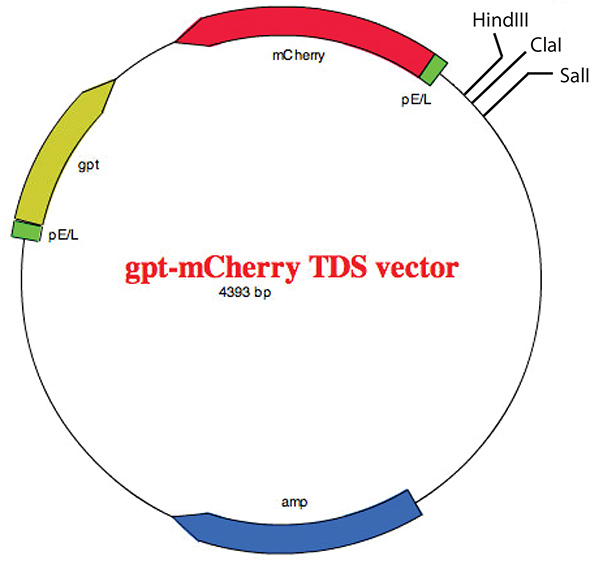
Figura 5. Mapa del vector TDS gpt-mCherry que muestra el sitio de clonación múltiple. El vector ha sido descritopreviamente 22 y el mapa vectorial fue creado con la ayuda de EZ Plasmid Map v1.9 del Zhang Lab Group (SCU). Haga clic aquí para ver la imagen más grande.
Discusión
Esta técnica describe un protocolo eficiente y modular para la creación de virus recombinantes que expresan proteínas virales marcadas fluorescentemente. El método asegura que el único cambio en el genoma viral es la adición de una etiqueta o marcador, sin dejar marcadores de selección. La corta longitud del brazo requerida para la recombinación homóloga permite su síntesis directa, eliminando varias rondas que consumen mucho tiempo de PCR y clonación, mientras que la fluorescencia de mCherry y la selección metabólica de GPT se utilizan para aislar los intermedios de recombinación viral. Estos intermedios se pueden resolver, después de la eliminación de la selección, a un virus con un gen marcado o de nuevo al tipo parental. Un método similar que implica el uso de la selección fluorescente y metabólica se ha descritopreviamente 27 aunque el método usado en este estudio utilice regiones más cortas, sintetizadas de la homología, permitiendo la identificación del virus recombinante deseado proyección de imagen la fluorescencia del gene marcado de interés. Esta selección secundaria solo es aplicable para el etiquetado de genes virales altamente expresados que producen suficiente fluorescencia en un ensayo de placa. Alternativamente, se podría prever la inserción de un casete de expresión completa, por ejemplo una proteína fluorescente bajo un fuerte promotor viral. En este caso, los brazos izquierdo y derecho definirían el punto de inserción en lugar del gen viral a etiquetar.
Hay algunos pasos clave que resultaron útiles durante el procedimiento experimental. La superposición líquida en el paso 2.3.3 descrito anteriormente resultó crucial para la detección y aislamiento de placas fluorescentes rojas/verdes. Creemos que la combinación de los reactivos de selección de GPT y la superposición de agarosa disuadió el crecimiento de virus recombinantes y, por lo tanto, cambió a una superposición líquida para el primer paso de amplificar los virus después de la transfección. También es importante elegir placas fluorescentes que muestren fluorescencia de color de etiqueta localizada para el enriquecimiento y la purificación, ya que los productos intermedios resultantes de la recombinación del brazo izquierdo pueden resultar en fluorescencia difusa observada en placas si el brazo izquierdo también contiene una secuencia promotora. El gen marcador mCherry en el vector TDS también puede ser reemplazado por gfp,por ejemplo, para permitir la fácil incorporación y selección de mCherry como una etiqueta fluorescente.
Algunas técnicas descritas anteriormente varían ligeramente de los métodos establecidos para crear el virus de la vaccinia recombinante. Por ejemplo, el MOI del virus utilizado para crear recombinantes es normalmente inferior a 128,sin embargo, el uso de MOIs más altos ha sido suficiente para la creación de virus de vaccinia recombinante por este método. El uso de reactivos de selección de GPT normalmente requiere la preincubación de las células con reactivos de selección18,sin embargo, agregarlos durante la fase de rescate posterior a la infección todavía proporcionó suficiente selección de recombinantes deseados, particularmente debido a la presencia de un marcador de selección fluorescente también.
Como se mencionó anteriormente, una de las limitaciones de esta técnica es que el paso secundario de selección de fluorescencia se basa en que la proteína etiquetada de interés esté altamente expresada, a un nivel que permita su detección por ojo en un ensayo de placa. Sin esto, sería posible purificar virus que solo exhibieron fluorescencia mCherry, de los cuales al menos el 50% contendría los virus recombinantes deseados, que podrían ser identificados mediante estrategias moleculares como la PCR descrita en el paso 2.12 anterior. Otra limitación podría ser la inactivación de ciertas proteínas como resultado de su etiquetado. La etiqueta fluorescente puede sufrir mutaciones o ser extirpada por el virus recombinante con el paso con el tiempo. Por lo tanto, se recomienda el muestreo regular de las existencias de virus recombinantes por microscopía y PCR. Finalmente, puede haber un límite en el número de proteínas marcadas fluorescentemente que se pueden incorporar en un solo virus. Un aspecto de esto es la capacidad de visualizarlos a todos simultáneamente; dada la naturaleza superpuesta de los espectros de emisión de las etiquetas fluorescentes disponibles, es importante seleccionarlas cuidadosamente para garantizar un sangrado espectral mínimo. Además, el uso de etiquetas estrechamente relacionadas como GFP y Cerúleo abre la posibilidad de recombinación entre los dos, dependiendo de sus ubicaciones en el genoma recombinante.
La naturaleza modular de esta técnica permite la sustitución simple de etiquetas fluorescentes basadas en la compatibilidad con otras opciones de tinción y / o etiquetas. Mediante la eliminación de marcadores seleccionables, el método TDS permite la adición en serie de varias proteínas fluorescentes o la combinación de etiquetado basado en TDS con deleciones de genes basadas en TDS para análisis fenotípicos29. Como ejemplo de la utilidad de este enfoque, se generó un virus fluorescente de doble etiqueta que etiqueta los núcleos del virus y la membrana WV. Los estudios de imágenes con este virus podrían utilizarse para estudiar el movimiento, la morfogénesis y el envoltorio del virus durante la replicación del virus. Las proteínas virales de vaccinia aún no caracterizados también pueden ser etiquetadas y estudiadas por esta técnica.
El virus de Vaccinia se ha utilizado extensivamente en estudios de la proyección de imagen debido a muchas características del virus que son favorables a la microscopia de la vivir-célula. Las etiquetas fluorescentes se expresan a partir del genoma viral, eliminando la necesidad de transfección, lo que permite analizar fácilmente las células primarias derivadas de animales infectados o células no transmisibles. Inicialmente, los VVV fluorescentes se utilizaron para el seguimiento subcelular simple del movimiento del virus30,pero los enfoques más recientes han ampliado su utilidad para incluir estudios FRET31,FRAP en partículas de virus único32,reporteros promotores33,imágenes intravitales34y estudios estructurales35-37. Todas estas técnicas podrían estar al alcance de la mano junto con este método de creación de virus fluorescentes recombinantes.
Divulgaciones
No se declaran conflictos de intereses.
Agradecimientos
Este trabajo fue financiado por la subvención del Proyecto de Descubrimiento de la Federación australiana del Consejo de Investigación #1096623.
Materiales
| Name | Company | Catalog Number | Comments |
| Mycophenolic acid | Sigma-Aldrich | M3536-50MG | Dissolve in 0.1 N NaOH |
| Xanthine | Sigma-Aldrich | X0626-5G | Dissolve in 0.1 N NaoH |
| FuGENE HD transfection reagent | Promega | E2311 | |
| Fluorescence microscope fitted with Chroma filters 31001, 31002 | Olympus, Chroma | BX51 (Olympus); 31001, 31002 (Chroma) |
Referencias
- Fenner, F. Adventures with poxviruses of vertebrates. FEMS Microbiol. Rev. 24, 123-133 (2000).
- Goebel, S. J., et al. The Complete DNA-Sequence of Vaccinia Virus. Virology. 179, 247-266 (1990).
- Smith, G. L., Chan, Y. S., Howard, S. T. Nucleotide-sequence of 42 kbp of vaccinia virus-strain WR from near the right inverted terminal repeat. J. Gen. Virol. 72, 1349-1376 (1991).
- Roberts, K. L., Smith, G. L. Vaccinia virus morphogenesis and dissemination. Trends Microbiol. 16, 472-479 (2008).
- Gammon, D. B., Evans, D. H. The 3 '-to-5 ' Exonuclease Activity of Vaccinia Virus DNA Polymerase Is Essential and Plays a Role in Promoting Virus Genetic Recombination. J. Virol. 83, 4236-4250 (2009).
- Yao, X. D., Evans, D. H. Effects of DNA structure and homology length on vaccinia virus recombination. J. Virol. 75, 6923-6932 (2001).
- Ward, B., Isaacs, S. N. . Ch. 16 Vaccinia Virus and Poxvirology Vol. 269 Methods in Molecular Biology. 16, 205-218 (2004).
- Smith, G. L., Moss, B. Infectious Poxvirus Vectors Have Capacity for at Least 25,000. Base-Pairs of Foreign DNA. Gene. 25, 21-28 (1983).
- Heuser, J. Deep-etch EM reveals that the early poxvirus envelope is a single membrane bilayer stabilized by a geodetic "honeycomb" surface coat. J. Cell Biol. 169, 269-283 (2005).
- Schmidt, F. I., Bleck, C. K. E., Mercer, J. Poxvirus host cell entry. Curr. Opin. Virol. 2, 20-27 (2012).
- Ward, B. M. Visualization and characterization of the intracellular movement of vaccinia virus intracellular mature virions. J. Virol. 79, 4755-4763 (2005).
- Carter, G. C., et al. Vaccinia virus cores are transported on microtubules. J. Gen. Virol. 84, 2443-2458 (2003).
- Ward, B. M., Moss, B. Visualization of intracellular movement of vaccinia virus virions containing a green fluorescent protein-B5R membrane protein chimera. J. Virol. 75, 4802-4813 (2001).
- Rodriguez, J. F., Esteban, M. Plaque size phenotype as a selectable marker to generate vaccinia virus recombinants. J. Virol. 63, 997-1001 (1989).
- Blasco, R., Moss, B. Selection of recombinant vaccinia viruses on the basis of plaque-formation. Gene. 158, 157-162 (1995).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus - a selectable eukaryotic cloning and expression vector. Proc. Natl. Acad. Sci. U.S.A. 79, 7415-7419 (1982).
- Panicali, D., Grzelecki, A., Huang, C. Vaccinia virus vectors utilizing the beta-galactosidase assay for rapid selection of recombinant viruses and measurement of gene-expression. Gene. 47, 193-199 (1986).
- Falkner, F. G., Moss, B. Escherichia-coli gpt gene provides dominant selection for vaccinia virus open reading frame expression vectors. J. Virol. 62, 1849-1854 (1988).
- Liu, G. Q., et al. Selection of recombinant vaccinia viruses (Tian-Tan strain) expressing hepatitis-B virus surface-antigen by using beta-galactosidase as a marker. Sci. China Ser. B-Chem. 33, 188-197 (1990).
- Domínguez, J., Lorenzo, M. D. M., Blasco, R. Green fluorescent protein expressed by a recombinant vaccinia virus permits early detection of infected cells by flow cytometry. J. Immunol. Methods. 220, 115-121 (1998).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. J. Virol. 64, 3108-3111 (1990).
- Cordeiro, J. V., et al. F11-Mediated Inhibition of RhoA Signalling Enhances the Spread of Vaccinia Virus In Vitro and In Vivo in an Intranasal Mouse Model of Infection. Plos One. 4, (2009).
- Jensen, O. N., et al. Identification of the major membrane and core proteins of vaccinia virus by two-dimensional electrophoresis. J. Virol. 70, 7485-7497 (1996).
- Hirt, P., Hiller, G., Wittek, R. Localization and Fine-Structure of a Vaccinia Virus Gene Encoding an Envelope Antigen. J. Virol. 58, 757-764 (1986).
- Rizzo, M. A., Springer, G. H., Granada, B., Piston, D. W. An improved cyan fluorescent protein variant useful for. 22, 445-449 (2004).
- Shu, X. K., et al. A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. Plos Biol. 9, (2011).
- Wong, Y. C., Lin, L. C. W., Melo-Silva, C. R., Smith, S. A., Tscharke, D. C. Engineering recombinant poxviruses using a compact GFP-blasticidin resistance fusion gene for selection. J. Virol. Methods. 171, 295-298 (2011).
- Broder, C. C., Earl, P. L. . 62, 173-197 (1997).
- Blasco, R., Moss, B. Extracellular Vaccinia virus formation and cell-to-cell virus transmission are prevented by deletion of the gene encoding the 37,000-dalton outer envelope protein. J. Virol. 65, 5910-5920 (1991).
- Newsome, T. P., Marty, A. J., Lynn, H., Procter, D. J., Diefenbach, R. J., Cunningham, A. L. Ch. Navigating the subcellular space: Lessons from vaccinia virus. Viral Transport, Assembly and Egress. , 155-177 (2011).
- Jeshtadi, A., et al. Interaction of Poxvirus Intracellular Mature Virion Proteins with the TPR Domain of Kinesin Light Chain in Live Infected Cells Revealed by Two-Photon-Induced Fluorescence Resonance Energy Transfer Fluorescence Lifetime Imaging Microscopy. J. Virol. 84, 12886-12894 (2010).
- Weisswange, I., Newsome, T. P., Schleich, S., Way, M. The rate of N-WASP exchange limits the extent of ARP2/3-complex-dependent actin-based motility. Nature. 458, (2009).
- Dower, K., Rubins, K. H., Hensley, L. E., Connor, J. H. Development of Vaccinia reporter viruses for rapid, high content analysis of viral function at all stages of gene expression. Antiviral Res. 91, 72-80 (2011).
- Dénes, B., Fodor, N., Obenaus, A., F, I. Engineering oncolytic Vaccinia viruses for non-invasive optical imaging of tumors. Open Biotechnol. J. 2, 252-261 (2008).
- Humphries, A. C., et al. Clathrin Potentiates Vaccinia-Induced Actin Polymerization to Facilitate Viral Spread. Cell Host Microbe. 12, 346-359 (2012).
- Horsington, J., Turnbull, L., Whitchurch, C. B., Newsome, T. P. Sub-viral imaging of vaccinia virus using super-resolution microscopy. J. Virol. Methods. 186, 132-136 (2012).
- Horsington, J., et al. A36-dependent Actin Filament Nucleation Promotes Release of Vaccinia Virus. PLoS Pathog. 9, (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados