Method Article
Visualización de la proteína-DNA en células bacterianas en directo mediante fotoactivado Tracking Single-molécula
En este artículo
Resumen
Microscopía de localización fotoactivado (PALM) combinada con el seguimiento de una sola molécula permite la observación directa y la cuantificación de la proteína-DNA en células de E. coli vivas de Escherichia.
Resumen
Proteína-DNA están en el corazón de muchos procesos celulares fundamentales. Por ejemplo, la replicación del ADN, transcripción, reparación y organización de los cromosomas se rigen por las proteínas de unión al ADN que reconocen estructuras o secuencias específicas de ADN. Experimentos in vitro han ayudado a generar modelos detallados para la función de muchos tipos de proteínas de unión al ADN, sin embargo, , los mecanismos exactos de estos procesos y su organización en el complejo entorno de la célula viva siguen siendo mucho menos comprendidos. Recientemente hemos introducido un método para cuantificar las actividades de reparación del ADN en células de Escherichia coli en vivo usando fotoactivado Localización Microscopía (PALM) combinada con el seguimiento de una sola molécula. Nuestro enfoque general identifica los eventos de unión al ADN individuales por el cambio en la movilidad de una sola proteína en asociación con el cromosoma. La fracción de moléculas ligadas proporciona una medida cuantitativa directa para el acto de proteínasividad y abundancia de sustratos o sitios de unión a nivel de una sola célula. A continuación, describimos el concepto del método y demostrar la preparación de muestras, adquisición de datos, y los procedimientos de análisis de datos.
Introducción
Este protocolo describe la medición directa de la proteína-DNA en células de Escherichia coli que viven. La técnica utiliza el cambio en el coeficiente de difusión de una sola proteína marcada con fluorescencia ya que se une el cromosoma (Figura 1). Para demostrar el método que utilizamos ADN polimerasa, una proteína de unión al ADN prototípico I (Pol1) que llena las lagunas de ADN en la replicación del filamento de revestimiento y las vías de reparación por escisión de 1.
El advenimiento de la microscopía de fluorescencia de super-resolución permite la visualización de estructuras moleculares en las células con resolución nanométrica. Fotoactivado Localización Microscopía (PALM) emplea las proteínas fluorescentes que se pueden activar desde un estado oscuro inicial a un estado fluorescente (Figura 2). Sólo un subconjunto de todas las moléculas marcadas se activa en cualquier momento para determinar sus posiciones de una manera secuencial, de forma independiente de Tque suman concentración de moléculas marcadas en la muestra 2. La precisión de localización por molécula depende principalmente del tamaño de la Función Point Spread fluorescente (PSF), el número de fotones recogidos, y la señal de fondo 3. Muchas aplicaciones de este método se centran en la mejora de la visualización de las estructuras celulares. La realización que Palm se puede combinar con una sola molécula de seguimiento de 4 abierto nuevas vías para seguir directamente el movimiento de un número arbitrario de proteínas marcadas en las células vivas. Aumento de la sensibilidad y la resolución temporal de los microscopios de fluorescencia ahora permiten el seguimiento de las proteínas fluorescentes difunden individuales en el citoplasma bacteriano 5.
Aquí, utilizamos PAmCherry, una proteína fluorescente ingeniería que convierte irreversiblemente desde un estado inicial no fluorescente a un estado fluorescente tras la irradiación con 405 nm de luz 6. Fluoróforos PAmCherry activados pueden ser imagend por excitación a 561 nm y un seguimiento durante varias tramas hasta photobleaching. Se demuestra la capacidad del método para identificar eventos de unión al ADN transitorias de proteínas individuales utilizando una fusión de Pol1 y PAmCherry. El tratamiento de células con metil metanosulfonato (MMS) causa daño metilación del ADN que se convirtió en sustratos de ADN con huecos por las enzimas de reparación de base-escisión. Nuestro método muestra la unión de moléculas individuales POL1 claro en respuesta al daño MMS 7.
Protocolo
1. Cultivo Celular
Utilice tubos de cultivo estériles y puntas de pipeta. La E. coli cepa AB1157 Pola PAmCherry lleva un PAmCherry fusión C-terminal de Pol1. La fusión se inserta en la ubicación cromosómica nativa mediante la sustitución del gen de tipo salvaje utilizando recombinación lambda Red como se describe en Datsenko et al. 8 La funcionalidad de la proteína de fusión se confirmó a juzgar por las tasas de crecimiento celular y la sensibilidad a la que daña el ADN metil agente metanosulfonato (MMS). Más información sobre la construcción de la cepa de células se puede encontrar en Uphoff et al. 7, Datsenko et al. 8, y Reyes-Lamothe et al. 9 Los cultivos de células se cultivan en medio M9 mínimo para reducir la autofluorescencia y evitar las partículas de fondo en el portaobjetos de un microscopio. Alternativamente, un medio definido rico en nutrientes se puede utilizar 10.
- Racha de la E. AB115 coli cepa7 Pola PAmCherry de un stock de glicerol congelado en una placa de agarosa de caldo de Luria (LB) con antibióticos selectivos (aquí, 25 mg / ml de kanamicina) y se incuba a 37 ° C durante la noche.
- Inocular un cultivo de 5 ml de LB a partir de una sola colonia de células y crecer a 37 ° C con agitación a 220 rpm durante 3 horas.
- Diluir la cultura 1:10.000 en 5 ml de medio mínimo (medio M9, aminoácidos MEM + prolina, vitaminas MEM, 0,2% de glicerol) y se incuba a 37 ° C con agitación a 220 rpm durante la noche.
- A la mañana siguiente, medir la densidad óptica (DO) usando un espectrofotómetro y se diluye el cultivo en 5 ml de medio mínimo fresco a OD 0,025. Crecer durante 2 horas a 37 ° C con agitación a 220 rpm hasta la fase exponencial temprana (OD 0,1).
- Concentrado 1 ml de células en un tubo de microcentrífuga de 1,5 ml por centrifugación a 2300 xg durante 5 min. Eliminar el sobrenadante y resuspender el botón celular en 20 l medio residual y vórtice.
2. Portaobjetos de microscopio Preparation
- Preparar una solución de agarosa de baja fluorescencia del 1,5% en DH 2 O. Utilice un horno de microondas para fundir la agarosa hasta que la solución es clara. Mezclar 500 l de la solución de agarosa fundida con 500 l de medio mínimo 2x pipeteando suavemente hacia arriba y abajo varias veces.
- Corre la solución de agarosa de manera uniforme en el centro de un cubreobjetos de microscopio (n 1.5 espesor). Esto tiene que hacerse rápidamente antes enfría la agarosa, evitando las burbujas.
- Acoplar la almohadilla con un segundo cubreobjetos (No 1.5 espesor). Para eliminar las partículas fluorescentes de fondo, cubreobjetos fueron quemados previamente en un horno a 500 ° C durante 1 hora. Cubreobjetos quemadas pueden ser almacenados durante semanas a temperatura ambiente cubierto de papel de aluminio.
- En experimentos de daño en el DNA, preparar una plataforma de agarosa que contiene 100 mM MMS. Siga el procedimiento de los pasos 2.1 a 2.3, pero añadir 8,3 MMS mu l a 500 l de medio M9 antes de la mezcla con 500 l de 1,5% de agarosa fundida, para una concentración final de 100 mM de MMS. (NOTA: MMS es tóxico y mutagénico y debe manejarse con guantes, mascarilla, gafas y bata de laboratorio).
- Retire el carro superior de la almohadilla y añadir 1 l de suspensión celular concentrada en la almohadilla. Inmovilizar las células cubriendo la almohadilla con un cubreobjetos sin usar quemada (No 1.5 espesor, haciendo coincidir la especificación objetivo de microscopio) y presionando muy suavemente en la diapositiva. Las células deben ser reflejados dentro de los 45 min de inmovilización antes de que se seque la almohadilla de agarosa. Para evitar que se sequen durante los experimentos más largos, agarosa almohadillas pueden ser sellados mediante juntas de silicio.
- Por experimentos daño de ADN, incubar las células inmovilizadas sobre la almohadilla de agarosa que contiene 100 mM de MMS durante 20 min en una recipiente humidificada a temperatura ambiente antes de formación de imágenes.
3. Preparación de Microscopía de Adquisición de Datos
PALMA basa en la detección y localización precisa de las proteínas fluorescentes individuales. La sensibilidad y la alineación óptima deel microscopio es crítico para la calidad de los datos. Microscopios de fluorescencia individual-molécula emplean típicamente reflexión total interna (TIR) de iluminación para mejorar la relación señal a ruido por emocionantes sólo fluoróforos dentro de una sección delgada por encima de la superficie del cubreobjetos. Aquí, las imágenes en el interior de E. coli requiere la iluminación muy inclinado el 11, que se puede conseguir en el microscopio TIRF al disminuir ligeramente el ángulo de la luz de excitación. De formación de imágenes PAmCherry requiere, además, un láser de fotoactivación 405 nm y un láser de excitación de 561 nm. La emisión de fluorescencia se registra en un electrón multiplicando CCD (EMCCD) de la cámara con un aumento resultante en una longitud de píxel de 114,5 nm / píxel. Para una precisión óptima localización, el tamaño del pixel debe coincidir aproximadamente con la anchura de la desviación estándar de la PSF para asegurar un muestreo suficiente sin la propagación de la señal a través de muchos píxeles. Figura 3 muestra un esquema de una configuración mínima PALMA. Película 1da la impresión de que el proceso de construcción del microscopio a medida, véase Uphoff et al 7 para una descripción detallada del instrumento..
- Realizar la alineación rutina microscopio. Mida el 405 nm y 561 nm intensidades de láser de onda continua en frente del objetivo. Ajuste la intensidad de 561 nm a 3,5 mW (~ 400 W / cm 2) y 405 nm intensidad de 10 mW (~ 1 W / cm 2). Use una rueda de filtros de densidad neutral variable continua que permite el ajuste gradual de la intensidad de 405 nm de 0-10 mW. Desconectar la iluminación láser hasta el inicio del experimento.
- Coloque la muestra en la platina del microscopio y traer las células en enfoque en el modo de microscopía de luz transmitida (Figura 4 A). La ganancia de la cámara EMCCD tiene que ser apagado para evitar daños en la cámara por la sobreexposición.
- Definir un FOV recortado para reducir el tamaño de los datos y aumentar la velocidad de lectura de la cámara.
- Cubra la muestra de la luz ambiente y switch en la ganancia de la cámara EMCCD.
- Ajuste la velocidad de fotogramas de 15,26 ms / frame (incluyendo 0.26 cámara ms tiempo de lectura). Véase "tiempo de exposición y de excitación intensidades" en la sección de discusión.
- Visualice los datos de la cámara para comprobar la señal de fondo oscuro (Figura 4B).
- Encienda el láser de 561 nm y comprobar la señal de fondo de excitación (Figura 4C).
- Encienda el láser de 405 nm para la fotoactivación de las proteínas de fusión Pol1-PAmCherry y aumentar la intensidad hasta que aparezcan PSFs fluorescencia.
- Ajustar el ángulo del haz de excitación para iluminar sólo una sección delgada de la muestra cerca de la superficie cubreobjetos.
- Para este fin, el haz de láser se enfoca en el plano focal posterior de un 1,4 objetivo 100X NA (Figura 3). La traducción de la lente de enfoque perpendicular a la viga se mueve el foco de distancia desde el centro del objetivo haciendo que el haz para salir del objetivo bajo un ángulo.
- Aim para maximizar la intensidad de fluorescencia y minimizar la señal de fondo. Tenga en cuenta que el estricto excitación TIR es óptimo fluoróforos imágenes dentro de 100 nm de la superficie del cubreobjetos, sin embargo, las proteínas de unión al ADN de imágenes asociadas a la E. coli nucleoide requiere una iluminación más profunda hasta 0,8 micras.
4. Adquisición de Datos
Aquí se describe el protocolo general para la adquisición de una película PALMA. El mismo procedimiento se aplica para obtener imágenes de las proteínas de fusión Pol1-PAmCherry en buen estado E. coli células y bajo tratamiento de daño del ADN continuo con MMS. La aplicación del método de las proteínas de fusión de diferente peso molecular o número de copias por célula requerirá diferentes ajustes de adquisición (véase la sección de debate).
- Encontrar un nuevo campo de visión (FOV) de las células en el modo de microscopía de luz transmitida y enfocar la imagen. Tomar una instantánea de la cámara para registrar la contornos celulares (Figura 4A).
- Cubra la muestra de la luz ambiente y encienda la ganancia de la cámara EMCCD.
- Encienda el láser de 561 nm y blanquear la autofluorescencia celular y manchas de fondo en el cubreobjetos durante unos segundos antes de iniciar la adquisición de datos. Para las células cultivadas y la imagen en medio M9 y utilizando cubreobjetos de quemado por lo general hay muy poca fluorescencia de fondo, sin embargo, preblanqueo podría ser útil para obtener imágenes de las células en un medio de crecimiento rico tal como LB. Tenga en cuenta que la iluminación intensa es tóxico para las células de modo preblanqueo debe mantenerse a un mínimo.
- Iniciar la adquisición de una película PALMA bajo continua de excitación 561 nm a 15,26 ms / frame.
- Encender el láser de 405 nm y aumentar gradualmente la intensidad en el transcurso de la película, que alcanza hasta 1 W / cm 2. Evitar mayores intensidades de 405 nm que causan la autofluorescencia celular. Preste atención a la densidad de las moléculas fluorescentes - es importante para mantener las tasas de activación baja tal que PSFs son claramenteaislados en cada cuadro (Figuras 4D-F).
- Registre 10.000 marcos / película (dependiendo del número de moléculas para ser reflejado por célula); una película típicamente toma 2-3 min y requiere 0,5-1 GB de espacio en disco duro, dependiendo del tamaño del campo de visión FOV.
- Repita el procedimiento de adquisición de múltiples FOV. Tenga en cuenta que cada campo de visión sólo se pueden obtener imágenes de una vez porque fluoróforos PAmCherry obtener fotoactivado y se blanquea de forma irreversible.
5. Análisis de Datos
Un marco automatizado y robusto análisis de datos es esencial para el rendimiento y la eficiencia del método. Utilizamos software personalizado escrito en MATLAB.
- Realizar el análisis de localización utilizando algoritmos descritos en Crocker et al. 12, Holden et al. 13, HoldenI et al. 14, y Wieser et al. 15 PSF se identifican por primera vez en una imagen filtrada de paso de banda se utiliza un kernel gaussiana con 7 pixels de diámetro (Figura 5A). Posiciones de los candidatos corresponden a PSF con intensidades pico de píxeles por encima de 4,5 veces la desviación estándar de la señal de fondo (Figura 5B). El píxel más brillante localmente por PSF candidato sirve como aproximación inicial para el ajuste de una función gaussiana elíptica (Figura 5C). Los parámetros de ajuste libres son: posición x, la posición Y, X-anchura, y-ancho, ángulo de rotación, la amplitud y desplazamiento de fondo. La máscara de Gauss elíptica representa molécula durante el tiempo de exposición, lo que desdibuja y deforma el PSF.
- Trace los (x, y) localizaciones resultantes de todos los fotogramas de la película PALMA la imagen de microscopía de luz transmitida del mismo FOV en. Localizaciones de Pol1-PAmCherry deben aparecer dentro de la zona central de la E. coli células (Figura 6A). Si muchas localizaciones aparecen fuera de las células, el umbral de la localización era demasiado bajo o la muestra contenía partículas fluorescentes de fondo.
- Para el análisis automatizado de seguimiento, la aplicación MATLAB del algoritmo descrito en Crocker et al. 12 puede ser utilizado (ver "Análisis de difusión" en la sección de discusión). Posiciones que aparecen en los fotogramas siguientes dentro de una ventana de seguimiento definido por el usuario se conectan para formar una trayectoria. En el caso de que múltiples localizaciones se producen en la misma ventana, pistas son asignadas al minimizar la suma de las longitudes de paso. Para una discusión detallada de las distintas consideraciones a la hora de calcular los coeficientes de difusión de los datos de seguimiento de partículas individuales, ver Wieser et al. 15
- El algoritmo utiliza un parámetro de memoria para dar cuenta de parpadeo transitoria o localizaciones perdidas durante una pista. Aquí, nos fijamos el parámetro de memoria de 1 marco, los valores más altos se pueden utilizar para el seguimiento de fluoróforos con los estados oscuros de larga vida.
- Elija una ventana de seguimiento adecuado en base a los siguientes pasos de calibración. Para Pol1, utilizamos 0,57 m (5 píxeles).
- Ejecutar el algoritmo de seguimiento para el seguimiento de una serie de parámetros de la ventana. Calcular el número de pistas medido por célula como una función de la ventana de seguimiento para identificar la ventana de seguimiento más pequeño posible que no lo hace pistas (Figura 6B) se dividió.
- Trazar las pistas resultantes sobre la imagen de microscopía de luz transmitida de la misma FOV para visualizar la distribución espacial de la molécula de movimiento dentro de las células. Pistas POL1 deben mostrar difusión confinado dentro de las células individuales (figuras 6C-D).
- Si una fracción de pistas parece cruzar entre las células esto sugiere que las moléculas separadas fueron erróneamente vinculados porque la ventana de seguimiento fue elegido demasiado grande y / o la tasa de fotoactivación era demasiado alto (Figura 6E).
- Trazar la distribución acumulada de las longitudes de paso entre localizaciones consecutivas (Figura 6F). La curva se eleva y satura sin problemas para suficientemente grandes ventanas de seguimientopero muestra un borde de corte si la ventana fue elegido demasiado pequeño.
- Analizar las características de difusión de Pol1, calcule el desplazamiento cuadrático medio (MSD) entre localizaciones consecutivas para cada pista con un total de N pasos):
MSD = 1 / (N-1) Σ i = 1 N-1 (X i +1 - x i) 2 + (y i +1 - yi) 2.
Incluya sólo las pistas con un mínimo de 4 pasos (N ≥ 5 localizaciones) para reducir la incertidumbre estadística en los valores de TME. - Trazar una curva de valores de MSD en un rango de tiempos de retardo mediante el cálculo de los desplazamientos a través de múltiples marcos (Figura 6G). La forma de la curva de MSD puede ayudar a clasificar el movimiento molecular observado (Figura 6H).
- Calcular el coeficiente de difusión aparente D * por canción del MSD:
D * = MSD / (4 Dt) - σ loc 2 / Dt.
El segundo term corrige el error de localización estimada (en este caso, loc σ = 40 nm y Dt = 15.26 ms, ver Wieser et al. 15). - Trace un histograma de los valores de medición * D de todas las pistas del campo de visión (Figura 7).
- Identificar moléculas POL1 individuales que aparecen unidos al cromosoma basado en el valor medido D * por pista. Separar las poblaciones de la envolvente (distribución agudo centrado en D * ~ 0 m 2 / s) y moléculas que se difunden libremente (amplia distribución centrada en D * ~ 0,9 m 2 / s) mediante el establecimiento de un umbral de D * <0,15 m 2 / s ( barras de color rojo en las figuras 7A y 7D).
- Llevar a cabo la localización, seguimiento y análisis de difusión para Pol1 en células en buen estado (Figuras 7A-C) y en las células que están bajo tratamiento daño de ADN con MMS (Figuras 7D-E). La fracción de pistas consolidados proporciona una medida cuantitativa directa de la DNA la actividad de reparación de Pol1 in vivo.
Resultados
El concepto de fotoactivado sola molécula de seguimiento para estudiar las interacciones proteína-DNA in vivo se ilustra en la Figura 1. Proteínas de fusión PAmCherry se detectan en E. directo células de E. coli en una manera secuencial por la fotoactivación de las moléculas individuales estocásticamente con 405 nm de luz a una frecuencia de menos de una molécula por célula a la vez. Moléculas activadas se crean imágenes de bajo continua 561 nm de excitación. Movimiento molecular en la célula se puede seguir mediante la conexión de localizaciones cercanas en una serie de tramas hasta photobleaching irreversible. Debido a que la difusión de las proteínas de unión al ADN es más lento después de la unión del cromosoma, el coeficiente de difusión aparente D * obtenido por pista depende directamente de las interacciones proteína-ADN individuales.
La Figura 2 demuestra la fotoactivación de proteínas de fusión Pol1-PAmCherry en E. vivo células de E. coli. La influencia de la intensidad de 405 nm ON la densidad de las moléculas fluorescentes se puede ver en la Figura 4. Tenga en cuenta que la densidad no está determinado únicamente por la intensidad de 405 nm, pero, además, por el número de moléculas que están disponibles para la activación; la piscina de moléculas restantes se agota en el transcurso de una película de palma.
Localización análisis se realiza para cada fotograma de una película de palma como se ilustra en la Figura 5. Se midió la precisión de localización utilizando moléculas inmóviles en células fijadas o moléculas unidas en células vivas. Nuestros ajustes de adquisición dieron una precisión de localización de σ loc = 40 nm, de acuerdo con la predicción teórica 3.
Las localizaciones POL1 resultantes ocupan la zona central de la célula (Figura 6A), en términos generales la recapitulación de la organización espacial de la E. coli nucleoide 7. La mayoría de los Pol1 pistas en las células no dañadas mostrar difede fusión como se muestra en la Figura 6C. Una célula típica contiene varios cientos de pistas POL1 (Figura 6D), en consonancia con el número de copias de aproximadamente 400 moléculas POL1 por E. . coli celular 1 Figuras 6B y 6E-F proporciona orientación sobre la elección de un parámetro de la ventana de seguimiento adecuado - si la ventana de seguimiento es demasiado grande, las diferentes moléculas son más propensos a convertirse erróneamente vinculado a una pista, si la ventana de seguimiento es demasiado pequeño, pistas con pasos más largos se dividirá. La curva de MSD para Pol1 aumenta linealmente durante cortos tiempos de retardo y se satura en los tiempos de retardo más largos debido al confinamiento celular (Figura 6G). Diferentes tipos de movimiento molecular se pueden identificar por análisis de MSD. Movimiento dirigido da una curva parabólica; movimiento browniano se caracteriza por una línea recta, la curva de difusión confinado alcanza una meseta; un desplazamiento de la curva de MSD para partículas inmóviles representa el Lincertidumbre ocalization (Figura 6H). Información adicional sobre una sola partícula de seguimiento y sugerencias para solucionar problemas puede encontrarse en Arnauld et al. 16
Hemos aplicado previamente el método para medir la actividad de reparación del ADN de Pol1 en respuesta al daño del ADN exógeno alquilación 7. El D * histograma de Pol1 pistas en células en buen estado muestra una población dominante de difundir moléculas (Figuras 7A-C). Una pequeña fracción de 2,7% de moléculas POL1 encuadernados es probable que participan en la replicación del filamento de revestimiento y reparación de daños en el ADN endógeno. Bajo continuo daño 100 mM MMS, la población de las pistas con D * ~ 0 2 micras / s aumenta a 13,8% (Figura 7D). Estas pistas representan moléculas POL1 personas físicas que realicen la síntesis de reparación de ADN para llenar los vacíos de un solo nucleótido, como parte de la ruta de base de reparación por escisión. Las posiciones de pistas unidas muestran la ubicación de los individuoDaño del ADN y la reparación de sitios (Figura 7E-F).
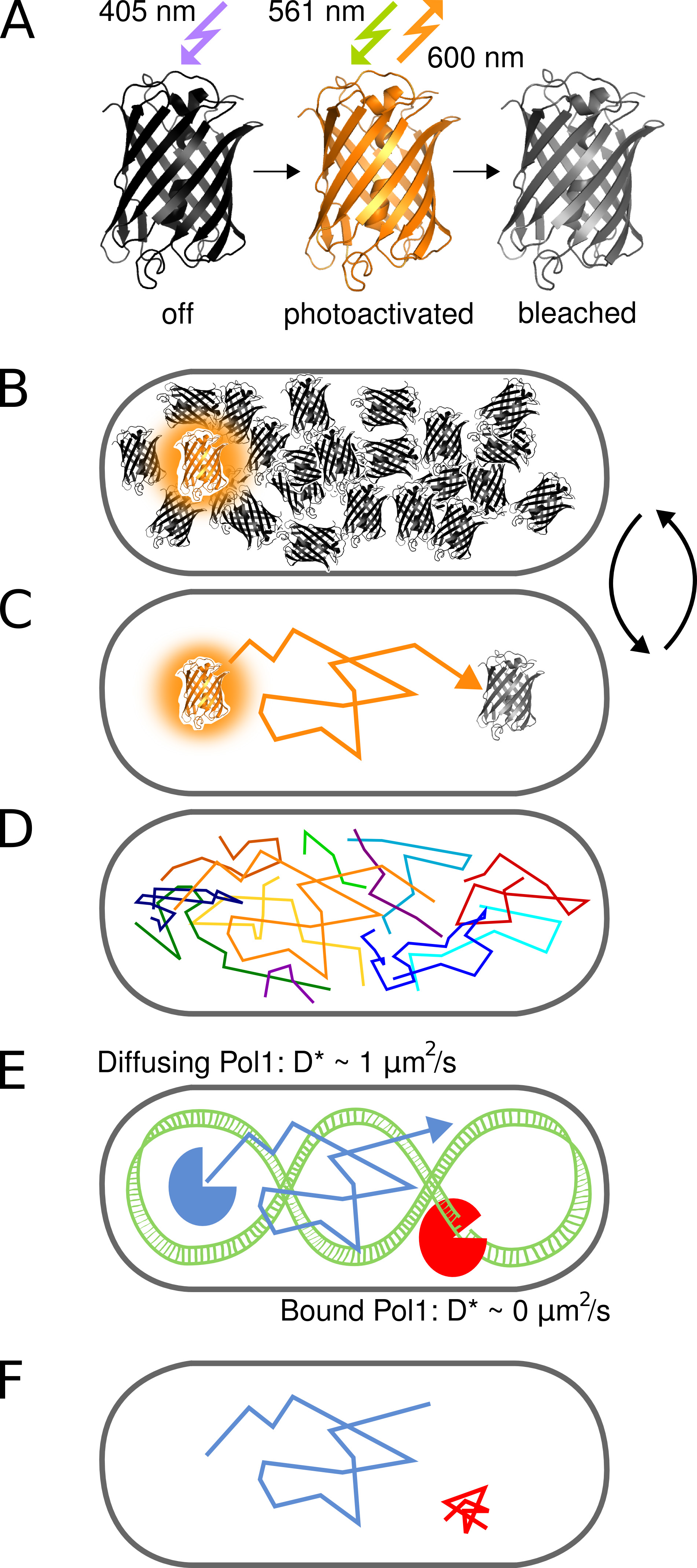
Figura 1. Representación gráfica del método. (A) El PAmCherry proteína fluorescente puede fotoactivado desde un estado inicial no fluorescente tras la irradiación con luz 405 nm. El estado brillante está entusiasmado en 561 nm y emite fluorescencia en torno a 600 nm hasta los blanqueadores fluoróforo irreversible. (B) El control de la velocidad de la fotoactivación permite imágenes solamente una sola proteína de fusión PAmCherry estocásticamente activado por célula en cualquier momento mientras el arbitrariamente grande conjunto de moléculas que aún no han sido activados o que ya han sido blanqueados restos en un estado oscuro. (C) La posición de la molécula fluorescente se determina desde el centro de la PSF y TR aisladoacked para varios marcos de hasta photobleaching. (D) Pistas de muchas moléculas se registran de una manera secuencial. (EF) La interacción de una proteína de unión a ADN con una secuencia diana cromosómica o estructura detiene el movimiento difusivo al azar. Moléculas unidas y no unidas se distinguen por el coeficiente de difusión aparente D * extrae de pistas individuales. La fracción resultante de moléculas ligadas da una medida cuantitativa de la actividad de una proteína de unión al ADN in vivo. Haga clic aquí para ver la imagen más grande.
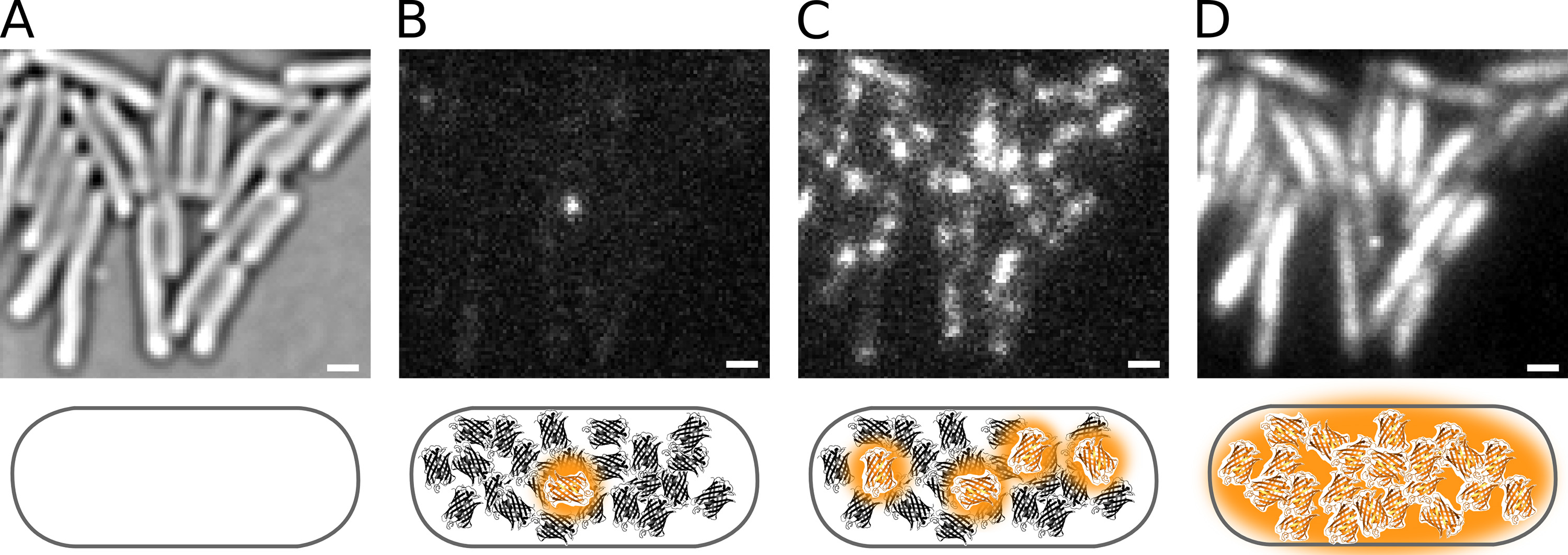
Figura 2. La fotoactivación de Pol1-PAmCherry en E. directo células de E. coli. Las barras de escala: 1 m. Esquemas se muestran debajo de cada panel. ( A) Imagen de microscopía óptica de las células inmovilizadas sobre una almohadilla de agarosa transmitida. (B) Phototactivating un solo fluoróforo PAmCherry en una célula. (C) Una mayor tasa de fotoactivación aumenta el número de moléculas fluorescentes. (D) Integrated PAmCherry fluorescencia de una película PALMA. Haz clic aquí para ver la imagen más grande.
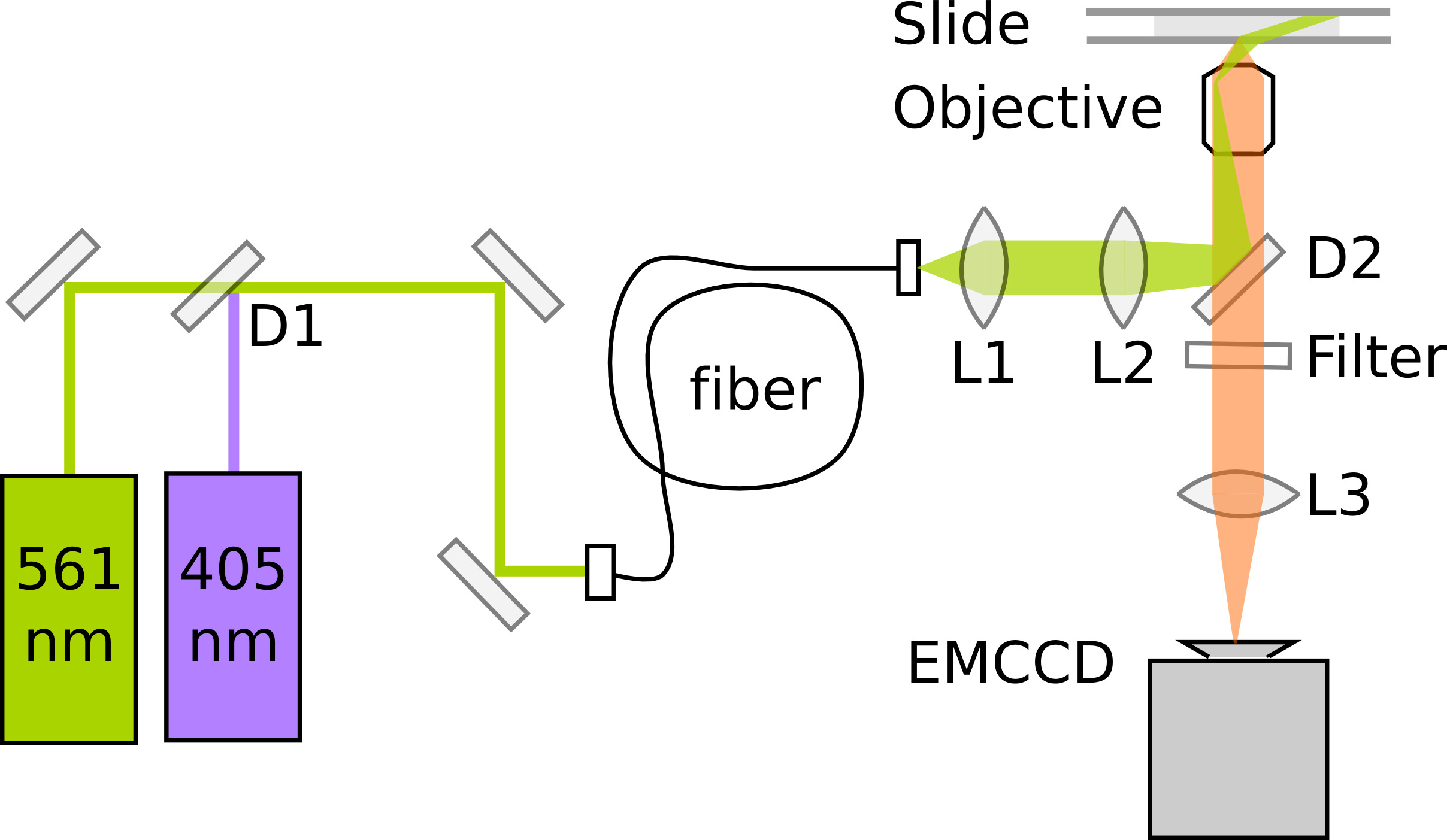
Figura 3. Esquema de una configuración mínima de palma para las proteínas de fusión y fotoactivadora PAmCherry imágenes D1:. Espejo dicroico (por ejemplo, 550 nm de paso largo). D2: espejo dicroico (por ejemplo, 570 nm de paso largo). L1: Lente colimadora. L2: lente TIR. L3: Lente Tube.1177/51177fig3highres.jpg "target =" _blank "> Haga clic aquí para ver la imagen más grande.

Figura 4. Imágenes representativas de una película de palma con 15,26 ms / frame barras de escala:. 1 micra. (A) de transmisión de imagen a la luz de las células inmovilizadas sobre una almohadilla de agarosa. (B) Imagen de fondo oscuro medido en la cámara EMCCD con el láser apagado. (C) Excitación imagen de fondo bajo continua de excitación 561 nm antes de fotoactivación. (DF) Aumento de la intensidad de 405 nm conduce a mayores tasas de fotoactivación de PAmCherry, fotografiados bajo continuo 561 nm de excitación. Las áreas encuadradas se muestran ampliada a continuación. (D) de baja intensidad de 405 nm (<1 mW) activos muy pocas moléculas fluorescentes por FOV. (E) Medio 405Resultados de intensidad nm (~ 2 mW) fotoactivación en una buena densidad de fibras discontinuas de poliéster para la localización y análisis de seguimiento. (F) Mayor intensidad de 405 nm (~ 10 mW) activa más de una molécula fluorescente en algunas células, que oscurece la localización y análisis de seguimiento. Haga clic aquí para ver la imagen más grande.

Figura 5. Ilustración del análisis de localización. Las barras de escala: 1 m (A) de filtrado de paso de banda elimina el ruido de píxeles espuria y aplana gradientes de intensidad en todo el campo de visión.. (B) PSFs candidatos se identifican en la imagen filtrada en base a un umbral definido por el usuario que se elige para minimizar falsas detecciones positivos y falsos negativos. El threshoLD corresponde a la intensidad mínima de un píxel candidato dividido por el fondo desviación estándar (relación señal-ruido, SNR). (C) El píxel localmente más brillante que pasa el umbral sirve como estimación de localización inicial (cruz de naranja) para un ajuste gaussiano elíptica de dos dimensiones. Las barras de escala: 0,5 m. La localización de super-resolución resultante (Blue Cross) tiene una precisión media de loc σ = 40 nm. Haz clic aquí para ver la imagen más grande.
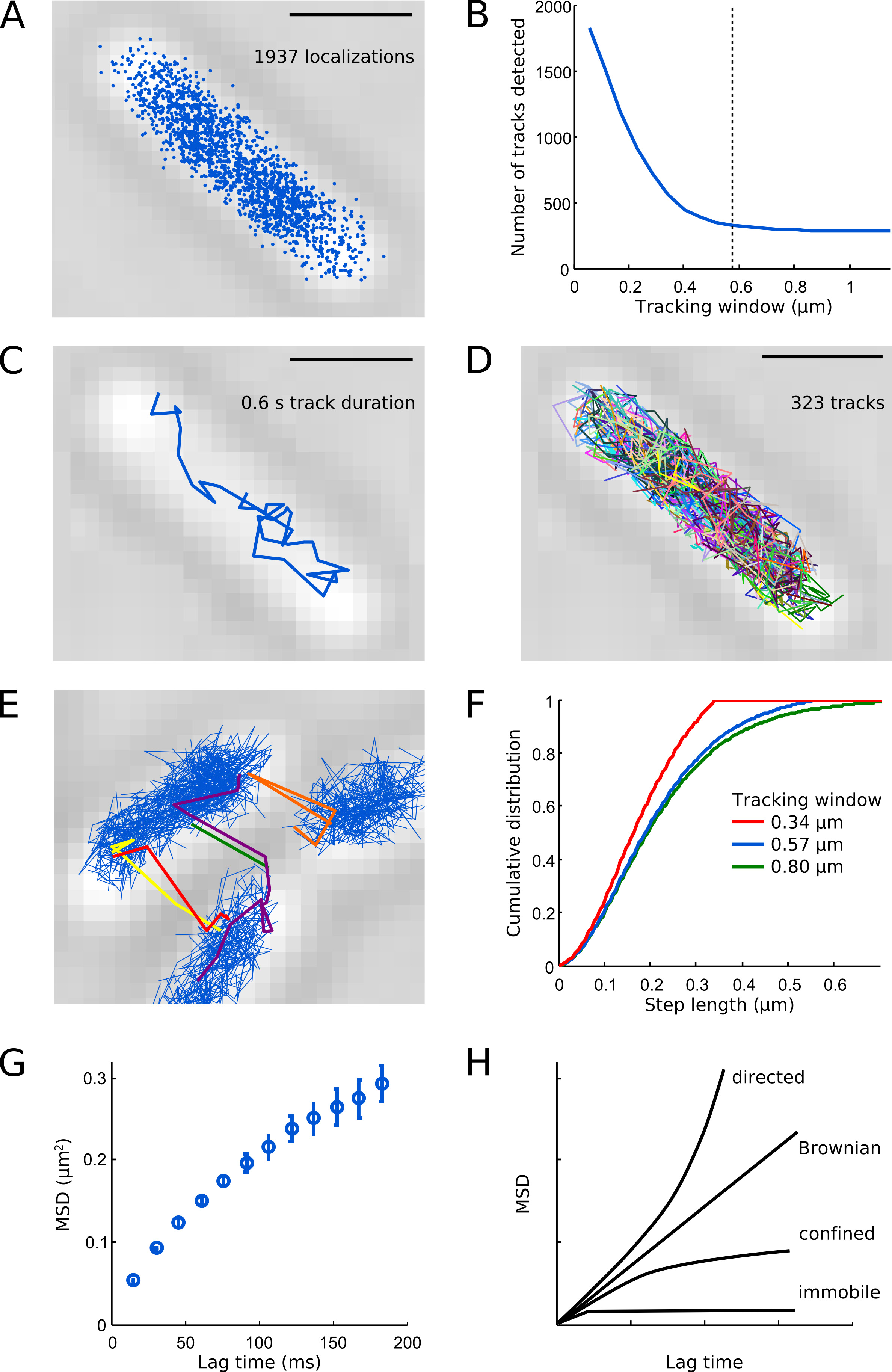
.. Figura 6 Ejemplo de análisis de seguimiento de barras de escala: 1 m. (A) Todas las localizaciones detectadas de Pol1-PAmCherry en un ejemplo de células. (B) Número de pistas detectared en el ejemplo de células como una función de la ventana de seguimiento. Las pequeñas ventanas de seguimiento dividen trayectorias moleculares, lo que conduce a un artefacto de alto número de pistas. La línea discontinua indica nuestra elección para el parámetro ventana de seguimiento (0.57 m, 5 píxeles) - esto le da un buen compromiso entre la detección de la distribución total de pasos y mantener las trayectorias de diferentes moléculas intactas. (C) Ejemplo pista de una sola molécula de Pol1-PAmCherry. (D) Todas las pistas medidos se muestran en colores al azar. (E) los artefactos de seguimiento si se elige la ventana de seguimiento demasiado grande (aquí 0,8 m, 7 píxeles) o la densidad de PSF por trama es demasiado alta. (F) las distribuciones acumuladas de las longitudes de paso para las ventanas de seguimiento: 0,34 m (3 píxeles, línea roja), 0,57 m (5 píxeles, línea azul) y 0,80 m (7 píxeles, línea verde). Tenga en cuenta que la ventana de seguimiento 0,34 micras corta pasos de más de 0,34 m, que claramentetrunca la distribución total de pasos. La ventana de seguimiento de 0,57 micras detecta casi la misma distribución de pasos como lo hace la ventana de seguimiento 0,80 micras. Curva (G) MSD muestra difusión confinada de Pol1. Curvas (H) Esquema de MSD para el movimiento dirigido, el movimiento browniano, la difusión confinado, y las partículas inmóviles. Haz click aquí para ver la imagen más grande.
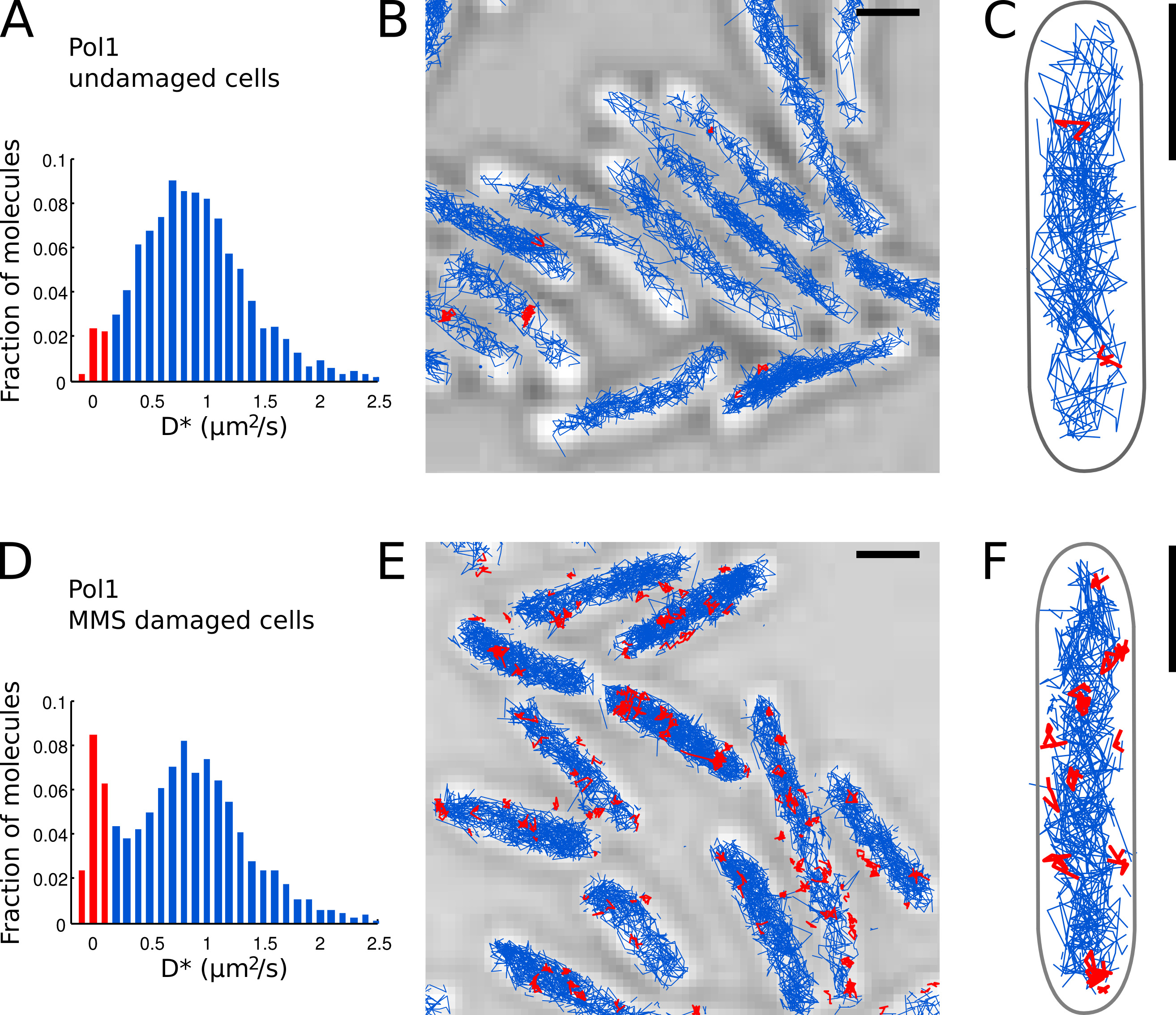
Figura 7. La medición directa de la actividad de reparación del ADN de Pol1 en E. directo . coli células barras de escala: 1 m. (A) Histograma del coeficiente de difusión aparente D * para todas las pistas de 4 o más pasos en un campo de visión de las células no dañadas (N = 4.162 pistas). La población de moléculas clasificadas como b ound se resalta en rojo. (BC) Pistas de Pol1-PAmCherry se muestran en una imagen de microscopía de luz transmitida. Pistas clasificados como presos en función de su coeficiente de difusión se muestran en rojo. (D) D * histograma para las pistas POL1 medidos en células inmovilizadas sobre una almohadilla de agarosa con mM MMS 100 y se incubaron durante 20 min antes de la proyección de imagen (N = 2.128 pistas). La población de moléculas unidas que participan en la reparación del ADN se muestra en rojo. (EF) Pol1-PAmCherry pistas transmitido imagen de microscopio óptico que muestra las huellas de los eventos individuales de reparación del ADN Pol1 en rojo en. Haga clic aquí para ver la imagen más grande.

Película 1. La construcción de una instalación PALMA medida."Target =" _blank JoVE_Uphoff_Movie1.avi "> Haga clic aquí para ver el video.
Discusión
Discutimos varias consideraciones clave para el éxito del experimento.
La elección y la expresión de la proteína de fusión de fluorescencia: Hay una gran gama de colores de las proteínas fluorescentes fotoactivables y photoswitchable 17. La elección concreta depende de las características de microscopio, en particular los láseres y filtros disponibles. La combinación de 405 nm y 561 nm es ideal para las proteínas fluorescentes fotoactivables comunes. Elegimos PAmCherry 6 porque es monomérica y no mostró la agregación de las células. Además, la fotoactivación irreversibles permite contar el número de fluoróforos activados para medir el número de copias de proteína por célula. En lugar de expresar la proteína de fusión a partir de un plásmido, se prefiere la inserción cromosómica del gen que codifica para la proteína de fusión en el locus de tipo salvaje. Esto asegura la sustitución completa de la proteína de interés con el fluorescente versión y mantener el nivel de expresión de tipo salvaje.
Tasa Fotoactivación: Es importante ajustar la tasa de fotoactivación de tal manera que, en promedio, menos de una molécula por célula se encuentra en el estado fluorescente en cualquier fotograma de la película. Esto depende de la intensidad de 405 nm y el número de moléculas de izquierda a ser activado. A densidades muy bajas de imagen, sin embargo, no todas las moléculas serán fotografiadas antes del final de la película o películas muy largas tienen que ser adquiridos. El número de fotogramas grabados por película depende del número de copias de proteínas de fusión por célula y la media photobleaching curso de la vida de PAmCherry en las condiciones de excitación utilizadas. El número de copias de Pol1 es ~ 400 moléculas / célula 1 y el valor medio de la distribución de tiempo de vida fotoblanqueo exponencial fue ~ 4 marcos. Mediante el aumento de la intensidad 405 nm gradualmente, la activación se distribuye uniformemente sobre las 10.000 tramas de la película. Por lo tanto, cada celda es occupied por moléculas fluorescentes para un total de ~ 1600 marcos, asegurando poco solapamiento de PSF y complicaciones de seguimiento en una película de 10.000 marcos.
Tiempo de exposición y de excitación intensidades: Ante todo, los tiempos de exposición deben ser lo suficientemente corto para observar PSFs nítidas con poco movimiento borrosa. Sin embargo, se debe elegir la velocidad de fotogramas para producir el movimiento molecular observable entre cuadros sucesivos más allá de la incertidumbre de localización, de lo contrario los fotones cruciales se desperdician por sobremuestreo de la pista. El movimiento de las moléculas no unidas deben tomarse muestras a intervalos de tiempo suficientemente largo para ser claramente distinguible del movimiento aparente de moléculas unidas debido a la incertidumbre en la localización. Cuando se ajusta el tiempo de exposición, la intensidad PSF se debe ajustar. La precisión de la localización de un PSF aumenta con el número de fotones detectados durante la duración de una trama. Intensidades de excitación más altos aumentan los bu tasa por emisión de fotónt también la tasa fotoblanqueo y la señal de fondo. Utilice la intensidad de excitación más bajo que le da la precisión de localización deseada. Para Pol1-PAmCherry elegimos 15,26 ms / frame y 3,5 mW 561 nm de excitación (400 W / cm 2). Es importante para confirmar la viabilidad celular de las condiciones de formación de imágenes particulares mediante el control de crecimiento celular y la morfología antes y después de la adquisición de datos (ver Información Suplementaria en Uphoff et al. 7).
Pol1 exhibe un tiempo de unión de ~ 2 seg a un sustrato de ADN con huecos in vivo 7; por lo tanto, se espera que la mayoría de las moléculas a ser ya sea en el estado unido o no unido para toda la duración de una pista. Moléculas unidas aparecerá esencialmente inmóvil porque los sitios cromosómicos tienen un coeficiente de difusión de varios órdenes de magnitud inferior (~ 10 -5 m 2 / seg, Elmore et al. 18) de Pol1 difusión en el citoplasma (~ 1 m 2 / seg).
Análisis Difusión: El coeficiente de difusión aparente D * se calcula a partir del MSD de pistas individuales, como promedio durante un mínimo de 4 pasos (5 fotogramas) para reducir el error estadístico. Tenga en cuenta que ~ 75% de las moléculas de blanquear en menos de 5 cuadros para las condiciones de formación de imágenes descritos. Tales pistas cortas no proporcionan suficiente certeza estadística de distinguir moléculas dependientes e independientes. Sin embargo, las fracciones relativas de las moléculas dependientes e independientes que informan sobre la actividad de la proteína son independientes del número total de temas analizados.
Es útil para tener en cuenta el error de localización fibras discontinuas de poliéster (loc σ) en el cálculo de D *, porque la incertidumbre añade un paso aleatorio evidente para cada localización de una molécula de 15.
Para mejorar la clasificación de moléculas enlazadas y se difunden, se recomienda calcular D * both partir de los desplazamientos de un solo paso y los desplazamientos más el tiempo de dos tramas. A continuación, es posible establecer dos umbrales separados D *: D * (15 ms) <0,15 m 2 / s, y D * (30 ms) <0,075 m 2 / s.
Tenga en cuenta que D * es un coeficiente de difusión aparente que se ve afectada por el confinamiento celular de las pistas y el movimiento de desenfoque debido a la difusión durante el tiempo de exposición. Para extraer precisos coeficientes de difusión imparciales, que ha demostrado ser útil para comparar el movimiento observado a los datos simulados en función de un modelo estocástico browniano movimiento 5,7. Simulación de datos también pueden ser utilizados para probar los procedimientos de análisis de datos.
Las aplicaciones potenciales de este método: Se describen un enfoque general para la visualización y la cuantificación de las interacciones proteína-DNA in vivo por el cambio en la movilidad de una proteína tras la unión al cromosoma. Las actividades de ADN-oProteínas de unión de ARN-implicadas en la reparación, la replicación, la transcripción, y el mantenimiento de cromosomas por lo tanto pueden ser seguidos en tiempo real a nivel de una sola célula con una resolución espacial por debajo del límite de difracción óptica. Fotoactivado seguimiento de una sola molécula se extiende métodos de seguimiento convencionales que están restringidos a unas pocas moléculas marcadas por célula. Un método alternativo que mide la difusión molecular in vivo es la fluorescencia de recuperación después de photobleaching (FRAP). Mientras FRAP es muy útil para medir las características globales de difusión en células grandes, que se limita en su capacidad para resolver varias especies moleculares con diferentes movilidades en un entorno espacialmente heterogénea, especialmente para las pequeñas células bacterianas.
Hemos aplicado fotoactivado sola molécula de seguimiento para medir las actividades de unión al ADN y localizaciones subcelulares de una gama de diferentes proteínas en E. coli incluyendo Pol1, ADN ligasa, proteína Fis, DNApolimerasa III 7, así como el mantenimiento estructural de proteínas Cromosomas MukB, E, y F 19. Anticipamos que el método también se puede adaptar a otros tipos de células.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Reconocemos Justin Pinkney y Johannes Hohlbein para ayudar con la construcción del microscopio a medida y Seamus Holden para la localización de software. Rodrigo Reyes-Lamothe se dio las gracias por proporcionar el E. coli cepa. La investigación fue financiada por el Séptimo Programa Marco Europeo Comisión del Programa Beca FP7/2007-2013 SALUD-F4-2008 a 201.418, Reino Unido Biotecnología y Ciencias Biológicas de Investigación Beca BB/H01795X/1, y el Consejo Europeo de Investigación Beca 261.227 a ANK. DJS fue financiado por una subvención WT083469 Programa de Wellcome Trust. SU fue apoyado por una beca de doctorado MathWorks.
Materiales
| Name | Company | Catalog Number | Comments |
| E. coli strain carrying a chromosomal insertion for a PAmCherry DNA-binding fusion protein | created by Lambda-Red recombination | ||
| MEM amino acids | Invitrogen | 11130-051 | minimal medium supplement |
| MEM vitamins | Invitrogen | 11120-052 | minimal medium supplement |
| Agarose | BioRad | 161-3100 | certified molecular biology grade |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1 hr |
| Methyl methanesulfonate (MMS) | Sigma-Aldrich | 129925 | CAUTION: toxic |
| PALM setup | home-built | described in Uphoff et al.7 | |
| MATLAB | MathWorks | for data analysis and visualization | |
| Localization software | custom-written, available online | http://www.physics.ox.ac.uk/Users/kapanidis/Group/Main.Software.html | MATLAB and C++ software package that can be adapted for localization analysis. Cite Holden et al.13 if used in publication. |
| Tracking software | available online | http://physics.georgetown.edu/matlab/ | MATLAB implementation by Blair and Dufresne. Cite Crocker & Grier12 if used in publication. |
Referencias
- Friedberg, E. C. DNA Repair and Mutagenesis. , American Society for Microbiology. Washington, DC. (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer spatial resolution. Science. 313 (5793), 1642-1645 (2006).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat. Methods. 7 (5), 377-381 (2010).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc. Natl. Acad. Sci. U.S.A. 108 (31), (2011).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat. Methods. 6 (2), 153-159 (2009).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc. Natl. Acad. Sci. U.S.A. 110 (20), 8063-8068 (2013).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97 (12), 6640-6645 (2000).
- Reyes-Lamothe, R., Possoz, C., Danilova, O., Sherratt, D. J. Independent positioning and action of Escherichia coli replisomes in live cells. Cell. 133 (1), 90-102 (2008).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J. Bacteriol. 119 (3), 736-747 (1974).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5 (2), 159-161 (2008).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid. Interface. Sci. 179 (1), 298-310 (1996).
- Holden, S. J., et al. Defining the limits of single molecule FRET resolution in TIRF microscopy. Biophys. J. 99 (9), 3102-3111 (2010).
- Holden, S. J., Uphoff, S., Kapanidis, A. N. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat. Methods. 8 (4), 279-280 (2011).
- Wieser, S., Schütz, G. J. Tracking single molecules in the live cell plasma membrane-Do's and Don't's. Methods. 46 (2), 131-140 (2008).
- Arnauld, S., Nicolas, B., Hervé, R., Didier, M. Multiple-target tracing (MTT) algorithm probes molecular dynamics at cell surface. Protoc. Exch. , Available from: http://dx.doi.org/10.1038/nprot.2008.128 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. (11), 555-565 (2009).
- Elmore, S., Müller, M., Vischer, N., Odijk, T., Woldringh, C. L. Single-particle tracking of oriC-GFP fluorescent spots during chromosome segregation in Escherichia coli. J. Struct. Biol. 151 (3), 275-287 (2005).
- Badrinarayanan, A., Reyes-Lamothe, R., Uphoff, S., Leake, M. C., Sherratt, D. J. In vivo architecture and action of bacterial Structural Maintenance of Chromosome proteins. Science. 338 (6106), 528-531 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados