Method Article
Un ensayo de adhesión de flujo para estudiar Leucocyte Reclutamiento para hepático humano sinusoidales endotelio en condiciones de estrés de cizalla
En este artículo
Resumen
El reclutamiento de leucocitos en el hígado se produce dentro de los canales especializados de los sinusoides hepáticos que se alinean por las células endoteliales sinusoidales hepáticas únicas. Microscopía de contraste de fase de reclutamiento de leucocitos a través del endotelio sinusoidal hepático humano en condiciones de tensión de cizallamiento fisiológica puede facilitar la elucidación de los mecanismos moleculares que subyacen a este proceso.
Resumen
La infiltración de leucocitos en el tejido de hígado humano es un proceso común en todas las enfermedades inflamatorias del hígado adultas. Infiltración crónica puede conducir al desarrollo de la fibrosis y la progresión a cirrosis. La comprensión de los mecanismos moleculares que median el reclutamiento de leucocitos hacia el hígado podría identificar dianas terapéuticas importantes para la enfermedad hepática. La interacción clave durante el reclutamiento de leucocitos es la de las células inflamatorias con endotelio en condiciones de estrés de cizallamiento. El reclutamiento para el hígado se produce dentro de los canales de cizallamiento bajas de los sinusoides hepáticos que se alinean por las células endoteliales sinusoidales hepáticas (HSEC). Las condiciones dentro de los sinusoides hepáticos pueden recapitulan perfundiendo leucocitos a través de canales revestidos por monocapas HSEC humanos con caudales específicos. En estas condiciones leucocitos se someten a un breve paso inmovilización seguido por la activación y adhesión firme, seguido de una etapa de rastreo y la posterior transmigración a través de la endotelialcapa. Usando microscopía de contraste de fases, cada paso de este "cascada de adhesión" se puede visualizar y grabó seguido de análisis fuera de línea. Las células endoteliales o los leucocitos pueden ser tratados previamente con inhibidores para determinar el papel de las moléculas específicas durante este proceso.
Introducción
Está bien establecido que el reclutamiento de leucocitos en general sigue el paradigma de la cascada de adhesión de varios pasos 1. Esto implica la captura de leucocitos de la sangre que fluye por las células endoteliales que recubren la pared del vaso. Inicialmente, los leucocitos se someten a una etapa de laminación que está mediada por selectina o los receptores de los miembros de la superfamilia de las inmunoglobulinas. Esto permite que los receptores acoplados a proteína G (GPCRs) expresados en la superficie de leucocitos para ser activados por quimiocinas presentados en el glicocálix endotelial. Esto conduce a la alteración de la confirmación de la integrina a un estado de "alta afinidad" en la superficie de leucocitos y el arresto y la firma de adhesión al endotelio. Adherencia firme es seguido por un cambio de forma y de rastreo del leucocito en el buque. El paso final es la transmigración a través de la monocapa endotelial, que puede ocurrir a través de paracelular o transcelular rutas.
Mientras que la cascada de adhesión de varios pasos describirs el mecanismo general de reclutamiento de leucocitos en el cuerpo hay diferencias específicas de órganos. En el hígado la mayoría de reclutamiento de leucocitos se produce dentro de los sinusoides hepáticos en contraste con otros órganos donde el reclutamiento generalmente se produce dentro de las vénulas post-capilares 2. Los sinusoides hepáticos son un entorno de baja cizalladura y leucocitos sufren un breve paso tethering con anterioridad a la adhesión firme que se selectina independiente 2. Estos canales están revestidos por el endotelio sinusoidal hepático que es discontinua y contiene fenestras, poros abiertos 100-200 nm de diámetro, y carecen de una membrana basal 3. Elucidar los mecanismos moleculares que median el reclutamiento de leucocitos a través del endotelio sinusoidal hepático humano podría identificar de órganos dianas terapéuticas específicas para las enfermedades inflamatorias del hígado.
Ensayos de adhesión de flujo son herramientas esenciales en el estudio de reclutamiento de leucocitos. Ellos permiten la reconstrucción de recru leucocitositment en presencia de la tensión de cizallamiento para analizar la adherencia bajo fuerzas bien definidos. El uso más frecuente para el ensayo es la adherencia de leucocitos estudio a monocapas endoteliales cultivadas o sustratos purificados. Cámaras de flujo comercialmente disponibles se utilizan para perfundir células bajo condiciones de flujo laminar entre dos superficies planas y luego visualizar el proceso dinámico de la adhesión en un microscopio 4. Grupos anteriores han demostrado que ciertas interacciones adhesivas sólo tienen lugar bajo flujo y no pueden ser estudiados en ensayos estáticos 5,6.
Hemos utilizado esta técnica para recapitular los sinusoides hepáticos y estudiar el reclutamiento de leucocitos en condiciones de baja tensión de cizallamiento. HSEC humana primarios se cultivaron en microportaobjetos y leucocitos puede entonces ser perfundido más de esta monocapa a una velocidad de flujo calculado para reproducir el esfuerzo cortante dentro de los sinusoides hepáticos. La tensión de cizallamiento es una tensión que se aplica en paralelo o tangencial a una superficie como OPPosed al estrés normal, que es perpendicular. Cualquier líquido que se mueve a lo largo de una frontera ejercerá una tensión de corte en esa frontera. El esfuerzo cortante ha demostrado ser un componente esencial de la transmigración de linfocitos 7. En estas condiciones, cada paso de la cascada de adhesión puede ser visualizada por microscopía de contraste de fase. Este método ha permitido importantes conocimientos sobre el reclutamiento de leucocitos dentro del hígado incluyendo el estudio de moléculas de adhesión convencionales 8, el papel de las quimioquinas y receptores de quimioquinas 9-11, y moléculas de adhesión atípicos tales como la proteína de adhesión vascular 1 (VAP-1 ) 8,12 y linfática común y endotelial vascular receptor-1 (Clever-1) 13. Mientras que este ensayo ha sido mencionado en varias de las publicaciones de nuestro Grupo, su descripción ha sido breve y hemos aprovechado esta oportunidad para ofrecer un detallado paso a paso guía para ayudar en la solución de problemas y prevenir errores técnicos cuando intentoción del ensayo. Además, se ha cambiado recientemente la compra de componentes de las cámaras MicroSlide que permite modificaciones precisas en el estrés de cizalla. Creemos que esto amplía la aplicabilidad del ensayo a otras células endoteliales e inmunes. El siguiente método describe la preparación y la técnica para llevar a cabo un ensayo de adherencia basado en el flujo con células sinusoidales hepáticas humanas endoteliales y linfocitos de sangre periférica.
Protocolo
1. Preparación MicroSlide
- Precapa un MicroSlide de seis canales con cola de rata colágeno de tipo I (RTC, diluido 1:100 en PBS dando una dilución de trabajo de 220 g / ml). Esto se realiza mediante la inyección de 30 l de solución diluida de RTC directamente en los canales e incubando durante 2 horas a 37 ° C, seguido de tres lavados con PBS.
2. La siembra de células en microportaobjetos
- Disociar un matraz T75 confluente de células hepáticas humanas cultivadas endoteliales sinusoidales (HSEC) (aislado a partir de tejido de hígado como se ha descrito previamente 13) en tripsina-EDTA, lavar en PBS, y se resuspende en 3 x 10 6 células / ml en medio completo (endotelial humana medios basal suplementada con mM de L-glutamina 2, 100 U / ml de penicilina y estreptomicina 100μg/ml, 10% inactivado por calor suero AB humano, 10 ng / ml de factor de crecimiento endotelial vascular y 10 ng / ml de factor de crecimiento de hepatocitos). Inyectar 30 l de suspensión celular nefastasctly en cada canal.
- Deja células se adhieran durante 1 hora en un incubador humidificado a 37 ° C con una atmósfera de CO2 al 5% en una parrilla corrediza. Después de permitir que las células se adhieran a llenar los puertos en cada lado de cada canal con medio completo (Figura 1).
3. Citoquinas estimulación de las células
- Deja las células en una incubadora durante 24 horas. Evaluar el crecimiento de células usando un microscopio de contraste de fase invertida. 24 horas antes del ensayo de adhesión, estimular las monocapas endoteliales con citoquinas mediante la sustitución de los medios de cultivo con medio completo suplementado por el factor de necrosis tumoral alfa y el interferón gamma, tanto a 10 ng / ml.
4. Aislamiento de linfocitos de sangre periférica
- Aislar los linfocitos de sangre periférica de sangre completa mediante la purificación de la fracción mononuclear inicialmente por centrifugación en gradiente de densidad sobre un medio de centrifugación de separación de células apropiada durante 25 min a 800x g. Se incuban las células en el plástico durante 1 hora para permitir la adherencia de los monocitos.
- Después de la adhesión a plástico aspirado de la enriquecida con linfocitos sobrenadante. Lavar los linfocitos y resuspender ellos (típicamente 1 x 10 6 células / ml en medio de flujo (medios basales endoteliales que contienen 0,1% (v / v) de albúmina de suero bovino (BSA)).
5. El tratamiento previo de endotelio o leucocitos con inhibidores
- Preparar las diluciones recomendadas de anticuerpos de función de bloqueo o de inhibidores de moléculas pequeñas en media/0.1 endotelial% (v / v) de BSA. Reemplazar medio completo con solución de bloqueo de anticuerpo / inhibidor en el canal elegido MicroSlide 30 min antes de ensayo de flujo.
- Cuando se han previsto pretratamiento de los receptores de quimioquinas en linfocitos, leucocitos aislados resuspender en solución RPMI que contenía 0,1% (v / v) de BSA y se incuban con 200 ng / ml de toxina pertussis para bloquear la actividad de receptores acoplados a proteína G de los receptores de quimioquinas; alternativamente diluir específica funciónanticuerpos bloqueantes o inhibidores de molécula pequeña de receptores de quimioquinas en la dilución recomendada. Incubar leucocitos a 37 ° C durante 30 min, a continuación, lavar y resuspender en medio de flujo.
6. Configuración de flujo del sistema de ensayo
- Precalentar una cámara transparente controlado por termostato a 37 ° C. La cámara debe tener puertos para la inserción de tubo de silicona y de alimentación electrónica para una válvula de solenoide electrónico que permite la conmutación entre las células y los medios de comunicación con prácticamente ningún volumen muerto. La cámara está montada en un microscopio invertido para permitir que la microscopía de contraste de fase. Figura 2 muestra la cámara de ensayo de flujo y microscopio y MicroSlide colocado en la platina del microscopio.
- Prellenado una jeringa de vidrio de 50 ml con un cierre luer con 10 ml de agua destilada estéril y adjuntar una longitud de tubo de silicona de 25 cm del puerto de jeringa. Inserte en una bomba de jeringa. Alterar la velocidad de retirada de la bomba de jeringa de acuerdo con lalas instrucciones del fabricante MicroSlide para mantener una tensión de cizalla de 0,05 Pa (0,5 dinas / cm 2, Figura 3).
- Tome dos jeringas de 5 ml, deseche los émbolos y adjuntar los barriles a los dos puertos de flujo de una válvula de solenoide electrónico utilizando un tubo de silicona.
- Adjuntar 12 cm de tubo de silicona a la válvula de flujo de salida. La válvula permite la alternancia entre un tampón libre de células de lavado (media/0.1 endotelial% (v / v) de BSA) y la suspensión de linfocitos.
- Limpie la válvula de solenoide electrónico mediante la inserción de tampón de lavado en los dos cilindros de jeringas y la garantía de búfer está fluyendo desde un barril a través de la válvula y en el tubo de silicona de flujo de salida.
- Utilice el interruptor de la válvula para alternar a la otra barril y garantizar el tampón está fluyendo y que todas las burbujas se eliminan del sistema. Retirar el tampón de lavado de uno de los barriles y reemplazar con suspensión de linfocitos Figura 4a.
- Conecte el tubin siliconag de la bomba de jeringa a un puerto de un canal microportaobjetos elegido a través de un adaptador de microportaobjetos. A continuación, conecte el tubo de silicona de la válvula de salida al puerto opuesto a través de un adaptador de microportaobjetos. Asegúrese de que el tubo de silicona y los adaptadores están llenos de tampón de lavado antes de la conexión para evitar las burbujas de aire que entra en el sistema (Figura 4b).
- Una vez conectado al sistema de flujo, coloque el microportaobjetos en la platina del microscopio y fije con cinta adhesiva o clips para evitar el movimiento. Ajuste el microscopio con el objetivo 10X junto con la configuración de la fase correspondiente. Asegúrese de que la monocapa endotelial se visualiza como en enfoque utilizando la lente ocular. Asegurar que las imágenes pueden ser capturadas a través de una cámara que está unida al microscopio mediante el cual las imágenes pueden ser transmitidas a un monitor y se registran.
7. Flujo técnica de ensayo y grabación de Adhesión para el Análisis
- Perfundir la capa endotelial con tampón de lavado durante 2 min iniciando withdrawal de la bomba de jeringa para eliminar cualquier residuo o anticuerpo bloqueante unido y luego cambiar la válvula para permitir a 5 min bolo de solución de leucocitos en una tensión de cizallamiento constante de 0,05 Pa.
- Durante los últimos 2 minutos del bolo de leucocitos, grabar 10 campos al azar a lo largo de la longitud de la microportaobjetos. Esto permite análisis fuera de línea de linfocitos balanceo / tethering en la monocapa endotelial. Registre cada campo durante aproximadamente 10 segundos antes de pasar a la siguiente y asegúrese de que las grabaciones se hacen en contra de la dirección del flujo para evitar el registro de la misma célula de laminación dos veces en rápida sucesión.
- Siga el bolo de leucocitos con un bolo de 5 min de tampón de lavado mediante la devolución de la válvula a su posición inicial. Durante el final de 2 min de este bolo llevar a cabo una segunda fase de grabación por la elección de al menos 10 campos seleccionados al azar a lo largo de la longitud de la MicroSlide. Registre cada campo durante unos 5 segundos antes de pasar a la siguiente y asegurarse de que la monocapa endotelial y leucoc adherenteytes están en foco claro. Esto permite análisis fuera de línea del patrón de la adhesión.
Resultados
Este ensayo tiene la capacidad de visualizar la cascada de adhesión de varios pasos de flujo y elucidar los mecanismos moleculares subyacentes mediante la comparación de los resultados de los experimentos de control para aquellos con inhibidores moleculares. Varios lechos vasculares se pueden recapitulan mediante la incorporación de células endoteliales específicos y la alteración de las condiciones de estrés de cizallamiento.
Cada paso de la cascada de adhesión puede ser analizada fuera de línea, siguiendo el método de grabación se indica en el protocolo. El primer paso de la cascada de adhesión es la rodadura de leucocitos que pueden ser expresadas como un porcentaje del total de células adherentes. Análisis Desconectado permite que el número de células adherentes que se enumeró en cada campo registrada durante el bolo de leucocitos. La reproducción de la imagen permite la comparación de las células que están firmemente adheridas y los que están experimentando un movimiento de balanceo a través del endotelio. Movimiento de balanceo puede ser visualizado utilizando esta técnica, cada campo se graba durante al menos 10 seg. Células de laminación se identifican por su reducida velocidad sobre la superficie endotelial en comparación con las células que fluye. Este comportamiento se debe demostrar por lo menos durante 5 segundos y sin desprendimiento. La cascada de adhesión dentro de los sinusoides hepáticos se lleva a cabo en un entorno de bajo cizallamiento y en estudios in vivo han confirmado mínima de rodadura con sólo una breve etapa de inmovilización. Hemos confirmado que el ensayo de flujo refleja el entorno de los sinusoides hepáticos mediante la demostración de que menos del 10% de los leucocitos adherentes persistentemente rodar sobre estimulado HSEC en estos ensayos.
El siguiente paso de la cascada de adhesión es la adhesión firme. La adhesión total puede calcularse a partir de la segunda etapa de grabación durante el bolo de tampón de lavado (paso 7.3). Análisis Desconectado permite que el número total de células firmemente adherentes que se cuentan en cada campo (Figura 5). Las células firmemente adherentes se definen como células que son estacionaria o shapechanged con el comportamiento de rastreo lento.El número medio de células por campo puede entonces calcularse. Esta figura a continuación, se puede utilizar, en combinación con el área de superficie total del campo de vista (determinado usando una retícula o equivalente), concentración de linfocitos (típicamente 1 x 10 6 células / ml) y la tasa de flujo para expresar el grado de la adhesión de linfocitos como células adherentes / mm 2/10 6 células perfundido.
Estudiar el patrón de adhesión implica el análisis de los dos últimos pasos de la cascada de adhesión que incluye cambio de forma, el rastreo y la migración transendotelial. Los leucocitos adherentes a la superficie superior de la monocapa de HSEC aparecen en fase brillante, mientras que los que han migrado a través de la monocapa aparece fase de oscuridad (Figura 6). Las células pueden ser clasificados como exhibiendo adhesión "estático" (nonmigrated / vuelta), morfología 'forma-changed' o como 'migra' y categorías individuales se expresan como un porcentaje de lapoblación total del adhesivo.

Figura 1. Monocapa de células hepáticas humanas primarias endoteliales sinusoidales dentro de la cámara de flujo. A) microportaobjetos llenos de medio que contiene monocapa de células endoteliales antes del comienzo de. B) Imagen de contraste de fase de confluente endotelial monocapa flujo ensayo de adhesión, las células endoteliales deben ser sembradas en MicroSlide que han sido pre-revestido (para las células endoteliales hepáticas humanas esto debería ser con colágeno tipo cola de rata 1) y es esencial que las células endoteliales son saludables en la cultura y confluente. Haga clic aquí para ver la imagen más grande .

Figura 2. Flujo cámara de ensayo. Una cámara de ensayo de flujo de configuración se puede ver aquí, que consiste en una cámara transparente que está montada en un microscopio invertido. Un calentador se coloca en la cámara y debe ser controlada por termostato para mantener una temperatura de 37 ° C. No debe haber puertos disponibles para conectar un tubo de silicona de una MicroSlide dentro de la cámara a una bomba de jeringa que se encuentra fuera. El microportaobjetos se coloca directamente sobre la platina del microscopio. Haga clic aquí para ver la imagen más grande .

Figura 3. La jeringa de la bomba. Una bomba de jeringa es conectared a través de tubo de silicona a la cámara de flujo. La bomba está ajustada a una tasa de retirada específica en función de la tensión de corte deseada requerida para el ensayo. Haga clic aquí para ver la imagen más grande .

Figura 4. Conexión de la válvula a la cámara de flujo. A) una válvula de solenoide electrónica permite la conmutación entre dos cuerpos de jeringa que contienen cualquiera de las células o los medios de comunicación con prácticamente ningún espacio muerto. B) Una vez que la válvula se vacía y los dos barriles están configurados, el tubo de silicona de la válvula está conectado a la cámara de flujo. Es muy importante que cuando se conecte el adaptador en el tubo de silicona para el puerto de la cámara de flujo existe una interfase líquido / líquido. Haga clic aquí para ver la imagen más grande.

Figura 5. Medición de la total adhesión de leucocitos Durante los últimos dos minutos del paso del bolo tampón de lavado (como se indica en el protocolo), un mínimo de diez campos aleatorios debe ser registrada.. Estos se pueden analizar fuera de línea y el número total de células firmemente adherentes se pueden contar en cada campo. La adhesión total de leucocitos se puede comparar entre las cámaras de control y los tratados previamente con anticuerpos de bloqueo, aquí se muestra un campo de representante de una corredera de control y una diapositiva pretratado con molécula de adhesión intracelular-1 (ICAM-1) de bloqueo de anticuerpos. Las flechas se han añadido para resaltar los leucocitos adherentes, en la representacióntiva campo de la corredera de control hay un total de 25 leucocitos identificado y en el ICAM-1 diapositiva bloque hay un total de 13 leucocitos identificados. Las barras de escala = 100 micras. Haz click aquí para ver la imagen más grande .
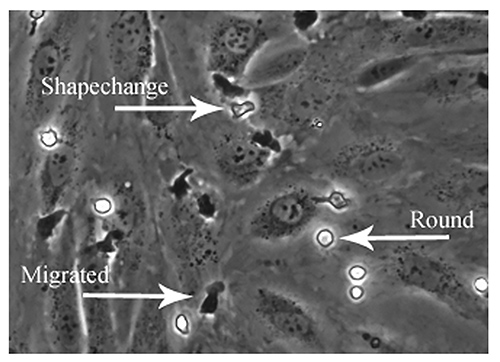
Figura 6. Análisis del patrón de adhesión de leucocitos sobre monocapas endoteliales por microscopía de contraste de fase. Desconectado análisis de los campos grabados también se puede utilizar para estudiar la dirección y velocidad de adhesión de leucocitos. Los pasos específicos de la cascada de adhesión se pueden visualizar y cuantificar el uso de imágenes de contraste de fase. Brillante células de fase que son firmemente adherente pero no activado se puede llamar la adhesión "ronda", las células que se activand y la fase luminosa se puede llamar "forma cambiado" y las células que son oscuras fase son las células que han sido sometidos a la migración transendotelial y puede denominarse 'migrado'. La imagen muestra ejemplos de cada patrón de adhesión. Haga clic aquí para ver la imagen más grande .
Discusión
El paso más crítico para llevar a cabo con éxito un ensayo de flujo es asegurar que una monocapa sana y confluente de células endoteliales está listo antes de que el ensayo de adhesión de flujo. Células endoteliales primarias pueden ser difíciles de cultivar y sensibles a las alteraciones en los métodos de cultivo. Es importante que 1) cámaras de flujo están de manera adecuada y uniformemente recubiertas con células endoteliales en una monocapa; para HSEC usamos rata colágeno de tipo I, pero esta cola pueden ser diferentes para otras poblaciones endoteliales, 2) medio de cultivo es adecuado para el tipo de célula, para HSEC hemos descrito nuestro medio completo en la sección de protocolo. Otros pasos vitales incluyen el establecimiento de la bomba de jeringa a la velocidad apropiada para reflejar los niveles fisiológicos de esfuerzo de corte.
Durante el ensayo de flujo es necesario para evitar burbujas de aire dentro del circuito de flujo que puede dañar la monocapa endotelial o de tiras de las células inmunes de la superficie endotelial. Esto se puede evitar por la norma ENsuring que todos los tubos y adaptadores de silicona son perfundidos con tampón de lavado antes de la conexión, que todas las burbujas de aire se eliminan y los medios de comunicación que se precalentaron antes de su uso. Al conectar los adaptadores a los puertos en el MicroSlide es muy importante que haya una interfaz de líquido / líquido durante la conexión, si hay alguna aire entonces esto va a formar un espacio de aire dentro del sistema que perturbar la monocapa endotelial durante la retirada de la jeringa paso. La solución de leucocitos en el cuerpo de la jeringa necesita agitación regular para asegurar que las células no se establecen, manteniendo así una densidad celular constante durante todo el experimento.
Durante los pasos de grabación que es importante para garantizar que la imagen de la capa endotelial está adecuadamente enfocada y clara para permitir el análisis fuera de línea precisa, y que durante la segunda etapa del ensayo de flujo (mensaje de leucocitos en bolo) se deja que el tiempo suficiente durante el tampón de lavado fase antes de la grabación se reanudó para asegurar quese eliminan todos los leucocitos adherentes. Del mismo modo es esencial utilizar las células endoteliales en una monocapa de densidad adecuada para evitar la pérdida de las células que pueden interferir con los patrones de flujo en los capilares estrechos y también puede ser difícil de diferenciar de leucocitos adherentes más grandes bajo microscopía de contraste de fase. Hemos descrito la densidad óptima de siembra para las células endoteliales sinusoidales hepáticas humanas, pero esto puede variar entre diferentes poblaciones y especies endoteliales.
Se han logrado avances significativos en el estudio de reclutamiento de leucocitos en modelos animales con microscopía intravital. La principal ventaja del método de ensayo de adhesión de flujo es que el reclutamiento de leucocitos puede ser estudiada en un sistema binario con células endoteliales humanas primarias. Además, estas interacciones pueden ser estudiados bajo niveles fisiológicos relevantes de la tensión de cizallamiento. Es importante para confirmar los resultados de los estudios en animales intravital con los sistemas celulares humanos ya que puede haber diferees en las propiedades endoteliales entre las especies. Una de las limitaciones del ensayo de flujo es que el reclutamiento de leucocitos se está estudiando en un entorno unicelular de la monocapa endotelial. Además una vez que los leucocitos se han adherido y transmigrado a través del endotelio que pueden no estar en presente en número suficiente para ser aislado y sometido a procesos posteriores.
A pesar de estas limitaciones, una vez que el ensayo de adhesión flujo se ha dominado, se puede desarrollar para llevar a cabo un análisis más detallado de la cascada de adhesión de leucocitos y adaptado para recapitular un entorno multicelular. Grabación prolongada de campos individuales y el uso de software de seguimiento se puede utilizar para analizar el comportamiento de rastreo de los leucocitos. Además al finalizar el ensayo de flujo de los micro-portaobjetos pueden ser interrogados mediante microscopía confocal de barrido láser y el etiquetado de inmunofluorescencia para estudiar la adhesión y la transmigración en más detalle. Además, hemos desarrollar previamenteed un modelo in vitro, donde los leucocitos que fluyen podrían interactuar con endotelio hepático condicionada por la presencia de hepatocitos. Este ensayo también puede ser desarrollado para estudiar las subpoblaciones de leucocitos: nuestro grupo ha realizado estudios con subconjuntos tales como células reguladoras T, células B, y leucocitos de hígado infiltrante.
Estos estudios son evidencia de que el ensayo de adhesión de flujo es una poderosa herramienta para estudiar el reclutamiento de leucocitos general y específica de órganos en los sistemas humanos.
Divulgaciones
Los autores declaran no tener intereses financieros en competencia
Agradecimientos
SS es financiado por una Beca Clínica Wellcome Trust Intermedio, CW por un Fiduciario del Programa de Beca Wellcome.
Materiales
| Name | Company | Catalog Number | Comments |
| Six channel microslide VI 0.4 flow chamber | Ibidi | 80601 | Other channel size and precoated slides are available depending on assay requirements. |
| Flow adaptors microslide VI 0.4 | Ibidi | 80646 | |
| Flow assay chamber | Solent Scientific | 33-3322 | These chambers are custom made by the company dpending on the model of microscope and accessories. |
| Inverted Microscope IX2 | Olympus, UK | Model IX50 | |
| Harvard Syringe Pump | Harvard Apparatus, UK | 702101 | |
| Electronic solenoid valve | Lee Products Limited, UK | Part Number LFYA1226032H | |
| Silicon Tubing large | Fisher Scientific | FB50855 | 2 mm inner diameter, 4 mm outer diameter |
| Silicone Tubing-small | Fisher Scientific | FB50853 | 1 mm inner diameter, 3 mm outer diameter |
| Harvard Glass Syringe | Harvard Apparatus, UK | 55-0962 | |
| Cell separation medium/Lympholyte | VH Bio | CL-5020 | |
| Rat Tail Collagen | Sigma Aldrich | C3867-1VL |
Referencias
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Wong, J., et al. A minimal role for selectins in the recruitment of leukocytes into the inflamed liver microvasculature. Clin. Invest. , 2782-2790 (1997).
- Braet, F., Wisse, E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review. Compar. Hepatol. 1, 1 (2002).
- Lawrence, M. B., Springer, T. A. Leukocytes roll on a selectin at physiologic flow rates: distinction from and prerequisite for adhesion through integrins. Cell. 65, 859-873 (1991).
- Finger, E. B., et al. Adhesion through L-selectin requires a threshold hydrodynamic shear. Nature. 379, 266-269 (1996).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell biol. 136, 717-727 (1997).
- Cinamon, G., Shinder, V., Alon, R. Shear forces promote lymphocyte migration across vascular endothelium bearing apical chemokines. Nat. Immunol. 2, 515-522 (2001).
- Lalor, P. F., et al. Vascular adhesion protein-1 mediates adhesion and transmigration of lymphocytes on human hepatic endothelial cells. J. Immunol. 169, 983-992 (2002).
- Aspinall, A. I., et al. CX(3)CR1 and vascular adhesion protein-1-dependent recruitment of CD16(+) monocytes across human liver sinusoidal endothelium. Hepatology. 51, 2030-2039 (2010).
- Curbishley, S. M., Eksteen, B., Gladue, R. P., Lalor, P., Adams, D. H. CXCR 3 activation promotes lymphocyte transendothelial migration across human hepatic endothelium under fluid flow. Am. J. Pathol. 167, 887-899 (2005).
- Oo, Y. H., et al. Distinct roles for CCR4 and CXCR3 in the recruitment and positioning of regulatory T cells in the inflamed human liver. J. Immunol. 184, 2886-2898 (2010).
- Weston, C. J., Shepherd, E. L., Adams, D. H. Cellular localization and trafficking of vascular adhesion protein-1 as revealed by an N-terminal GFP fusion protein. J. Neural Transm. , (2013).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. J. Immunol. 186, 4147-4155 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados