Method Article
De imagen no invasivas y Análisis de la isquemia cerebral en ratas vivas utilizando Tomografía por emisión de positrones con
En este artículo
Resumen
Brain damage resulting from cerebral ischemia may be non-invasively imaged and studied in rats using pre-clinical positron emission tomography coupled with the injectable radioactive probe, 18F-fluorodeoxyglucose. Further, the use of modern software tools that include volume of interest (VOI) brain templates dramatically increase the quantitative information gleaned from these studies.
Resumen
El accidente cerebrovascular es la tercera causa principal de muerte entre los estadounidenses de 65 años de edad o más, 1. La calidad de vida de los pacientes que sufren de un derrame cerebral no vuelve a la normalidad en una gran mayoría de los pacientes 2, que se debe principalmente a la actual falta de tratamiento clínico para el accidente cerebrovascular agudo. Esto requiere la comprensión de los efectos fisiológicos de la isquemia cerebral en el tejido cerebral con el tiempo y es una importante área de investigación activa. Con este fin, se ha avanzado experimental con ratas como modelo preclínico para el accidente cerebrovascular, en particular, el uso de métodos no invasivos como la 18 F-FDG (FDG), junto con Tomografía por Emisión de Positrones (PET) 3,10,17. Aquí presentamos una estrategia para inducir isquemia cerebral en ratas mediante la oclusión de la arteria cerebral media (MCAO) que imita la isquemia cerebral focal en los seres humanos, y la formación de imágenes de sus efectos sobre las 24 horas usando FDG-PET junto con la tomografía computarizada de rayos X (CT) con un Albira PInstrumento ET-CT. A VOI atlas plantilla fue posteriormente fusionados con los datos de ratas cerebrales para permitir un análisis imparcial del cerebro y sus subregiones 4. Además, se presenta un método para la visualización 3D de la evolución en el tiempo FDG-PET-CT. En resumen, presentamos un protocolo detallado para iniciar, cuantificar y visualizar un evento ictus isquémico inducido en una rata viva Sprague-Dawley en tres dimensiones utilizando FDG-PET.
Introducción
El accidente cerebrovascular es una de las principales causas de muerte en los países desarrollados, y es directamente responsable de la muerte de 1 de cada 19 estadounidenses 1. Se ha estimado que alrededor de 795.000 estadounidenses sufren ictus cada año, de los cuales 87% son de naturaleza isquémica 5. Durante un evento isquémico, suministro continuo de oxígeno y glucosa a las neuronas corticales se ve gravemente afectada inducir un ambiente hipóxico, lo que conduce a una disminución de la función celular en las regiones cerebrales afectadas. Dependiendo de la gravedad del accidente cerebrovascular, el flujo sanguíneo cerebral y la captación de glucosa varía espacial y temporalmente.
Los daños debidos a un accidente cerebrovascular puede ser identificado a través de métodos no invasivos, como la 18 F-FDG (FDG) Tomografía por Emisión de Positrones 6. FDG es un análogo de la glucosa en el que el grupo hidroxilo en la posición 2 'ha sido reemplazado por el emisor de positrones 18 F de isótopos. 18 F es advantageous debido a su largo, la vida media de 110 minutos, lo que le permite ser utilizado para detectar el consumo de glucosa en el cerebro. FDG PET produce un mapa de alta resolución cuantitativa de consumo de desoxiglucosa en el cerebro 7 como 18 F tiende a acumularse en las regiones de alto consumo de glucosa, lo que indica que tales tejidos son metabólicamente muy activa 8. El 18 F núcleo sufre desintegración beta, liberando un positrón, que aniquila rápidamente con un electrón de cerca, la producción de rayos gamma, que son detectadas por el instrumento. PET con FDG se pueden repetir en el mismo individuo con al menos 10 18 F vidas medias, o alrededor de 18 horas, entre las gammagrafías, proporcionando así una manera de estudiar los cambios en la actividad cerebral a través del tiempo en el mismo individuo.
Modelos animales preclínicos, como las ratas, a menudo se utilizan para evaluar los efectos de los accidentes cerebrovasculares y la efectividad de los tratamientos para el accidente cerebrovascular. Desde FDG PET es no invasivo, que puede ser utilizado para medirlos efectos del derrame cerebral en el tiempo sin alterar la fisiología del animal. Dependiendo de la ubicación del evento de carrera, las diferentes regiones del cerebro pueden verse afectados. Sin embargo, con pequeños animales como ratas, que define de forma manual y la cuantificación de la actividad en regiones específicas del cerebro de la rata puede ser un reto. Con el fin de comparar la actividad metabólica de la glucosa en regiones específicas del cerebro de rata con el tiempo, los volúmenes de interés (VOI) para cuantificar deben ser delineadas consistentemente. Un atlas precisas del cerebro de rata ha sido desarrollado para aliviar este problema 9, y se ha convertido en forma digital para su uso en la cuantificación de los datos FDG-PET preclínicos. Aquí presentamos un método para clasificar el daño tisular accidente cerebrovascular en una, manera metódica consistente. El método se detalla el procedimiento quirúrgico para iniciar la isquemia cerebral en un modelo animal, la cuantificación de sub-regiones específicas del cerebro afectadas por el accidente cerebrovascular, y producir una visualización tridimensional de la extensión y localización de accidente cerebrovasculardaño a los tejidos utilizando las técnicas y herramientas apropiadas. Utilizando la metodología descrita en este estudio, los investigadores pueden iniciar consistentemente isquemia cerebral en ratas, realizar imágenes de PET, y cuantificar los cambios en la captación de FDG utilizando regiones cerebrales definidas en modelos preclínicos de accidente cerebrovascular en el tiempo.
Protocolo
Manejo de animales y todos los experimentos con ellos se llevaron a cabo estrictamente de acuerdo con los protocolos que fueron aprobados por el Comité Institucional Cuidado de Animales y el Empleo de la Universidad de Notre Dame (Protocolo número 14-086).
1. Los animales
- Animales y Accidente Cerebrovascular de iniciación: Las ratas macho Sprague Dawley uso que pesan entre 220 y 270 g para todos los estudios de tiempos.
- Anestesiar ratas con isofluorano al 2,5% (2 L / min en 100% de O 2) usando un cono de nariz.
- Colocar el animal en decúbito dorsal sobre una almohadilla térmica. Pegue las patas delanteras.
- Afeitado ventralsurface del cuello. Prepara la zona afeitada con EtOH al 70%, seguido de solución de yodo povidona al 10%.
- Instrumentos estériles se utilizan para este procedimiento; guantes son reemplazados después de la preparación del animal. Se emplean técnicas de punta estéril.
- Usando tijeras, hacer una incisión 2-2,5 cm paralela a la tráquea, 0,5 cm a la derecha de la tráquea. Utilizando dissectio romon localizar la arteria carótida.
- Use retractores para ayudar a visualizar el buque. Coloque una abrazadera micro en la arteria carótida común (CCA).
- Busque el primer punto de ramificación que será la arteria carótida externa (CEPA) y la arteria carótida interna (ACI). Cauterizar ramas más pequeñas unidas a la ECA, tales como la arteria occipital.
- Ligar la ECA del desvío hacia la arteria tiroidea con una sutura de seda 4-0. Las suturas deben tener una longitud extra para permitir pinzas para sujetar la sutura.
- Cauterizar la ECA por encima de la sutura (craneal). Para sujetar la sutura con las pinzas, tire de la ECA en sentido caudal y será paralela a la CCA.
- Busque el ICA y utilizar otra pinza micro para ocluir esta arteria.
- Haz un pequeño agujero en el ECA utilizando pequeñas tijeras de primavera. Inserte el oclusor en la LCE y atar una sutura alrededor del oclusor para evitar el flujo de sangre.
- Retire la abrazadera micro en el ICA y avanzar en el oclusor hasta sentir una resistencia.
NOTA Asegúrese de que los avances en el ICA y no la arteria pterygopalatin oclusión. El oclusor debe avanzar sin problemas y la punta blanca no debe ser visto si el oclusor se coloca correctamente. - Retire la abrazadera micro de la CCA. Cortar el exceso de oclusor o sutura.
- Coloque 9 mm Clips Auto para cerrar la incisión en la piel.
- Retire el animal de la anestesia y permite animal para despertar. Después de 2 horas:
- Anestesiar ratas con isoflurano.
- Retire los clips de la herida.
- Localice el extremo del oclusor y sacarlo de la arteria cerebral media tirando suavemente de él hasta la punta blanca del oclusor entra en contacto con las suturas. No tire de él todo el camino, esto hará que el sangrado.
- Vuelva a colocar los clips de la herida de la incisión.
- Retire el animal de la anestesia y permite animal para despertar.
2. Adquisición de imágenes
Realizar tres PET y CT slatas para cada rata. Tómese pre escaneo 1-2 días antes de la inducción de derrame cerebral, para proporcionar una línea de base para el 18 F-FDG captación. Analiza cada rata 1,5 horas después del accidente cerebrovascular, antes de la reperfusión se realiza (imagen con oclusor todavía en el animal). Analiza cada rata 26 horas después de accidente cerebrovascular (post reperfusión 24 hr) para cuantificar el daño del tejido cerebral debido a una lesión derrame cerebral.
NOTA: El punto de tiempo de 24 hr mencionado en el resto del manuscrito se refiere al tiempo posterior reperfusión cuando se escanearon las ratas.
- Anestesiar ratas bajo gas isofluorano 2,5% en la cámara de anestesia.
- Inyectar aproximadamente 500 Ci de 18 F-desoxiglucosa (FDG) (200 l volumen total) en una vena de la cola de rata.
- Espere 1 hora.
- Coloque rata anestesiada en cama estándar para ratas, bajo cono de la nariz anestesia con isofluorano. Mida la distancia en mm entre la nariz de la rata y el borde de la cama de la rata para horizontal compensado.
3. Adquisición de imágenes
- Abrir Albira suite software.
- Seleccione comprador.
- Nombre nuevo estudio.
- Bajo PET o SPECT haga clic en Agregar> Seleccionar protocolo de PET. Haga clic en Agregar.
- Bajo CT haga clic en Agregar> Seleccionar protocolo CT. Haga clic en Agregar.
- Haga clic en el número bajo de posición horizontal inicial bajo el PET. Establecer el número de distancia medida en mm entre la nariz de la rata y el frente de la cama de la rata. Repita el procedimiento para la TC.
- Establecer reserva de rata e introduzca el peso en gramos.
- Set compuesto de FDG.
- Ajuste Tiempo de Inyección e Inyección Fecha y Dosis.
- Haga clic en el botón Inicio de Estudio.
NOTA: Al finalizar el estudio de PET CT, los datos se guardarán automáticamente. - Abra Albira Reconstructor.
- Change Pendiente to Last 10 o Todos.
- Seleccione el nombre de archivo de escaneo.
- Haga clic en Agregar.
- Haga clic en Inicio Reconstrucción. NOTA: El archivo se guarda en formato MicroPET.
Análisis 4. Imagen
- Realizar análisis de imagen usando el software de análisis de PMOD en conjunción con la W. Schiffer cerebro Atlas.
- Abrir PMOD> Fusión.
- Vaya a la pestaña coregistration Preprocesamiento en la parte superior de la pantalla.
- Abra el menú desplegable de carga de referencia en el centro de la pantalla y seleccione NIfTI. Vaya a C: //PMOD3.2/resources/templates/usertemplates. Seleccione Rat (W.Schiffer) -FDG.nii y haga clic en Abrir.
- Abra el menú desplegable de carga de entrada a la derecha de la pantalla y seleccione MicroPET. Vaya a la deseadaArchivo MicroPET. Selecciónelo y haga clic en Abrir.
- Vaya a la pestaña coregistration Manual en la parte superior de la pantalla.
- Seleccione la cuarta ficha en el grupo medio de pestañas de la derecha (Reslicing).
NOTA: Dos botones van a aparecer en las exploraciones MicroPET. - Utilice el rectángulo blanco abierto para girar las exploraciones MicroPET y el rectángulo blanco lleno de mover las exploraciones MicroPET. Alinear las dos exploraciones. Para ello, busque monumentos como las glándulas de Harder, y la parte superior y las funciones cerebrales posteriores que se pueden utilizar para que coincida con la exploración MicroPET con el modelo del cerebro. A continuación, ajuste la exploración MicroPET hasta que coincida con el atlas del cerebro (W. Schiffer).
NOTA: Por ejemplo, las glándulas de Harder aparecen brillantes en ambos las exploraciones MicroPET y los atlas del cerebro (W. Schiffer), y se puede utilizar como una referencia para la alineación. - Si es necesario, gire el MicroPET escanear 180 ° en la vista coronal y aumentar la exploración significativamente en ªe vista sagital, junto con otros cambios de orientación de menor importancia.
- Vaya a la pestaña Fusión de pantalla completa (VOI) en la parte superior de la pantalla.
- Seleccione el origen A en la parte superior derecha de la pantalla.
- Navegue a Plantilla> Atlas en la parte inferior de la página.
- Seleccione Rat (W. Schiffer) en el menú desplegable.
NOTA: (Opcional) Para volver a la pestaña coregistration Manual donde el atlas deben aparecer superpuesto en atlas del cerebro (W. Schiffer). El atlas se pueden utilizar para ayudar a alinear la exploración MicroPET y el atlas del cerebro (W. Schiffer). Después de la alineación, vuelva a la pestaña Fusión de pantalla completa (VOI). Una plantilla aparecerá en el cerebro, lo que indica que se medirán secciones del cerebro de las Estadísticas Vio. - Seleccione Fuente B en la parte superior derecha de la pantalla.
- Seleccione el botón VOI Estadística en la righ superiort de la pantalla.
NOTA: Aparecerá una hoja de cálculo. - Seleccione Guardar.
NOTA: Una escritura Como aparecerá [VOI Estadísticas] ventana. - Seleccione Guardar en archivo del sistema.
NOTA: Una PMOD (guardar): elegir aparecerá la ventana componentes. - En el campo Nombre de archivo, escriba el nombre del archivo deseado.
- Seleccione Guardar.
- Realizar análisis de datos utilizando Microsoft Office Excel 2010.
- Abra Excel.
- Seleccione Archivo> Abrir.
- Cambiar el tipo de archivo en Todos los archivos de Excel a Todos los archivos.
- Vaya a los archivos VIOSTAT guardados. Seleccione el archivo deseado.
NOTA: Aparecerá un asistente de importación. - Seleccione Finalizar. Si está usando un Mac, haga doble clic en el archivo VOISTAT y lo hará directamente abierto como un archivo de Excel.
- Seleccione la columna que contiene el campo VoiName (Region). Copie la información y péguelo en un nuevo archivo de Excel.
- Seleccione la columna que contiene los campos promediados y [1/1]. Copie la información y pegarla en el nuevo archivo de Excel.
- Repita este proceso para todos los archivos VOISTAT.
- Empezar una nueva pestaña para cada conjunto de datos.
- Regreso a la primera ficha. Seleccione una nueva célula. Calcular la relación entre el lado derecho de una sección de cerebro para el lado izquierdo de una sección de cerebro dividiendo el valor del lado derecho del cerebro por el lado izquierdo del cerebro. La sección del cerebro que pertenece a la parte derecha del cerebro aparece antes de la sección que pertenece a la parte izquierda del cerebro. Repita esto para todas las secciones del cerebro.
- Seleccione una nueva célula. Utilice la función PROMEDIO para calcular el promedio de cada una de las relaciones calculadas anteriormente a través de todos los ratones.
- Seleccione una nueva célula. Calcular el SEM de cada sección del cerebro mediante el uso de la función STDEV y dividiendo it por la raíz cuadrada del número de ratones.
- Repita esto para cada conjunto de datos.
Visualización 5. Imagen
- Convertir imágenes en el formato de archivo de analizar el uso de software de análisis PMOD.
- Abrir PMOD> Ver.
- Vaya a la pestaña Ver en la parte superior de la pantalla.
- Abra el menú desplegable de carga en la parte derecha de la pantalla y seleccionar MicroPET. Vaya a la MicroPET deseada o archivo CT. Selecciónelo y pulse Abrir.
- Abra el menú Guardar desplegable a la derecha de la pantalla y seleccione Analizar. Navegar hasta el destino deseado. Escriba el nombre deseado en el campo Nombre de archivo. Seleccione Guardar.
- Crear secuencias de imágenes que utilizan el software de imágenes VolView.
- VolView Abrir.
- Seleccione Abrir archivo a la izquierda de la pantalla.
- Vaya a la versión analizar del archivo de datos computarizada para el escaneo deseado. Selecciónelo y pulse Abrir.
NOTA: Aparecerá un asistente Abrir archivo. - Utilice la configuración predeterminada pulsando Siguiente en la ventana emergente.
- Selecciona la pestaña Plugins a la izquierda de la pantalla.
- Abra el menú Plugin desplegable y seleccione Utilidad> Combinar volúmenes.
- Desmarque Componentes Rescale.
- Seleccione Asignar segunda entrada.
- Vaya a la versión analizar del archivo de datos MicroPET por la misma exploración. Selecciónelo y pulse Abrir.
NOTA: Aparecerá un asistente Abrir archivo. - Utilice la configuración predeterminada pulsando Siguiente en cada pantalla.
NOTA: La exploración MicroPET aparecerá superpuesta en la TAC. - Seleccione el color / Opacidad Ajustes pestaña en la parte izquierda de la pantalla.
- Abra el menú desplegable de componentes en la parte inferior derecha de la pantalla. Seleccione 1.
NOTA: Esto asegurará que la TC es la única imagen afectada por las siguientes direcciones. - En la sección Escalar Asignación de color, seleccione el punto medio. Eliminarlo arrastrándolo fuera de la de la barra deslizante.
- Seleccione el punto de la izquierda.
NOTA: Aparecerá una ventana Selector de color. - Cambiar el color del punto de negro.
- Seleccione el punto correcto.
NOTA: Aparecerá una ventana Selector de color. - Cambiar el color del punto de blanco.
- En la sección Escalar Opacidad Mapping, añadir un punto haciendo clic en cualquier parte del cuadro.
- Ajustar la sección hasta que la imagen CT sólo muestra el esqueleto de la rata.
- Marque Activar sombreado.
- Seleccione el ReView pestaña a la izquierda de la pantalla.
- Cambiar el número de fotogramas a 72.
- Cambie X rotación a 360.
- Seleccione Crear.
- Navegar hasta el destino deseado. Crear una nueva carpeta para almacenar las imágenes haciendo clic derecho en un espacio vacío y seleccionar Nuevo> Carpeta.
- Escriba el nombre deseado en el campo Nombre de archivo. Seleccione Guardar.
NOTA: Aparecerá una ventana del tamaño constructivo. - Seleccione Aceptar.
- Volview va a generar las imágenes. Cuando esté terminado, aparecerá una ventana que indica "su película se ha creado correctamente!" Seleccione Aceptar.
- Vuelva a la ficha Configuración de color / opacidad.
- Bajo Componente Peso (s), ajuste el control deslizante para el componente 1 por lo que tiene la value de 0.
NOTA: Sólo aparecerá la exploración MicroPET. - Repetir los pasos 5.2.21-28 para crear una segunda secuencia de imágenes.
- Vuelva a la ficha Configuración de color / opacidad.
- Bajo Componente Peso (s), ajuste el control deslizante para el componente 2 por lo que tiene el valor de 0.
NOTA: Sólo aparecerá la tomografía computarizada. - Repetir los pasos 5.2.21-28 para crear una tercera secuencia de imágenes.
- Generar películas de rotación (que se muestran en el video) utilizando el software ImageJ.
- ImageJ Abrir.
- Seleccione Archivo> Importar> Secuencia de imágenes.
- Navegue hasta el archivo que contiene las imágenes que ven sólo los datos de la TC para la detección previa. Seleccione la primera imagen y pulse Seleccionar.
NOTA: Aparecerá una ventana Opciones de secuencia. - Seleccione Aceptar.
- Seleccione File &# 62; Importar> Secuencia de imágenes.
- Navegue hasta el archivo que contiene las imágenes que ven sólo los datos MicroPET para la detección previa. Seleccione la primera imagen y pulse Seleccionar.
NOTA: Aparecerá una ventana Opciones de secuencia. - Seleccione Aceptar.
- Seleccione Archivo> Importar> Secuencia de imágenes.
- Navegue hasta el archivo que contiene las imágenes que ven tanto los datos de la TC y MicroPET para la detección previa. Seleccione la primera imagen y pulse Seleccionar.
NOTA: Aparecerá una ventana Opciones de secuencia. - Seleccione Aceptar.
- Seleccionar Imagen> Pilas> Herramientas> Combinar.
NOTA: Aparecerá una ventana combinador. - Seleccione el menú desplegable STACK1. Seleccione la pila que contiene los datos de la TC.
- Seleccione el menú desplegable STACK2. Seleccione la pila que contiene el Midatos croPET. Seleccione Aceptar.
NOTA: Aparecerá una nueva pila con ambas exploraciones. - Seleccionar Imagen> Pilas> Herramientas> Combinar.
NOTA: Aparecerá una ventana combinador. - Seleccione el menú desplegable STACK1. Seleccione la pila que contiene las pilas combinados.
- Seleccione el menú desplegable STACK2. Seleccione la pila que contiene tanto los datos de CT y los datos MicroPET. Seleccione Aceptar.
NOTA: Aparecerá una nueva pila con las tres exploraciones. - Mantenga las pilas combinados abierto. Repita los pasos 5.3.2-16 para el poste de escaneado de 1,5 horas y el puesto 24 hr pilas de imágenes de escaneo.
- Seleccionar Imagen> Pilas> Herramientas> Combinar.
NOTA: Aparecerá una ventana combinador. - Seleccione el menú desplegable STACK1. Seleccione la pila que contiene todos los datos de la exploración pre.
- Seleccione el STACK2 menú desplegable. Seleccione la pila que contiene todos los post de datos de exploración de 1,5 horas.
- Compruebe Combine verticalmente.
- Seleccione Aceptar.
NOTA: Una nueva pila tanto con el análisis previo a la exploración y posterior 1.5 hr aparecerá. - Seleccionar Imagen> Pilas> Herramientas> Combinar.
NOTA: Aparecerá una ventana combinador. - Seleccione el menú desplegable STACK1. Seleccione la pila que contiene las pilas combinados.
- Seleccione el menú desplegable STACK2. Seleccione la pila que contiene todos los datos de las 24 h después de exploración.
- Compruebe Combine verticalmente.
- Seleccione Aceptar.
NOTA: Aparecerá una nueva pila con los nueve exploraciones. - Seleccione Archivo> Guardar como> AVI.
- Seleccione Aceptar.
- Navegar hasta el destino deseado. Escriba el nombre que desee en el Nombre de archivo Campo. Seleccione Guardar.
Resultados
La isquemia cerebral se inició en vivo ratas Sprague-Dawley a través de la oclusión de la arteria cerebral media, con imágenes nucleares posterior realiza para detectar sus efectos. Ratas vivas fueron imágenes de 24 horas antes de tiempo de admisión, así como 1,5 horas y 24 horas de post isquemia, cada uno con inyecciones independientes de aproximadamente 500 Ci de 18 F-FDG que se desintegra por completo dentro de 18 horas. El sistema de anillo de tres Albira detector utilizado para estos estudios tiene una sensibilidad del 9%, por lo que 500 Ci una dosis razonable para las ratas. Datos de imagen representativos para PET y TC de rayos X se muestran para una rata en la pre-24 hr y 24 hr puntos de tiempo post-reperfusión en la Figura 1, la parte superior y filas inferiores respectivamente. El transversales (paneles A y E), sagital (paneles B y F) y coronal (paneles C y G) rebanadas para cada exploración se presentan con datos FDG-PET de colores en un & #8220; escala de intensidad del arco iris ", y superpuesta a la TC en escala de grises. Tenga en cuenta que CT se utilizó para co-registro anatómica de los datos de PET dentro del cráneo animal, y no se observaron cambios en el tejido cerebral radiodensidad durante estos experimentos. A las 24 h se produjo un descenso dramático en la captación de glucosa en el hemisferio ipsilateral, sugiriendo daño tisular generalizada debido al accidente cerebrovascular isquémico inducido. Una representación 3D de la superposición de datos se presenta en la Figura 1D y H. Cuando se gira en la pantalla, estos datos prestados proporcionan una mayor visualización de la disminución inducida por golpes en la captación de FDG.
Con el fin de cuantificar las alteraciones en la absorción de la glucosa cerebral debido a un accidente cerebrovascular de una manera espacio-temporal, un atlas cerebral VOI se aplicó a pre-accidente cerebrovascular basal, 1,5 horas, y 24 horas (post-reperfusión) para cada exploración. Esto se logró utilizando el paquete de software PMOD en conjunción con la W. Schiffer plantilla de cerebro de rata y atlas. En primer lugar, PMOD se utilizó para transformar cada uno de los conjuntos de datos de PET de cerebro de rata para el espacio y la geometría adecuada a través de co-registro manual mediante el movimiento y las herramientas Rotar bajo la etiqueta Reslicing. Tenga en cuenta que la herramienta de escala también está disponible para ajustar el tamaño total del cerebro, si es necesario. Mientras que el uso de los atlas Schiffer es superior a la elaboración manualmente VOI dentro del espacio del cerebro, puede haber error experimental inducida de la fusión cerebro incorrecto. Así, en algunos casos puede ser necesario un aumento en el número de animales para alcanzar significación estadística. A continuación, los atlas del cerebro W. Schiffer VOI se aplican automáticamente para medir la acumulación de FDG, en unidades de captación estándar, dentro de sub-regiones definidas del cerebro de rata (Figura 2). El atlas cerebral VOI también se pueden utilizar de forma iterativa con el modelo del cerebro estándar para optimizar aún más la fusión manual de los datos experimentales. Como el evento Stoke fue aislado en el hemisferio derecho del cerebro en cada animal, el daño to cada región se cuantificó mediante el cálculo de una relación de la actividad de captación de glucosa entre las regiones contralateral (Figura 2). El uso de estas relaciones proporciona una normalización conveniente entre los hemisferios derecho e izquierdo, y elimina la variabilidad que se puede encontrar al comparar los valores de intensidad de señal de PET a través de diferentes análisis. En 1,5 horas después del accidente cerebrovascular, 18 captaciones F-FDG no se vieron afectados en el área isquémica. Por lo tanto, no se observaron cambios cuantitativos en la captación de glucosa entre los hemisferios ipsilateral y contralateral (Figura 3, azules y barras verdes). Esto podría ser debido a la hiper-captación de glucosa por la región peri-isquémica o el aumento del metabolismo de la glucosa en este punto de tiempo para compensar la pérdida de ATP celular 10,11. Sin embargo, se observó disminución significativa en la captación de glucosa en regiones específicas del hemisferio ipsilateral a través de múltiples animales (n = 5) a las 24 h post-reperfusión (Figura 3, barras rojas). Othregiones er cerebrales muestran poco o ningún daño en el hemisferio ipsilateral.
En concreto, las regiones del hemisferio ipsilateral que consistentemente exhibió captaciones de FDG disminuidas fueron: amígdala, putamen caudado, el auditorio, el lóbulo entorrinal, insular, paracorteza, y las regiones de la corteza somatosensorial. Las lesiones corticales causados por ictus se asocia con la pérdida de conexiones neuronales y mapas funcionales alterados. Las anomalías estructurales en la amígdala debido a golpes de ventaja a la psicopatología y la disfunción cognitiva 12. No es sorprendente que la región caudado-putamen se vio afectada por la captación de FDG como el flujo sanguíneo cerebral en la parte lateral de esta región es suministrada por la arteria cerebral media 13 ocluida. La patología en esta región del cerebro de roedores conduce a problemas de aprendizaje discriminar, el procesamiento cognitivo, y las funciones no motores 14. Incapacidad para asumir FDG también se observó en el una corteza entorrinald corteza auditiva en el lóbulo temporal medial del hemisferio isquémico. En 2001, Davis et al. Informó que los daños corteza entorrinal en ratas conduce a la integración sensorial alterada y el aprendizaje espacial persistente deificits 15. Disfunción auditiva se sabe que ocurre en el accidente cerebrovascular en los seres humanos, aunque con poca frecuencia 16. Sin embargo, la captación de FDG por el colículo inferior que es una de las principales vías auditivas no se vio afectada por un accidente cerebrovascular en nuestro modelo. Se ha demostrado que las ratas con accidente cerebrovascular inducida por MCAO aumentan la epinefrina, norepinefrina, y la actividad del nervio simpático, debido a infarto en el córtex insular, una de las regiones en nuestro modelo que mostraron pobres captación de FDG 17. Esto podría resultar en cambios en la función autonómica que afectan al sistema cardíaco. Poor captación de FDG también se observó en el área somatosensorial de la corteza frontoparietal. Infarto isquémico en esta área se ha reportado que causa anormalidades estructurales y pérdida de conexiones tálamo18. Limited captación de FDG también se observó en la corteza visual, lo que podría conducir a la alteración de la plasticidad dominancia ocular, como se informa en neonatos de rata sometidos a isquemia hipóxica 19. Sin embargo, la disminución de la captación de FDG no se observó en el colículo superior un área que está involucrada en 20 orientación motor visual. La captación de FDG en la zona del hipocampo también se vio afectada, un área que es importante en la memoria espacial y la navegación. Se observó consistentemente que sub-regiones del cerebro medio, como el colículo superior y el inferior, el área tegmental ventral (VTA), así como el bulbo olfatorio del cerebro anterior, y el tálamo profunda no se vieron afectados por la oclusión de la arteria carótida media (Figura 3).
Tomados en conjunto, estos resultados demuestran que la FDG-PET con CT proporciona una estrategia de formación de imágenes viable, reproducible, y no invasiva con la que para controlar la isquemia cerebral en ratas de una manera longitudinal.
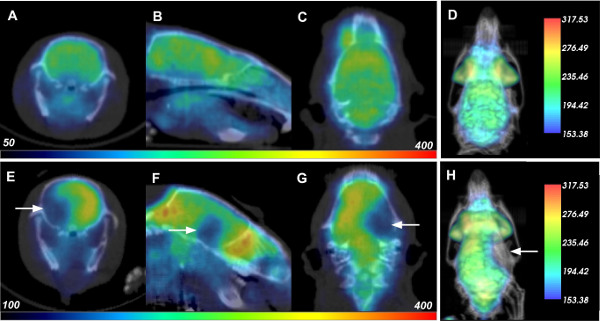
Figura 1:. PET-CT Datos de ratas antes y después de la isquemia cerebral Cada fila muestra la transversal correspondiente (A, E), sagital (B, F), coronal (C, G), y 3D prestados (D, H) PET datos -CT de una rata de 24 horas antes (fila superior) y 24 horas después de la reperfusión (o 26 horas después de la inducción de la isquemia cerebral, la parte inferior). Las flechas blancas indican la ubicación de la disminución de la captación de FDG debido al daño por apoplejía. Por favor, haga clic aquí para ver una versión más grande de esta figura.
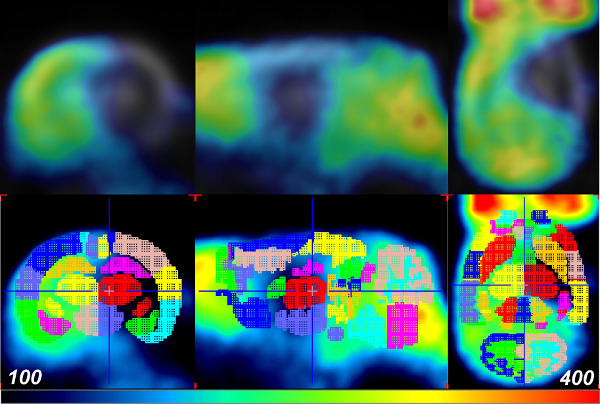
Figura 2: Datos de PET alineados con el atlas del cerebro W. Schiffer rata utilizando PMOD Los datos FDG-PET de.una rata de 24 horas después de la reperfusión (o isquemia cerebral post-26 hr; fila superior) se fusiona con los VOI atlas plantilla cerebro para el análisis (fila inferior). Los colores indican la VOI separada del atlas de la plantilla del cerebro. Por favor, haga clic aquí para ver una versión más grande de esta figura.

. Figura 3: Representante Análisis cuantitativo de la captación de glucosa en el cerebro de rata por la Sección Ratios de derecho a hemisferio izquierdo señal FDG PET en la captación de unidades estándar de cada región del cerebro Atlas W. Schiffer Rata reportó para las exploraciones tomadas antes isquémica evento accidente cerebrovascular (pre; azul), 1,5 hr (verde) y 24 h (rojo) post-reperfusión (o 26 horas después de la reperfusión). Las barras de error representan el error estándar para eventos infarto cerebral n = 5 de rata, en cada punto de tiempo. ** P ≤ 0,01, * p≤ 0,05 (prueba t pareada). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. Ilustración de Cirugía MCAO La línea roja es el oclusor que se inserta en la arteria carótida externa. El óvalo azul representa el área del cerebro.
Discusión
Aquí presentamos una estrategia detallada para carrera de admisión, la PET y el cerebro medición subregión estandarizada de daño tisular en ratas Sprague-Dawley. Obtención de imágenes de modelos de animales pequeños, especialmente en el área de accidente cerebrovascular es beneficioso, como tratamiento para el accidente cerebrovascular para ser eficaz depende de un tiempo extremadamente corto terapéutico. Aquí presentamos un modelo de lesión por reperfusión, en trazo fue inducida a través de una oclusión de la arteria cerebral media, y de imagen realizamos utilizando FDG PET, junto a un CT de rayos X para la referencia anatómica. Fue posible mediciones regimentada de la captación de FDG en sub-regiones del cerebro mediante mapeo preciso de los atlas plantilla VOI en el cerebro de la rata en el software de análisis de imágenes PMOD. Valores Ratiometric FDG se recogieron dividiendo sub-regiones del cerebro correspondiente en hemisferios opuestos, lo que permite una medición directa de daño mientras la normalización de las variaciones en la señal global de FDG PET entre diferentes animales y el tiempo pUNTOS. Estas mediciones son consistentes con el efecto esperado de golpe en el cerebro de rata, lo que demuestra consistentemente, pérdida significativa de tejido cerebral captación de glucosa en ciertas regiones del hemisferio ipsilateral. Esta metodología tiene el potencial para aumentar nuestra capacidad para comparar los conjuntos de datos FDG PET de los animales sometidos a muchos tipos de trauma cerebral, incluyendo el accidente cerebrovascular isquémico. Mediante la estandarización de los volúmenes a ser cuantificado a través de los hemisferios del cerebro ya través de múltiples animales, este método genera mediciones consistentes de disminución de la captación de glucosa en los tejidos. Tenga en cuenta que otros trazadores PET con captación en el cerebro, al igual que 11 C-racloprida por los receptores D2, se puede utilizar con este protocolo, así 21. Por último, se describe un método para visualizar una apoplejía isquémica en un cerebro de rata dentro de su esqueleto con gran precisión anatómica en tres dimensiones. Desde el deterioro fisiológico y funcional inducida por apoplejía puede ser transitoria o permanente, este método no invasivo de imágenespermite a los investigadores para evaluar el daño cerebral en el mismo animal durante un período de tiempo. Proporciona una manera de anotar neurológicamente las ratas, así evaluar los déficits neurológicos a corto y largo plazo en el mismo animal. La función de plantilla del software PMOD permite a los investigadores con una cierta cantidad de precisión para trazar el área lesionada y tal vez se correlacionan con secuelas neurológicas y patrones de comportamiento.
Para la cuantificación exacta de daño por apoplejía por subregión cerebro, el paso clave es la alineación de los datos de PET con el atlas de cerebro de rata dentro de PMOD. Las inconsistencias en la alineación pueden conducir a la cuantificación incorrecta de las subregiones del cerebro afectadas por la isquemia. Como se describe en la etapa de protocolo 4.1.7, es posible utilizar las glándulas de Harder como puntos de referencia para la alineación de los atlas del cerebro con los datos experimentales de PET. Efectos de volumen parcial (PVE) son una preocupación durante este tipo de análisis, y limitarán la resolución general de la estructura del cerebro quepuede ser fotografiado. Desbordamiento de la señal puede ocurrir entre los volúmenes adyacentes, o el propio VOI podría ser demasiado pequeña en relación con la resolución del instrumento, reduciendo así la exactitud cuantitativa del método 22. El sistema Albira PET usado en estos estudios está equipado con tres anillos de detectores y produce una resolución de 1,1 mm, que evolucionó a partir correspondiente sistema de un solo anillo que logra 1,5 mm 23. Buvat y colaboradores en cuenta que PVE afectará a las mediciones de los tumores con un diámetro de menos de 2-3 veces la resolución del sistema a plena anchura media max (FWHM), lo que correspondería a un volumen esférico de 5,6 a 18,9 mm 3 para el 3- anillo Albira. Casteels et al. Declarado recientemente que los volúmenes mayores de 8 mm 3 tendrán efectos de volumen parcial mínimos para modernos escáneres PET pre-clínicos con resolución en el rango de 1.1 a 1.3 mm 24. El atlas Schiffer se ha construido cuidadosamente con estos parámetros en mente, y utiliza 58 VOI, de los cuales 13 están por debajo del umbral de 8 mm 3. Estos incluyen el VOI para hemisferios derecho e izquierdo de la corteza prefrontal medial (6,3 mm 3, R / L), el Par Un Corteza (7,6 mm 3, R / L), el colículo superior (7,1 mm 3, R / L) , el VTA (5,5 mm 3, R / L), colículo inferior (5.7 mm 3, R / L), la glándula pituitaria (5,9 mm 3), y el flujo de sangre CB (5,1 mm 3). Además, las mediciones de la corteza frontal (1,4 mm 3 R / L) serán los más susceptibles a PvE debido a su pequeño tamaño.
Los estudios en animales más grandes, como las ratas, que tienen un correspondiente aumento en el tamaño de la anatomía, tendrán un mayor número de sub-regiones del cerebro que pueden ser cuantificados de forma fiable en comparación con los ratones. Sin embargo, estos métodos son aplicables a imágenes del cerebro en ratones, que tienen su propia atlas cerebral disponible en PMOD que se compone de 18 subregiones que sondimensionada para minimizar PVE. Además, el uso de PET para identificar regiones cerebrales más pequeños que los que se describe en este estudio puede requerir el uso de una metodología alternativa. El método aquí descrito permite la cuantificación reglamentada y eficiente de daño en el tejido cerebral con el tiempo, segmentado por subregión cerebro, en ratas vivas. Lesión por isquemia se demuestra aquí como un ejemplo, pero la metodología presentada para la cuantificación de los cambios en la actividad cerebral se puede aplicar a cualquier otra condición que afecta al cerebro de rata.
En conclusión, los datos FDG-PET-CT de animales pequeños pueden ser adquiridos de una manera no invasiva y económica, y se pueden utilizar convenientemente para formación de imágenes de pequeños animales de una manera cuantitativa. Utilizando la herramienta de plantilla Schiffer del programa PMOD, áreas isquémicas del cerebro pueden ser delineadas y se miden los datos de PET. Esta es una poderosa herramienta para el estudio futuro de la reorganización del cerebro, la reparación y la neurogénesis después de la isquemia cerebral que promoverá desarrollnt de neuro-terapias de los pacientes con ictus con discapacidad. Esta visualización también será particularmente útil en la evaluación de otros casos de trauma cerebral, donde el daño a los tejidos se puede alinear de modalidades de imágenes separadas.
Divulgaciones
WML is a consultant for Bruker Molecular Imaging
Agradecimientos
This study was supported by a grant from Bruker Molecular Imaging (to WML) and from the NIH (Grant HL019982 to FJC).
Materiales
| Name | Company | Catalog Number | Comments |
| Albira PET SPECT CT | Bruker | 3D molecular imaging equipment | |
| Sprague Dawley Rats | Charles River Laboratories | 400 | Animal Subjects |
| 18-F-D-Glucose | Spectron | PET compound | |
| micro clamp | FST | 18055-03 | artery clamp |
| occluder #4037 | Doccol Corp. | 403712PK10 | surgical stroke induction |
Referencias
- Minino, A. M., Murphy, S. L., Xu, J., Kochanek, K. D. Deaths: final data for 2008. Natl Vital Stat Rep. 59, 1-126 (2011).
- Niemi, M. L., Laaksonen, R., Kotila, M., Waltimo, O. Quality of life 4 years after stroke. Stroke. 19, 1101-1107 (1988).
- Ter-Pogossian, M. M., Phelps, M. E., Hoffman, E. J., Mullani, N. A. A positron-emission transaxial tomograph for nuclear imaging. 114, 89-98 (1975).
- Schiffer, W. K., et al. Serial microPET measures of the metabolic reaction to a microdialysis probe implant. J Neurosci Methods. 155, 272-284 (2006).
- Roger, V. L., et al. Heart disease and stroke statistics--2012 update: a report from the American Heart Association. Circulation. 125, e2-e220 (2012).
- Heiss, W. D., et al. Progressive derangement of periinfarct viable tissue in ischemic stroke. J Cereb Blood Flow Metab. 12, 193-203 (1992).
- Foster, N. L., et al. Alzheimer's disease: focal cortical changes shown by positron emission tomography. Neurology. 33, 961-965 (1983).
- Bustamante, E., Pedersen, P. L. High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase. Proc Natl Acad Sci U S A. 74, 3735-3739 (1977).
- Toga, A. W., Santori, E. M., Hazani, R., Ambach, K. A 3D digital map of rat brain. Brain Res Bull. 38, 77-85 (1995).
- Yuan, H., et al. Saptiotemporal uptake characteristics of [18]F-2-Fluoro-2-Deoxy-D-Glucose in a rat middle cerebral artery occlusion model. Stroke. 44, (2013).
- Nemoto, E. M., Hossmann, K. A., Cooper, H. K. Post-ischemic hypermetabolism in cat brain. Stroke. 12 (5), 666-676 (1981).
- Sachdev, P. S., Chen, X., Joscelyne, A., Wen, W., Brodaty, H. Amygdala in stroke/transient ischemic attack patients and its relationship to cognitive impairment and psychopathology: the Sydney stroke study. Am. J. Geriatr. Psychiatry. 15, 487-496 (2007).
- Nagasawa, H., Kogure, K. Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion. Stroke. 20, 1037-1043 (1989).
- Hauber, W., Schmidt, W. J. Differential effects of lesions of the dorsomedial and dorsolateral caudate-putamen on reaction time performance in rats. Behavioral Brain Research. 60, 211-215 (1994).
- Davis, A. E., Gimenez, A. M., Therrien, B. Effects of entorhinal cortex lesions on sensory integration and spatial learning. Nurs. Res. 50, 77-85 (2001).
- Hausler, R., Levine, R. A. Auditory dysfunction in stroke. Acta Otolaryngol. 120, 689-703 (2000).
- Cechetto, D. F., Wilson, J. X., Smith, K. E., Wolski, D., Silver, M. D., Hachinski, V. C. Autonomic and myocardial changes in middle cerebral artery occlusion: stroke models in the rat. Brain Res. 502, 5296-5305 (1989).
- Carmichael, S. T., Wei, L., Rovainen, C. M., Woolsey, T. A. New patterns of intracortical projections after focal cortical strike. Neurobiol. of Disease. 8, 910-922 (2001).
- Failor, S., et al. Neonatal cerebral hypoxia-ischemia impairs plasticity in rat visual cortex. J. Neurosci. 30, 81-92 (2010).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Ann. Rev. Neurosci. 3, 189-226 (1980).
- Kuhn, F. P., et al. Comparison of PET template-based and MRI-based image processing in the quantitative analysis of C11-raclopride PET. EJNMMI Res. 4 (1), 7(2014).
- Soret, M., Bacharach, S. L., Buvat, I. Partial-Volume Effect in PET Tumor Imaging. J. Nuc. Med. 48, 932-945 (2007).
- Sanchez, F., et al. ALBIRA: A Small Animal PET/SPECT/CT Imaging System. Med. Phys. 40 (5), 051906(2013).
- Casteels, C., et al. Construction and Evaluation of Quantitative Small-Animal PET Probabilistic Atlases for [18F]FDG and [18F]FECT Functional Mapping of the Mouse Brain. PLOS One. 8 (6), e65286(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados