Method Article
Transgénicos Roedor Ensayo para la cuantificación de la célula germinal masculina Mutant Frecuencia
En este artículo
Resumen
De novo mutations in the male germline may contribute to adverse health outcomes in subsequent generations. Here we describe a protocol for the use of a transgenic rodent model for quantifying mutations in male germ cells induced by environmental agents.
Resumen
De novo mutations arise mostly in the male germline and may contribute to adverse health outcomes in subsequent generations. Traditional methods for assessing the induction of germ cell mutations require the use of large numbers of animals, making them impractical. As such, germ cell mutagenicity is rarely assessed during chemical testing and risk assessment. Herein, we describe an in vivo male germ cell mutation assay using a transgenic rodent model that is based on a recently approved Organisation for Economic Co-operation and Development (OECD) test guideline. This method uses an in vitro positive selection assay to measure in vivo mutations induced in a transgenic λgt10 vector bearing a reporter gene directly in the germ cells of exposed males. We further describe how the detection of mutations in the transgene recovered from germ cells can be used to characterize the stage-specific sensitivity of the various spermatogenic cell types to mutagen exposure by controlling three experimental parameters: the duration of exposure (administration time), the time between exposure and sample collection (sampling time), and the cell population collected for analysis. Because a large number of germ cells can be assayed from a single male, this method has superior sensitivity compared with traditional methods, requires fewer animals and therefore much less time and resources.
Introducción
Mutaciones del ADN esporádicos en la línea germinal pueden conducir a una reducción del éxito reproductivo y, si heredó, pueden causar enfermedad genética o predisposición mayor al cáncer en la descendencia 1-3. Pruebas de peso que demuestran que una gran proporción de mutaciones de novo son heredados de la línea germinal paterna 4, y que el número de mutaciones en la descendencia se correlaciona positivamente con la edad paterna en el momento de la concepción 5. Se cree que la mayor proporción de mutaciones masculinos para ser el resultado de la diferencia de edad durante la gametogénesis entre los sexos, el mayor número de divisiones celulares de espermatogénesis en comparación con el número de divisiones celulares oogenic en la línea germinal femenina 2, y una disminución progresiva en el ADN reparar la eficiencia con la edad en los hombres. Todos estos factores contribuyen a un aumento de la probabilidad de errores de replicación en la línea germinal masculina 6. Sin embargo, el impacto de la exposición paterna a Envirofactores nmental sobre la frecuencia de mutaciones de novo sigue siendo incierto. Sin embargo, un gran número de agentes ambientales son conocidos para inducir mutaciones de células germinales en roedores 7, y hay más pruebas de que algunos de estos agentes también puede afectar a la línea germinal humana 8. A pesar de estas preocupaciones, los productos químicos se prueban rutinariamente por su capacidad de inducir mutaciones en las células somáticas para fines reglamentarios y se supone por lo general que las pruebas somáticas son suficientes para proteger la línea germinal. Por lo tanto, los productos químicos son raramente evaluados por su capacidad para inducir mutaciones en las células germinales.
Una de las razones de pruebas mutagenicidad en células germinales se ha omitido en gran parte del proceso de toma de decisiones de regulación es la falta de metodologías prácticas. Métodos basados en roedores tradicionales, tales como los dominantes letales 9 y específicos locus 10 pruebas, estiman las tasas de mutación de células germinales al anotar fenotipos mutantes en embriones o descendencia depadres expuestos. Estos ensayos requieren el uso de un número muy grande de animales, el tiempo y los recursos para adquirir resultados estadísticamente significativos.
Aunque varios métodos modernos para la cuantificación de la mutación de células germinales han surgido recientemente, muchos sufren deficiencias en cuanto a su funcionalidad, eficiencia y relevancia biológica. Por ejemplo, repetir las mutaciones de longitud en simples repeticiones en tándem (ESTR) loci ampliado se puede cuantificar en las células germinales masculinas que utilizan un enfoque de PCR sola molécula 15. Sin embargo, la ejecución de este método puede ser técnicamente difícil y laborioso, y a diferencia de las mutaciones puntuales, la importancia biológica y la salud de los cambios en la longitud de repetición de los loci ESTR altamente inestable siguen sin estar claros 16. Tecnologías de secuenciación de todo el genoma modernos pueden proporcionar una gran cantidad de datos biológicamente significativos cuando se aplican al problema de mutaciones hereditarias 4,17, pero el alto costo, las altas tasas de error, se requiere la validación asociadopara confirmar las mutaciones, y la bioinformática desafíos aún limitar la aplicación rutinaria de esta opción en calidad de pruebas reglamentarias 18.
En este documento, se describe un método práctico para la cuantificación de mutaciones inducidas directamente en las células germinales de ratones machos transgénicos. Este protocolo se describe para el modelo MutaMouse transgénico, que tiene múltiples copias concatenados de un vector de fago lambda gt10 recombinante que contiene un gen reportero lacZ de Escherichia coli integrado en ambas copias del cromosoma 3 19 (Figura 1).
Este protocolo también es relevante para otros modelos de roedores transgénicos (TGR) en base a los mismos principios (BigBlue ratón y la rata, o lacZ plásmido ratón, etc.) O ligeramente diferentes genes reporteros (ratón delta gpt y ratas, los modelos TGR crítica en Lambert et . al 20). Este método se basa en el ensayo de mutación TGR descrito en una recientemente publicadoy revisado las guías OCDE 21 y elaboramos sobre las consideraciones especiales que se requieren para dar cabida a la evaluación de las mutaciones en la línea germinal masculina, debido a las características únicas de la espermatogénesis. Brevemente, el ensayo consiste en exponer ratones machos transgénicos a una sustancia mutagénica, seguido por un tiempo de muestreo donde las lesiones pre-mutacionales se fijan en mutaciones estables. En el momento de muestreo seleccionado, los ratones se sacrificaron y las células germinales se recogen, ya sea del epidídimo cauda o los túbulos seminíferos. Como se discute más adelante, los efectos mutagénicos en las diferentes fases de la espermatogénesis pueden ser determinados mediante la selección del tiempo entre la exposición y recogida de muestras. Insertos transgénicos, que comprenden múltiples copias del genoma del fago λ por célula, se aíslan a partir de ADN genómico de células germinales y empaquetan en cápsides vacías de fago λ creación de partículas de fago λ infecciosas que luego se utilizan para infectar una E. coli huésped. Las bacterias infectadas se cultivan en Selecmedios tivos que pueden distinguir las células que contienen un vector con una copia mutada de lacZ de células que albergan de tipo salvaje lacZ. El efecto mutagénico de la exposición en la línea germinal masculina se determina comparando la frecuencia de mutantes transgenes entre el control y los ratones tratados (Figura 2, crítica en Lambert et al. 20). Un gran número de células germinales se puede ensayar a partir de un solo ratón, dando a esta sensibilidad superior ensayo sobre los métodos tradicionales, al tiempo que reduce el número de animales requeridos. Y debido a que no se requiere equipo especializado o entrenamiento, este ensayo proporciona una opción práctica y eficiente para las pruebas de mutación de células germinales en la mayoría de los laboratorios de biología molecular de toxicología / modernas.
Un requisito esencial para la aplicación efectiva del ensayo de mutación de células germinales TGR es una comprensión del ciclo de espermatogénesis (Figura 3). El tiempo para las células germinales de ratón para el progreso de stem células en los túbulos seminíferos a espermatogonias, espermatocitos, espermátidas, y finalmente para madurar los espermatozoides en el epidídimo (espermatogénesis es decir.) es de aproximadamente 49 días. La mutación puede ocurrir en diversas fases de este ciclo y es a menudo determinado compuesto. Dos características clave que son de particular relevancia para la mutagénesis en células germinales masculinas son el cese de la síntesis de ADN durante la meiosis temprana, y la pérdida progresiva de la capacidad de reparación del ADN durante 6 finales de post-meiosis, dos procesos que se requieren para la inducción y la fijación de mayoría de las mutaciones.
Debido a estas características únicas de la espermatogénesis, hay tres variables experimentales críticos para la conducción de la TGR ensayo de mutación de células germinales: (1) el tiempo de la administración del compuesto de ensayo; (2) el tiempo de muestreo; y (3) la selección de la población de células germinales para recoger para el análisis (Figura 3 y Tabla 1). El tiempo de administración es la Experimevariable de NTAL que determina cómo las células diana largas están expuestos a los compuestos de ensayo. La longitud del tiempo de administración también puede ser utilizada para combatir la exposición a determinados tipos de células o fases de la espermatogénesis. Por ejemplo, una sola administración día podría ser utilizado para determinar los efectos de una exposición aguda en un tipo de célula particular. Del mismo modo, la exposición puede ser enfocada a una fase de la espermatogénesis entero, centrándose por ejemplo en espermatocitos sólo dividen meióticamente, o mitóticamente dividiendo espermatogonias utilizando un tiempo de administración de 2 semanas y un tiempo de muestreo apropiado. Tiempos de la administración crónica y sub-crónicos se utilizan para evaluar los efectos de la exposición a largo plazo, para asegurar suficiente distribución farmacocinética del compuesto de ensayo, o permitir la acumulación suficiente de mutaciones de mutágenos débiles (por ejemplo, el tiempo de administración de 28 días recomendado en la prueba de la OCDE directriz).
Tiempo de muestreo es la variable crítica para determinar en la quefase de la espermatogénesis las células diana eran en el momento de la exposición. El tiempo de muestreo determina la cantidad de tiempo, y por lo tanto, cuánto más a lo largo del ciclo de la espermatogénesis, las células pasan a través después de la exposición. Por ejemplo, para investigar los efectos en espermatogonias de células madre, un tiempo de muestreo> 49 días se requiere si la recogida de esperma madurado completamente, o> 42 días si la recolección de células germinales inmaduras de los túbulos seminíferos, para asegurar que todas las células recogidas han tenido tiempo suficiente para desarrollar a partir de células expuestas tallos. Es importante tener en cuenta que un tiempo de muestreo de al menos 70 días sería preferible para demostrar un efecto de células madre verdadera para proporcionar tiempo suficiente para la distribución farmacocinético de la sustancia tóxica, para la eliminación de las células expuestas en las fases posteriores de la espermatogénesis, y para tener en cuenta un período de esterilidad temporal que puede ocurrir ~ 6 semanas después de la exposición a compuestos altamente mutagénicos 22. Del mismo modo, un tiempo de muestreo de 21 días aseguraría que colle espermacted del epidídimo cauda habría acaba de completar la meiosis en el último día de la exposición.
Las células germinales pueden ser recogidos como esperma maduro de la cola del epidídimo, o como una mezcla de diversos tipos de células espermatogénica de los túbulos seminíferos. Espermatozoides maduros permanecen en la cauda de ~ 3 días, por lo que es posible determinar con relativa exactitud el tipo de célula o fase de la espermatogénesis a partir del cual se originó el esperma para cualquier diseño experimental dado. Por lo tanto, el análisis de cauda permisos de esperma muy específica las investigaciones sobre efectos mutacionales etapa específica. Por otro lado, las suspensiones celulares recogidas de los túbulos seminíferos contienen una mezcla de varios tipos de células germinales en diferentes fases de desarrollo, y por lo tanto ofrecen una resolución más pobre de la fase de la espermatogénesis en el que se originaron las mutaciones. Además, las suspensiones de células recuperadas de los túbulos seminíferos tienden a contener una sobre representación de espermátidas, seguido de espermatocitos, y verpocos espermatogonias y células madre y (estas proporciones están representados por barras blancas graduados en la Figura 3). Además, las suspensiones preparadas a partir de los túbulos seminíferos también pueden contener varias células somáticas. Por lo tanto, porque los tipos de tantas células están presentes, los efectos mutacionales pueden ser influenciados por una variedad de células no diana. Sin embargo, la recogida de muestras de los túbulos seminíferos ofrece una opción económica para la detección simultánea de múltiples tipos de células germinales y fácil integración del análisis de las células germinales en el protocolo estándar de ensayo de la OCDE para la mutación somática.
Para reiterar, dependiendo de las necesidades del investigador, el tiempo de administración, tiempo de muestreo y la población celular recogida se puede ajustar para interrogar a los efectos de la exposición en diversos tipos de células y en diferentes fases de la espermatogénesis. Seleccionando cuidadosamente estas variables, los experimentos pueden ser diseñados para estudios mecanicistas específicas, o para la prueba de regulación más generalizadafines ing.
Para lograr el dominio en el ensayo, se recomienda el uso de una administración oral aguda de 100 mg / kg de N-etil-N-nitrosourea (ENU), seguido de un tiempo de muestreo 70 días como control positivo. Análisis de esperma de caballo por lo tanto se dirige a células madre de espermatogonias (Figura 3), que típicamente presentan un aumento de 4-5 veces en la frecuencia mutante (MF) sobre los controles después de esta dosis altamente mutagénico de ENU. Cabe señalar que esta dosis es conocido para inducir esterilidad 6 semanas después de la exposición, por lo tanto puede que no sea una dosis de control adecuado para los tiempos de muestreo más cortos. Esta dosis también producirá un aumento detectable en MF en la mayoría de los tejidos somáticos 20. Los resultados representativos se presentan a continuación fueron generados después de un régimen de exposición aguda 70 usando tres dosis de ENU hasta e incluyendo 100 mg / kg.
Protocolo
Todos los protocolos que implican la cría de animales, mantenimiento y manejo fueron aprobados por el comité de cuidado de los animales de Health Canada.
1. Las exposiciones de animales
- Aleatoriamente distribuir ratones macho transgénico (8-12 semanas de edad) para el control de los grupos y los grupos de tratamiento (min = 5 por grupo) ratones .Treat con compuesto de ensayo y de control pertinente por una vía de exposición adecuado para el tiempo de administración seleccionado. Elija el tiempo de muestreo adecuado según el tipo de célula de la espermatogénesis de interés (Figura 3).
- Después de que el tiempo de muestreo, la eutanasia a los ratones por dislocación cervical bajo anestesia con isofluorano (u otro método adecuado). Dibujar con cuidado los testículos de una incisión en el abdomen o el escroto y extirpar los epidídimos cauda. (Figura 4, para ver un vídeo detallado de colección epidídimo ver Duselis et al 24.). Alternativamente, recoger los testículos si el análisis de los túbulos seminíferoscélulas s. Congelar en nitrógeno líquido y se almacenan a -80 ° C para su uso posterior.
2 Aislamiento y digestión de Cauda esperma
- Descongele cauda del epidídimo en el hielo. Transferencia de caballo descongelado a una placa de Petri y picar a fondo con una hoja de bisturí o la maquinilla de afeitar.
- Añadir 700 l de temperatura ambiente D-PBS a la placa de Petri. Utilizando una punta de pipeta 1.000 l de gran calibre, esperma liberación de la cauda por el dibujo y la liberación de la suspensión hasta que el D-PBS se vuelve turbia con esperma (aproximadamente 10 veces). NOTA: Para preparar punta de la pipeta de gran calibre cortó 2-3 mm desde el extremo de una punta de pipeta de plástico.
- Filtrar la suspensión a través de un filtro de malla de acero inoxidable en un tubo de 1.5 ml fresco. Lave la placa de Petri con un adicional de 700 l de D-PBS y traslado al mismo tubo de 1.5 ml a través del filtro de malla. Retire la malla, colocar el tubo en hielo.
- Repetir los pasos 2.1 a 2.3 para las muestras restantes.
- Haga girar samplesat 11.000 xg durante 3 min. Sobrenadante cuidadosamente decante. Evite perturbar el sedimento.
- Añadir 1,0 ml de citrato de sodio frío 1x solución salina (SSC). Está completamente re-suspendido Vortex hasta pellet. Esto puede tardar algunos rondas de vórtice.
- Añadir 15 l de SDS al 10%. Invertir / agitar vigorosamente durante 30 segundos para romper las células no espermáticas. Agitación demasiado suavemente resultará en la interrupción inadecuada y el sedimento no se formará correctamente en el siguiente paso.
- Haz girar a 11.000 xg durante 2 min. A, pellet "esponjoso" suelto es indicativo de interrupción incompleta de células somáticas debido a la insuficiente agitación en el paso 2.7. Si esto ocurre, simplemente agite la muestra de nuevo, y respin hasta que se forme una bolita apretada. Decantar cuidadosamente el sobrenadante. Evite perturbar el sedimento. Brevemente girar de nuevo y retirar los restos de sobrenadante con 200 l pipeta.
- Añadir 940 l 0.2x SSC fría y agitar hasta pellet se resuspende. Este gránulo puede ser muy difícil volver a suspender y puede tomar varias rondas de agitación en vórtex. A veces matas de sperm son inevitables.
- Añadir 120 mu l β-mercaptoetanol, 100 l 10% de SDS, 20 l 0,5 M EDTA, pH 8, y 20 l de proteinasa K (60 mg / ml, preparado fresco). Mezclar bien y digerir durante la noche con rotación a 37 ° C. Proceder a la extracción con fenol / cloroformo.
3. fenol / cloroformo extracción de ADN de esperma de cauda
NOTA: Debido a que el ADN nuclear en fase tardía espermátidas y espermatozoides maduros se compleja con protaminas, y es altamente condensado en comparación con el ADN de las células somáticas, los métodos de aislamiento de ácidos nucleicos convencionales no generará ADN de rendimiento y pureza suficiente para el ensayo de mutación para trabajar eficientemente. Múltiples extracciones con fenol-cloroformo después de una digestión agresivos están obligados a liberar y purificar el ADN de los espermatozoides (basado en métodos de 15).
- Célula de esperma de transferencia de digerir a un tubo de polipropileno de 15 ml.
- Añadir 2 ml de fenol: mezcla de cloroformo (1: 1). Gire el tubo a 22 rpmdurante 3 min.
- Centrifugar a 1600 xg durante 10 min y transferir capa superior acuosa junto con la capa de interfaz difusa a un tubo de 15 ml fresco.
- Repetir los pasos 3.1.2 y 3.1.3 3x, pero cambiando los tiempos de rotación a 3 min, 4 min, y 6 min, respectivamente. En la repetición final, evitar la transferencia de cualquiera de la capa de interfaz "fuzzy".
- Después de la extracción de 4 º, añadir 70 l de 3M NaAc, pH 5,2 por 1 ml de extracto acuoso y 2 ml de cloroformo: alcohol isoamílico (24: 1). Gire el tubo a 22 rpm durante 12 min.
- Centrifugar a 1600 xg durante 10 min y transferir capa superior acuosa a un tubo de 15 ml fresco.
- Precipitado de ADN mediante la adición de 2 volúmenes de etanol absoluto y suavemente girar el tubo en su lado con balanceo suave.
- Recoger ADN mediante la cola de impresión en la punta de una pipeta de pastos termosellada. Enjuague ADN por agitación la punta de la pipeta en 70% de etanol y aire seco durante 5 min.
- Después de la extracción, se disuelven precipitado de ADN en 40 a 100 l Tritampón s-EDTA, pH 8 Almacenar a 4 ° C. Permitir que el ADN se disuelva a 4 ° C durante un mínimo de dos días antes de proceder a ensayo de mutación lacZ. Si se encuentran problemas de solubilidad, el ADN se puede disolver adicionalmente a 65 ° C durante 15 min antes de su uso. Determinar la concentración de ADN con una spectrophotometre en A 260 y asegurar que la concentración del ADN disuelto es de entre 200-2.000 ng / l.
4. El aislamiento y la digestión de las células germinales de los túbulos seminíferos
- Si se congela, descongelar testículo en hielo (aproximadamente 1 hora). Transferencia testículo a una placa de vidrio esmerilado.
- Mantenga un extremo de los testículos con un par de fórceps. En el otro extremo del testículo, perforar un agujero en la cápsula epitelial utilizando otro par de fórceps o un par de tijeras de disección (Figura 5A). Apriete los túbulos seminíferos a través de la punción y deseche la cápsula epitelial (Figura 5B).
- Add 500 l de temperatura ambiente D-PBS a los túbulos seminíferos descapsulados.
- Ángulo de un rodillo de tejido (caucho de silicona ajustado firmemente sobre un tubo de giro libre 5 mm de diámetro de acero inoxidable, o aparato similar) de manera que un extremo está en contacto con la placa en un ángulo aproximado de 5-10 ° (Figura 5C). Sin aplicar ninguna presión, mueva suavemente el rodillo de un lado a otro a través de los túbulos hasta que se aplanan y la D-PBS se enturbia con células liberadas (aproximadamente 5-10x).
- Añadir otros 500 l de D-PBS en los túbulos y rodar suavemente sobre los túbulos un par de veces adicionales.
- Transferir la suspensión celular a un tubo de microcentrífuga de 1,5 ml y reducir al mínimo la cantidad de túbulos desprendidas de ser transferido (Figura 5D).
- Repita los pasos 4.5 a 4.6 para recolectar más células en caso de necesidad.
- Permitir 1 - 2 min para cualquier túbulos recogidos accidentalmente se depositan en el fondo del tubo. Transferir el D-PBS a un fresh 1,5 ml tubo dejando atrás los túbulos asentados (aproximadamente 100 l de D-PBS). Una pequeña alícuota de esta suspensión se puede comprobar bajo un microscopio (contraste de fases) para evaluar la composición de la población celular.
- Centrifugar las células a 11.000 xg durante 30 seg. Decantar cuidadosamente el sobrenadante sin perturbar el sedimento. El sedimento de células se puede congelar a -80 ° C en este punto si es necesario.
- Descongelar las células, si es necesario. Transferencia a una 15 ml tubo de polipropileno de células y resuspender en 5 ml de tampón de lisis (10 mM Tris pH 7,6, EDTA 10 mM, NaCl 100 mM, 1 mg / ml de proteinasa K, 1% de SDS). Recopilación de toda la noche en una incubadora con rotación a 37 ° C.
- Proceder a la extracción con fenol / cloroformo.
5. fenol / cloroformo extracción de ADN a partir de células túbulo seminífero germinales
NOTA: A menos agresivo extracción se utiliza para aislar el ADN de células germinales túbulos seminíferos, ya que estos tipos de células aún no han progresado a través de ncondensación uclear.
- Añadir 5 ml de fenol: mezcla de cloroformo (1: 1) que durante la noche seminíferos de digestión celular túbulos. Girar tubo a 22 rpm durante 20 min.
- Centrifugar a 1600 xg durante 10 min y transferir capa superior acuosa, evitando al mismo tiempo la capa de interfaz "fuzzy", a un tubo de 15 ml fresco.
- Añadir 100 l de NaCl 5 por 5 ml de extracto acuoso (normalmente 5 ml se recupera)
- Añadir 5 ml de cloroformo: alcohol isoamílico (24: 1). Gire el tubo a 22 rpm durante 12 min.
- Centrifugar a 1600 xg durante 10 min y transferir capa superior acuosa a un tubo de 15 ml fresco.
- Precipitado de ADN mediante la adición de 2 volúmenes de etanol absoluto y suavemente girando e invirtiendo los tubos.
- Recoger ADN mediante la cola de impresión en la punta de una pipeta de pastos sellado. Enjuague ADN por agitación la punta de la pipeta en 70% de etanol y aire seco durante 5 min.
- Disolver ADN en 40-100 l de tampón Tris-EDTA, pH 8 Almacenar a 4 ° C. Permitir ADN para disolver a 4 ° C durante un mínimo de dosdías antes de proceder a ensayo de mutación lacZ (véase el paso 3.9). Si se encuentran problemas de solubilidad, el ADN se puede disolver adicionalmente a 65 ° C durante 15 min antes de su uso. Determinar la concentración de ADN con una spectrophotometre en A 260 y asegúrese de que la concentración es de entre 200 y 2000 ng / l.
6. LacZ ensayo de mutación
La contaminación bacteriana o fúngica puede interferir con la eficiencia de envasado, así como el crecimiento de la placa y de puntuación. Por tanto, es fundamental para llevar a cabo el ensayo de lacZ utilizando las medidas de asepsia adecuadas para evitar la contaminación de la reacción de envasado, la cultura de acogida y crecimiento de los medios.
- Día Antes del ensayo: Preparar Bottom Agar y Cultura Alojamiento
- Ocho placas (4 placas para anotar mutantes, 4 placas de contar el título) que contiene 8 ml cada fondo agar se requieren por muestra (es decir., 64 ml por muestra). El agar parte inferior es idéntica para amboslas placas de recuento de mutantes y el título. Preparar agar inferior suficiente para está procesando el número de muestras. Asépticamente verter en placas de Petri de 90 mm (8 ml por placa) y permita que el agar se solidifique. NOTA: placas de agar de fondo se pueden preparar hasta 1 semana de antelación.
- En un tubo de 50 ml, añadir 10 ml de caldo LB, 100 l de solución de maltosa 20%, 25 l de ampicilina (20 mg / ml) y 20 l de kanamicina (5 mg / ml). Inocular con E. coli (lacZ - / galE -) 25 y crecer durante la noche a 37 ° C con agitación a 240 rpm.
- Día 1: Células Sub-cultura
- Células sub-cultura mediante la preparación de una dilución 1: 100 de la cultura durante la noche en LB fresco (sin antibióticos). Se necesita un volumen de 8 ml de subcultivo por muestra. Incubar a 37 ° C con agitación a 240 rpm durante aproximadamente 3,5 h hasta que OD 600 = 1.
- Cuando OD 600 = 1, dividir suspensión de células uniformemente en tubos de 50 ml y centrifugar a 1300 xg a 15 ° C durante 10min. Eliminar el sobrenadante y volver a suspender las células en la mitad del volumen original (es decir., 4 ml por muestra) de LB que contiene 10 mM MgSO 4. Poner las células a un lado hasta que se necesite [etapa 6.2.4.3].
- Día 1: Embalaje de ADN en fago lambda Partículas
- Calentar al baño maría a 30 ° C.
- Utilizando una punta de pipeta 10 l de gran calibre, la transferencia de 4 l de ADN a un tubo de 1,5 ml. NOTA: Este paso se puede realizar de un día o más de antelación para reducir el tiempo de preparación.
- Calentar el primer tubo (rojo) a partir de un kit de extracto de empaquetamiento del fago (1 tubo por cada 2 muestras). Brevemente girar para recoger el extracto en el fondo del tubo.
- Transferir 4,8 l de extracto de empaquetamiento desde el primer tubo para la muestra de ADN y mezclar por agitación suave con la punta de pipeta. Brevemente centrifugar las muestras en tubos. Incubar durante 1,5 horas a 30 ° C baño de agua.
- Caliente el segundo tubo (azul) extracto de empaquetamiento (1 tubo de ~ 15 muestras). Brevemente girar para recoger el extracto en el fondode tubo.
- Transferir 4,8 l de extracto de empaquetamiento desde el segundo tubo para la muestra de ADN y mezclar por agitación suave. Brevemente centrifugar las muestras en tubos. Incubar durante una 1,5 horas más a 30 ° C baño de agua.
- Vuelva a suspender las partículas de fago empaquetadas en 500 l de tampón SM y se mezcla por rotación durante 30 min a 20 rpm.
- Después de girar, muestras vórtice brevemente y se centrifuga a 11.000 xg durante 30 segundos para recoger muestras en el fondo de los tubos. Las partículas de fago están listos para la infección [etapa 6.2.4].
- Día 1: Preparar Top Agar
- Preparar agar superior separada para las placas de titulación y placas de selección de mutantes. Cada muestra requiere 4 placas de titulación, y 4 placas mutantes. Cada placa requiere 8 ml de agar superior. Añadir el agente selectivo fenil-β-D-galactopiranósido (P-Gal) a la parte superior de selección de mutantes agar solamente. Preparar dos principales agares con antelación (día de ensayo) y se mantiene a 50 ° C antes de la adición de MgSO4 a ambos top agar, y PGal mutante de agar de selección.
- Día 1: la infección de células con fago empaquetado y Chapado
- Etiquetar dos tubos de 50 ml por muestra: 1 tubo "mutante" por muestra y 1 tubo de "título" por muestra
- Label 8 placas de agar por muestra: 4 placas "mutantes" por muestra y 4 platos "titulación" por muestra
- Alícuota 2 ml de células resuspendidas desde el paso [6.2.1.2] a cada tubo.
- Añadir 500 l de partículas de fago empaquetadas [de paso 6.2.2.8] a "mutante" tubo 50 ml (células que contienen). Se mezclan suavemente y permiten partículas de fago para infectar las células durante 30 min a temperatura ambiente.
- Después de 30 min, agitar brevemente las células infectadas y la transferencia de 15 l de células infectadas para el tubo de 50 ml apropiadas "título" (que contiene células).
- Para muestra el título de la placa, añadir 30 ml de agua tibia (50 ° C) agar "título" de arriba (NO contiene P-Gal) para tubo de 50 ml "título". Inmediatamente distribute mezcla agar / celular entre los 4 platos "titulación" (~ 8 ml por placa). Trabaje con rapidez para que el agar superior no se enfría en las pipetas, y tratar de no introducir burbujas de aire.
- Placa las muestras "mutantes" siguiente. Asegúrese de P-Gal se añade a la "selección mutante" agar superior. Añadir 30 ml de agar caliente "selección de mutantes" (que contiene P-Gal) al tubo "mutante" 50 ml. Distribuir Inmediatamente mezcla agar / celular entre los 4 platos "mutantes" (~ 8 ml por placa).
- Permitir placas para solidificar (~ 15 min) y luego invierten y se incuban a 37 ° C durante la noche.
- Día 2: Las placas de recuento
- Después de la incubación durante la noche, contar el número de placas en las placas mutantes y el título. Para un gran número de placas, contar sólo una parte de la placa para estimar el recuento total (por ejemplo., A menudo ¼ de la placa de titulación tendrá entre placas 100-200). Un mínimo de 100 placas debe ser contado por placa cuando COUnting una porción de la placa.
- Calcular el número de unidades formadoras de placa (UFP) por l de células. Esto se hace dividiendo el número de placas en las placas de titulación "" por el volumen de células cultivadas en placas (15 l).
- Utilice el número de PFU / l para estimar el número total de UFP en el volumen total de las células infectadas sembradas en placas sobre las placas de "mutantes" (UFP / l * [2 ml + 0,5 ml de células partículas de fago empaquetadas - 15 l para placas de titulación] ).
- Estimar el MF dividiendo el número total de placas mutantes contados en los 4 platos "mutantes" por el número total estimado de UFP en el volumen total de las células infectadas por determinados a partir de las placas de "titulación".
- Cuando la espontánea lacZ MF es del orden de 3 x 10 -5 en el grupo de control, ya que para las células germinales MutaMouse, la directriz de la OCDE recomienda un mínimo de 125 000 a 300 000 UFP no mutantes por animal ser pantallaed para la mutación con el fin de obtener una señal de línea base fiable. Otros modelos transgénicos pueden tener menor espontánea MF, en cuyo caso sería necesario un mayor número de UFP. Una prueba de la potencia estadística se puede realizar con el fin de determinar el número mínimo de UFP y animales necesarios para obtener la resolución deseada. Los datos de múltiples repeticiones podrán mezclarse para satisfacer este requisito mínimo PFU, siempre que no producen significativamente diferentes frecuencias mutantes.
7. Estadísticas
La unidad experimental para el análisis es el ratón. Los datos producidos a partir de este ensayo general no se distribuyen normalmente. Como tal, seleccionar el método estadístico para el análisis basado en la característica de distribución de los datos.
NOTA: Estándar análisis paramétricos (. Por ejemplo, ANOVA) se puede emplear si se aplica la transformación de datos apropiada para igualar la varianza de la respuesta a través de la gama de obserción. Poisson o análisis de regresión binomial son a menudo más apropiado. Análisis no paramétrico también se puede emplear. Rutinariamente Empleamos la regresión de Poisson utilizando el procedimiento de modelo lineal generalizado (es decir., Proc GENMOD) en SAS v.9.2 (SAS Institute, Cary, NC) como se describe por Lemieux et al 26.
Resultados
Con un recuento medio de la placa de 200 mil placas por animal, por lo general observamos un fondo media MF de aproximadamente 2,8 x 10 -5 en las células germinales masculinas con una desviación estándar de 1.7 x 10 -5 en nuestros grupos de control (basado en datos de ocho independiente experimentos). Con este recuento de la placa, el nivel y la varianza de fondo, grupos de dosis con n = 5 animales cada uno es suficiente para detectar un aumento de 2 veces en MF con potencia> 0.8.
Los resultados se presentan típicamente en formatos tabulares o gráficos. Tabla 2 y la Figura 6 muestran resultados representativos de cauda de esperma de machos MutaMouse (n = 5 por grupo) se expone a una dosis única oral aguda de 0, 25, 50, y 100 mg / kg N-etil-N-nitrosourea (ENU), seguido de un tiempo de muestreo 70 días. Este período de 70 días permite la medición de los eventos mutacionales que se produjeron en espermatozoides que eran células madre de espermatogonias en el momento de la exposición (Figura 3). Densidades típicas de placa en placas de mutantes y el título se muestran en la Figura 7. Como se muestra en la Tabla 2 y la Figura 6, la exposición aguda inducida por ENU un aumento significativo dependiente de la dosis en el MF de las células madre de espermatogonias. La dosis baja indujo un aumento de 2,6 veces significativo sobre los controles, que tenía una línea de base MF de 2,6 x 10 -5. Inducción máxima se produjo en la dosis más alta, lo que provocó un aumento de 4,4 veces respecto a los controles.
Un ejemplo de este ensayo efectuado en las células germinales de los túbulos seminíferos se puede encontrar en Douglas et al. 27, donde MF se determinó en células germinales túbulo en diferentes intervalos de tiempo tras una repetición de la inyección intraperitoneal 5 días de 50 mg / kg ENU. En ese estudio, la frecuencia de mutantes en células seminíferos se incrementaron hasta 15 días después del tratamiento y se mantuvo constante a partir de entonces.
| ExpoSeguro de régimen | Tejido recogido | Tipo de célula recopilada (célula diana) | Fase de célula diana al comienzo de la exposición | Fases pasaron durante la exposición |
| Agudo + 70 | Cauda | El espermatozoide maduro | Células madre | Células madre |
| 14 + 21 | Cauda | El espermatozoide maduro | Espermatogonias | Espermátide |
| 14 + 35 | Cauda | El espermatozoide maduro | Células madre | Spermatocyte |
| 28 + 3 | Cauda | El espermatozoide maduro | Spermatocyte | Spermatocyte Espermátide El espermatozoide maduro |
| Túbulos | Células madre | Células madre | Células madre | |
| Espermatogonias | Spermatogonia | Espermatogonias | ||
| Spermatocyte | Spermatocyte | |||
| Espermátide | Espermátide | |||
| 28 + 49 | Cauda | El espermatozoide maduro | Cel madre | Células madre |
| Túbulos | Células madre Espermatogonias Spermatocyte Espermátide | Células madre | Células madre |
Tabla 1. tipos celulares y las fases de la espermatogénesis que están dirigidos por el ensayo de mutación roedor transgénico por varios diseños experimentales.
| Grupo de dosis | Animal # | Mutant PFU | PFU total | MF (x10 -5) | Media de MF (x 10 -5) | Veces el cambio | p-valor |
| Control | 1 | 5 | 180245 | 2.8 | 2.6 | 1.0 | - |
| 2 | 4 | 137835 | 2.9 | ||||
| 3 | 11 | 385672 | 2.9 | ||||
| 4 | 2 | 431396 | 0,5 | ||||
| 5 | 6 | 152413 | 3.9 | ||||
| 25 mg / kg | 6 | 17 | 162353 | 10.5 | 6.9 | 2.6 | 0.0002 |
| 7 | 14 | 150094 | 9.3 | ||||
| 8 | 4 | 154401 | 2.6 | ||||
| 9 | 9 | 154401 | 5.8 | ||||
| 10 | 12 | 196978 | 6.1 | ||||
| 50 mg / kg | 11 | 17 | 155727 | 10.9 | 9.3 | 3.6 | <0,0001 |
| 12 | 11 | 135847 | 8.1 | ||||
| 13 | 25 | 193499 | 12.9 | ||||
| 14 | 12 | 133.859 | 9.0 | ||||
| 15 | 14 | 252807 | 5.5 | ||||
| 100 mg / kg | 16 | 26 | 170968 | 15.2 | 11.5 | 4.4 | <0,0001 |
| 17 | 28 | 234584 | 11.9 | ||||
| 18 | 10 | 145289 | 6.9 | ||||
| 19 | 35 | 292236 | 12.0 | ||||
| 20 | 22 | 190848 | 11.5 |
Cuadro 2 La frecuencia mutante lacZ en cauda de esperma transgénico macho mexpuesto hielo de forma aguda a ENU cuando eran células madre de espermatogonias (tiempo de administración = 1 día, tiempo de muestreo = 70 días). PFU = unidad formadora de placa, MF = frecuencia de mutantes.
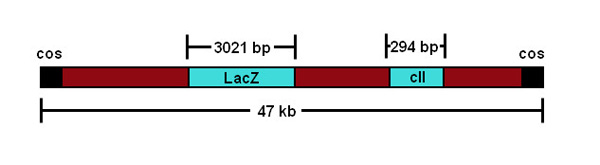
Figura 1. Una representación esquemática de la construcción del fago lambda gt10.
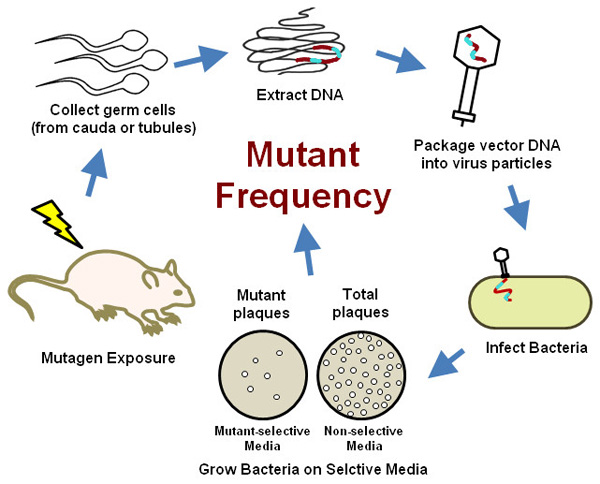
Figura 2 Un esquema del germen roedor ensayo de mutación de células transgénicas.
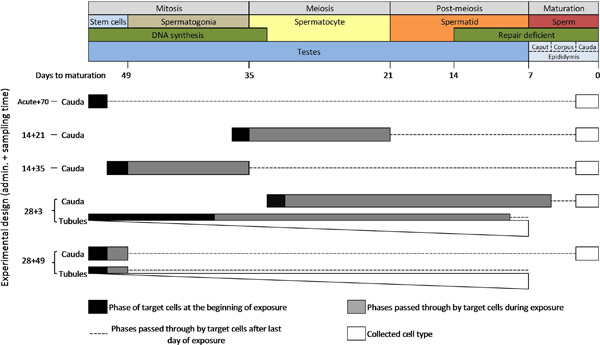
Figura 3. Un diagrama esquemático de la espermatogénesis en el ratón y los tipos de células y PHAses que están dirigidos por el ensayo de mutación roedor transgénico por varios diseños experimentales. NOTA: Las barras blancas graduados representan la proporción relativa de los tipos de células presentes en las suspensiones celulares preparadas a partir de los túbulos seminíferos (es decir, espermátidas> espermatocitos> espermatogonias> células madre). Por favor, haga clic aquí para ver una versión más grande de esta figura.
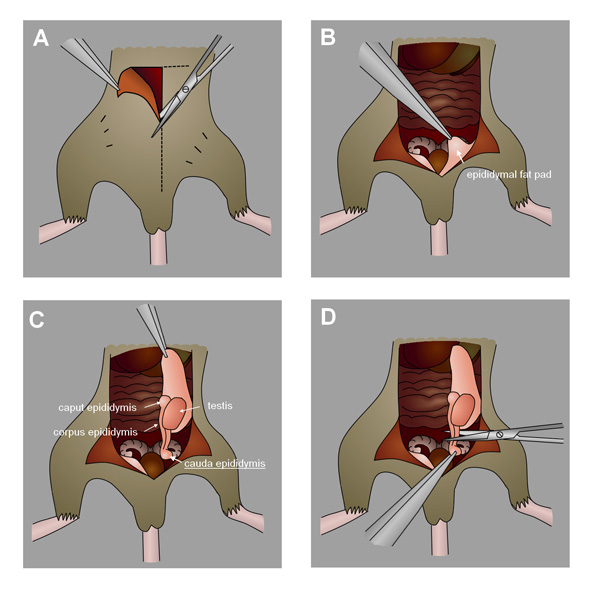
Figura 4. Colección del epidídimo cauda ratón. A) Hacer una incisión en el abdomen hacia el escroto. B) Identificar el epidídimo grasa almohadilla. C) Tire suavemente de la almohadilla de grasa a extraer los testículos y el epidídimo. D) Localizar y extirpar el epidídimo cauda.
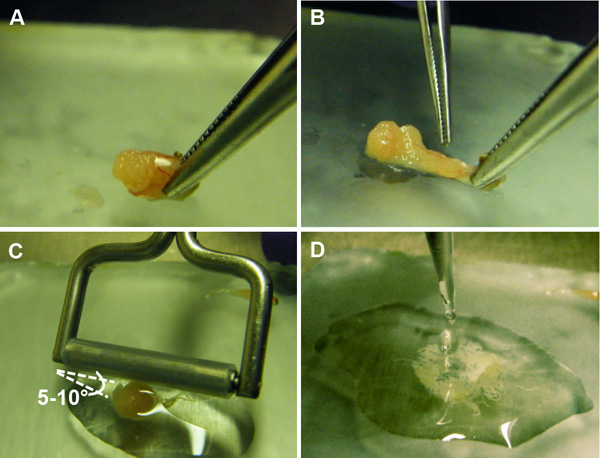
Figura 5 Preparación de suspensión de células germinales de los túbulos seminíferos. A) Se hace una incisión en la cápsula epitelial de los testículos, la exposición de los túbulos seminíferos. B) Los túbulos seminíferos se aprietan fuera de la cápsula. C) Un rodillo de tejido se pasa suavemente sobre los túbulos en un ángulo de 5-10 ° a liberar las células germinales que contiene. D) La suspensión de células germinales se recoge para su posterior procesamiento.
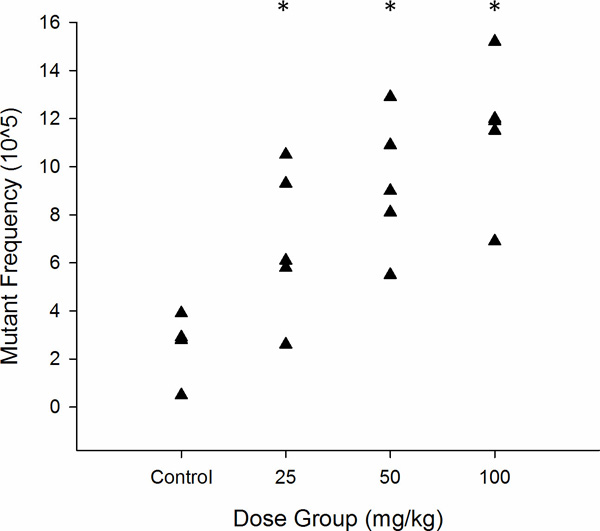
Figura 6. Representación gráfica de la frecuencia de mutantes lacZ en MutaMouse esperma expuesto de forma aguda como células madre para ENU (n = 5). Cadatriángulo representa el MF de un animal. * p <0.05 según lo determinado por la regresión de Poisson.
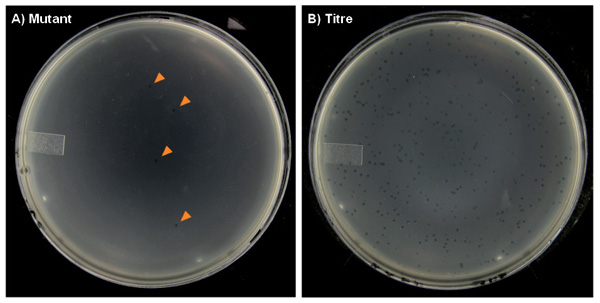
Figura 7. placas de agar representativos del ensayo de mutación roedor transgénico con placas formadas en un césped de E. bacteria huésped coli. A) Las placas de "mutantes" tendrán muy pocas placas (marcados con flechas), especialmente en los grupos de dosis de control, lo que ocasionalmente tenga cero placas en algunos platos. B) Las placas de "titulación" pueden tener cientos de placas.
Discusión
En comparación con los métodos tradicionales, el ensayo de mutación de células germinales TGR proporciona un medio más rápido, más económico, y más sensibles de cuantificar inducida en mutaciones de células germinales in vivo. Mediante la evaluación de los transgenes MF directamente en el esperma, a diferencia de los hijos, el número de animales, el tiempo y los recursos requeridos para evaluar la mutagenicidad de la línea germinal de cualquier compuesto individual se reduce significativamente. En términos de sensibilidad, hemos sido capaces de detectar un aumento de 2,6 veces significativa de células madre espermatogonias MF después de la exposición a 25 mg / kg ENU usando sólo 5 animales por grupo de dosis. En contraste, el ensayo locus específico no pudo detectar ningún cambio significativo en MF en esta misma dosis usando> 3.000 ratones en el grupo expuesto y> 500.000 ratones de control 28.
Además de su conveniencia para ambas investigaciones mecanicistas y reglamentarios, este método proporciona una oportunidad para que los estudios comparativos entre somáticas y germinales línea Mutatisobre las tasas. La evidencia reciente sugiere que para algunos agentes mutaciones de células germinales pueden ser inducidos a una concentración inferior a la requerida para la mutación somática. Por ejemplo, la exposición prolongada a la N-hidroximetilacrilamida, un metabolito de la acrilamida carcinógeno alimentos 12, aumenta la frecuencia de mutaciones dominantes letales de células germinales en ratones sin afectar a la frecuencia de micronúcleos en las células rojas de la sangre, una medida tradicional de células somáticas daño citogenético 13. Además, la exposición de ratones a las dos frecuencias de mutación principal y lateral de tabaco humo provoca elevados de repetición en tándem loci de ADN en el esperma a dosis que no aumentan la frecuencia de micronúcleos en sangre 14. Estos hallazgos desafían el supuesto de que las pruebas de genotoxicidad somática es siempre protector de la línea germinal, y refuerzan la demanda de un medio más eficiente y costo-efectiva para cuantificar germen frecuencia de mutación celular. Sin embargo, la evidencia de los mutágenos de células germinales preferenciales sigue siendo débil, En gran parte debido a la falta de datos disponibles para la comparación de las tasas de mutación en los tejidos de células somáticas y germinales. El ensayo de mutación TGR permite la prueba y la comparación de las tasas de mutación inducida en múltiples tejidos utilizando el mismo transgén paralelo. Por lo tanto, las pruebas de mutación comparativo utilizando el ensayo de TGR podría ayudar a llenar los vacíos de datos en torno a la posibilidad de efectos en células germinales preferenciales.
Evaluación simultánea de la mutación de células somáticas y germinales para las pruebas reglamentarias también mejoraría la eficiencia al reducir el número de animales requeridos. La directriz de la OCDE para la mutación somática recomienda un tiempo de administración de 28 días, seguido de un tiempo de muestreo de tres días (del 28 + 3). Análisis de esperma de caballo puede ofrecer una pobre sensibilidad en este punto de tiempo, ya que se dirige a las células expuestas principalmente durante las fases de espermatocitos y spermatid de la espermatogénesis (Figura 3). Las células en estas fases no sintetizan ADN y pierden progresivamente su capacidad de reparación del ADN 6 </ Sup>. Además, el esperma de caballo de muestreo en este punto de tiempo dejaría de detectar las mutaciones que ocurren en las células espermatogonias y madre. Por lo tanto, para la integración en el diseño 28 + 3, la directriz de la OCDE recomienda la recolección de células germinales de los túbulos seminíferos. Esta población mixta contiene células derivadas de la síntesis de ADN y reparación competentes tipos de células, incluidas las células madre, y están expuestos a través de la mayoría de las fases de la espermatogénesis. Sin embargo, debido a la naturaleza mixta de estas células, el análisis de células túbulos seminíferos no proporciona información específica de fases. Además, existe la preocupación de que la presencia de células no diana puede influir en el MF observado (por ejemplo, las llamadas falsas positivas mutágeno de células germinales debido a la contaminación de las células somáticas la mutación, o la dilución de una señal de células germinales mutado a partir de células germinales reparar el ADN deficientes) . Actualmente no hay datos suficientes para concluir si los resultados de las células túbulos seminíferos en 28 + 3 ofrecen la misma sensibilidad y especificidad de unas cauda espermatozoides en momentos posteriores. Nuestro laboratorio está actualmente comparando FMs inducidas en células túbulos seminíferos y esperma de caballo recogidos después de varios tiempos de muestreo para abordar este punto. Tomamos nota de que la directriz de la OCDE sugiere un tiempo de muestreo alternativo de 28 días para que los tejidos que se dividen lentamente, como el hígado, que también pueden ser adecuados para el análisis de las células germinales. Sin embargo, los datos disponibles son todavía insuficientes y estamos actualmente no se puede recomendar un diseño experimental único para el análisis simultáneo de células somáticas y las células germinales utilizando el ensayo de mutación TGR para las pruebas reglamentarias.
Una característica de este ensayo que debe señalarse es que los eventos mutacionales se evalúan en un transgén no murino. Sin embargo, existe una amplia evidencia que sugiera que el transgén responde a mutágenos ambientales en una forma similar a los genes endógenos 20. Además, debido a que los orígenes precisos de eventos mutacionales independientes son difíciles deresolver, los resultados se informaron en general como una frecuencia mutante (en contraste con una frecuencia de mutación). La frecuencia de mutación real se puede resolver si los resultados se corrigen para la expansión clonal (es decir. La división y multiplicación de una única célula mutada que pueden contribuir a la frecuencia observada de mutantes transgén) mediante secuenciación de ADN. La secuenciación de los mutantes transgenes se puede realizar para caracterizar las mutaciones lacZ, e identificar mutantes que pueden derivarse de eventos expansión clonal, aunque esto aumenta significativamente el tiempo y el coste del análisis. Además del gen lacZ, theλgt10 vector transgénico alberga un gen reportero de mutación-dependiente de la temperatura alternativa: una variante del gen cII λ, que es más corto (294 pb vs el 3021 pb lacZ, figura 1) y más fácil de secuenciar 29. Secuenciación también permite el análisis del espectro de mutación inducida, proporcionando información sobre la mutatiomecanismo de final del compuesto en cuestión. Un ejemplo extremo de la expansión clonal es la aparición de una mutación "jackpot" (es decir., Mutaciones transgénicas en una fase muy temprana de desarrollo de un órgano que contribuyen a un elevado dramáticamente MF, a veces cientos de miles de veces mayor que el fondo). Animales o tejidos con una mutación "jackpot" deben ser retirados del análisis.
El ensayo que hemos descrito es ampliamente aplicable a otros modelos TGR tales como el ratón y la rata BigBlue, y el plásmido lacZ ratón, todos los cuales albergan vectores indicadores de mutación similares (revisado en 20). La gran mayoría de los estudios de células germinales realizado hasta la fecha, que emplean métodos similares se han centrado casi exclusivamente en los mutágenos bien caracterizados tales como ENU y la radiación (revisado en 30). Se espera que con la reciente publicación de las guías de la OCDE para el ensayo de TGR, este ensayo serácada vez más popular para la detección química y evaluación reglamentaria. La incorporación del ensayo de mutación de células germinales TGR en una batería de pruebas reglamentarias llenará el vacío existente al permitir la evaluación eficiente de la inducción de mutaciones en las células germinales 11. Además, este ensayo se puede usar para medir MF en prácticamente cualquier tejido, proporcionando un medio adecuado para la comparación de las sensibilidades relativas de las células somáticas y las células germinales a la inducción de mutaciones por agentes ambientales en los extremos genéticas idénticas.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This research was funded by the Canadian Regulatory System for Biotechnology (CRSB) and Chemicals Management Plan (CMP) initiatives.
Materiales
| Name | Company | Catalog Number | Comments |
| MutaMouse | Covance | - | |
| E. coli (lacZ-/galE-) | Covance | - | See reference 25 in manuscript |
| Chloroform | Caledon | 3001-2-40 | |
| Dulbecco's phosphate-buffered saline (D-PBS) | Gibco | 14190-250 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M, pH 8 | Sigma-Aldrich | 03690 FLUKA | |
| Isoamyl alcohol | Caledon | 2/10/7900 | |
| Lennon LB broth base | Invitrogen | 12780-029 | |
| Stainless steel mesh filter | Sigma-Aldrich | S3770 | |
| Transpack packaging extract | Agilent Technologies | 200220 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Ethyl alcohol, anhydrous (EtOH) | Commercial Alcohols | - | |
| Ampicilin | Gibco | 11593-027 | prepare 20 mg/ml in dH2O |
| Kanamycin | Gibco | 11815-024 | prepare 5 mg/ml in dH2O |
| Phenol | Invitrogen | 15509-097 | Saturate in 0.1 M Tris-HCl as per manufacturers direction |
| Phenyl-β-D-galactopyranoside (P-Gal) | Sigma-Aldrich | P6501 | dissolve 3 g per 10 ml of dimethylformamide |
| Proteinase K | Invitrogen | 25530-031 | prepare 60 mg/ml solution dH2O just before use, 20 µl per sample |
| Sodium acetate (NaAc) | Fisher Scientific | BP333-500 | prepare 3 M solutution, pH 5.2 |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L4390 | prepare 10% solution in dH2O |
| 1 M MgSO4 | 24.6 g MgSO4·7H2O per 100 ml dH2O, autoclave, store at room temperature up to 1 year | ||
| LB Broth | 5.0 g LB base, 6.4 g NaCl per 1 L dH2O. Autoclave and cool | ||
| Saline sodium citrate (SSC) | 150 mM NaCl, 15 mM trisodium citrate, pH 7.0 | ||
| SM Buffer | 5.8 g NaCl, 2.0 g MgSO4·7H2O, 50 ml 1 M Tris-HCl (pH 7.5), 5.0 ml of gelatin (2% w/v), per 1 L dH2O, autoclave, store at room temperature up to 1 year | ||
| TE buffer | 10 mM Tris, 1 mM EDTA, pH 8 |
Referencias
- Ahmadi, A., Ng, S. C. Fertilizing ability of DNA-damaged spermatozoa. J. Exp. Zool. 284 (6), 696-704 (1999).
- Crow, J. F. The origins, patterns and implications of human spontaneous mutation. Nat. Rev. Genet. 1 (1), 40-47 (2000).
- Nelson, K., Holmes, L. B. Malformations due to presumed spontaneous mutations in newborn infants. N. Engl. J. Med. 320 (1), 19-23 (1989).
- Kong, A., et al. Rate of de novo mutations and the importance of father's age to disease risk. Nature. 488 (7412), 471-475 (2012).
- Michaelson, J. J., et al. Whole-genome sequencing in autism identifies hot spots for de novo germline mutation. Cell. 151 (7), 1431-1442 (2012).
- Marchetti, F., Wyrobek, A. J. DNA repair decline during mouse spermiogenesis results in the accumulation of heritable DNA damage. DNA Repair (Amst). 7 (4), 572-581 (2008).
- Marchetti, F., Wyrobek, A. J. Mechanisms and consequences of paternally-transmitted chromosomal abnormalities. Birth Defects Res. C. Embryo. Today. 75 (2), 112-129 (2005).
- Demarini, D. M. Declaring the existence of human germ-cell mutagens. Environ. Mol. Mutagen. 53 (3), 166-172 (2012).
- Epstein, S. S. Use of the dominant-lethal test to detect genetic activity of environmental chemicals. Environ. Health. Perspect. 6, 23-26 (1973).
- Russell, W. L. X-ray-induced mutations in mice. Cold Spring Harb. Symp. Quant. Biol. 16, 327-336 (1951).
- Singer, T. M., Yauk, C. L. Germ cell mutagens: Risk assessment challenges in the 21st century. Environ. Mol. Mutagen. 51 (8-9), 919-928 (2010).
- Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S., Tornqvist, M. Acrylamide: A cooking carcinogen. Chem. Res. Toxicol. 13 (6), 517-522 (2000).
- Witt, K. L., et al. Mouse bone marrow micronucleus test results do not predict the germ cell mutagenicity of N-hydroxymethylacrylamide in the mouse dominant lethal assay. Environ. Mol. Mutagen. 41 (2), 111-120 (2003).
- Marchetti, F., Rowan-Carroll, A., Williams, A., Polyzos, A., Berndt-Weis, M. L., Yauk, C. L. Sidestream tobacco smoke is a male germ cell mutagen. Proc. Natl. Acad. Sci. U.S.A. 108 (31), 12811-12814 (2011).
- Yauk, C. L., Dubrova, Y. E., Grant, G. R., Jeffreys, A. J. A novel single molecule analysis of spontaneous and radiation-induced mutation at a mouse tandem repeat locus. Mutat. Res. 500 (1-2), 147-156 (2002).
- Niwa, O. Indirect mechanisms of genomic instability and the biological significance of mutations at tandem repeat loci. Mutat. Res. 598 (1-2), 61-72 (2006).
- Campbell, C. D., et al. Estimating the human mutation rate using autozygosity in a founder population. Nat. Genet. 44 (11), 1277-1281 (2012).
- Beal, M. A., Glenn, T. C., Somers, C. M. Whole genome sequencing for quantifying germline mutation frequency in humans and model species: Cautious optimism. Mutat. Res. 750 (2), 96-106 (2012).
- Shwed, P. S., Crosthwait, J., Douglas, G. R., Seligy, V. L. Characterisation of MutaMouse lambdagt10-lacZ transgene: Evidence for in vivo rearrangements. Mutagenesis. 25 (6), 609-616 (2010).
- Lambert, I. B., Singer, T. M., Boucher, S. E., Douglas, G. R. Detailed review of transgenic rodent mutation assays. Mutat. Res. 590 (1-3), 1-280 (2005).
- OECD. . OECD Guideline for the testing of chemicals: Transgenic rodent somatic and germ cell gene mutation assays. , (2011).
- Rodriguez, M., Panda, B. B., Ficsor, G. Testes weight reflect ethylnitrosourea induced histopathology in mice. Toxicol. Lett. 17 (1-2), 77-80 (1983).
- Russell, L. B. Effects of male germ-cell stage on the frequency, nature, and spectrum of induced specific-locus mutations in the mouse. Genetica. 122 (1), 25-36 (2004).
- Duselis, A. R., Vrana, P. B. Harvesting sperm and artificial insemination of mice. J. Vis. Exp. (3), 184 (2007).
- Gossen, J. A., Molijn, A. C., Douglas, G. R., Vijg, J. Application of galactose-sensitive E. coli strains as selective hosts for LacZ- plasmids. Nucleic Acids Res. 20 (12), 3254 (1992).
- Lemieux, C. L., et al. Simultaneous measurement of benzo[a]pyrene-induced pig-a and lacZ mutations, micronuclei and DNA adducts in muta mouse. Environ. Mol. Mutagen. 52 (9), 756-765 (2011).
- Douglas, G. R., Jiao, J., Gingerich, J. D., Gossen, J. A., Soper, L. M. Temporal and molecular characteristics of mutations induced by ethylnitrosourea in germ cells isolated from seminiferous tubules and in spermatozoa of lacZ transgenic mice. Proc. Natl. Acad. Sci. U.S.A. 92 (16), 7485-7489 (1995).
- Russell, W. L., Hunsicker, P. R., Raymer, G. D., Steele, M. H., Stelzner, K. F., Thompson, H. M. Dose--response curve for ethylnitrosourea-induced specific-locus mutations in mouse spermatogonia. Proc. Natl. Acad. Sci. U.S.A. 79 (11), 3589-3591 (1982).
- Swiger, R. R., Cosentino, L., Shima, N., Bielas, J. H., Cruz-Munoz, W., Heddle, J. A. The cII locus in the MutaMouse system. Environ. Mol. Mutagen. 34 (2-3), 201-207 (1999).
- Singer, T. M., Lambert, I. B., Williams, A., Douglas, G. R., Yauk, C. L. Detection of induced male germline mutation: Correlations and comparisons between traditional germline mutation assays, transgenic rodent assays and expanded simple tandem repeat instability assays. Mutat. Res. 598 (1-2), 164-193 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados