Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de un dispositivo 3D grafeno Electrodo dielectroforéticas
En este artículo
Resumen
Un microdispositivo con potencial de alto rendimiento se utiliza para demostrar en tres dimensiones (3D) dielectroforesis (DEP) con nuevos materiales. Papel nanoplatelet grafeno y la cinta de doble cara se apilaban alternativamente; un micro-así 700 micras fue perforado transversal a las capas. DEP comportamiento de perlas de poliestireno se demostró en el micro-así.
Resumen
El diseño y la fabricación de una novela microdispositivo electrodo 3D utilizando 50 micras de espesor de papel de grafeno y 100 micras cinta de doble cara se describe. El protocolo detalla los procedimientos para construir una, reutilizable, de múltiples capas versátil cámara dielectroforesis laminado. Específicamente, seis capas de 50 m x 0,7 cm x 2 cm de papel de grafeno y cinco capas de cinta de doble cara se apilaron alternativamente juntos, a continuación, sujetan a un portaobjetos de vidrio. A continuación, un m de diámetro micro-así 700 fue perforado a través de la estructura laminada usando una máquina de micro perforación controlado por ordenador. Propiedades aislantes de la capa de cinta entre capas de grafeno adyacentes fueron asegurados por las pruebas de resistencia. Plata epoxi conductor conectado capas alternas de papel de grafeno y formó conexiones estables entre el papel de grafeno y los electrodos de alambre de cobre externos. A continuación, el dispositivo acabado se sujeta y se sella a un portaobjetos de vidrio. El gradiente de campo eléctrico fue modelado en tque el dispositivo de múltiples capas. Comportamientos dielectroforéticas de 6 micras perlas de poliestireno se demostraron en los 1 mm de profundidad de micro pocillos, con conductividades medianas que van desde 0,0001 S / m a 1,3 S / m, y se aplican frecuencias de la señal de 100 Hz a 10 MHz. Se observaron respuestas dielectroforéticas negativos en tres dimensiones más de la mayor parte del espacio de la conductividad-frecuencia y de cruce valores de frecuencia son consistentes con valores de la bibliografía se informó anteriormente. El dispositivo no impidió electroósmosis y electrotérmicos flujos de corriente alterna, que se produjeron en las regiones de alta y baja frecuencia, respectivamente. El papel de grafeno utilizado en este dispositivo es muy versátil y, posteriormente, podría funcionar como un biosensor después de caracterizaciones dielectroforéticas son completa.
Introducción
El grafeno es un nuevo material conocido por sus propiedades electrónicas de alta calidad y potenciales químicos y biosensores aplicaciones 1. Nanoplatelets grafeno se han utilizado para soporte del catalizador 2, 3, 4, biosensores super-condensadores 5 y compuestas-electrodos incluidos grafeno / polianilina y compuestos de nanopartículas de silicio / grafeno 6-8. Este manuscrito describe la utilización de papel de grafeno como electrodos en una única tridimensional (3D), dispositivo de microfluidos de capas. Electrodos de papel de grafeno se laminaron con aislante cinta de doble cara y una cámara perforado dentro de la cual se realizó dielectroforesis AC 3D de perlas de poliestireno.
La dielectroforesis (DEP) se refiere al movimiento de partículas polarizables bajo campos eléctricos no uniformes. DEP Positivo (pDEP) o DEP negativo (nDEP) se produce cuando las partículas son más o menos polarizable que el medio circundante, resulting en movimiento hacia el campo eléctrico más fuerte o más débil, respectivamente. Esta herramienta electrocinético no lineal se ha usado para la separación, clasificación, atrapando, y la identificación de partículas y células biológicas 9-15. La fuerza dielectroforética experimentada por una partícula polarizada es una función del gradiente de campo eléctrico, radio de la partícula y la forma, propiedades dieléctricas de partículas incluyendo la conductividad y la permitividad, así como la conductividad medios de comunicación y la permitividad. En tradicional de dos dimensiones (2D) de DEP, el movimiento de partículas está en el plano principal de la gradiente de campo eléctrico típicamente formado entre electrodos de superficie microfabricados; movimiento en la dirección vertical es insignificante en comparación con las direcciones en el plano, en la mayoría de los dispositivos. Sin embargo, el aprovechamiento de esta tercera dimensión de gradientes de campo eléctrico para el 3D DEP permite un mayor rendimiento de la muestra y aumenta la flexibilidad para diseñar nuevas y mejores separaciones dielectroforéticas en la que el flujo es traverse al campo gradientes 16, 17. Otros diseños específicos incluyen 3D DEP basado en 18 aislante, electrodos de carbono 3D DEP 13, 19 y 3D galvanoplastia DEP 10. Como queda de manifiesto por la investigación en las estructuras 3D, tales dispositivos pueden ser operados en modo de flujo continuo para lograr rendimientos más altos. Observación del movimiento de partículas 3D en nuestro dispositivo 3D en capas se logra como una función de frecuencia y conductividad media a través de microscopía de luz a diferentes alturas focales.
Fatoyinbo et al. Primero informó DEP en un 3D laminado estructura del electrodo / aislamiento utilizando apilados alternativamente 30 micras papel de aluminio y 150 películas de resina epoxi 20 micras. Hubner et al. Diseñaron electrodos laminados 3D similares con 35 m de cinta de cobre y 118 micras de poliamida adhesivo 21. Este trabajo toma prestado el diseño en 3D, bueno 22, 23, Y utiliza de forma exclusiva la comodidad de 50 micras de papel grafeno como las capas conductoras y 100 m de cinta de doble cara como las capas aislantes, que logró sellar y con suficiente blindaje eléctrico. El grafeno papel versatilidad es una clara ventaja para microdispositivos electrodos 3D porque los nanoplatelets grafeno tienen la capacidad de actuar al mismo tiempo como biosensores, que este grupo previamente demostrada 24.
Los gradientes de campo logrados en el grafeno papel / polímero laminado microdispositivos 3D dependen de las dimensiones micro-así, las capas de papel de grafeno, y el campo eléctrico aplicado. Las dimensiones críticas incluyen la separación vertical del electrodo (conductor y aislante espesores de capa) y el diámetro micro pocillos y altura (determinado por capas apiladas). La señal eléctrica se puede ajustar a través de la amplitud y la frecuencia. La estructura del dispositivo actual es para el funcionamiento por lotes, pero se puede adaptar a un dispositivo de flujo continuo. El fabuloso dispositivotécnica rication descrito aquí es adecuado para el desarrollo de 3D laminado electrodos con una amplia variedad de propiedades nanoplatelet grafeno simplemente intercambiando el papel de grafeno utilizado. Ventajas de la utilización de papel de grafeno son versatilidad de propiedades físicas y químicas, gasto reducido, y los nanoplatelets de grafeno simultáneamente pueden actuar como biosensores para detectar una amplia gama de bioanalytes 24. Las metas a largo plazo de los sistemas de DEP en 3D de alto rendimiento son identificar rápidamente los tipos de células 25-27, o lograr sin etiquetas, clasificación de células eléctricamente mediada de las células enfermas de las poblaciones de células sanas 28. En este trabajo se demuestra la optimización del material y preparación de equipo y el servicio seguido de la ilustración y el análisis de los resultados típicos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Fabrique una estructura 3D laminado Electrodo / aislamiento
- Para una capa de grafeno 6, 5 dispositivo de capa de cinta, cortar el papel de grafeno con un bisturí o cuchilla de afeitar similares y una regla de borde recto en seis 0,7 cm x 1,5 cm rectángulos y usar las tijeras para cortar la cinta de doble cara sensible a la presión en cinco 1.3 cm x ~ 5 cm rayas.
NOTA: Como se muestra en la Figura 1a, esto produce un electrodo de 3 planta, 3 dispositivo de electrodo de señal de CA. El 7 mm realización de anchura de la capa es lo suficientemente estrecha como para que quepan en un portaobjetos de vidrio, sin embargo, lo suficientemente amplia como para facilitar la perforación. La longitud de 2 mm no se rompen con facilidad en el uso repetido y tiene espacio suficiente para conectar los cables de cobre. La profundidad del equipo es limitada por las profundidades de la fresa más. - Coloque la primera capa de papel de grafeno sobre un portaobjetos de vidrio limpio. Lentamente cubrir un extremo del papel de grafeno con una franja de cinta, dejando un margen de ~ 2 mm para asegurar el aislamiento entre las dos capas de papel de grafeno adyacentes (Figura 1b ).
- Coloque la segunda capa de papel de grafeno en la parte superior de la cinta de desplazamiento a la primera capa de papel de grafeno (Figura 1a). Aplique una presión moderada (presión de manera uniforme con el pulgar, ~ 100 N durante 0,7 cm 2 de área) después de la adición de cada capa de la realización para asegurar un buen sellado entre capas.
- Repita los pasos 1.2 y 1.3 para el resto de capas, dejando la parte superior e inferior del papel capas de grafeno. Cortar a lo largo de la línea de puntos se muestra en la Figura 1b para eliminar el exceso de cinta de los bordes del dispositivo dejando un pequeño margen de ~ 1 mm para asegurar el aislamiento sellada entre capas de papel de grafeno (Figura 1b).
NOTA: La cinta de doble cara no se utiliza como las capas superior e inferior para evitar la recogida de residuos, ya que la estructura laminada se perfora, montado en un portaobjetos, y se llena con la muestra. - Realizar una prueba de aislamiento rápido con un multímetro (modo de resistencia). Coloque las sondas positivos y negativos en dos lados diferentes de thdispositivo electrónico (A y B en la figura 1c); alta resistencia (kilo-mega-ohmios) indica un buen aislamiento entre las capas. Retire la estructura en capas de la lámina de vidrio para preparar para la perforación de micro pocillos.
NOTA: Un dispositivo normalmente no pasa la prueba de aislamiento cuando las capas de papel de grafeno adyacentes hacen contacto durante los pasos 1.2 a 1.4. Deseche estos dispositivos.
2. Taladro Micro-bien en la estructura laminada
- Use una máquina mecánica micro-fresado controlado por ordenador y elegir una fresa con un 700 micras de diámetro y 2,1 mm de longitud de corte. Inmovilizar la estructura laminada en la etapa de micro-fresado utilizando abrazaderas apropiadas (Figuras 2A y B). Ejecutar el husillo de la máquina de molienda a 8.600 rpm, a continuación, baje la fresa de extremo lentamente en y a través del centro de la estructura laminada. Mueva la fresa de espiga giratoria hacia arriba y abajo a través de la micro-y para alisar la pared interior.
- Elija micro-asídiámetros, que están limitados por disposición molino de extremo de diámetro / longitud de los ratios de aspecto de corte. Asegúrese de que la superficie interna de las micro-así es como vertical y limpio posible para gradientes de campo eléctrico óptimo y paso de la luz a través de la micro pocillos.
- Limpie los residuos de micro-bien con el aire a presión. Realice otra prueba de aislamiento como se describe en 1.5.
3. Conecte los cables eléctricos a la estructura laminada
- Doblar dos 3 cm de largo 32 T hilos de cobre a un ángulo recto en 2 cm. Mezclar ~ 1,5 ml de la parte A y B de la plata epoxi conductora.
NOTA: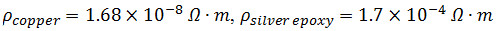
- Aplicar manualmente epoxi plata mezclada con la parte superior y las puntas de las 3 capas de papel de grafeno para asegurar un buen contacto entre las capas en el lado A de la estructura estratificada (Figura 1c), a continuación, coloque el extremo del cable de cobre de 1 cm en el epoxi y entre dos capas. Suavemente cuadradosueeze las capas para eliminar el exceso de epoxi y asegurar un buen contacto eléctrico. Repita para el lado B de la estructura laminada.
- Coloque todo el dispositivo en la rejilla del horno, secar durante la noche a 70 ° C y 1 atm a.
4. Preparar la muestra y Medios de Comunicación
- Preparar los medios de comunicación isotónica de un espectro de conductividades usando el medidor de conductividad, 290 mM de solución de manitol de stock y adiciones de serie de isotónica salina tampón fosfato (PBS).
NOTA: Existe una correlación lineal entre la concentración de conductividad y el volumen de ~ 290 mOsm / L de PBS (la realización) en 290 ~ solución mOsm / L de manitol (no conductor). El video muestra a un medio de 0,01 S / m de conductividad. - Mezclar perlas de poliestireno con medios preparados de conductividad o e-pura agua (~ 5 x 10 -6 S / m) a un vol 1:50: proporción vol. Este protocolo es fácilmente adaptable a las células biológicas.
5. Experimento configurar y utilizar dispositivos
- Sujete el dispositivo onto un portaobjetos de vidrio con una presión moderada (Figura 2d) con abrazaderas de papel modificados o equivalente. Las zapatas deben ser lo suficientemente cerca de la micro-bien para sellar la estructura laminada a la lámina de vidrio prevención de fugas de la muestra. La pinza debe encajar dentro de la platina del microscopio con la presión optimizado a un) evitar la deformación de la estructura laminada, y b) asegurar que el fluido de micro-así no se escapa. La deformación altera la geometría bien y trayectoria de la luz reduciendo reproducibilidad experimento.
- Usando una jeringa de micro o equivalente, inyectar lentamente ~ 1 l de la muestra en el micro-y así evitar la introducción de cualquier burbuja. Repetir la inyección si es necesario y tenga cuidado de no dañar las paredes micro pocillos con la aguja afilada. Un poco llene en exceso el micro pocillos y se deslice inmediatamente cubierta de vidrio sobre el micro-bien para eliminar el exceso de líquido, evitar la evaporación, y garantizar volúmenes reproducibles para cada experimento.
NOTA: A punta de diamante glasscutter funciona bien para scorey grieta cubierta de cristal de tamaño. - Asegure el microdispositivo laminada completada a la platina del microscopio y fije los cables del electrodo generador de funciones a los dos conductores de cobre en el dispositivo. En AxioVision (software Zeiss), haga clic en el botón para iniciar la grabación de la cámara en el modo de adquisición multidimensional. Iniciar señal del generador de función en un período de tiempo fijo después de comenzar la grabación de la cámara CCD para documentar las respuestas con y sin campo eléctrico aplicado.
NOTA: Aquí 100 Hz a 10 MHz de frecuencia con una señal de pico a pico de 15 V se aplicaron y los experimentos se observaron a un aumento de 10X en 1 a 200 por encima de la superficie de portaobjetos de vidrio durante 2 segundos sin campo y ~ 5 min con campo aplicado. Las imágenes se guardan digitalmente en 1 a 5 fotogramas por segundo (fps) para su posterior análisis. - Una vez finalizado el experimento, retire el dispositivo y desmantelar las abrazaderas. Sumerja tanto el portaobjetos de vidrio y el dispositivo con agua y jabón, luego enjuague bien. Dispositivos de reutilización de 30 horas con un rendimiento consistente.
6. Análisis de Datos y Procesamiento de Imágenes
- Analizar los datos de imágenes con software preferido, como ImageJ. Calcular la velocidad del desplazamiento de partículas entre imágenes consecutivas en un intervalo de tiempo dado.
- Calcular la fuerza la fuerza y el campo DEP experimental basado en la velocidad de compilar las tendencias y comparar con la teoría 29.
- Medida de velocidad de las partículas radialmente en la geometría de micro-así coherente con la forma de la gradiente de campo eléctrico. Desde el borde de micro-bien en el centro, identificar 8 contornos concéntricos isoeléctricos (350, 300, ... 50, 0 M), lo que resulta en 7 regiones.
NOTA: La hora de las partículas para atravesar la distancia de 50 m se utilizó para calcular la velocidad. Cuando las variaciones geométricas que requerían, los contornos isoeléctricos se ajustaron ligeramente.
Access restricted. Please log in or start a trial to view this content.
Resultados
Experimentos dielectroforéticas en 6 perlas de poliestireno micras se llevaron a cabo en un 0,38 mm 3 cilíndrico micro pocillos. Los resultados demuestran que un 3D laminado dispositivo basado en el papel de grafeno puede ilustrar firmas dielectroforéticas similares como dispositivos de laminado de hoja metálica 3D 20, 21, tradicional 2D de metal-electrodo 26, 27, y los dispositivos aisladores 2D 25. En los siguientes experimentos, se aplicó una señal de CA 15 V pic...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este manuscrito detalla los protocolos para fabricar una capa de grafeno novela 6 y 5 capas de cinta microdispositivo. Además, el funcionamiento del dispositivo se ilustra a través de los comportamientos observados DEP de 6,08 m perlas de poliestireno junto con un enfoque de análisis de velocidad de la partícula única, geométricamente relevante. Este enfoque versátil para construir dispositivos electrocinéticos no lineales es menos costoso que el electrodo y técnicas de microfabricación capa de fluidos, mientr...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos a revelar.
Agradecimientos
Gracias a las Ciencias XG de generosas donaciones de papel de grafeno. Gracias al Dr. C. Friedrich para generosamente dejarnos usar el equipo de micro-perforación. Un agradecimiento especial se extiende a Tayloria Adams para narrar el video.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
Referencias
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. O. S., Hoettges, K. F., Wattingham, R. Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -H., Cheng, I. F., Chang, H. -C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados