Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El Sistema Swimmeret de cangrejo de río: Una guía práctica para la disección del cordón nervioso y extracelulares Grabaciones del patrón motor
En este artículo
Resumen
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Resumen
Aquí se demuestra la disección del nervio espinal cangrejos abdominal. La preparación comprende los dos últimos ganglios torácicos (T4, T5) y la cadena de ganglios abdominal (A1 a A6). Esta cadena de ganglios incluye la parte del sistema nervioso central (CNS) que impulsa la locomoción coordinada de los pleópodos (swimmerets): el sistema swimmeret. Se sabe desde hace más de cinco décadas que en los cangrejos cada swimmeret es impulsada por su propio núcleo generadores de patrones independiente que genera la actividad rítmica alternancia 1-3. Las neuronas motoras que inervan la musculatura de cada swimmeret comprender dos anatómica y funcionalmente distintas poblaciones 4. Uno de ellos es responsable de la retracción (carrera de potencia, PS) de la swimmeret. El otro impulsa la prolongación (carrera de retorno, RS) de la swimmeret. Las neuronas motoras del sistema swimmeret son capaces de producir espontáneamente un patrón motor ficticio, que es idéntico al patrón grabado en vivo 1.
El objetivo de este informe es dar a conocer una interesante y conveniente sistema modelo para el estudio de las redes y la coordinación de los microcircuitos independientes para prácticas de laboratorio de los estudiantes de generación de ritmo. El protocolo previsto incluye paso a paso las instrucciones para la disección del cordón nervioso abdominal del cangrejo de río, el fijar de la cadena de aislados de ganglios, desheathing los ganglios y registrando el patrón motor ficticio swimmerets extracelular del sistema nervioso aislado.
Además, podemos controlar la actividad de las neuronas swimmeret registrados intracelularmente a partir de las dendritas. Aquí también se describe brevemente estas técnicas y proporcionamos algunos ejemplos. Además, la morfología de las neuronas swimmeret se puede evaluar usando varias técnicas de tinción. Aquí proporcionamos ejemplos de intracelular (por iontoforesis) tinte lleno neuronas y rellenos de grupos de neuronas motoras swimmeret. En nuestro laboratorioutilizamos esta preparación para estudiar las funciones básicas de locomoción ficticia, el efecto de la retroalimentación sensorial sobre la actividad del SNC, y la coordinación entre los microcircuitos en un nivel celular.
Introducción
Los swimmerets de cangrejos de río tienen una función en el control de la postura y la golpeaban rítmicamente cuando los animales nadan hacia adelante, ventilar sus madrigueras o hembras airean sus huevos 5, 6. Los swimmerets del cangrejo señal, Pacifastacus leniusculus, ocurren en pares de la segunda a la quinta segmento abdominal, con una extremidad a cada lado del abdomen 7. El sistema nervioso central produce en su propia el golpeteo rítmico motor que impulsa el movimiento swimmeret en el animal intacto, así como en la preparación cordón nervioso aislado. Cuando no hay retroalimentación sensorial o de entrada presente descendente el patrón motor rítmico producido se llama la locomoción ficticia 1, 2. En el sistema swimmeret este patrón motor no difiere en cualquier parámetro de la actividad de los swimmerets medidos en el animal intacto.
El movimiento de cada swimmeret es accionado por un microcircuito que se encuentra en y limitado a un corresponding hemiganglion 1 -. 3 En cada microcircuito hay un kernel generadores de patrones que se compone de cinco interneuronas no enriquecidas identificados. Pueden caracterizarse funcionalmente como siendo Inhibidor de Power Stroke (IPS) o inhibidor de la carrera de retorno (IRS) 8. Estos IPS y interneuronas IRS no son osciladores endógenos, en lugar de su actividad alterna es impulsado por la inhibición recíproca 9. Debido a que estas interneuronas inhiben directamente las neuronas motoras swimmeret, la alternancia PS-RS movimiento se genera 10. Locomotion sin embargo, no sólo requiere la generación de actividad, sino también la coordinación de los diferentes microcircuitos independientes. En el sistema swimmeret dicha coordinación es establecida por el microcircuito de coordinación que asegura que las extremidades son activos en tiempos correctos. Este microcircuito es construido por tres neuronas identificadas en cada segmento de 11 a 15.
Este protocolo prevé ªe primera vez una guía disección paso a paso para aislar la cadena de ganglios (T4 a A6, Figura 1). Mostramos cómo la clavija del cable aislado nervio abdominal y desheathe cada ganglio. En este aislado de preparación del sistema nervioso, las neuronas responsables del movimiento swimmeret están listos para su uso en experimentos electrofisiológicos y morfológicos. La segunda parte de este protocolo demuestra las principales características del patrón motor swimmeret. Esto incluye una guía paso a paso para grabar extracelularmente la actividad de las neuronas motoras swimmeret. Los axones de las neuronas motoras RS proyectan a través de la rama anterior del nervio N1, mientras que los axones de las neuronas motoras PS proyectan a través de la rama posterior del mismo nervio (Figura 1) 4. Por lo tanto su actividad se puede grabar a partir de estas ramas con electrodos diferenciales pines.

Figura 1: Aislado sistema nervioso de ganglio torácico 4 (T4) para ganglio abdominal 6 (A6) y un diagrama esquemático de que T4:. Ganglio torácico 4; T5: ganglio torácico 5; A1, A2 ... A6 ganglio abdominal 1, el ganglio abdominal 2 ... ganglio abdominal 6; N1: nervios N1; N2: nervio N2; N3: nervio N3; PS: el poder de carrera; RS: vuelta de carrera. Abreviaturas direccionales: A = anterior; P = posterior.
Este procedimiento de disección y la técnica electrofisiológica demostrado son convenientes para los estudiantes de pregrado y pueden complementar los cursos prácticos de los estudiantes en la fisiología. La cadena aislado de los ganglios se ha utilizado en una serie de experimentos para estudiar la función del sistema nervioso, la coordinación, o modulación de microcircuitos swimmeret 6 así como el control neuronal de la conducta adaptativa en la locomoción 16, 17. Así, el sistema swimmeret cangrejo de río proporciona una cantidad enorme de la enseñanza interesante o tllover las oportunidades que todos comienzan con la disección del cordón nervioso ventral de cangrejos de río y registro extracelular del patrón motor ficticio.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este procedimiento de disección está de acuerdo con las Comunidades Europeas Directiva del Consejo de 22 de septiembre de 2010 (2010/63 / UE).
1. Preparación
- Obtener cangrejos, Pacifastacus leniusculus (Dana), de ambos sexos ≥8 cm de tamaño. Asegúrese de que los animales son vitales y las extremidades y abdomen abdominales están intactos.
- Tenga cuidado para inspeccionar el caparazón y que esta cutícula es duro y rígido. Antes y animales postmuda tienen un caparazón suave y no son adecuados para los experimentos debido a que durante el proceso de muda muchos parámetros cambian (por ejemplo, disminución de la actividad locomotora).
- Ensamblar todas las herramientas y materiales utilizados durante la disección, alfileres y desheathing del cordón nervioso se muestra en la Figura 2 y que figuran en los suplementos suministrados.

Figura 2: Materiales y herramientas utilizados para la disección, alfileres y desheathing del cordón nervioso.
(1) gran cubo lleno de hielo; (2) solución salina cangrejos; (3) dispensador de solución salina; (4) microscopio de disección; (5) plato de disección; (6) tijeras fuertes; (7) pinzas (8) tijeras de primavera; (9) caja de Petri llena de Sylgard claro; (10) pernos de fijación; (11) fuente de la lámpara fría.
2. Bruto Disección
- Anestesiar a los animales en hielo durante 15 - 20 min. Llevar a cabo la primera parte de la disección bruto a un banco de laboratorio cerca del fregadero, ya que incluye un paso exanguinación y la muestra necesita ser enjuagado regularmente con solución salina cangrejos de río durante el procedimiento.
- Sostenga la parte ventral de los animales y utilizar tijeras fuertes para cortar las dos garras en sus bases cerca de tórax (Figura 3-1). Retire urópodo izquierda y derecha (Figura 3-2).
- Coloque la cara ventral de los animales en el plato forrado con disección Sylgard negro. Elevate cefalotórax mediante la inserción de hielo debajo y precisar el abdomen en el telson (Figura 4A).
- Llene el depósito de solución salina con ~ 60 ml de solución salina enfriada cangrejos. Perfundir cangrejos con solución salina fría a través de la apertura de la garra (Figura 4B). El exceso de solución salina se escurra a través de los cortes en los urópodos. Cubrir los cangrejos con hielo durante desangramiento
- Decapitar al animal con un único corte transversal justo por detrás de los ojos del animal con unas tijeras fuertes (Figura 5A). Retire todos piernas para caminar cerca de las articulaciones de base como se indica en la figura 5B.
- Aislar el abdomen con los últimos segmentos torácicos desde el resto de la cephalothorax. Hacer un primer corte en el nivel de las segundas patas para caminar (segmento torácico 3) mediante la inserción de la punta de las tijeras en la abertura de la segunda pata caminar y de corte hacia el lado opuesto. (Figura 6A-1).
- Extender este primer corte a ambos lados a través de tque cefalotórax (Figura 6A-2).
- Voltear el animal abierta para que algunos de los órganos internos visibles. Empuje la glándula digestiva prominente (Figura 6B-3) a la parte anterior de la muestra y el uso de fórceps para retirar los órganos reproductivos de la cavidad abdominal.
- Retire la parte anterior del cefalotórax (Figura 6C). Utilice cortes laterales para eliminar las partes laterales del caparazón, que cubren las branquias, en ambos lados del tórax restante (Figura 6D-4). Retire las branquias y enjuague la muestra con solución salina fría.
- Continuar la disección con un corte a través de toda la longitud de la placa esternal como se indica en la Figura 6E-5. Hacer este recorte en las posiciones laterales máximas entre Pleurón y swimmerets (Figura 6E marcas rojas). Proceder en el otro lado con un mismo corte. Enjuagar la muestra con solución salina fría.
- Llevar a cabo la disección restante bajo un dissection microscopio. Coloque el lado ventral del abdomen de los cangrejos de río arriba en el plato de la disección forrado con Sylgard negro y lleno con solución salina cangrejos de río de modo que cubra la muestra.
NOTA: Los siguientes pasos (02.12 a 04.08) contiene instrucciones direccionales que se aplican a los experimentadores diestros. En los siguientes pasos (02.12 a 06.08) es importante para reemplazar salina cangrejos en intervalos regulares, cada 20 a 30 minutos con solución salina fría, para mantener el sistema nervioso saludable. - Fijar la muestra con alfileres de insectos posteriormente en el telson y anterior a los restos del caparazón. Coloque la muestra de forma que los puntos de Telson a la izquierda y es paralelo al borde de la mesa.
- El uso de fórceps gruesas en la mano izquierda para agarrar a través de una abertura de la pierna para caminar (Figura 7A) y tire de la muestra abierta (flecha blanca Figura 7B). Identificar los grandes dos cadenas musculares flexor dorsal (Figura 7B-1 y C-1) y reducir su ventralbase como se muestra en la Figura 7B.
- Identificar la arteria esternal (Figura 7C-2), que desciende del dorsal (el corazón) a ventral, en el segmento torácico 4º. Esta arteria se encuentra justo por encima del cordón nervioso (Figura 7C-3), antes de que se proyecta bajo el cordón nervioso, formando la arteria ventral.
- Seccionar la arteria esternal. Como se demuestra en la Figura 7C, levante la arteria primero, utilizando una cuchilla de las tijeras, y sólo cortar cuando el cordón nervioso ventral situado es visible.
- Fijar los músculos flexores dorsales anterior (a la derecha). Esto debe hacerse con la máxima posición estirada con alfileres para que no se bloquee la visión y la muestra permanece en tensión. Cuando las fibras musculares se fijan dorsal (Figura 8-1), el primero de los ganglios abdominal, A1 y A2, con los nervios asociados N1, N2, y N3 son visibles (Figura 8).
- El uso de fórceps en la mano izquierda para agarrar la especificaciónimen en una abertura de las piernas para caminar. A lo largo de los siguientes pasos disección tire suavemente para mantener la muestra abierta.
- Seccionar los nervios N3 en la posición más distante del cordón nervioso. (Figura 8-3).
- Cortar los músculos flexores cerca de la apodema ventral como se muestra en la Figura 8-4. Tenga cuidado de no dañar el cable de los nervios o la N2 nervios.
- Repita los pasos de 2,18 y 2,19 para la N3 nervios y los músculos flexores de los restantes abdominal ganglios A2 a A5.
- En el último ganglio abdominal, A6, cortar los músculos flexores dorsales del apodema ventral y el espécimen debe verse como se muestra en la Figura 9.
- Cortar la placa posterior del esternón a los nervios del A6 (Figura 9-1) y mantener la parte ventral (Figura 9-2). Deseche la parte dorsal con los músculos flexores (Figura 9-3). Fije la placa esternal anterior con alfileres en las aberturas de las piernas para caminar,y posteriormente a A6.
3. fina disección
- Coloque la muestra bajo el microscopio con la parte anterior dirigida lejos y la parte posterior hacia el borde de las tablas.
- El uso de fórceps, como se muestra en la Figura 10A para eliminar las partes más anteriores de la sterna cefalotórax.
NOTA: Los ganglios torácicos y nervios asociados están parcialmente cubiertas por la musculatura de la pierna y sterna cefalotórax. El sterna cefalotórax formar un esqueleto que separa las cavidades situadas lateralmente de las piernas para caminar unos de otros y de la cavidad medial en el que reside el cordón nervioso ventral. - Cortar los músculos entre las estructuras exoesqueléticas restantes tal como se indica en la Figura 10B -1 y B2. El uso de fórceps para agarrar y levantar la parte anterior del cordón nervioso ventral (Figura 10C).
NOTA: El cordón nervioso será dañado en el proceso para evitar la captación de la nerve cable varias veces. - Cortar los nervios torácicos lateralmente mientras levanta el cordón nervioso (Figura 10C-3). Mantenga estos nervios en longitud adecuada para la fijación. Quitar la parte exprimido de la cadena de ganglios, que fue recogido con una pinza, cortando todo el tejido anterior a la T4 (Figura 10C-4).
- Coloque la muestra con la parte anterior a la izquierda y se centran en A1. Cortar la N1 y N2 nervios de A1 en una longitud adecuada (máx. 1 cm) para fijar a cabo.
- Concéntrese en A2 e identificar los nervios N1, N2, N3 y de este segmento (Figura 11). Los nervios N1 de ganglios abdominal A2-A5 residen entre dos repliegues cuticulares esternales en cada segmento (Figura 11A-1) y están cubiertos por la musculatura. Haga un corte a lo largo de la invaginación cuticular esternal posterior. Comience en el borde lateral del abdomen y proceder hacia la línea media, como se muestra en la Figura 11A.
- Si el objetivo sigue siendo N1 calarojo con el tejido como se muestra en la Figura 11B (flecha roja), corte a través del haz muscular, pero esta vez anterior a los dos repliegues cuticulares esternales y el nervio N1 (Figura 11B-2).
- Cortar N1 nervio lo más distante posible (Figura 11 C-3). Nervio N1 es totalmente visible y la rama anterior y posterior se puede identificar (Figura 11C).
- Proceder a la N1 nervio contralateral y primero cortar los músculos a lo largo de la invaginación cuticular esternal posterior, comenzando medialmente, cerca del ganglio (Figura 11D). Si el nervio está todavía cubierta por el tejido, corte a través del haz muscular, pero esta vez anterior a los dos repliegues cuticulares esternales y el nervio N1, similar a la figura 11B-2. Cortar la N1 nervio lo más distante posible.
- Cortar los nervios N2 de este ganglio a una longitud adecuada (aprox. 0,5 cm) para la fijación.
- Repita los pasos 3.7 a 3.11 para los nervios de A3-A5.
- Cortar el nerves de ganglio A6 lo más distante posible (Figura 12A). El uso de fórceps para agarrar múltiples nervios de A6 a levantar este ganglio y empezar a aislar la cadena de ganglios de la placa esternal.
- Mientras levanta el cordón nervioso, tire de ella suavemente en la dirección anterior como se demuestra en la figura 12B (flecha blanca). A medida que se levantaron los ganglios individuales, retire la arteria ventral que puede ser instalado en la parte ventral del cordón nervioso (Figura 12C). Continúa esta secuencia (suavemente) cortar pull-hasta que el cordón nervioso está completamente aislado.
- Transferir la cadena aislada de ganglios a una placa de Petri llena de Sylgard claro y lleno de solución salina cangrejos de río (Figura 12D).
4. Fijación del cordón nervioso en la placa de Petri
NOTA: Utilice pequeños pasadores cortados de alambre de acero inoxidable (ver suplementos) para fijar el cordón nervioso. Toque sólo la terminación nerviosa con las pinzas y no hacer squeeze las conectivas o ganglios.
- Pin de la cadena de ganglios en línea recta, mientras que la aplicación suave estiramiento.
- Colocar el cable de nervio en la placa de Petri con el lado dorsal hacia arriba (Figura 13, línea negro). El lado ventral de los ganglios puede ser identificado por su convexidad; el lado dorsal es plana. Pin de los nervios torácicos a los lados. Continuar con los nervios de A6, estirando la cuerda nerviosa largo de su eje longitudinal.
- Pin los nervios de A1 en un ángulo de 90 ° en relación con el cordón nervioso.
- Continúe con el A2 y el pin de la N2 nervios en un ángulo de 35 a 45 ° en relación con el cordón nervioso (Figura 1).
- Separar los nervios N1 en sus ramas anterior y posterior antes de fijar como se demuestra en la Figura 14. Utilice dos pares de pinzas finas para recoger con un par de pinzas de la anterior y con la otra la rama posterior del nervio N1. Tenga cuidado al elegir sólo el extremo más distals de las ramas del nervio. Ahora tire cuidadosamente separados.
- Pin de la rama anterior de la N1 nervio en un ángulo de 90 ° con respecto al cordón nervioso (Figura 1A). Pin de la rama posterior del nervio N1 entre la rama N1 anterior y el nervio N2.
- Repetir el 4.4 hasta 4.6 pasos por los nervios de los ganglios A3-A5. Si bien fijando el tramo cordón nervioso en longitudinal, así como las direcciones transversales.
5. Desheathing los ganglios
- Coloque la preparación de tal manera que las manos del experimentador siempre están descansando en un plano estable para evitar la agitación. Con el fin de desheath los ganglios iluminan el cordón nervioso desde abajo.
- Concéntrese en cualquier ganglio abdominal A1 a A5. Con unas tijeras finas primavera para hacer un pequeño corte lateral a través de la vaina del ganglio, posterior al ganglio y entre los nervios N2 y N3 (flecha roja Figura 15A).
- Recoge la vaina ganglio usando muy ffórceps INE y cortan transversalmente a través de la vaina por encima de los conectivos, como se indica en la figura 15A-1. Tenga cuidado de no apretar o cortar el cordón nervioso con las tijeras.
- Todavía sostener y levantar la vaina ganglio con pinzas siguen a cortar a lo largo de los bordes laterales del ganglio (Figura 15B-2 y -3). Retire la funda. Alternativamente fijarlo a ambos lados de las conectivas de tal manera que se fija el cordón nervioso pero no se aprieta.
- Repita los pasos 5.2 a 5.4 para todos los ganglios de A1 a A5 abdominal.
- Desheathe los ganglios torácicos y el ganglio A6 de una manera similar. Para desheathe A6 inicio anterior al ganglio y proceder en dirección posterior. Pin de la vaina de ganglio A6 al extremo posterior de la cadena de ganglios.
6. extracelular Grabaciones de neuronas motoras
- Ensamblar todas las herramientas y materiales utilizados para las grabaciones extracelulares mostrados in Figura 16B y que figuran en los suplementos. Una visión general de la configuración de la grabación se muestra en la Figura 16A. Iniciar todo el equipo electrónico utilizado en este experimento (Figura 16C), de manera que los amplificadores pueden calentarse durante al menos 30 min antes de la grabación. Encienda el ordenador e inicie el software de grabación.
- Coloque la cadena de ganglios en la mesa microscopio e iluminar desde abajo. Insertar el electrodo de registro en el Sylgard cerca del nervio objetivo y el electrodo de referencia en una posición cercana, pero lateral a los ganglios (Figura 17A y B). Doble el nervio objetivo alrededor del electrodo de registro (Figura 17C).
- Estire el nervio ligeramente, para asegurar el contacto entre el electrodo y el nervio y el pin en el lado (F igura 17D). Fijar los cables de los electrodos a la mesa microscopio usando arcilla, para que se mantengan en la posición deseada.
- Utilice unjeringa llena de vaselina y una aguja de calibre 20 (con punta redondeada) (Figura 17E-3) para aislar el nervio objetivo de la solución de baño. Primero aplique un poco de vaselina en el Sylgard alrededor del electrodo de registro. El resultado es una capa de vaselina que cubre el Sylgard en la proximidad del electrodo de registro (Figura 17E-4). Tenga cuidado de no frotar directamente sobre el nervio y evitar las burbujas de aire en esta capa.
- Sellar el electrodo de registro con vaselina desde todos los lados hasta el nivel de la superficie de la solución salina (Figura 17F).
- Repita este procedimiento para todos los nervios de destino cuya actividad debe ser monitoreado.
- Inicie la grabación. Use un modo de adquisición libre continua o hueco y una frecuencia de muestreo de 5 kHz. Ajuste el amplificador extracelular a los siguientes parámetros; ganar para 1000 (amplifica la señal de 1.000 veces, tener cuidado de incluir este parámetro amplificación en la configuración del software de adquisición) unda gama de filtros de paso de banda de 300 Hz (corte bajo) a 2000 Hz (corte alto).
Access restricted. Please log in or start a trial to view this content.
Resultados
Con las grabaciones extracelulares simultáneas de RS y PS, las neuronas motoras de un ganglio, la actividad alterna de estos conjuntos de neuronas motoras, se puede controlar (Figura 18), lo que representa el patrón de locomoción ficticia.
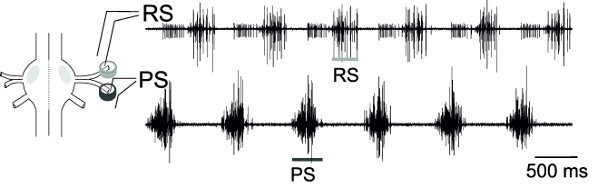
Figura 18: Esquema de un ganglio y la colocación del electrodo de patilla diferencial registro extracelular de RS neuronas motoras (trazo...
Access restricted. Please log in or start a trial to view this content.
Discusión
La anatomía del cangrejo de río y su ganglio abdominal se ha descrito anteriormente 5, 18, 19, 20 y se recomienda para familiarizarse con ellos antes de la disección para evitar el corte de nervios importantes.
Es fundamental para mantener la preparación a temperaturas inferiores a 23 ° C para evitar la degradación del cordón nervioso aislado. Esto se puede conseguir fácilmente mediante la sustitución de la solución de baño cada 20-30 min con solución salin...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Damos las gracias a Jos Burgert por ayudar con algunas de las figuras. Estamos muy agradecidos a Ingo Selbach (y el grupo "Edelkrebsprojekt NRW") por sus esfuerzos para suministrar el laboratorio con animales de experimentación. Damos las gracias a Anna C. Schneider para la corrección primeras versiones del manuscrito. Esta investigación fue apoyada por una beca SM Emmy Noether DFG 206 / 3-1 y una subvención de inicio de la Universidad de Colonia para la facultad femenina.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Referencias
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados