Method Article
Mínimo procedimiento quirúrgico invasivo de inducir infarto de miocardio en ratones
En este artículo
Resumen
A highly reproducible model for myocardial infarction in mice with minimal invasive manipulations is described. The model can be easily performed, resulting in a high reproducibility and survival rate. Thus, the described model will reduce the number of required animals as requested by the 3R principle (Replacement, Refinement and Reduction).
Resumen
El infarto de miocardio sigue siendo la principal causa de muerte en los países occidentales, a pesar de los considerables progresos en el área de desarrollo de stent en las últimas décadas. Para el esclarecimiento de los mecanismos subyacentes y el desarrollo de nuevas estrategias terapéuticas, la disponibilidad de modelos animales válidos son obligatorios. Puesto que necesitamos nuevos conocimientos sobre mecanismos patogénicos de las enfermedades cardiovasculares en condiciones in vivo para luchar contra el infarto de miocardio, la validez del modelo animal es un aspecto crucial. Sin embargo, la protección de los animales son de gran relevancia en este contexto. Por lo tanto, establecemos un modelo mínimamente invasivo y sencillo de infarto de miocardio en ratones, lo que asegura una alta reproducibilidad y la tasa de supervivencia de los animales. Por lo tanto, este modelo cumple con las exigencias del principio 3R (reemplazo, refinamiento y reducción) para los experimentos con animales y asegurar la información científica necesaria para su posterior desarrollo de estrategias terapéuticas para cardiovenfermedades ascular.
Introducción
El infarto de miocardio es una de las principales causas de muerte en los países industrializados. A pesar del progreso innegable de los enfoques diagnósticos y terapéuticos, las enfermedades cardiovasculares siguen siendo la principal causa de mortalidad. Dada la esperanza de vida mejorado y riesgos relacionados con la vida, se espera un aumento continuo de la incidencia de enfermedades cardiovasculares en el futuro. Por lo tanto, existe una fuerte necesidad de establecer y validar nuevos enfoques para el tratamiento de la enfermedad cardiovascular. La información de estudios en humanos sufren de sus limitaciones, estos estudios por lo general no son suficientes para explicar y entender los mecanismos a nivel molecular, siendo incapaz de dar soluciones a estos problemas de salud importantes.
Por otra parte, la investigación básica ha sido limitada debido a la complejidad y dificultad de reproducir los mecanismos de la enfermedad cardiovascular en el laboratorio. Por lo tanto, para aumentar nuestro conocimiento sobre la fisiopatología de cardioenfermedades vasculares, es esencial para validar modelos animales 1,2. Sin embargo, para identificar todas las cascadas de eventos moleculares implicados en la curación después de infarto de miocardio, el análisis en diferentes puntos temporales es necesario, causando un gran número de animales experimentos.
Experimentos con infarto de miocardio con frecuencia se realizan mediante el uso de modelos animales. La inducción de infarto de miocardio en animales pequeños 3-11 es el modelo más adecuado y eficiente empleado para investigar los eventos celulares y moleculares que los modelos animales grandes. Por otra parte, ninguna otra especie presenta la disponibilidad de cepas transgénicas o como ratones knockout 12. Estos modelos de ratón son muy útiles en otras enfermedades, incluyendo patologías cardiovasculares (tales como la aterosclerosis, la restenosis en stent) 13,14. Además, el período de embarazo de bajo y el alto número de progenie califican modelos de ratón como el sistema más atractivo para estudiar los mecanismos moleculares de INFA infartorction 12.
Sin embargo, el tamaño del corazón en ratones espera de alta precisión de la manipulación durante la microcirugía. La enseñanza de este personal de cirugía calificados y capacitados es un tiempo y proceso de trabajo intensivo. Por lo tanto, aquí presentamos un procedimiento de microcirugía detallada, incluyendo consejos y trucos para guiar colaboradores, incluso con calificaciones promedio, como los estudiantes o técnicos para llevar a cabo el complejo modelo de infarto de miocardio en ratones.
Inicialmente, la intubación se realiza por medio de una cánula corta sin utilizar la traqueotomía. La incisión torácica se encuentra en la zona intercostal, evitando la lesión de nervios o / y el tejido circundante. Esta sub-paso es de gran importancia para asegurar una rápida recuperación y la curación 15. La ligadura se hace diferenciado para los modelos de isquemia crónica y la isquemia / reperfusión, por una alta tasa de supervivencia mientras que todavía mantiene un tamaño significativo de miocardio. Nuestra experiencia muestra that usando sutura de seda asegura una reproducibilidad más alta en comparación con crio-lesiones 16.
En conclusión, el método aquí descrito es aplicable tanto en la isquemia crónica y modelos de isquemia / reperfusión en animales pequeños. Los trucos y consejos presentados en este procedimiento están destinadas a permitir que el personal con incluso bajo o promedio de calificación de aplicarlo en modelos animales pequeños.
Protocolo
NOTA: Los experimentos presentados en este trabajo se realizan de acuerdo al bajo alemán y de las directrices europeas para el cuidado de los animales. Los animales son criados en las instalaciones de los Animales de Laboratorio Instituto de Ciencia Animal, Universiy hospital de Aquisgrán, Alemania, bajo la supervisión del Prof. Dr. R. Tolba y el Dr. A. Teubner (encargado del bienestar animal).
1. Cuidado de Animales
- Mantenga los ratones en una unidad de atención especializada, asegurando el acceso adecuado a los alimentos y el control veterinario especializado y tratamiento. Si los animales se mueven o se compran fuera, por favor asegurar un semana antes de someterse al procedimiento.
2. La intubación
- Anestesiar 8-10 semanas de edad de sexo masculino C57BL / 6 ratones de tipo salvaje, 25-27 g mediante inyección intraperitoneal de 100 mg / kg de ketamina y 10 mg / kg de xilazina. Vigilar el nivel de anestesia por reflejos de pellizco del dedo del pie. Coloca un ungüento veterinario en los ojos para evitar la sequedad durante el procedimiento.
- Administrar terapia del dolor con subcutáneamente peso buprenorfina 0,1 mg / kg de peso corporal antes de iniciar el procedimiento quirúrgico, siguiendo las pautas de cuidado de animales de su institución.
- Asegurar el mantenimiento de condiciones estériles para evitar infecciones durante la cirugía mediante el uso de materiales e instrumentos estériles.
- Coloca el ratón anestesiado en posición supina sobre una mesa de cirugía climatizada. Eliminar el pelo de ambos área del cuello ventral y media izquierda del tórax usando una pequeña maquinilla de afeitar y desinfectar con alcohol al 70% antes de la incisión.
- Realice una pequeña incisión mediana de 0,5 cm utilizando tijeras de cirugía en el centro del cuello. Debajo de la piel, ir a través de los cuerpos grasos 2 con unas pinzas curvas estériles y visualizar la tráquea bajo microscopio estereoscópico a través de la transparencia de la cubierta muscular.
- Presentar oralmente la cánula de intubación en la tráquea bajo vista utilizando el microscopio estereoscópico (Figura 1). Distinguir la cánula de metal excelentes referenciasugh el tejido transparente. Y comprobar, la posición y ubicación durante la operación en cualquier momento (Figura 1B).
- Conectar la cánula para el pequeño ventilador para animales y ajustar la configuración de ventilación de acuerdo fabrica directrices (volumen corriente entre 100-150 l y una tasa de respiración entre 100-150 por minuto).
3. Infarto de Miocardio Inducción
- Realizar una incisión en la piel de menos de 0,5 cm en el medio de una línea entre xifoides y axila izquierda. El uso de fórceps para separar la capa muscular de las costillas subyacentes.
- Realice una pequeña incisión entre las costillas mediante el uso de una pequeña tijera hasta que la cavidad torácica se abre 17. Para miocardio crónico, realizar la incisión en el espacio intercostal 5 TH (Figura 1C) y / o para el modelo de isquemia / reperfusión, en el 4º espacio intercostal (Figura 1D): para un número enfoque más fácil desde debajo de la 2 ª y la 3 ª espacio intercostal, respectivamente).
- Coloque los retractores en la incisión para abrir la cavidad torácica y para visualizar el corazón.
- Retire con cuidado el pericardio para evitar procesos fibróticos excesivas.
- Visualice la arteria coronaria izquierda descendente (LAD) como un recipiente de color rojo claro profunda posicionado. Si el muchacho no se puede visualizar, considerar algunos puntos de referencia para aumentar la reproducibilidad.
- Para el modelo de miocardio crónico, coloque la ligadura en el centro de la parte ventral del corazón (entre la aurícula y el ápice), teniendo como referencia la vena como se muestra en la Figura 1C. Enlazar las dos ramas de la arteria mediante sutura de seda 0/7 para obtener una anterior y posterior de miocardio transmural. El color gris indica la posición de la ligadura y se puede repetir si es necesario (Figura 1C).
- Para isquemia modelo / reperfusión, coloque la ligadura bajo la aurícula, sobre el cuerpo principal de LAD (Figura 1D). El ligature se encuentra sobre un tubo de silicona para proteger la integridad de la vasija. El color gris indica la zona infartada y deberá aparecer en todo el corazón (Figura 1D). Coloque suturas temporales en las costillas durante el período de isquemia y humedecer usando una compresa para evitar la desecación de los tejidos. Después de la isquemia, retire el tubo de silicona y cortar la sutura con unas tijeras pequeñas para visualizar la reperfusión.
- Al lado de los anestésicos y analgésicos utilizados al principio del procedimiento (pasos 2.1 y 2.2), utilice 0,5% isoflurano durante la cirugía para asegurar el confort adecuado del animal, o seguir las instrucciones de cuidado de animales de su institución.
4. Sutura y Recuperación
- Eliminar el aire residual del tórax rellenando con una cálida solución salina isotónica.
- Cierre el tórax con 3 suturas 0/6 (como se muestra en la Figura 2A y 2B). Coloque las suturas medial en un ángulo de 90 °, para asegurar comocierre de las costillas ealed, como se muestra en la Figura 2 (Figura 2A, B).
- Cierre la capa muscular con 2 suturas (Figura 2C) y la piel con suturas 3-4 0/6 (Figura 2D). Realizar estas suturas por separado para obtener una ventana adecuada para su posterior medición ecocardiográfica.
- Desconectar la cánula de intubación desde el ventilador y permitir la respiración espontánea. Para la identificación después, marcar el ratón usando el sistema local (informarse con el encargado del bienestar animal de su institución).
- Establecer el ratón en la parte izquierda bajo la luz roja hasta que se despierte. No deje a un animal sin vigilancia hasta que se haya recuperado el conocimiento suficiente. No permita que un animal que ha sido sometido a una cirugía para estar en compañía de otros animales hasta que se recupere totalmente.
- Administrar el tratamiento del dolor con buprenorfina 0,1 mg / kg de peso corporal, por vía subcutánea durante los próximos 3 días, siguiendo las pautas de cuidado de animales de su institución.
5. Análisis de la infarto de miocardio
- Supervisar regularmente el funcionamiento del corazón por medio de la ecocardiografía (Figura 3): la fracción de eyección, fracción de acortamiento, el gasto cardíaco y las dimensiones del corazón.
- Anestesiar los animales usando inyección intraperitoneal de 100 mg / kg de ketamina y 10 mg / kg de xilazina. Confirmar anestesia adecuada antes de la cirugía por la falta de reflejos.
- Abra la cavidad torácica y extirpar el corazón, colocándolo en estéril lavado solución de PBS ampliamente la sangre restante.
- Si es necesario, recoger la sangre directamente del corazón, evitando la lesión de las regiones infracted, o después de la extracción del corazón, de la cavidad torácica.
- Después del lavado, se detiene el corazón en Diastola en solución KCl saturado (steril filtra 3M KCl en PBS). Para el análisis histológico fijar el corazón en 10% de formalina y proceder con el paso 5.7.
- Si es necesario, medir la viabilidad del cochecélulas diac por cloruro de tetrazolio Evans-Blue / Trifenil (TTC) tinción. Después de la reconstrucción de la ligadura en el lugar inicial, perfundir el corazón con 200 l 1% Solución Azul Evans utilizando una cánula aórtica y congelar el corazón de una pequeña bolsa de plástico a -20 ° C, sin lavar.
- Después de 2 horas, realice 5 diapositivas transversalmente utilizando un bisturí afilado y incubarlos durante 10-15 minutos en una solución de TTC a 37 ° C, según lo descrito por manufacturado. Fijar los portaobjetos durante 10 minutos en formol al 10% y los puso entre las diapositivas microscópicas para su posterior análisis.
- Insertar el tejido cardíaco en parafina, colocando el corazón en la punta, para realizar el seccionamiento transversal. Realizar la sección de serie de 5 micras. Recoge las primeras 20 secciones y deseche el próximo 300 micras. Continuar el protocolo sección hasta que se ha alcanzado el nivel de la válvula mitral (Figura 3A, B). Serial secciones, 400 micras aparte a lo largo de todo el corazón se recogen y se pueden teñir fo el análisis cualitativo y cuantitativo.
- Medir el tamaño del infarto mediante tinción 6-8 de un solo paso de Gomori.
- Analizar la angiogénesis, el contenido de colágeno o células reclutamiento inflamatorio en la sección de serie utilizando tinción inmunohistoquímico usual.
Resultados
El procedimiento de infarto de miocardio se produce dentro de 25 a 30 minutos y muestra una tasa de mortalidad del 10%. Después de la cirugía, los ratones se recuperan de la anestesia en los próximos 15 minutos. Sin impedimento físico se observó que el ratón funciona. Sin embargo, hay un mayor riesgo de ruptura del corazón una semana después de infarto de miocardio post-crónica, si los procesos de reparación son perturbados durante la fase inflamatoria. Desde el corazón es capaz de cambiar significativamente sus dimensiones durante el bombeo, es importante para todos los corazones recogidos para ser detenidos en la misma posición, por ejemplo en Diastola. Esto se puede lograr por perfusión del corazón con una solución de KCl saturado. Aumento de bloques concentración extracelular de K + de las bombas iónicas, disminuye el potencial de reposo de membrana de las células cardíacas, resultando en una detención de la actividad cardiaca diastólica.
El área de infarto se puede ver en el análisis de ultrasonido (Figura 3A, panel inferior). En comparación conel miocardio normal, regiones isquémicas aparece delgada y hipocinética (Figura 3A, panel superior). Dependiendo del modelo utilizado, el tamaño del infarto será diferente. El modelo de infarto de miocardio crónico induce circular, transmural del ápice (Figura 3B), mientras que la isquemia / reperfusión induce un, medio de pared delgada y a lo largo de todo el corazón (Figura 3C). Hay muchos métodos para determinar el tamaño del infarto. Si el objetivo es analizar el efecto directo sobre la viabilidad cardiaca, un Evans-Blue / TTC tinción 18 está indicado para ser realizado por lo menos 2 horas después de la reperfusión, para ser capaz de ver cualquier cambio en el miocardio. Las secciones pueden ser analizados inmediatamente (Figura 3B, panel central) después de teñir o se pueden mantener entre portaobjetos de vidrio en formalina durante 2-3 días (Figura 3C, panel central). La zona azul representa el miocardio sano, no se ve afectado por la isquemia. El área roja representa el miocardio viable dentro ªe área isquémica (miocardio riesgo), y el área blanca representa el tejido muerto. Por lo general, el tamaño del infarto se expresa como porcentaje de la zona de riesgo.
La cicatriz madura resultante después de la remodelación de procesos se puede medir fácilmente por immunohistolgy mediante la tinción de un solo paso de Gomori. Zonas azules manchados infartados y manchadas de rojo saludables ventriculares (Figura 3B y C, paneles de la derecha) se determinan en la primera sección de cada nivel hasta que la válvula mitral. Para evitar la variación debido a la unión de LAD a diferentes niveles, el infarto de toda la sección se considera y se expresó como un porcentaje del volumen ventricular izquierda total. Un volumen de infarto de 15-20% en el modelo de miocardio crónico y de 10-15% después de modelo de isquemia / reperfusión se puede lograr. Además, el modelo de miocardio crónico induce una dilatación acentuada, no se observa en el modelo de isquemia / reperfusión (Figura 3B y C right panel).
Procedimientos de tinción convencionales pueden ser utilizados, tales como: la tinción de CD31 utilizado para revelar la angiogénesis (rojo, Figura 4A) o tinción de actina de músculo liso para determinar miofibroblastos (verde, Figura 4B). Doble tinción de fluorescencia también se puede aplicar para identificar moléculas diana diferentes en el área de miocardio, ya que la ausencia de los cardiomiocitos no da ninguna auto-inmunofluorescencia (Figura 4C).
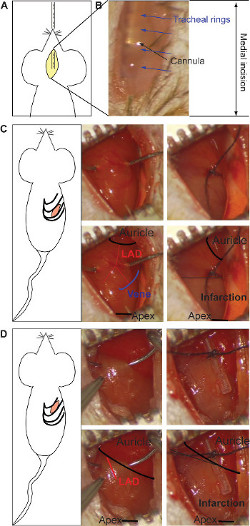
Figura 1: Incisión medial y la inserción de la cánula de la intubación (A). La visualización estereomicroscópica de la cánula de metal a través de la transparencia del tejido (B). Los anillos traqueales (flechas azules) y la cánula (flecha negro) se señalan. La incisión intercostal para el mes de miocardio crónicodel y la ligadura de LAD (C). La ligadura se encuentra en medio del corazón (entre la aurícula y el ápice, negro en el panel inferior), tomando como referencia el extremo de la vena (esquemática en azul, panel inferior). Ambas ramas de la arteria deben estar unidos (rojo en el panel inferior). El color gris indica área infartada y aparece en la parte media inferior del corazón (panel inferior derecho). La ligadura para el modelo de isquemia / reperfusión se realiza bajo la aurícula, la unión del cuerpo principal de LAD (rojo en el panel inferior) sobre un tubo de silicio (lado derecho) (D). El color gris indica el área infartada, que está presente en todo el corazón (panel inferior derecho). Por favor, haga clic aquí para ver una versión más grande de esta figura.
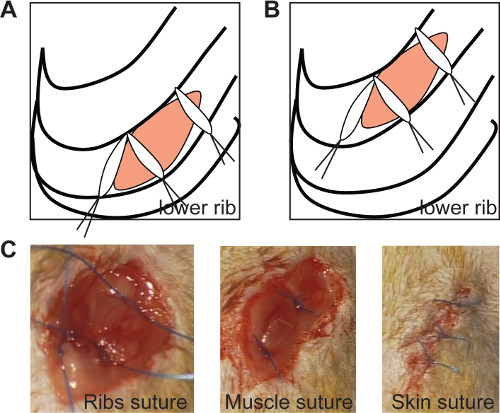
Figura 2: Los sellos de sutura la incisión torácica costillas si las suturas mediales están posicionados en un ángulo de 90 ° en tanto crónica (A) y la isquemia / reperfusión modelo (B, panel izquierdo). En vivo de imágenes de las costillas de sutura (C, panel izquierdo ), sutura muscular (C, panel central) y la sutura de la piel (C, panel derecho). Haga clic aquí para ver una versión más grande de esta figura.
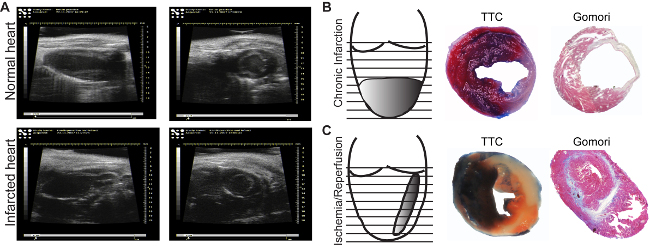
Figura 3: imágenes ecocardiográficas. Imágenes de normal (A, panel superior) y áreas infartadas (A, panel inferior), se adquieren en el eje largo (longitudinal, paneles de la izquierda) o en el eje corto (transversal, paneles de la derecha) .. miocardio inducido por ligadura crónica(B) y por una isquemia hr seguido por reperfusión (C). Evans Blue / TTC de tinción permite la identificación de perfundido (azul) / áreas no perfundido, así como la viable (rojo) / (blanco) miocardio muerto (B, C, paneles de media). Tinción de un solo paso de Gomori permite la identificación de las zonas infartadas (Azules), y los diferencia de las regiones normales (rojo) (B, C, paneles de la derecha). Por favor, haga clic aquí para ver una versión más grande de esta figura.
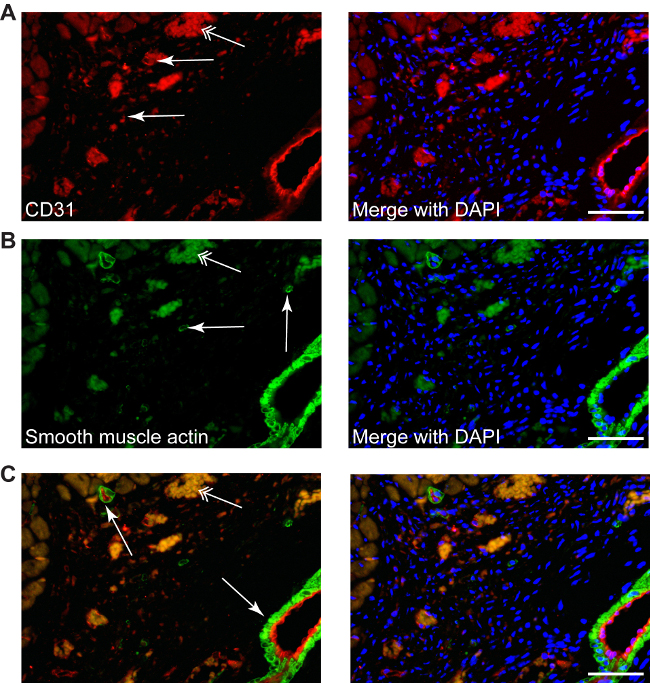
Figura 4: diferentes coloraciones se pueden realizar en la zona infartada, como se describe a CD31 neo-angiogénesis (A, simples, flechas rojas), o actina de músculo liso para miofibroblastos (B g,reen, flechas simples), así como doble tinción (C, CD31-rojo / verde-actina del músculo liso), contratinción con DAPI para los núcleos (azul). Los miofibroblastos se pueden diferenciar fácilmente de las células del músculo liso de las arterias pequeñas o grandes, que siempre van acompañados de una capa endotelial (C, flechas). Flechas dobles indican la autofluorescencia eritrocitos. Escala de barras de 50 micras.
Discusión
Durante el procedimiento, hay algunos puntos críticos que se destacaron: la intubación, la apertura de la cavidad torácica y la ligadura LAD. El primer paso fundamental es la intubación del animal antes experiements. Muchos grupos están utilizando un soporte vertical para la fijación del ratón y una fuente de luz para insertar la cánula directamente en la tráquea. Este método tiene la incertidumbre relativa a la correcta inserción de la cánula en la tráquea y es el más propenso al fracaso por los novicios. Realización de una pequeña incisión, la posición de la cánula puede ser controlada durante toda la maniobra, lo que disminuye la tasa predeterminada. Por otra parte, la traqueotomía es superada, disminuyendo así las complicaciones y reducir el tiempo de operación.
El siguiente paso fundamental es la apertura de la cavidad torácica. La esternotomía media representa una maniobra de alto riesgo retrasar la recuperación de los animales. La incisión lateral izquierdo que implica el corte de 2-3 costillas 15 , conduce a la recuperación deficiente y aumento de la mortalidad. Se utilizó en el modelo de incisión pequeña, discreta entre las costillas que ofrecen carga mínima. Los animales se recuperan muy rápidamente después de la cirugía y no lo hacen defectos presentes o curación perturbado. El espacio inter-costal inferior se toma como punto de referencia. Teniendo en cuenta esto, el acceso adecuado y diferenciado al lugar de ligadura crónica e isquemia / reperfusión modelo, no plantea problemas serios.
La ligadura en sí representa el paso más crítico. La arteria coronaria descendente izquierda es difícil de ser visualizado, y a menudo necesita ser consolidado sin vista. Por lo tanto, algunos puntos de referencia anatómicos se señalan para ayudar al cirujano para realizar la ligadura correcta. Para el modelo de miocardio crónico, la ligadura se coloca en el centro de la parte ventral del corazón, entre la aurícula y el ápice, sobre el final de la vena principal anterior (Figura 2B). La eficiencia se puede controllena mediante la visualización de la aparición del color gris en las zonas afectadas. Si el área infartada aparece anterior y no incluye la pared posterior, una nueva sutura puede ser colocado a la izquierda de la primera sutura. La raíz principal de LAD es siempre visible bajo la aurícula 18, y por lo tanto no presenta serios problemas en la detección de esta parte. Sin embargo, la aurícula presenta el mayor riesgo de sangrado y debe ser manejado con cuidado.
El procedimiento está limitado por la existencia de un equipo apropiado. Un ventilador y sistema de anestesia apropiada para los animales pequeños son caros y requieren conexiones a gas y sistema de ventilación de la habitación. Además, una estrecha supervisión de los animales es necesario en la primera semana después del procedimiento para detectar la posible clínico. Para examinar la función del corazón durante el experimento, se requieren de alta resolución de ultrasonido, complejo sistema de perfusión Langendorf, o pequeñas mediciones catéter intraventricular, involving altos costos y experiencia adicional.
Teniendo en cuenta el infarto de miocardio, no hay métodos alternativos disponibles para reproducir la complejidad de los eventos in vitro. Dependiendo del punto de interés, ex vivo de perfusión de un corazón aislado en el sistema de Langendorff proporciona información sobre la contractilidad, la función del corazón y de la viabilidad miocárdica en respuesta a diferentes estímulos o drogas. Sin embargo, se excluyen todas las interferencias de componentes de la sangre y el sistema inmunológico, y no está indicada para largos estudios de remodelación y la curación después de un infarto de miocardio.
Después de realizar el procedimiento de infarto de miocardio, todos los demás análisis funcional se puede llevar a cabo, como mediciones de la presión intraventricular, ultrasonido (sistemas de ultrasonido pequeño de animales) o corazón aislado de Langendorff-perfusión. Por otra parte, todos los análisis biológica y molecular se puede realizar para identificar las células, proteínas, ARNm, microRNAs, genes u otros biomarcadores, que se pueden utilizar como dianas terapéuticas para desarrollar nuevas estrategias de tratamiento para el infarto de miocardio.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by Interdisciplinary Centre for Clinical Research IZKF Aachen (junior research group to E.A.L.) within the faculty of Medicine at RWTH Aachen University. We are grateful Dr. Rusu and Ashley Christina Vourakis for critical review of the manuscript and Mrs. Roya Soltan for the professional help with immunohistochemistry staining.
Materiales
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | |
| Mouse ventilator | Harvard Apparatus | 730043 | Model Minient 845 |
| Dual Anesthesia System (Tabletop Version) | Harvard Apparatus | Selfcontained isofluranebased anesthesia unit for use on lab tables, with a compact 8" x 11" footprint. | |
| Intubation cannula | Harvard Apparatus | 732737 | |
| Forceps | FST, Germany | 9119700 | standard tip curved 0.17 mm x 0.1 mm |
| Scissors | FST, Germany | 9146011 | straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| Retractors | FST, Germany | 1820010 | 2.5mm wide |
| Retractors | FST, Germany | 1820011 | 5 mm wide |
| Wire handles | FST, Germany | 1820005 | 10 cm |
| Wire handles | FST, Germany | 1820006 | 14 cm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Silicon tube | IFK Isofluor, Germany | custommade product | diameter 500 µm |
| section thickness 100 µm | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| Ultrasound | Vevo, Canada | 770 Vevo |
Referencias
- Liehn, E. A., Postea, O., Curaj, A., Marx, N. Repair after myocardial infarction, between fantasy and reality: the role of chemokines. J Am Coll Cardiol. 58 (23), 2357-2362 (2011).
- Liehn, E. A., Radu, E., Schuh, A. Chemokine contribution in stem cell engraftment into the infarcted myocardium. Curr Stem Cell Res Ther. 8 (4), 278-283 (2013).
- Alexander, S., et al. Repetitive transplantation of different cell types sequentially improves heart function after infarction. J Cell Mol Med. 16 (7), 1640-1647 (2012).
- Liehn, E. A., et al. Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion. Arterioscler Thromb Vasc Biol. 33 (9), 2180-2186 (2013).
- Liehn, E. A., et al. Ccr1 deficiency reduces inflammatory remodelling and preserves left ventricular function after myocardial infarction. J Cell Mol Med. 12 (2), 496-506 (2008).
- Liehn, E. A., et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol. 56 (22), 1847-1857 (2010).
- Liehn, E. A., et al. Double-edged role of the CXCL12/CXCR4 axis in experimental myocardial infarction. J Am Coll Cardiol. 58 (23), 2415-2423 (2011).
- Oral, H., et al. CXC chemokine KC fails to induce neutrophil infiltration and neoangiogenesis in a mouse model of myocardial infarction. J Mol Cell Cardiol. 60, 1-7 (2013).
- Projahn, D., et al. Controlled intramyocardial release of engineered chemokines by biodegradable hydrogels as a treatment approach of myocardial infarction. J Cell Mol Med. 18 (5), 790-800 (2014).
- Schuh, A., et al. Novel insights into the mechanism of cell-based therapy after chronic myocardial infarction. Discoveries. 1 (2), e9 (2014).
- Schuh, A., et al. Effect of SDF-1 alpha on Endogenous Mobilized and Transplanted Stem Cells in Regeneration after Myocardial Infarction. Curr Pharm Des. 20 (12), 1964-1970 (2013).
- Zaragoza, C., et al. Animal models of cardiovascular diseases. J Biomed Biotechnol. 2011, 497841 (2011).
- Kanzler, I., Liehn, E. A., Koenen, R. R., Weber, C. Anti-inflammatory therapeutic approaches to reduce acute atherosclerotic complications. Curr Pharm Biotechnol. 13 (1), 37-45 (2012).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J. Vis. Exp. (32), 1438 (2009).
- Ryu, J. H., et al. Implantation of bone marrow mononuclear cells using injectable fibrin matrix enhances neovascularization in infarcted myocardium. Biomaterials. 26 (3), 319-326 (2005).
- Frobert, A., Valentin, J., Cook, S., Lopes-Vicente, J., Giraud, M. N. Cell-based Therapy for Heart Failure in Rat: Double Thoracotomy for Myocardial Infarction and Epicardial Implantation of Cells and Biomatrix. J. Vis. Exp. (91), e51390 (2014).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A Murine Model of Myocardial Ischemia-reperfusion Injury through Ligation of the Left Anterior Descending Artery. J. Vis. Exp. (86), e51329 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados